Kinetika Enzim Departemen Biokimia Reaksi Enzim Reaksi Enzim

Kinetika Enzim Departemen Biokimia

Reaksi Enzim

Reaksi Enzim

Reaksi Enzim

Kinetika Enzim Leonor Michaelis & Maud Menten Persamaan Michaelis-Menten: V 0 Laju/kecepatan awal enzim Vmaks Laju/Kecepatan maksimum enzim Km [S] Konstanta Mechaelis-Menten (konsentrasi substrat pada saat kecepatan setengah dari Vmaks) Konsentrasi Substrat
![Kinetika Enzim Bila [S] Km , maka V berbanding lurus dengan (S) Bila [S] Kinetika Enzim Bila [S] Km , maka V berbanding lurus dengan (S) Bila [S]](http://slidetodoc.com/presentation_image_h2/587353b21ce8ab701039598be15337dd/image-6.jpg)
Kinetika Enzim Bila [S] Km , maka V berbanding lurus dengan (S) Bila [S] = Km , maka V = 1/2 Vmax Bila [S] Km , maka V = Vmax
![Penentuan Km dan Vmax Plot double reciprocal atau plot Lineweaver-Burk • Plot 1/[S] vs Penentuan Km dan Vmax Plot double reciprocal atau plot Lineweaver-Burk • Plot 1/[S] vs](http://slidetodoc.com/presentation_image_h2/587353b21ce8ab701039598be15337dd/image-7.jpg)
Penentuan Km dan Vmax Plot double reciprocal atau plot Lineweaver-Burk • Plot 1/[S] vs 1/Vo • Persamaan L-B (garis lurus/linier) • X-intercept = -1/Km • Y-intercept = 1/Vmax
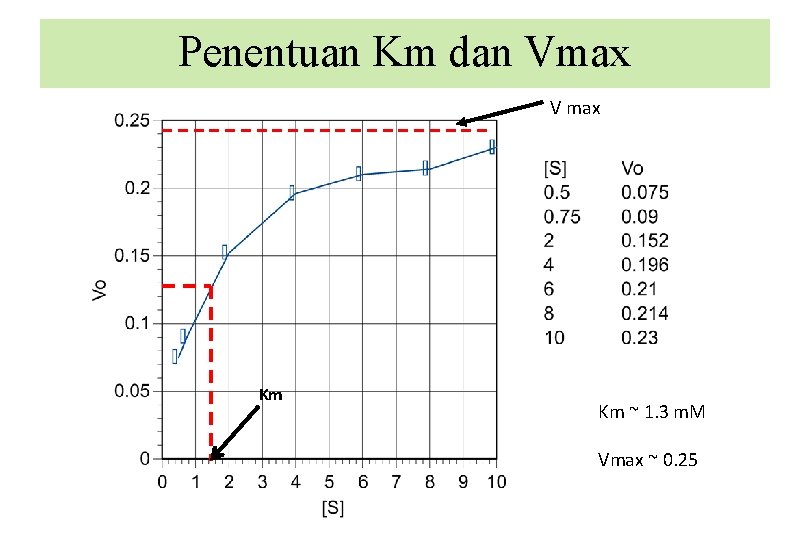
Penentuan Km dan Vmax V max Km Km ~ 1. 3 m. M Vmax ~ 0. 25

Penentuan Km dan Vmax -1/Km = -0. 8 Km = 1. 23 m. M 1/Vmax = 4. 0 Vmax = 0. 25
![Km ? ? ? 1. Km = [S] pada ½ Vmax 2. Km affinitas Km ? ? ? 1. Km = [S] pada ½ Vmax 2. Km affinitas](http://slidetodoc.com/presentation_image_h2/587353b21ce8ab701039598be15337dd/image-10.jpg)
Km ? ? ? 1. Km = [S] pada ½ Vmax 2. Km affinitas enzim dengan substrat 3. Km dapat digunakan untuk mengevaluasi spesifisitas enzim untuk berikatan dengan substrat 4. Nilai Km kecil artinya affinitas enzim-substrat tinggi; sebaliknya Km tinggi affinitas enzimsubstrat rendah Hexose Kinase Glucose + ATP <-> Glucose-6 -P + ADP Glucose Allose Mannose Km = 8 X 10 -6 Km = 8 X 10 -3 Km = 5 X 10 -6

Inhibisi Enzim Inhibitor reveribel E + S <-> ES -> E + P E + I <-> EI Ki = [E][I]/[EI] • Competitive • Non-competitive
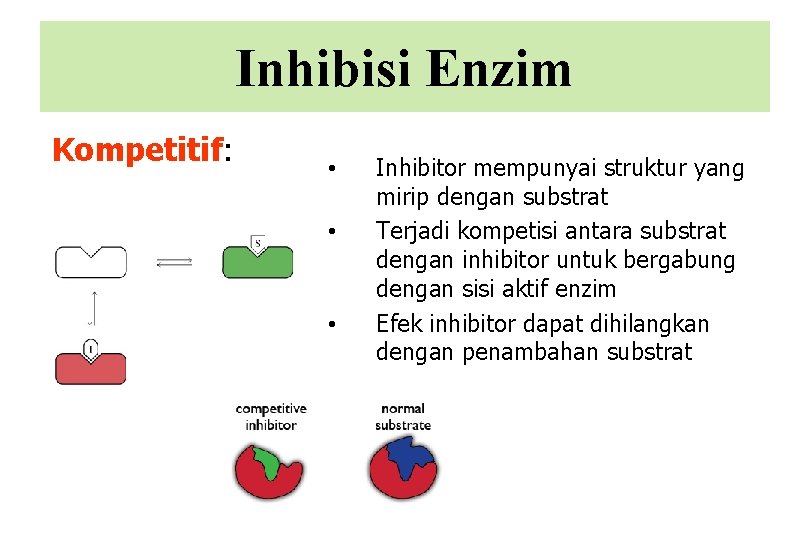
Inhibisi Enzim Kompetitif: • • • Inhibitor mempunyai struktur yang mirip dengan substrat Terjadi kompetisi antara substrat dengan inhibitor untuk bergabung dengan sisi aktif enzim Efek inhibitor dapat dihilangkan dengan penambahan substrat

Inhibisi Enzim Non-Kompetitif • • Peningkatan kadar substrat tdk dapat meniadakan efek inhibitor Menurunkan harga Vmax Berikatan dengan enzim pada tempat yang berbeda dengan tempat pengikatan substrat dan strukturnya tidak mirip substrat Dapat mengikat enzim bebas (E) maupun kompleks enzim-substrat

Plot Lineweaver-Burk Kompetitif Non-Kompetitif

Aplikasi Inhibitor Para-aminobenzoic acid (PABA) H 2 N- -COOH -SONH 2 Sulfanilamide Sulfa drug (anti-inflammation) Bakteri memerlukan PABA Untuk biosintesis asam folat, sehingga bakteri dapat tumbuh Domagk (1939) • Sulfanilamid mempunyai struktur yang sama dengan PABA, sehingga bakteri tidak dapat tumbuh • Sebagai inhibitor enzim • Inhibitor kompetitif


Quiz 1. Gambarkan hubungan antara kecepatan reaksi (aktivitas) terhadap substrat (S) 2. Bagaimana cara menentukan nilai Km dari gambar (pada no 1) 3. Apa perbedaannya penentuan Km dengan kurva LWB 4. Bandingkan, lebih akurat yang mana penentuan Km (pada soal no 2) dengan (soal no 3) 5. Berikan alasan singkat 6. Berikan definisi nilai Km
- Slides: 17