Kimia SMAMA Kelas X Semester 1 Disusun oleh









































































- Slides: 119

Kimia SMA/MA Kelas X Semester 1 Disusun oleh: 1. Erna Tri Wulandari 2. Narum Yuni Margono 3. Annik Qurniawati Disklaimer Daftar isi

DAFTAR ISI BAB I Hakikat dan Peran Kimia dalam Kehidupan, Metode Ilmiah, serta Keselamatan Kerja di Laboratorium BAB II Struktur Atom BAB III Sistem Periodik Unsur BAB IV Ikatan Kimia BAB V Bentuk Molekul dan Gaya Antarmolekul

BAB I Hakikat dan Peran Kimia dalam Kehidupan, Metode Ilmiah, serta Keselamatan Kerja di Laboratorium A. Hakikat dan Peran Ilmu Kimia dalam Kehidupan serta Metode Ilmiah B. Keselamatan Kerja di Laboratorium << Pengolahan limbah dengan sistem IPAL Kembali ke daftar isi

A. Hakikat dan Peran Ilmu Kimia dalam Kehidupan serta Metode Ilmiah 1. Hakikat Ilmu Kimia 2. Peran Ilmu Kimia dalam Kehidupan 3. Metode Ilmiah Kembali ke daftar isi Kembali ke awal bab

1. Hakikat Ilmu Kimia Ilmu yang mempelajari struktur materi Ilmu yang mempelajari susunan materi Kembali ke daftar isi Ilmu yang mempelajari sifat materi Hakikat Ilmu Kimia Kembali ke awal bab Ilmu yang mempelajari perubahan materi

2. Peran Ilmu Kimia dalam Kehidupan a. Cabang-Cabang Ilmu Kimia b. Manfaat Ilmu Kimia di Berbagai Bidang Kehidupan c. Peran Ilmu Kimia dalam Menyelesaikan Masalah Global d. Karir di Bidang Kimia Kembali ke daftar isi Kembali ke awal bab

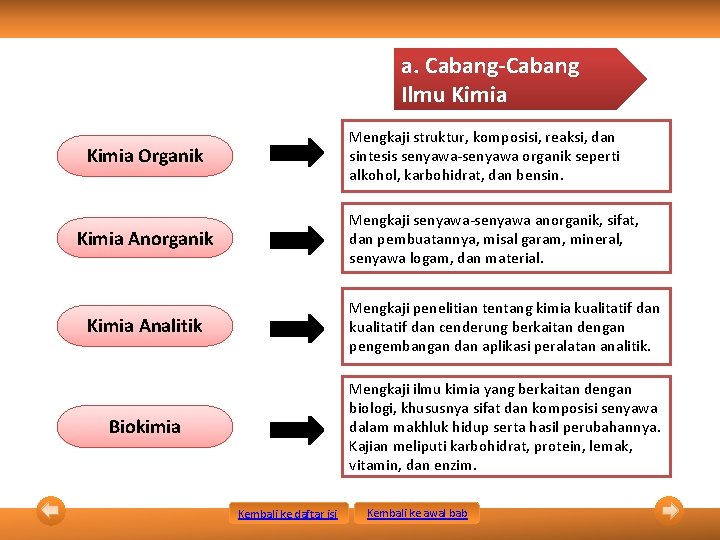
a. Cabang-Cabang Ilmu Kimia Mengkaji struktur, komposisi, reaksi, dan sintesis senyawa-senyawa organik seperti alkohol, karbohidrat, dan bensin. Kimia Organik Mengkaji senyawa-senyawa anorganik, sifat, dan pembuatannya, misal garam, mineral, senyawa logam, dan material. Kimia Anorganik Kimia Analitik Mengkaji penelitian tentang kimia kualitatif dan cenderung berkaitan dengan pengembangan dan aplikasi peralatan analitik. Biokimia Mengkaji ilmu kimia yang berkaitan dengan biologi, khususnya sifat dan komposisi senyawa dalam makhluk hidup serta hasil perubahannya. Kajian meliputi karbohidrat, protein, lemak, vitamin, dan enzim. Kembali ke daftar isi Kembali ke awal bab

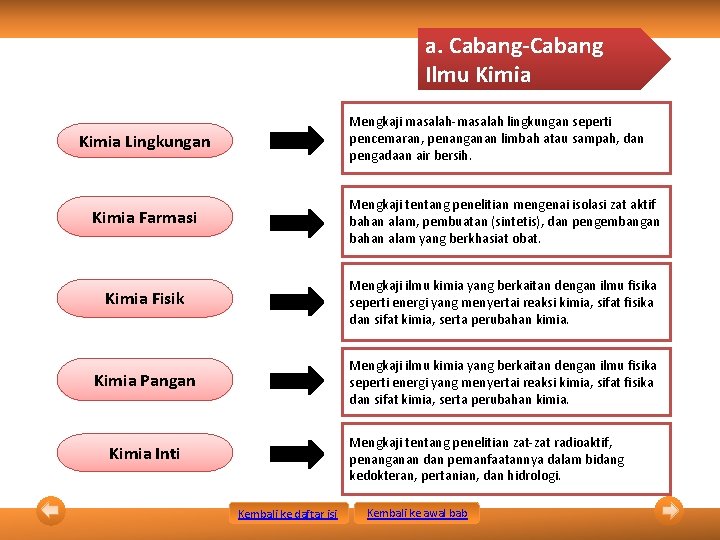
a. Cabang-Cabang Ilmu Kimia Mengkaji masalah-masalah lingkungan seperti pencemaran, penanganan limbah atau sampah, dan pengadaan air bersih. Kimia Lingkungan Kimia Farmasi Mengkaji tentang penelitian mengenai isolasi zat aktif bahan alam, pembuatan (sintetis), dan pengembangan bahan alam yang berkhasiat obat. Kimia Fisik Mengkaji ilmu kimia yang berkaitan dengan ilmu fisika seperti energi yang menyertai reaksi kimia, sifat fisika dan sifat kimia, serta perubahan kimia. Ilmu yang mempela Mengkaji ilmu kimia yang berkaitan dengan ilmu fisika jari reaksi kimia, sifat fisika seperti energi yang menyertai dan sifat kimia, serta perubahan kimia. perubaha n materi Mengkaji tentang penelitian zat-zat radioaktif, Kimia Pangan Kimia Inti penanganan dan pemanfaatannya dalam bidang kedokteran, pertanian, dan hidrologi. Kembali ke daftar isi Kembali ke awal bab

b. Manfaat Ilmu Kimia di Berbagai Bidang Kehidupan 1. Bidang Kedokteran Contoh: Pembuatan obat-obatan 2. Bidang Pertanian Contoh: pembuatan pupuk buatan dan pestisida 3. Bidang Geologi Contoh: penentuan unsur-unsur yang terkandung dalam bebatuan atau benda-benda alam. 4. Bidang Teknik Sipil Contoh: mempelajari kelebihan dan kekurangan suatu material bangunan Kembali ke daftar isi Pupuk membantu pertumbuhan tanaman Kembali ke awal bab

b. Manfaat Ilmu Kimia di Berbagai Bidang Kehidupan 5. Bidang Biologi Contoh: penentuan struktur dan sifat senyawa karbohidrat, protein, enzim, lemak, dan asam nukleat. 6. Bidang Hukum Contoh: pemeriksaan sidik jari dengan larutan Ag. NO 3 Sidik jari setiap orang bersifat khas Kembali ke daftar isi 7. Bidang Mesin Contoh: mempelajari sifat dan komposisi logam yang baik untuk pembuatan mesin Kembali ke awal bab

c. Peran Ilmu Kimia dalam Menyelesaikan Masalah Global Menemukan sumber energi alternatif seperti alkohol Pembuatan biogas menggunakan bahan baku kotoran hewan ternak Program langit biru, misalnya melengkapai knalpot kendaraan dengan katalis converter Kembali ke daftar isi Kembali ke awal bab

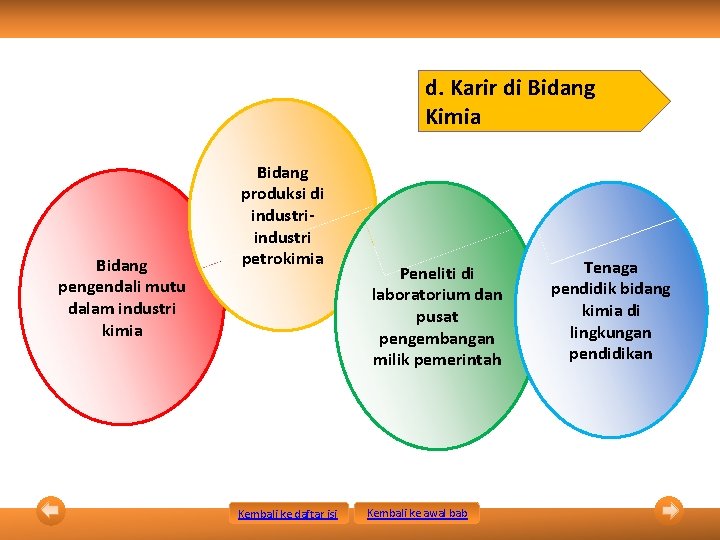
d. Karir di Bidang Kimia Bidang pengendali mutu dalam industri kimia Bidang produksi di industri petrokimia Kembali ke daftar isi Peneliti di laboratorium dan pusat pengembangan milik pemerintah Kembali ke awal bab Tenaga pendidik bidang kimia di lingkungan pendidikan

3. Metode Ilmiah Karakteristik Metode Ilmiah 1. Bersifat kritis dan analistis 2. Bersifat logis 3. Bersifat objektif 4. Bersifat konseptual 5. Bersifat empiris Kembali ke daftar isi Kembali ke awal bab

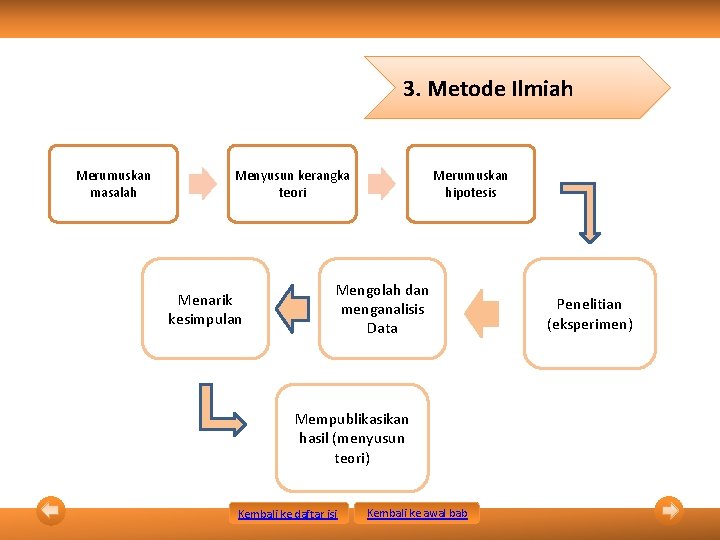
3. Metode Ilmiah Merumuskan masalah Menyusun kerangka teori Menarik kesimpulan Merumuskan hipotesis Mengolah dan menganalisis Data Mempublikasikan hasil (menyusun teori) Kembali ke daftar isi Kembali ke awal bab Penelitian (eksperimen)

3. Metode Ilmiah Sistematika Laporan Penelitian 1. 2. 3. 4. 5. 6. 7. 8. 9. Judul Penelitian Kata Pengantar Daftar Tabel Daftar Gambar Daftar Lampiran Daftar Isi Abstrak Bab I Pendahuluan Bab II Tinjauan Pustaka Kembali ke daftar isi 10. 11. 12. 13. 14. Bab III Metode Penelitian Bab IV Hasil dan Pembahasan Bab V Kesimpulan dan Saran Daftar Pustaka Lampiran Kembali ke awal bab

B. Keselamatan Kerja di Laboratorium 1. Alat-Alat Laboratorium dan Kegunaannya 2. Bahan Kimia, Sifat, dan Simbolnya 3. Penanganan Sampah dan Limbah Laboratorium serta Keadaan Darurat 4. Petunjuk dan Larangan di Laboratorium Kembali ke daftar isi Kembali ke awal bab

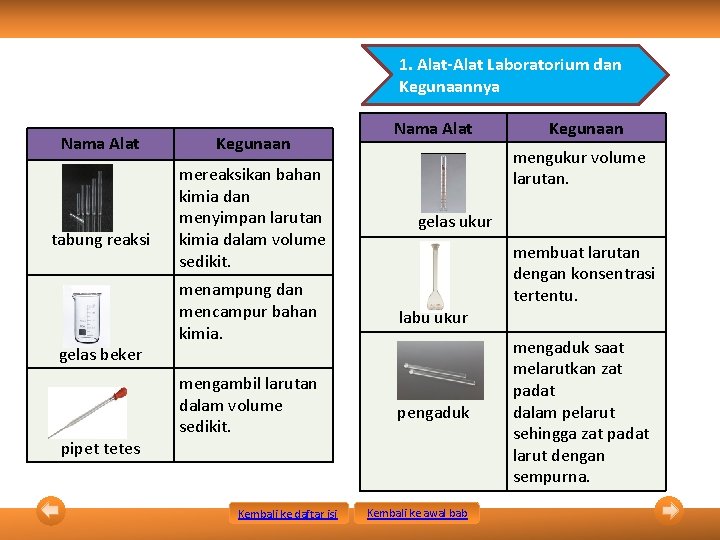
1. Alat-Alat Laboratorium dan Kegunaannya Nama Alat tabung reaksi gelas beker pipet tetes Kegunaan mereaksikan bahan kimia dan menyimpan larutan kimia dalam volume sedikit. Nama Alat mengukur volume larutan. gelas ukur menampung dan mencampur bahan kimia. labu ukur mengambil larutan dalam volume sedikit. pengaduk Kembali ke daftar isi Kegunaan Kembali ke awal bab membuat larutan dengan konsentrasi tertentu. mengaduk saat melarutkan zat padat dalam pelarut sehingga zat padat larut dengan sempurna.

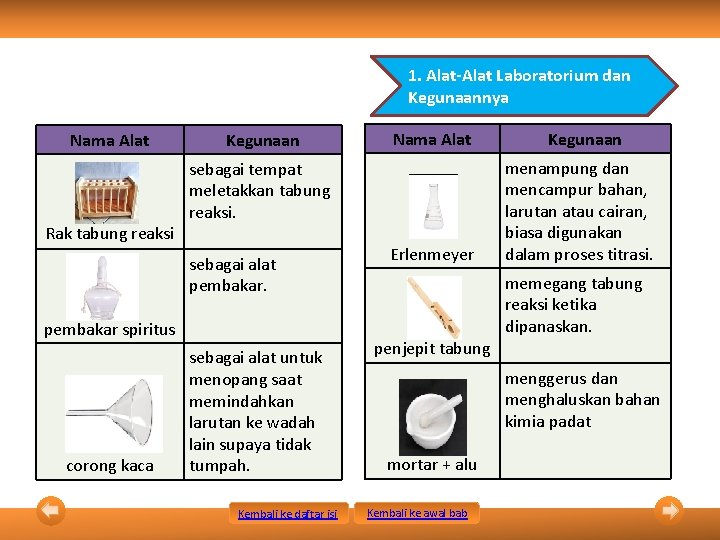
1. Alat-Alat Laboratorium dan Kegunaannya Nama Alat Rak tabung reaksi Kegunaan sebagai tempat meletakkan tabung reaksi. sebagai alat pembakar spiritus corong kaca Nama Alat sebagai alat untuk menopang saat memindahkan larutan ke wadah lain supaya tidak tumpah. Kembali ke daftar isi Erlenmeyer penjepit tabung Kegunaan menampung dan mencampur bahan, larutan atau cairan, biasa digunakan dalam proses titrasi. memegang tabung reaksi ketika dipanaskan. menggerus dan menghaluskan bahan kimia padat mortar + alu Kembali ke awal bab

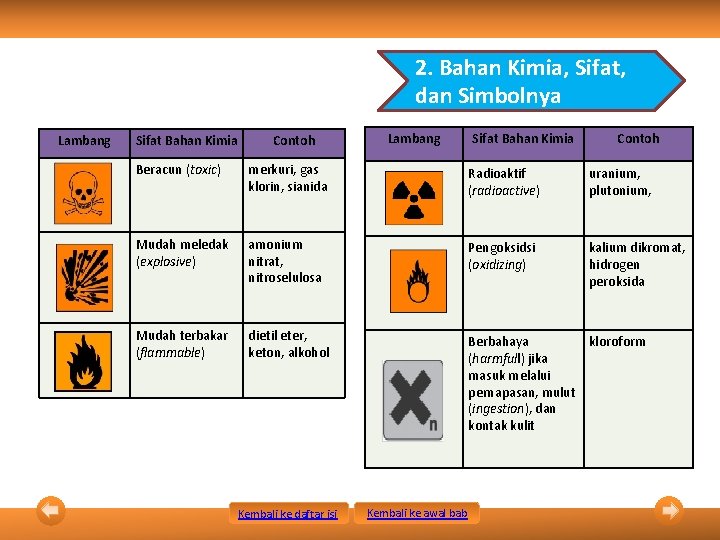
2. Bahan Kimia, Sifat, dan Simbolnya Lambang Sifat Bahan Kimia Contoh Beracun (toxic) merkuri, gas klorin, sianida Radioaktif (radioactive) uranium, plutonium, Mudah meledak (explosive) amonium nitrat, nitroselulosa Pengoksidsi (oxidizing) kalium dikromat, hidrogen peroksida Mudah terbakar (flammable) dietil eter, keton, alkohol Berbahaya kloroform (harmfull) jika masuk melalui pernapasan, mulut (ingestion), dan kontak kulit Kembali ke daftar isi Kembali ke awal bab

Lambang Sifat Bahan Kimia Contoh korosif (corrosive) asam nitrit, asam sulfat menyebabkan iritasi (irritant) 2. Bahan Kimia, Sifat, dan Simbolnya amonia, belerang dioksida membahayakan perak nitrat, lingkungan raksa(II) klorida (nature polluting) Kembali ke daftar isi Kembali ke awal bab

Petunjuk Umum untuk Menangani Buangan Sampah 3. Penanganan Sampah dan Limbah Laboratorium serta Keadaan Darurat a. Fine Chemicals Hanya dapat dibuang ke saluran pembuangan atau tempat sampah jika tidak bereaksi dengan air, tidak eksplosif, tidak bersifat radioaktif, tidak beracun, dan komposisinya diketahui jelas. e. Bahan Mengandung Merkuri Pembuangan bahan yang mengandung merkuri (seperti pecahan termometer merkuri, manometer, pompa merkuri) harus dilakukan dengan ekstra hati-hati. b. Larutan Basa Sebelum dibuang larutan basa (kecuali akalli hidroksida) harus dinetralkan terlebih dahulu. f. Bahan Radioaktif Sampah radioaktif memerlukan penanganan khusus. c. Larutan Asam Sebelum dibuang, larutan asam harus dinetralkan pada tempat dan prosedur sesuai ketentuan laboratorium. g. Air Pembilas Air pembilas harus bebas merkuri, sianida, amoniak, minyak, lemak, bahan beracun, dan bahan berbahaya lainnya sebelum dibuang ke saluran pembuangan. d. Pelarut yang dapat langsung dibuang di saluran pembuangan adalah pelarut yang tidak mengandung halogen. Kembali ke daftar isi Kembali ke awal bab

Petunjuk Umum Penanganan Kebakaran a. Jika nyala apinya kecil, lakukan pemadaman dengan Alat Pemadam Api Ringan (APAR). b. Matikan sumber arus listrik atau gardu utama agar listrik tidak mengganggu upaya pemadaman kebakaran. c. Lokalisasi api supaya tidak merembet ke arah bahan mudah terbakar lainnya. d. Jika api mulai membesar, jangan mencoba untuk memadamkan api dengan APAR. Segera panggil mobil unit Pertolongan Bahaya Kebakaran (PBK) terdekat. e. Bersikaplah tenang dalam menangani kebakaran dan jangan mengambil tindakan yang membahayakan diri sendiri maupun orang lain. Kembali ke daftar isi 3. Penanganan Sampah dan Limbah Laboratorium serta Keadaan Darurat Kembali ke awal bab

4. Petunjuk dan Larangan di Laboratorium Hal-Hal yang Perlu Diperhatikan di Laboratorium a. b. c. d. e. f. g. Membaca petunjuk praktikum atau merencanakan percobaan yang akan dilakukan sebelum memulai praktikum. Menggunakan kacamata pengaman atau penutup wajah. Bagi yang menggunakan lensa kontak harus berhati-hati dan menjaga agar tidak ada bahan kimia yang masuk ke mata. Menggunakan sarung tangan apabila diperlukan. Selama bekerja di laboratorium harus menggunakan baju laboratorium dan harus dikancingkan dengan baik untuk melindungi diri dan mencegah kontaminasi pada baju yang digunakan. Bagi wanita yang berambut panjang, diharuskan mengikat rambutnya. Dilarang makan dan minum di dalam laboratorium. Kembali ke daftar isi h. i. j. k. l. m. Menjaga kebersihan meja praktikum dan lingkungan laboratorium. Pastikan bahwa keran gas tidak bocor sewaktu hendak menggunakan bunsen. Pastikan bahwa keran air selalu dalam keadaan tertutup sebelum dan sesudah melakukan praktikum. Jagalah agar semua senyawa dan pelarut jauh dari mulut, kulit, mata, dan pakaian. Jika terkena bahan kimia, bersikaplah tenang dan jangan panik. Apabila kulit terkena bahan kimia, jangan digaruk agar tidak menyebar. Segera bersihkan bagian kulit yang mengalami kontak langsung menggunakan air bersih. Kembali ke awal bab

BAB II Struktur Atom A. Partikel Dasar Penyusun Atom B. Nomor Atom, Nomor Massa, Isotop, Isoton, Isobar, dan Isoelektron C. Perkembangan Teori Atom, Konfigurasi Elektron, dan Mekanika Kuantum << Alam semesta tersusun atas galaksi-galaksi Kembali ke daftar isi

A. Partikel-Partikel Dasar Penyusun Atom 1. Elektron ( 2. Proton ( 3. Neutron ( ) ) ) Kembali ke daftar isi Kembali ke awal bab

Elektron ditemukan oleh J. J. Thomson pada tahun 1897 melalui eksperimen dengan tabung sinar katode. • Sifat-sifat sinar katode: a. Merupakan partikel kecil yang tidak dapat dilihat b. Memiliki sifat cahaya dan sifat materi. c. Merambat tegak lurus dari permukaan katode menuju anode. d. Tidak tergantung pada jenis gas dan jenis elektrode. e. Bermuatan negatif sehingga dalam medan magnet dan medan listrik dibelokkan ke kutub positif. • Sinar katode tersebut merupakan elektron. • Kembali ke daftar isi 1. Elektron ( Kembali ke awal bab )

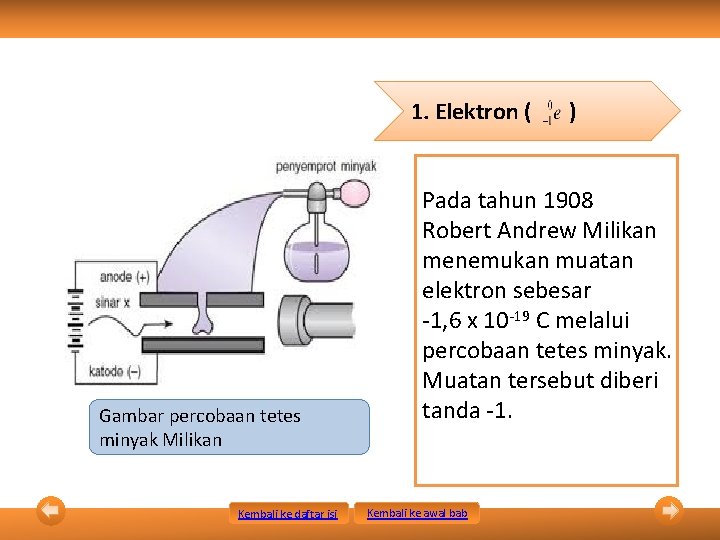
1. Elektron ( Gambar percobaan tetes minyak Milikan Kembali ke daftar isi ) Pada tahun 1908 Robert Andrew Milikan menemukan muatan elektron sebesar -1, 6 x 10 -19 C melalui percobaan tetes minyak. Muatan tersebut diberi tanda -1. Kembali ke awal bab

2. Proton ( • • Proton ditemukan oleh Eugen Goldstein pada tahun 1886 melalui percobaan tabung gas berkatode (tabung Crookes). Sifat-sifat sinar anode: • Bermuatan positif karena dapat dibelokkan medan magnet dan medan listrik menuju kutub negatif. • Merupakan radiasi partikel karena dapat memutar kincir. • Perbandingan e/m tergantung pada gas yang diisikan dalam tabung. • Ukuran partikel sinar anode bergantung pada jenis gas dalam tabung. • Muatan proton = +1 atau 1, 6 × 10– 19 C. • Semakin besar massa partikel, sinar anodenya semakin sukar dibelokkan. Kembali ke daftar isi Kembali ke awal bab )

2. Proton ( ) Percobaan Hamburan Sinar Alfa • Ernest Rutherford melakukan penembakan lempeng emas tipis dengan sinar alfa. • Pada percobaan tersebut, sebagian besar sinar alfa diteruskan atau menembus lempeng emas, sebagian kecil dibelokkan, dan sebagian kecil lagi dipantulkan. • Adanya sebagian kecil sinar alfa yang dipantulkan menunjukkan adanya inti atom yang bermuatan positif. Kembali ke daftar isi Kembali ke awal bab

3. Neutron ( • Pada tahun 1932 James Chadwick membuktikan bahwa partikel yang menimbulkan radiasi berdaya tembus tinggi tersebut bersifat netral atau tidak bermuatan disebut neutron. Pada tahun 1930 W. Bothe dan H. Becker melakukan percobaan penembakan partikel alfa pada inti atom berilium (Be). Percobaan ini menghasilkan radiasi partikel berdaya tembus tinggi. Partikel Penemu Massa (sma) Muatan Elektron J. J. Thomson 0 -1 Proton Goldstein 1 +1 Neutron J. Chadwick 1 0 Kembali ke daftar isi ) Kembali ke awal bab Lambang

B. Nomor Atom, Nomor Massa, Isotop, Isoton, Iosbar, dan Isoelektron 1. Nomor Atom (Z) 2. Nomor Massa (A) 3. Notasi Unsur 4. Isotop, Isoton, Isobar, dan Isoelektron 5. Massa Atom Relatif (Ar) Kembali ke daftar isi Kembali ke awal bab

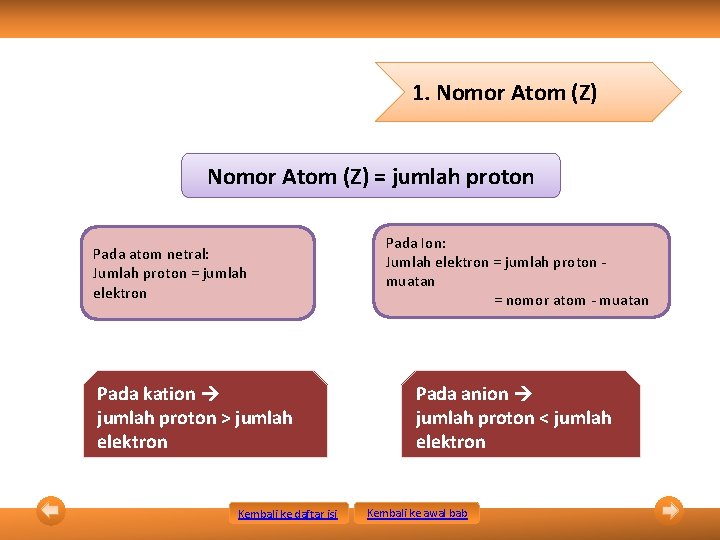
1. Nomor Atom (Z) = jumlah proton Pada atom netral: Jumlah proton = jumlah elektron Pada kation jumlah proton > jumlah elektron Kembali ke daftar isi Pada Ion: Jumlah elektron = jumlah proton muatan = nomor atom - muatan Pada anion jumlah proton < jumlah elektron Kembali ke awal bab

2. Nomor Massa (A) Nomor massa = jumlah proton + jumlah neutron = nomor atom + jumlah neutron Kembali ke daftar isi Kembali ke awal bab

3. Notasi Unsur Contoh: Keterangan: A = nomor massa Z = nomor atom = jumlah proton X = lambang unsur Kembali ke daftar isi nomor atom = jumlah proton = jumlah elektron =9 nomor massa = 19 jumlah neutron = nomor massa - nomor atom = 19 - 9 = 10 Kembali ke awal bab

4. Isotop, Isoton, Isobar, dan Isoelektron Isotop Pengerti Atom-atom yang an mempunyai nomor atom sama, tetapi nomor massa berbeda. Isoton Isobar Atom-atom yang mempunyai jumlah neutron sama. Atom-atom yang mempunyai nomor massa sama. Contoh Kembali ke daftar isi Kembali ke awal bab Isoelektron Atom-atom yang mempunyai jumlah elektron sama setelah melepaskan atau menangkap elektron.

5. Massa Atom Relatif (Ar) Massa atom relatif merupakan perbandingan massa suatu atom terhadap massa atom C-12. Kembali ke daftar isi Kembali ke awal bab

C. Perkembangan Teori Atom, Konfigurasi Elektron, dan Mekanika Kuantum 1. Perkembangan Model Atom 2. Konfigurasi Elektron dan Elektron Valensi 3. Bilangan Kuantum 4. Bentuk dan Orientasi Orbital Kembali ke daftar isi Kembali ke awal bab

1. Perkembangan Model Atom Thomson Model Atom Dalton Model Atom Modern Kembali ke daftar isi Model Atom Rutherford Model Atom Bohr Kembali ke awal bab

1. Perkembangan Model Atom Dalton Kembali ke daftar isi 1. Atom adalah bagian terkecil dari suatu unsur dan tidak dapat dibagi lagi. 2. Atom-atom unsur sejenis mempunyai sifat yang sama meliputi volume, bentuk, maupun massanya. Sebaliknya, atom-atom unsur tidak sejenis mempunyai sifat berbeda. 3. Dalam reaksi kimia terjadi penggabungan atau pemisahan atom. 4. Atom dapat bergabung dengan atom lain untuk membentuk suatu molekul dengan angka perbandingan bulat dan sederhana. Kembali ke awal bab

Model Atom Thomson 1. Perkembangan Model Atom Thomson menggambarkan atom sebagai sebuah bola bermuatan positif yang di dalamnya tersebar elektron seperti kismis dalam roti kismis. Kembali ke daftar isi Kembali ke awal bab

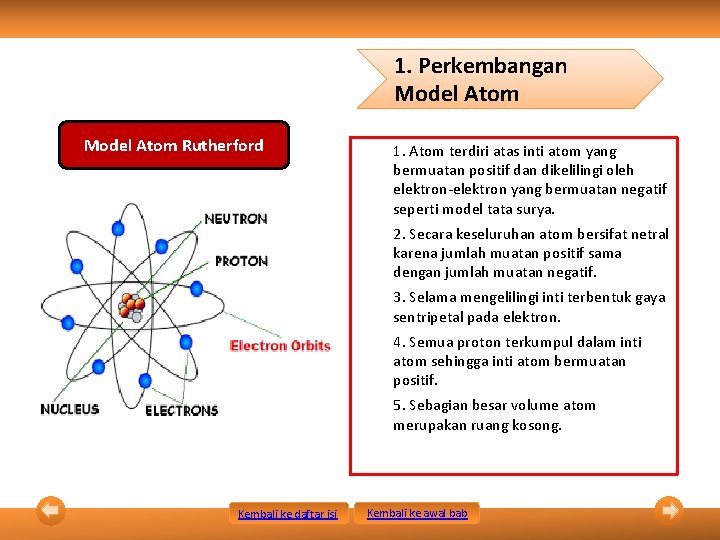
1. Perkembangan Model Atom Rutherford 1. Atom terdiri atas inti atom yang bermuatan positif dan dikelilingi oleh elektron-elektron yang bermuatan negatif seperti model tata surya. 2. Secara keseluruhan atom bersifat netral karena jumlah muatan positif sama dengan jumlah muatan negatif. 3. Selama mengelilingi inti terbentuk gaya sentripetal pada elektron. 4. Semua proton terkumpul dalam inti atom sehingga inti atom bermuatan positif. 5. Sebagian besar volume atom merupakan ruang kosong. Kembali ke daftar isi Kembali ke awal bab

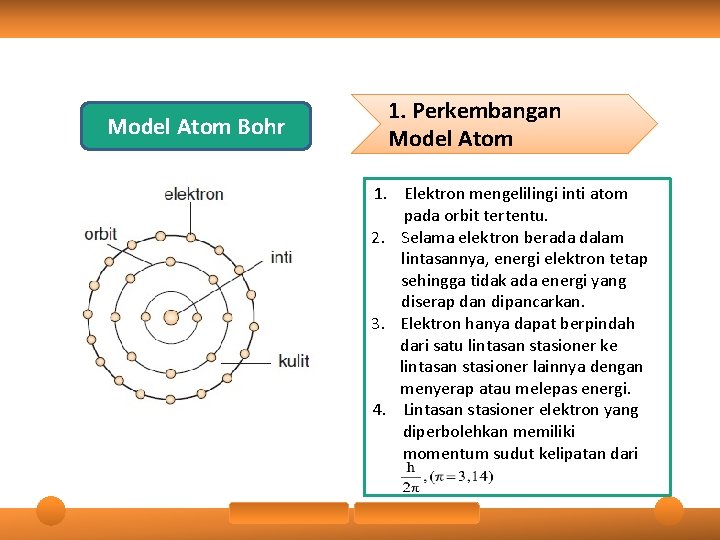
Model Atom Bohr 1. Perkembangan Model Atom 1. Elektron mengelilingi inti atom pada orbit tertentu. 2. Selama elektron berada dalam lintasannya, energi elektron tetap sehingga tidak ada energi yang diserap dan dipancarkan. 3. Elektron hanya dapat berpindah dari satu lintasan stasioner ke lintasan stasioner lainnya dengan menyerap atau melepas energi. 4. Lintasan stasioner elektron yang diperbolehkan memiliki momentum sudut kelipatan dari

1. Perkembangan Model Atom Berdasarkan Teori Mekanika Kuantum Kembali ke daftar isi § Model atom modern dibangun oleh beberapa ilmuwan seperti Louis de Broglie, Wolfgang Pauli, Erwin Schrödinger, dan Werner Heisenberg. § Menurut teori dualisme, elektron di dalam atom dapat dipandang sebagai partikel dan gelombang. § Teori ketidakpastian menyatakan bahwa kedudukan dan kecepatan gerak elektron tidak dapat ditentukan secara pasti, yang dapat ditentukan hanyalah kemungkinan terbesarnya atau probabilitasnya. § Daerah ruang di sekitar inti dengan kebolehjadian untuk mendapatkan elektron disebut orbital. Kembali ke awal bab

2. Konfigurasi Elektron dan Elektron Valensi a. Konfigurasi Elektron Nomor Kulit Nama Kulit Jumlah Elektron Maksimum 1 K 2 2 L 8 3 M 18 4 N 32 5 O 50 Kembali ke daftar isi Konfigurasi elektron adalah susunan elektron dalam suatu atom. • Tiap-tiap kulit elektron hanya dapat ditempati maksikum 2 n 2 elektron n = nomor kulit • Kembali ke awal bab

2. Konfigurasi Elektron dan Elektron Valensi Aturan Aufbau Asas Larangan Pauli Kaidah Hund Aturan Penulisan Konfigurasi Elektron Kembali ke daftar isi Kembali ke awal bab

2. Konfigurasi Elektron dan Elektron Valensi • Asas Larangan Pauli • ”Tidak ada dua buah elektron dalam orbital yang sama memiliki keempat bilangan kuantum yang sama”. • Bilangan kuantum spin harus berlawanan. • Jumlah elektron maksimum = 2 x jumlah orbital dalam subkulit Kembali ke daftar isi Kembali ke awal bab

2. Konfigurasi Elektron dan Elektron Valensi • Aturan Aufbau ”Pengisian elektron dalam orbital dimulai dari orbital dengan tingkat energi paling rendah. Setelah penuh, pengisian berlanjut ke orbital yang tingkat energinya satu tingkat lebih tinggi. Demikian seterusnya hingga semua elektron menempati orbital”. Kembali ke daftar isi Kembali ke awal bab

2. Konfigurasi Elektron dan Elektron Valensi • Kaidah Hund ”Elektron-elektron yang berada di suatu orbital akan menempati orbital yang kosong dengan arah rotasi sejajar. Setelah itu, elektron-elektron lainnya menempati orbital tersebut dengan arah rotasi yang berlawanan ”. Kembali ke daftar isi Kembali ke awal bab

2. Konfigurasi Elektron dan Elektron Valensi • Penulisan Konfigurasi Elektron dengan Lambang Gas Mulia Contoh: • Pengecualian Konfigurasi Elektron dalam Subkulit d dan f Contoh: Unsu Konfigurasi r Elektron Penyingkat an 7 N 1 s 2 2 p 3 [He] 2 s 2 2 p 3 12 Mg 1 s 2 2 p 6 3 s 2 [Ne] 3 s 2 Kembali ke daftar isi Unsu Konfigurasi r Elektron ( (Belum Stabil) 24 Cr [Ar] 4 s 2 3 d 4 [Ar] 4 s 1 3 d 5 29 Cu [Ar] 4 s 2 3 d 9 [Ar] 4 s 1 3 d 10 79 Au [Xe] 6 s 2 4 f 14 5 d 9 [Xe] 6 s 1 4 f 14 5 d 10 57 La [Xe] 6 s 2 4 f 1 5 d 0 [Xe] 6 s 2 4 f 0 5 d 1 Kembali ke awal bab

2. Konfigurasi Elektron dan Elektron Valensi Elektron valensi adalah jumlah elektron pada subkulit dengan harga n terbesar yang digunakan untuk pembentukan ikatan kimia. Contoh: Kembali ke daftar isi Kembali ke awal bab

3. Bilangan Kuantum Utama (n) Bilangan Kuantum Azimuth (ℓ) Bilangan Kuantum Magnetik (m) Bilangan Kuantum Spin (s) Kembali ke daftar isi Kembali ke awal bab

3. Bilangan Kuantum Utama (n) • • • Menyatakan posisi elektron dalam kulit atom, menjelaskan jarak rata awan elektron dari inti atom, serta menyatakan tingkat energi elektron dalam suatu atom. Semakin besar nilai n, tingkat energi atom semakin tinggi. Bilangan kuantum utama mempunyai harga mulai dari 1, 2, 3, 4, dan seterusnya. Kembali ke daftar isi Kulit n K 1 L 2 M 3 N 4 Kembali ke awal bab

3. Bilangan Kuantum Azimuth (ℓ) • Menyatakan subkulit atau orbital. Harga ℓ = 0, 1, 2, . . . (n – 1) harga ℓ = 0 --> subkulit s harga ℓ = 1 --> subkulit p harga ℓ = 2 --> subkulit d Kuli t n Harga ℓ yang diizinkan Subkulit K 1 0 1 s L 2 0, 1 2 s, 2 s M 3 0, 1, 2 3 s, 3 p, 3 d N 4 0, 1, 2, 3 4 s, 4 p, 4 d, 4 f harga ℓ = 3 --> subkulit f Kembali ke daftar isi Kembali ke awal bab

3. Bilangan Kuantum Magnetik (m) • Menentukan orientasi orbital dalam ruang di sekitar inti atom. harga m = –ℓ, 0, hingga +ℓ Kembali ke daftar isi ℓ Subkul it Harga m Jumlah Orbital 0 s 0 1 1 p -1, 0, +1 3 2 d -2, -1, 0, +1, +2 5 3 f -3, -2, -1, 0, +1, +2, +3 7 Kembali ke awal bab

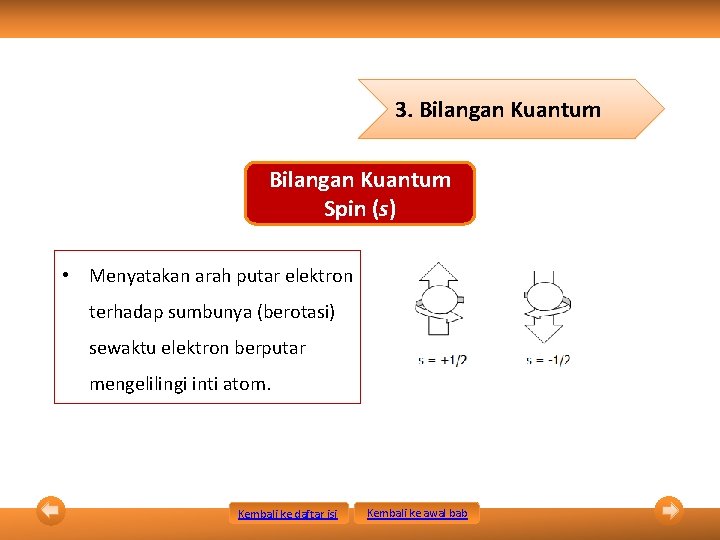
3. Bilangan Kuantum Spin (s) • Menyatakan arah putar elektron terhadap sumbunya (berotasi) sewaktu elektron berputar mengelilingi inti atom. Kembali ke daftar isi Kembali ke awal bab

3. Bilangan Kuantum Contoh Soal Kembali ke daftar isi Kembali ke awal bab

4. Bentuk dan Orientasi Orbital • Orbital s Kembali ke daftar isi • Orbital p Kembali ke awal bab

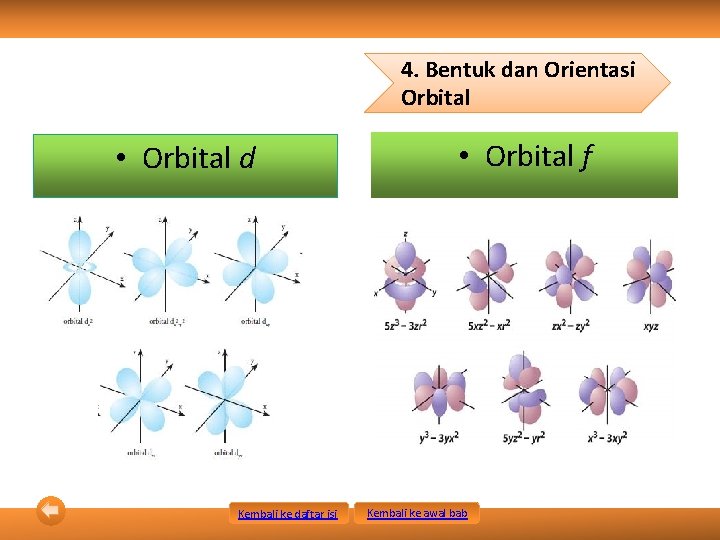
4. Bentuk dan Orientasi Orbital • Orbital d Kembali ke daftar isi • Orbital f Kembali ke awal bab

BAB III Sistem Periodik Unsur A. Perkembangan Sistem Periodik Unsur B. Sifat Unsur dan Sifat Keperiodikan Unsur << penataan barang-barang sesuai jenis dan ukurannya Kembali ke daftar isi

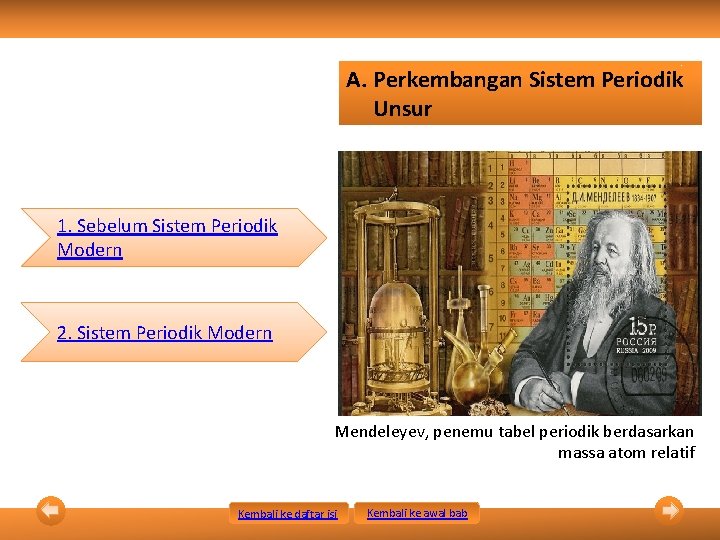
A. Perkembangan Sistem Periodik Unsur 1. Sebelum Sistem Periodik Modern 2. Sistem Periodik Modern Mendeleyev, penemu tabel periodik berdasarkan massa atom relatif Kembali ke daftar isi Kembali ke awal bab

1. Sebelum Sistem Periodik Modern Logam dan Nonlogam Lothar Meyer Tabel Periodik Lavoisier Sistem Periodik Mendeley ev Kembali ke daftar isi Kembali ke awal bab Triade Dobereiner Oktaf Newlands

1. Sebelum Sistem Periodik Modern a. Logam dan Nonlogam • Para ahli kimia Arab dan Persia pertama kali mengelompokkan unsur-unsur menjadi dua yaitu Lugham (logam) dan Laisa lugham (nonlogam). • Unsur logam (ada 16 unsur) besi, emas, perak, seng, nikel, dan tembaga. • Unsur nonlogam arsen, hidrogen, nitrogen, oksigen, karbon, belerang, dan fosfor. Kembali ke daftar isi Kembali ke awal bab

1. Sebelum Sistem Periodik Modern b. Tabel Periodik Lavoisier • Dasar Pengelompokan unsur adalah sifat kimia. • Lavoisier mengelompokkan unsur ke dalam empat golongan yaitu gas, tanah, logam, dan nonlogam. Kembali ke daftar isi Kembali ke awal bab

1. Sebelum Sistem Periodik Modern • c. Triade Dobereiner • Massa atom relatif unsur kedua merupakan rata-rata dari massa atom relatif unsur pertama dan ketiga. • Dobereiner menyimpulkan bahwa unsur-unsur dapat dikelompokkan ke dalam beberapa kelompok yang terdiri atas tiga unsur. Kembali ke daftar isi Kembali ke awal bab

1. Sebelum Sistem Periodik Modern • d. Oktaf Newlands • • • Unsur-unsur disusun berdasarkan kenaikan massa atom relatifnya. Hukum Oktaf menyatakan ”Jika unsur-unsur disusun berdasarkan kenaikan nomor massa atom, sifat unsur tersebut akan berulang pada unsur kedelapan. ” Kelemahan sistem oktaf Newlands adalah masih ada beberapa kotak yang diisi lebih dari satu unsur. Kembali ke daftar isi Kembali ke awal bab

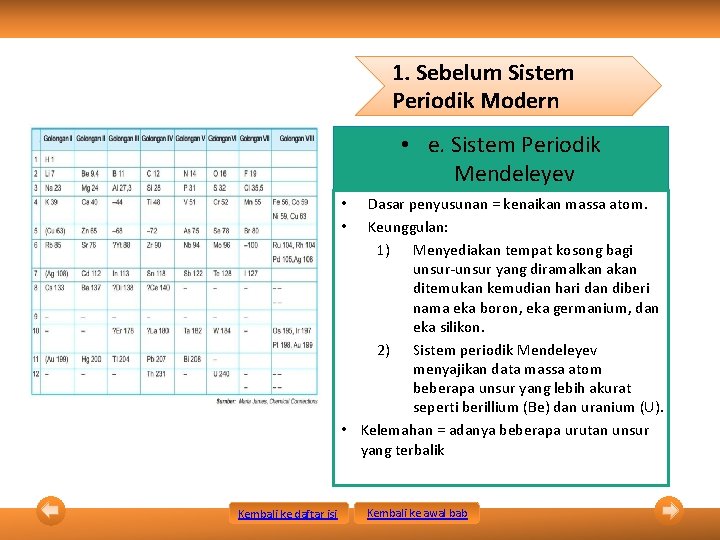
1. Sebelum Sistem Periodik Modern • e. Sistem Periodik Mendeleyev Dasar penyusunan = kenaikan massa atom. Keunggulan: 1) Menyediakan tempat kosong bagi unsur-unsur yang diramalkan akan ditemukan kemudian hari dan diberi nama eka boron, eka germanium, dan eka silikon. 2) Sistem periodik Mendeleyev menyajikan data massa atom beberapa unsur yang lebih akurat seperti berillium (Be) dan uranium (U). • Kelemahan = adanya beberapa urutan unsur yang terbalik • • Kembali ke daftar isi Kembali ke awal bab

• f. Lothar Meyer • • 1. Sebelum Sistem Periodik Modern Dasar penyusunan = kenaikan massa atom. Unsur-unsur yang menempati posisi sama dalam grafik menunjukkan sifat kimia yang mirip. Kembali ke daftar isi Kembali ke awal bab

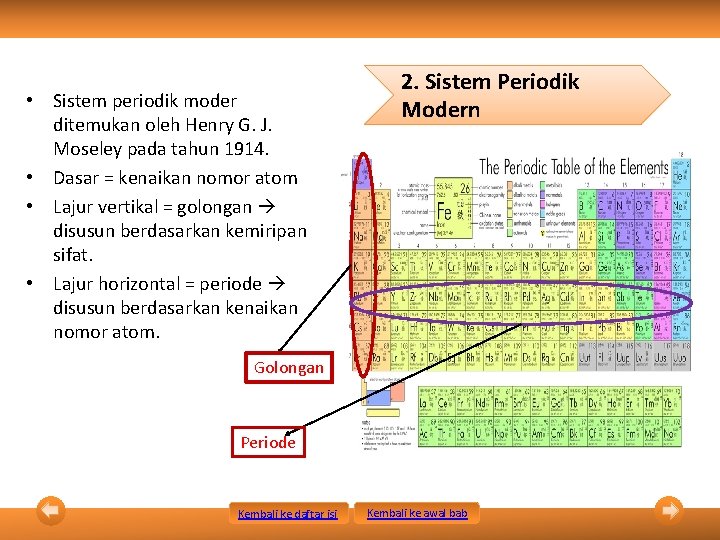
• Sistem periodik moder ditemukan oleh Henry G. J. Moseley pada tahun 1914. • Dasar = kenaikan nomor atom • Lajur vertikal = golongan disusun berdasarkan kemiripan sifat. • Lajur horizontal = periode disusun berdasarkan kenaikan nomor atom. 2. Sistem Periodik Modern Golongan Periode Kembali ke daftar isi Kembali ke awal bab

2. Sistem Periodik Modern Golongan Periode Kembali ke daftar isi Kembali ke awal bab Konfigurasi Elektron dan Letak Unsur dalam Tabel Periodik

2. Sistem Periodik Modern a. Golongan • Golongan menyatakan elektron valensi suatu unsur. • Ditulis dengan angka Romawi. • Terdiri atas 16 golongan Golongan Utama Golongan Kembali ke daftar isi Golongan Transisi Golongan Tambahan Golongan Transisi Dalam Kembali ke awal bab

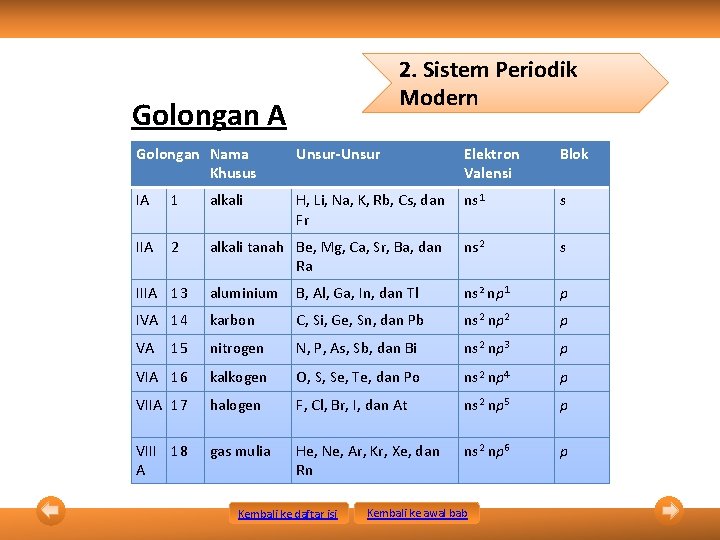
2. Sistem Periodik Modern Golongan A Golongan Nama Khusus Unsur-Unsur Elektron Valensi Blok IA 1 alkali H, Li, Na, K, Rb, Cs, dan Fr ns 1 s IIA 2 alkali tanah Be, Mg, Ca, Sr, Ba, dan Ra ns 2 s IIIA 13 aluminium B, Al, Ga, In, dan Tl ns 2 np 1 p IVA 14 karbon C, Si, Ge, Sn, dan Pb ns 2 np 2 p VA 15 nitrogen N, P, As, Sb, dan Bi ns 2 np 3 p VIA 16 kalkogen O, S, Se, Te, dan Po ns 2 np 4 p VIIA 17 halogen F, Cl, Br, I, dan At ns 2 np 5 p VIII 18 A gas mulia He, Ne, Ar, Kr, Xe, dan Rn ns 2 np 6 p Kembali ke daftar isi Kembali ke awal bab

2. Sistem Periodik Modern Golongan Tambahan Golongan Transisi Golongan Elektron Valensi Blo k IIIB 3 ns 2 (n - 1)d 1 d IVB 4 ns 2 (n - 1)d 2 d VB 5 ns 2 (n - 1)d 3 d VIB 6 ns 1 (n - 1)d 5 d VII B ns 2 (n - 1)d 5 d VIII 8, 9, B 10 ns 2 (n 1)d 6, 7, 8 d IB 11 ns 1 (n - 1)d 10 d IIB 12 ns 2 np 10 d 7 Golongan Transisi Dalam • Blok f • Deret Lantanida periode 6 • Deret Aktinida periode 7 Kembali ke daftar isi Kembali ke awal bab

2. Sistem Periodik Modern b. Periode • Periode menyatakan jumlah kulit atom unsur. • Ditulis dengan angka Arab. • Terdiri atas 7 periode Kembali ke daftar isi Periode Jumlah Unsur Keterangan 1 2 periode pendek 2 8 periode pendek 3 8 periode pendek 4 18 periode panjang 5 18 periode panjang 6 32 periode sangat panjang 7 32 (belum lengkap) periode belum lengkap Kembali ke awal bab

2. Sistem Periodik Modern c. Konfigurasi Elektron dan Letak Unsur dalam Tabel Periodik Contoh: Kembali ke daftar isi Kembali ke awal bab

2. Sistem Periodik Modern Cara Penyelesaian Soal Kembali ke daftar isi Kembali ke awal bab

B. Sifat Unsur dan Sifat Keperiodikan Unsur 1. Sifat-Sifat Unsur dalam Sistem Periodik Unsur 2. Massa Atom Relatif (Mr) 3. Sifat Keperiodikan Unsur Kembali ke daftar isi Kembali ke awal bab

1. Sifat-Sifat Unsur dalam Sistem Periodik Unsur Logam dan Nonlogam • Dalam satu golongan, dari atas ke bawah sifat logamnya semakin bertambah. • Dalam satu periode dari kiri ke kanan sifat logamnya semakin berkurang. Kembali ke daftar isi Kembali ke awal bab

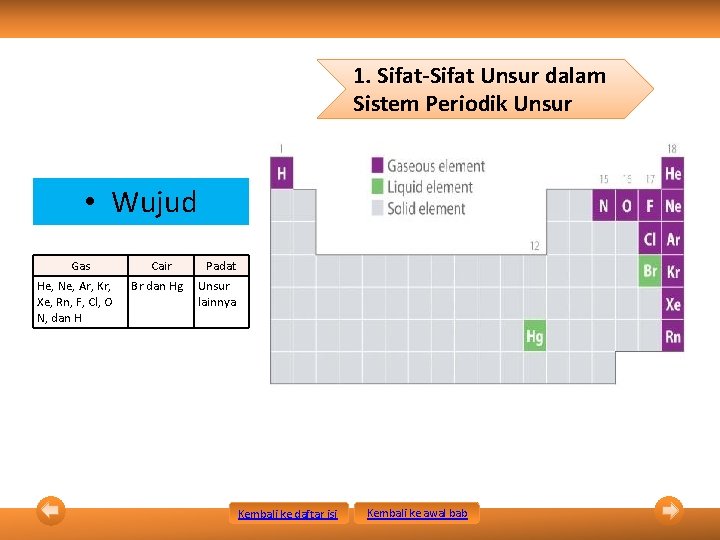
1. Sifat-Sifat Unsur dalam Sistem Periodik Unsur • Wujud Gas He, Ne, Ar, Kr, Xe, Rn, F, Cl, O N, dan H Cair Br dan Hg Padat Unsur lainnya Kembali ke daftar isi Kembali ke awal bab

1. Sifat-Sifat Unsur dalam Sistem Periodik Unsur Kemiripan Sifat Unsur-Unsur dalam Satu Golongan Sifat Unsur Golongan IA Sifat Unsur Golongan VIIA • bersifat logam • • lunak dan dapat diiris • ringan (massa jenis < 1 g Cm-3) • berupa molekul diatomik • reaktif terhadap air (semakin reaktif seiring bertambahnya nomor atom) bersifat nonlogam • beracun • berwarna • reaktif terhadap unsur golongan IA Sifat Unsur Golongan IIA • bersifat logam • reaktif terhadap air (kereaktifan lebih kecil dibandingkan unsur golongan IA) Kembali ke daftar isi Sifat Unsur Golongan VIIIA • • bersifat nonlogam berwujud gas monoatomik sukar bereaksi dengan unsur-unsur lain titik leleh dan titik didih sangat rendah Kembali ke awal bab

2. Massa Atom Relatif (Ar) Massa molekul relatif adalah perbandingan massa satu molekul senyawa terhadap massa satu atom C -12. Kembali ke daftar isi Kembali ke awal bab

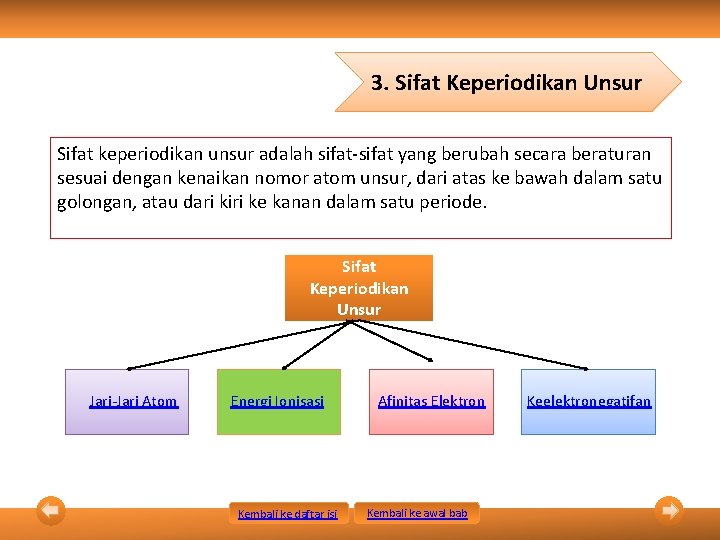
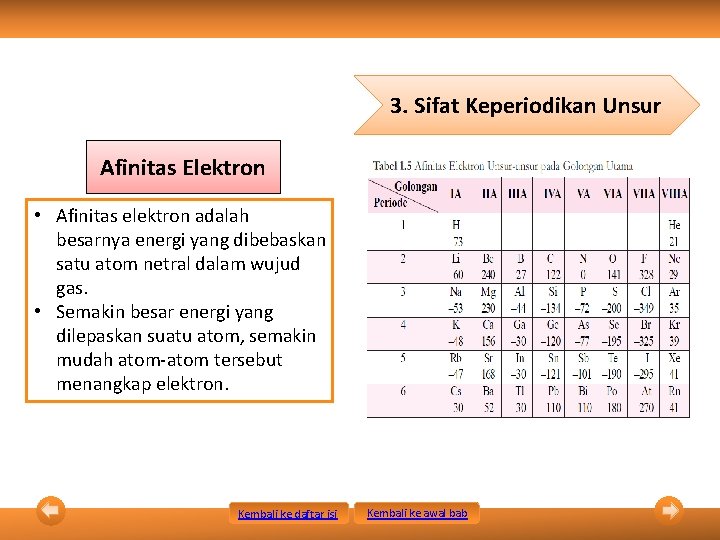
3. Sifat Keperiodikan Unsur Sifat keperiodikan unsur adalah sifat-sifat yang berubah secara beraturan sesuai dengan kenaikan nomor atom unsur, dari atas ke bawah dalam satu golongan, atau dari kiri ke kanan dalam satu periode. Sifat Keperiodikan Unsur Jari-Jari Atom Energi Ionisasi Kembali ke daftar isi Afinitas Elektron Kembali ke awal bab Keelektronegatifan

3. Sifat Keperiodikan Unsur Jari-Jari Atom • Jari-jari atom adalah jarak dari inti atom sampai kulit atom yang ditempati elektron terluar. • Dalam satu golongan dari atas ke bawah, jari-jari atom semakin besar. • Dalam satu periode dari kiri ke kanan, jari-jari atom semakin kecil. Kembali ke daftar isi Kembali ke awal bab

3. Sifat Keperiodikan Unsur Energi Ionisasi • Energi ionisasi atau potensial ionisasi adalah energi minimum yang diperlukan oleh atom netral berwujud gas untuk melepaskan elektron. • Dalam satu golongan dari atas ke bawah, energi ionisasi semakin berkurang. • Dalam satu periode dari kiri ke kanan, energi ionisasi cenderung bertambah. Kembali ke daftar isi Kembali ke awal bab

3. Sifat Keperiodikan Unsur Afinitas Elektron • Afinitas elektron adalah besarnya energi yang dibebaskan satu atom netral dalam wujud gas. • Semakin besar energi yang dilepaskan suatu atom, semakin mudah atom-atom tersebut menangkap elektron. Kembali ke daftar isi Kembali ke awal bab

Keelektronegatifan 3. Sifat Keperiodikan Unsur • Keelektronegatifan adalah kecenderungan suatu unsur untuk menarik elektron sehingga bermuatan negatif. • Dalam satu golongan dari atas ke bawah, keelektronegatifan semakin berkurang. • Dalam satu periode dari kiri ke kanan keelektronegatifan semakin bertambah. Kembali ke daftar isi Kembali ke awal bab

BAB IV IKATAN KIMIA A. Terbentuknya Ikatan Kimia B. Macam-Macam Ikatan Kimia << Ukiran pada gelas kaca diperoleh dari reaksi senyawa kovalen HF dengan Si. O 2 menghasilkan Si. F 4 Kembali ke daftar isi

A. Terbentuknya Ikatan Kimia 1. Konfigurasi Elektron Stabil 2. Peran Elektron dalam Ikatan Kimia 3. Lambang Lewis Kembali ke daftar isi Kembali ke awal bab

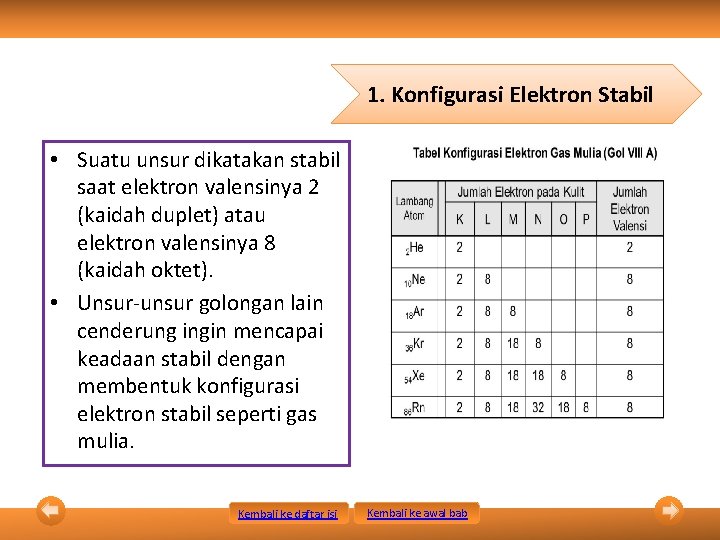
1. Konfigurasi Elektron Stabil • Suatu unsur dikatakan stabil saat elektron valensinya 2 (kaidah duplet) atau elektron valensinya 8 (kaidah oktet). • Unsur-unsur golongan lain cenderung ingin mencapai keadaan stabil dengan membentuk konfigurasi elektron stabil seperti gas mulia. Kembali ke daftar isi Kembali ke awal bab

2. Peran Elektron dalam Ikatan Kimia Kembali ke daftar isi Kembali ke awal bab

3. Lambang Lewis • Lambang Lewis dinyatakan dengan menuliskan lambang atom dikelilingi oleh sejumlah titik atau garis untuk menyatakan elektron valensi. • Jumlah elektron valensi suatu unsur sesuai dengan golongan unsur tersebut. Kembali ke daftar isi Kembali ke awal bab

B. Macam-Macam Ikatan Kimia 1. Ikatan Ion 2. Ikatan. Kovalen 3. Perbandingan Sifat Senyawa Ion dengan Senyawa Kovalen 4. Penyimpangan. Kaidah Oktet dan Duplet 5. Cara. Menggambar Struktur Lewis 6. Ikatan. Logam Kembali ke daftar isi Kembali ke awal bab

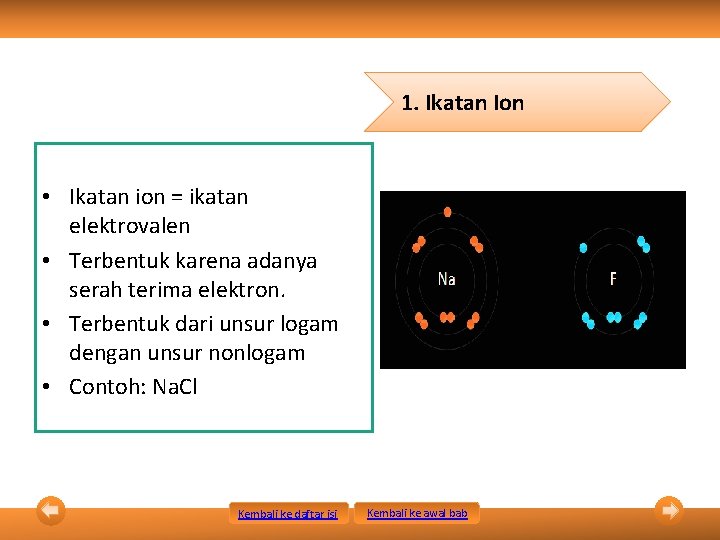
1. Ikatan Ion • Ikatan ion = ikatan elektrovalen • Terbentuk karena adanya serah terima elektron. • Terbentuk dari unsur logam dengan unsur nonlogam • Contoh: Na. Cl Kembali ke daftar isi Kembali ke awal bab

2. Ikatan Kovalen • Terbentuk akibat penggunaan bersama pasangan elektron. • Terjadi antarunsur nonlogam • Contoh: H 2 Kembali ke daftar isi Kembali ke awal bab

2. Ikatan Kovalen Tunggal, Rangkap Dua, dan Rangkap Tiga Ikatan Kovalen Tunggal Ikatan Kovalen Rangkap Dua Ikatan Kovalen Rangkap Tiga Terjadi akibat penggunaan bersama satu pasang elektron Terjadi akibat penggunaan bersama dua pasang elektron Terjadi akibat penggunaan bersama tiga pasang elektron Digambarkan dengan sepasang elektron atau satu garis lurus Digambarkan dengan dua pasang elektron atau dua garis lurus Digambarkan dengan tiga pasang elektron atau tiga garis lurus Contoh senyawa : H 2 Contoh senyawa: O 2 Contoh senyawa: N 2 Kekuatan: ikatan kovalen rangkap tiga > ikatan kovalen rangkap dua > ikatan kovalen tunggal Kembali ke daftar isi Kembali ke awal bab

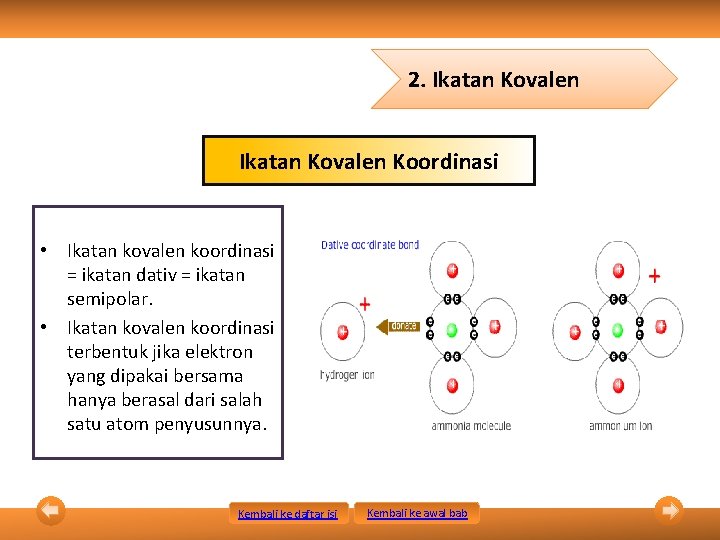
2. Ikatan Kovalen Koordinasi • Ikatan kovalen koordinasi = ikatan dativ = ikatan semipolar. • Ikatan kovalen koordinasi terbentuk jika elektron yang dipakai bersama hanya berasal dari salah satu atom penyusunnya. Kembali ke daftar isi Kembali ke awal bab

2. Ikatan Kovalen Polar dan Nonpolar Ikatan Kovalen Polar Ikatan Kovalen Nonpolar Ikatan antara atom -atom yang memiliki perbedaan keelektronegatifan Ikatan antara atom-atom yang tidak memiliki perbedaan keelektronegatifan Contoh: HCl, HBr, H 2 O Contoh: H 2, CH 4, dan BF 3. Kembali ke daftar isi Kepolaran senyawa ditentukan oleh beberapa hal berikut. 1) Jumlah momen dipol jumlah momen dipol = 0 --> nonpolar jumlah momen dipol > 0 --> polar 2) Bentuk molekul bentuk molekul simetris --> nonpolar, bentuk molekul asimetri --> polar 3) Molekul yang terdiri atas dua buah atom. Kedua atom sejenis --> nonpolar kedua atom tidak sejenis --> polar 4) Molekul yang terdiri atas tiga atau lebi h atom pusat punya PEB --> polar atom pusat tidak punya PEB --> nonpolar Kembali ke awal bab

3. Perbandingan Sifat Senyawa Ion dengan Senyawa Kovalen Senyawa Ion Senyawa Kovalen Titik leleh dan titik didih tinggi Titik leleh dan titik didih rendah karena gaya tarikmenarik antarmolekulnya lemah meskipun ikatan antaratomnya kuat. Larut dalam pelarut polar (contoh air) dan tidak larut dalam pelarut nonpolar (contoh kloroform) Sebagian larut dalam pelarut polar (senyawa kovalen polar) dan sebagian larut dalam pelarut nonpolar (senyawa kovalen nonpolar). Pada suhu kamar berwujud padat Pada suhu kamar ada yang berwujud gas (misal H 2 dan CO 2), cair (misal H 2 O dan HCl), ataupun padat (misal Si. O 2). Dalam bentuk larutan dan leburannya dapat menghantarkan arus listrik, tetapi dalam bentuk padatannya tidak dapat menghantarkan arus listrik. Sebagian larutannya dapat menghantarkan arus listrik (misal HCl) dan sebagian tidak menghantarkan arus listrik baik dalam bentuk larutan, leburan, maupun padatan misal Cl 2). Kembali ke daftar isi Kembali ke awal bab

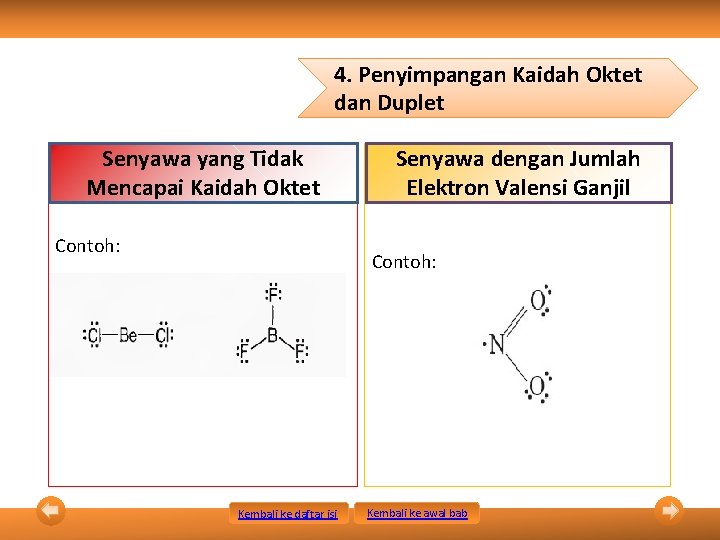
4. Penyimpangan Kaidah Oktet dan Duplet Senyawa yang Tidak Mencapai Kaidah Oktet Contoh: Senyawa dengan Jumlah Elektron Valensi Ganjil Contoh: Kembali ke daftar isi Kembali ke awal bab

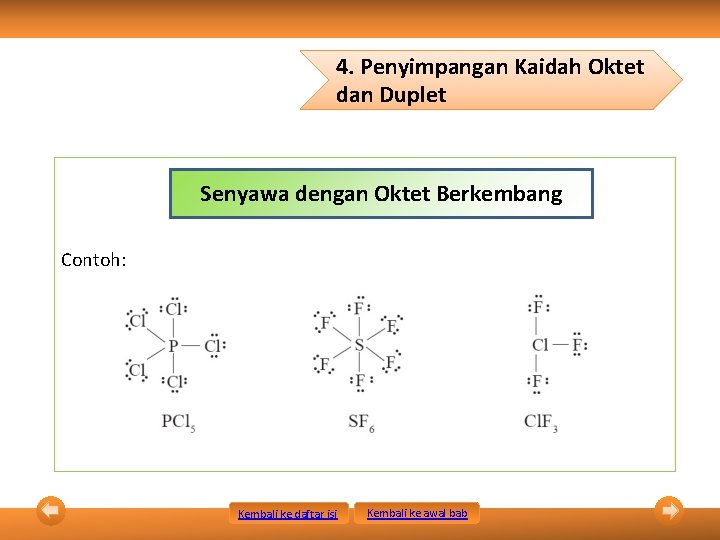
4. Penyimpangan Kaidah Oktet dan Duplet Senyawa dengan Oktet Berkembang Contoh: Kembali ke daftar isi Kembali ke awal bab

5. Cara Menggambar Struktur Lewis CONTOH: Kembali ke daftar isi Kembali ke awal bab

5. Cara Menggambar Struktur Lewis Cara Penyelesaian Soal Kembali ke daftar isi Kembali ke awal bab

6. Ikatan Logam Ikatan logam adalah ikatan antaratom dalam unsur logam yang terbentuk akibat adanya interaksi antarelektron valensi. Kembali ke daftar isi • Ciri-ciri ikatan logam sebagai berikut. a. Atom-atom logam dapat diibaratkan seperti bola pingpong yang berjejal rapat satu sama lain. b. Atom logam mempunyai sedikit elektron valensi sehingga sangat mudah dilepaskan untuk membentuk ion positif. c. Kulit terluar atom logam relatif longgar (terdapat banyak tempat kosong) sehingga elektron dapat berpindah dari satu atom ke atom lain. d. Mobilitas elektron dalam logam sedemikian bebas sehingga elektron valensi logam mengalami delokalisasi. e. Elektron-elektron valensi tersebut berbaur membentuk awan elektron yang menyelimuti ion-ion positif logam. Kembali ke awal bab

6. Ikatan Logam Sifat-sifat logam sebagai berikut. a. Pada suhu kamar berwujud padat. b. Dapat ditempa (tidak rapuh), dapat dibengkokkan, dan dapat direntangkan menjadi kawat. c. Penghantar atau konduktor listrik yang baik. d. Penghantar panas yang baik. Kembali ke daftar isi Kembali ke awal bab

BAB V BENTUK MOLEKUL DAN GAYA ANTARMOLEKUL A. Berbagai Bentuk Molekul B. Gaya Antarmolekul << Beberapa molekul berikatan sehingga membentuk struktur piramida Daftar Isi

A. Berbagai Bentuk Molekul 1. Teori Domain Elektron (VSEPR) 2. Kepolaran Senyawa Berdasarkan Bentuk Molekulnya 3. Teori Hibridisasi Kembali ke daftar isi Kembali ke awal bab

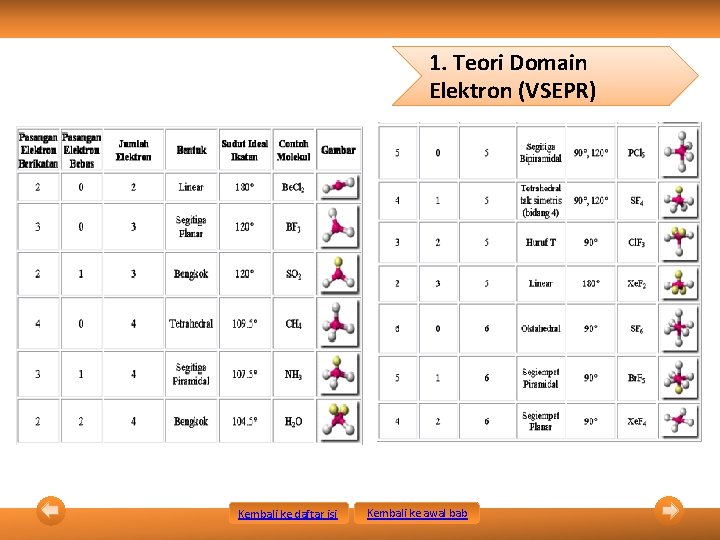
1. Teori Domain Elektron (VSEPR) • • • Bentuk molekul dapat ditentukan berdasarkan tolakan antarpasangan elektron dalam kulit valensi atom pusat. Kekuatan tolakan PEB – PEB > tolakan PEB – PEI > tolakan PEI – PEI. Jumlah domain elektron ditentukan sebagai berikut. – Setiap elektron ikatan, baik ikatan tunggal, rangkap dua, atau rangkap tiga, merupakan 1 domain. – Setiap pasangan elektron bebas merupakan 1 domain. Kembali ke daftar isi • Notasi VSEPR yang menunjukkan jumlah PEI dan PEB sebagai berikut. AXn. Em Keterangan: A = atom pusat X = PEI n = jumlah PEI E = PEB m = jumlah PEB Kembali ke awal bab

1. Teori Domain Elektron (VSEPR) Kembali ke daftar isi Kembali ke awal bab

1. Teori Domain Elektron (VSEPR) Beberapa langkah untuk meramalkan bentuk molekul ion poliatomik a. Menghitung jumlah pasangan elektron pada atom pusat ion, misal molekul ion b. Menghitung jumlah pasangan elektron ikatan (PEI) pada atom pusat PEI = jumlah atom – 1 PEI = 5 – 1 = 4 Kembali ke daftar isi c. Menghitung jumlah pasangan elektron yang berada di sekitar atom pusat. Pasangan elektron pusat = pasangan elektron – (3 × jumlah atom ujung (kecuali atom H)) Pasangan elektron pusat = 4 – (3 × 0) = 4 d. Menghitung jumlah pasangan elektron bebas PEB = pasangan elektron pusat – PEI PEB = 4 – 4 = 0 Jadi, notasi VSEPR untuk ion yaitu AX 4 dengan bentuk geometri tetrahedral. Kembali ke awal bab

1. Teori Domain Elektron (VSEPR) Cara penentuan notasi VSEPR Kembali ke daftar isi Kembali ke awal bab

2. Kepolaran Senyawa Berdasarkan Bentuk Molekulnya Senyawa Polar • Bentuk molekul tidak simetris • Mempunyai kutub/dipol • Rumus VSEPR: AX 2 E, AX 3 E, AX 2 E 2, AX 4 E, AX 3 E 2, dan AX 5 E • Contoh: NH 3 Kembali ke daftar isi Senyawa Nonpolar • Bentuk molekul simetris • Tidak mempunyai kutub/dipol • Rumus VSEPR: AX 2, AX 3, AX 4, AX 5, AX 2 E 3, AX 6, dan AX 4 E 2. • Contoh: CO 2 Kembali ke awal bab

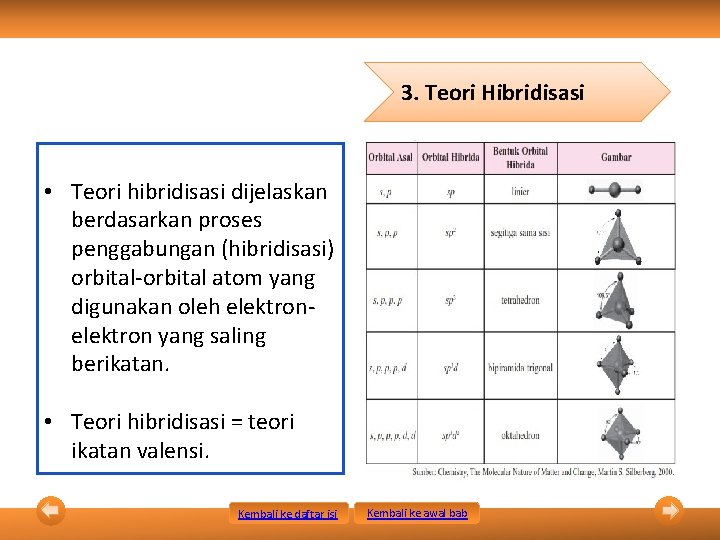
3. Teori Hibridisasi • Teori hibridisasi dijelaskan berdasarkan proses penggabungan (hibridisasi) orbital-orbital atom yang digunakan oleh elektron yang saling berikatan. • Teori hibridisasi = teori ikatan valensi. Kembali ke daftar isi Kembali ke awal bab

3. Teori Hibridisasi Cara Penentuan Bantuk Orbital Senyawa Kembali ke daftar isi Kembali ke awal bab

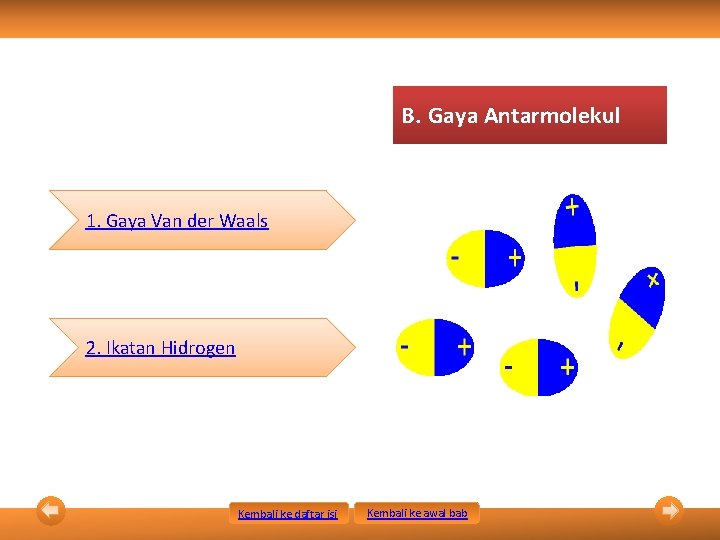
B. Gaya Antarmolekul 1. Gaya Van der Waals 2. Ikatan Hidrogen Kembali ke daftar isi Kembali ke awal bab

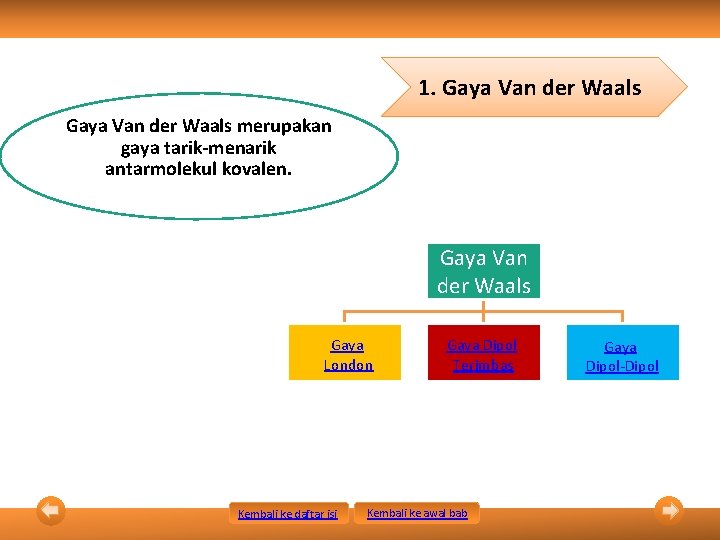
1. Gaya Van der Waals merupakan gaya tarik-menarik antarmolekul kovalen. Gaya Van der Waals Gaya London Kembali ke daftar isi Gaya Dipol Terimbas Kembali ke awal bab Gaya Dipol-Dipol

1. Gaya Van der Waals Gaya London • Gaya London = gaya dispersi = gaya tarik-menarik antarmolekul nonpolar. • Semakin besar massa molekul relatif, molekul semakin mudah mengalami polarisasi sehingga gaya London semakin kuat (titik leleh dan titik didih senyawa semakin tinggi) • Contoh: gaya tarik-menarik antarmolekul Br 2 Kembali ke daftar isi Kembali ke awal bab

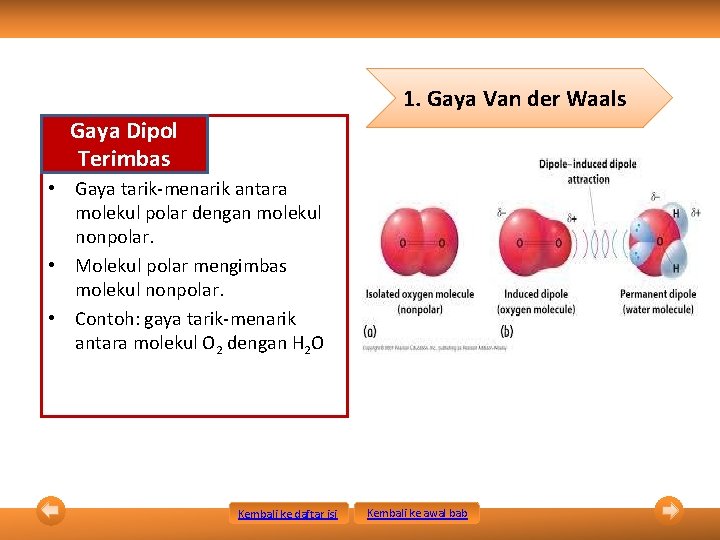
1. Gaya Van der Waals Gaya Dipol Terimbas • Gaya tarik-menarik antara molekul polar dengan molekul nonpolar. • Molekul polar mengimbas molekul nonpolar. • Contoh: gaya tarik-menarik antara molekul O 2 dengan H 2 O Kembali ke daftar isi Kembali ke awal bab

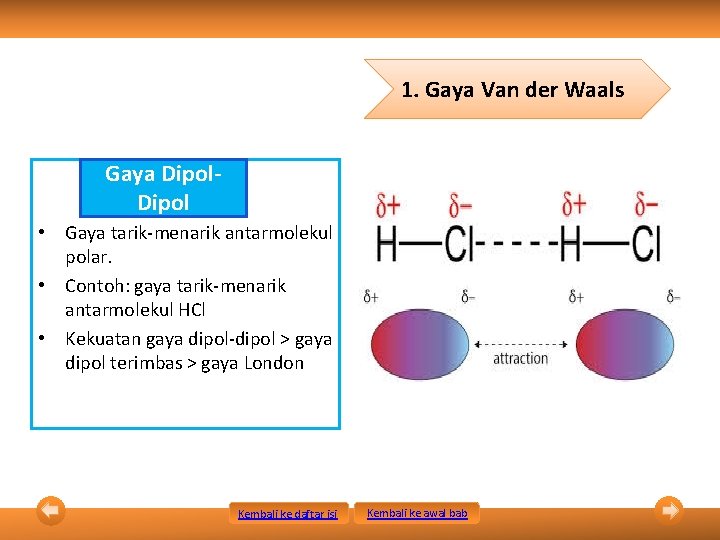
1. Gaya Van der Waals Gaya Dipol • Gaya tarik-menarik antarmolekul polar. • Contoh: gaya tarik-menarik antarmolekul HCl • Kekuatan gaya dipol-dipol > gaya dipol terimbas > gaya London Kembali ke daftar isi Kembali ke awal bab

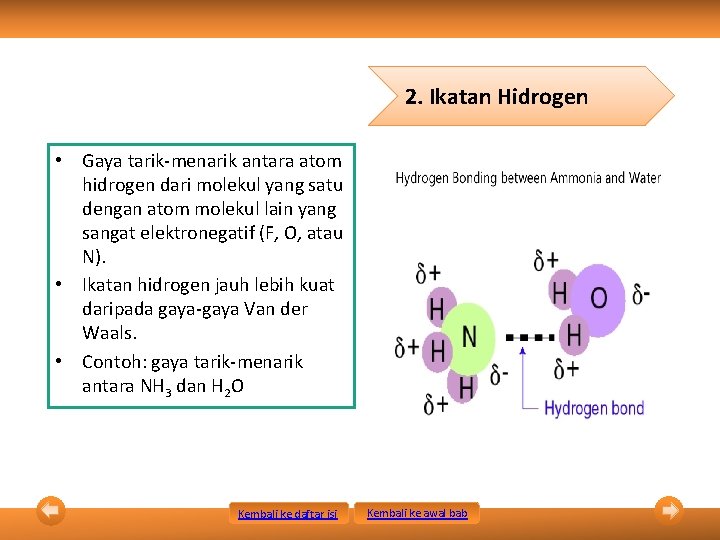
2. Ikatan Hidrogen • Gaya tarik-menarik antara atom hidrogen dari molekul yang satu dengan atom molekul lain yang sangat elektronegatif (F, O, atau N). • Ikatan hidrogen jauh lebih kuat daripada gaya-gaya Van der Waals. • Contoh: gaya tarik-menarik antara NH 3 dan H 2 O Kembali ke daftar isi Kembali ke awal bab

Terima Kasih Kembali ke daftar isi Kembali ke awal bab
 Materi kimia kelas 12 semester 1 sifat koligatif larutan
Materi kimia kelas 12 semester 1 sifat koligatif larutan Materi matematika kelas 11 semester 1
Materi matematika kelas 11 semester 1 Materi kegiatan ekonomi kelas 7
Materi kegiatan ekonomi kelas 7 Materi otk keuangan kelas 11 semester 2
Materi otk keuangan kelas 11 semester 2 Tugas prakarya kelas 11 semester 2
Tugas prakarya kelas 11 semester 2 Materi ips kelas 6 sd tentang asean
Materi ips kelas 6 sd tentang asean Materi korosi kelas 12
Materi korosi kelas 12 Materi desain grafis kelas 12 semester 1
Materi desain grafis kelas 12 semester 1 Pengertian supremum dan infimum
Pengertian supremum dan infimum Materi mice kelas 11 semester 2
Materi mice kelas 11 semester 2 Materi pembelajaran pkn smp kelas 8 semester 2
Materi pembelajaran pkn smp kelas 8 semester 2 Tugas tik kelas 9 semester 2
Tugas tik kelas 9 semester 2 Ciri ciri orang yang memelihara iman
Ciri ciri orang yang memelihara iman Kompetensi dasar ipa kelas 8 semester 2
Kompetensi dasar ipa kelas 8 semester 2 Kunci jawaban aspirasi kelas 11 semester 2
Kunci jawaban aspirasi kelas 11 semester 2 Pelajaran ips
Pelajaran ips Sudut sudut sepihak
Sudut sudut sepihak Aritmatika sosial
Aritmatika sosial Contoh soal teorema faktor kelas 11
Contoh soal teorema faktor kelas 11 Trigonometri kelas 10 semester 2
Trigonometri kelas 10 semester 2 Materi segitiga smp kelas 7 semester 2
Materi segitiga smp kelas 7 semester 2 Materi aritmatika sosial smp kelas 7 semester 2
Materi aritmatika sosial smp kelas 7 semester 2 Bahan ajar geografi kelas xi semester 1
Bahan ajar geografi kelas xi semester 1 Modul bahasa inggris kelas 11
Modul bahasa inggris kelas 11 Sayektine apantes tiniru tegese
Sayektine apantes tiniru tegese Materi kelas 12 semester 1
Materi kelas 12 semester 1 Ini adalah sketsa dari segitiga xyz
Ini adalah sketsa dari segitiga xyz Tugas tik kelas 8 semester 2
Tugas tik kelas 8 semester 2 Materi fisika kelas xi semester 2
Materi fisika kelas xi semester 2 Materi bahasa inggris kelas 11 smk semester 1
Materi bahasa inggris kelas 11 smk semester 1 Rangkuman ipa kelas 9
Rangkuman ipa kelas 9 Materi akidah akhlak kelas 7 semester genap
Materi akidah akhlak kelas 7 semester genap Materi esensial ips
Materi esensial ips Kompetensi dasar fisika kelas 11
Kompetensi dasar fisika kelas 11 Materi sosiologi kelas 12 semester 1
Materi sosiologi kelas 12 semester 1 Kd tik kelas 9 semester 2
Kd tik kelas 9 semester 2 Jurnal harian kelas 5 semester 2
Jurnal harian kelas 5 semester 2 Ragam hias teknik cetak
Ragam hias teknik cetak Kedudukan garis terhadap garis lainnya
Kedudukan garis terhadap garis lainnya Materi keuangan kelas 12
Materi keuangan kelas 12 Materi atletik kelas 6
Materi atletik kelas 6 Kompetensi dasar kelas 3 semester 2
Kompetensi dasar kelas 3 semester 2 Materi fiqih kelas 11 semester 1
Materi fiqih kelas 11 semester 1 Kkm prakarya kelas 9 semester 1 dan 2
Kkm prakarya kelas 9 semester 1 dan 2 Aktivitas 1 pkwu kelas 11
Aktivitas 1 pkwu kelas 11 Bahan ajar matematika kelas 8 semester 2
Bahan ajar matematika kelas 8 semester 2 Ppt prakarya dan kewirausahaan kelas xi semester 1
Ppt prakarya dan kewirausahaan kelas xi semester 1 Peta konsep sosiologi kelas 11 semester 2
Peta konsep sosiologi kelas 11 semester 2 Materi desain grafis kelas 10 semester 2
Materi desain grafis kelas 10 semester 2 Kekhasan agama katolik
Kekhasan agama katolik Contoh tugas portofolio pkn sd
Contoh tugas portofolio pkn sd Materi fiqih kelas 10 semester 2
Materi fiqih kelas 10 semester 2 Gambar penyepuhan emas
Gambar penyepuhan emas Flamabel
Flamabel Peta konsep hukum dasar kimia
Peta konsep hukum dasar kimia Materi kimia kelas 12 senyawa turunan alkana
Materi kimia kelas 12 senyawa turunan alkana Kata khusus
Kata khusus Disusun oleh kelompok
Disusun oleh kelompok Rangka kepala berbentuk bulat karena disusun
Rangka kepala berbentuk bulat karena disusun Makalah ini dibuat untuk memenuhi tugas
Makalah ini dibuat untuk memenuhi tugas Kalimat disusun oleh
Kalimat disusun oleh Sistem organ pencernaan pada manusia disusun oleh
Sistem organ pencernaan pada manusia disusun oleh Nasapi
Nasapi Makalah previewing and predicting
Makalah previewing and predicting Rancangan kerja yang disusun secara sistematis disebut
Rancangan kerja yang disusun secara sistematis disebut Disusun oleh dalam bahasa inggris
Disusun oleh dalam bahasa inggris Disusun oleh
Disusun oleh Bagaimana cara mengaktifkan microsoft publisher
Bagaimana cara mengaktifkan microsoft publisher Contoh critical incident technique
Contoh critical incident technique Proses penyusunan nspk kearsipan
Proses penyusunan nspk kearsipan Naskah drama musikal disusun oleh
Naskah drama musikal disusun oleh Disusun oleh kelompok
Disusun oleh kelompok Bahasa inggris disusun oleh
Bahasa inggris disusun oleh Ekosistem disusun oleh
Ekosistem disusun oleh Disusun oleh kelompok
Disusun oleh kelompok Disusun oleh kelompok
Disusun oleh kelompok Struktur organisasi disusun oleh
Struktur organisasi disusun oleh Jenis c h o r d apa yang disusun oleh nada 572
Jenis c h o r d apa yang disusun oleh nada 572 Disusun oleh kelompok
Disusun oleh kelompok Bahasa inggris disusun oleh
Bahasa inggris disusun oleh Pengertian distribusi frekuensi
Pengertian distribusi frekuensi Stream adalah
Stream adalah Contoh gambar tabel frekuensi
Contoh gambar tabel frekuensi Materi pkn kelas 2
Materi pkn kelas 2 Stream adalah
Stream adalah Batas kelas nyata dan batas kelas semu
Batas kelas nyata dan batas kelas semu Definisi distribusi frekuensi
Definisi distribusi frekuensi Penyajian data kuantitatif
Penyajian data kuantitatif Hess strand jobs
Hess strand jobs Mata kuliah ilmu alamiah dasar
Mata kuliah ilmu alamiah dasar Pengantar teknologi informasi semester 1
Pengantar teknologi informasi semester 1 Ulink lafayette
Ulink lafayette Dinoflagellates
Dinoflagellates Chemistry first semester exam review
Chemistry first semester exam review English semester 2 final exam
English semester 2 final exam Proposal penilaian akhir semester
Proposal penilaian akhir semester Us history final exam study guide semester 1
Us history final exam study guide semester 1 English 12 semester 1 final exam
English 12 semester 1 final exam Apes semester 1 final exam
Apes semester 1 final exam Monash abroad office
Monash abroad office Mary is trying hard in school this semester her father said
Mary is trying hard in school this semester her father said Pengertian ujian tengah semester
Pengertian ujian tengah semester Uf law externship
Uf law externship Laporan pkl rekam medis semester 1
Laporan pkl rekam medis semester 1 Us history semester 2 final exam
Us history semester 2 final exam Program tahunan adalah
Program tahunan adalah Chemistry fall semester exam review answers
Chemistry fall semester exam review answers Honors physics semester 1 review
Honors physics semester 1 review Is cal poly pomona quarter or semester
Is cal poly pomona quarter or semester Fungsi automata
Fungsi automata Discrete math problem
Discrete math problem Unibo alma rm
Unibo alma rm Deskripsi raport ekstrakurikuler pramuka
Deskripsi raport ekstrakurikuler pramuka Humss scheduling of subjects
Humss scheduling of subjects English semester exam
English semester exam Earth science semester 2 final exam answers
Earth science semester 2 final exam answers English 3 fall semester exam review
English 3 fall semester exam review Chemistry semester 1 exam review answers
Chemistry semester 1 exam review answers Chemistry semester 2 review unit 12 thermochemistry
Chemistry semester 2 review unit 12 thermochemistry World history 1st semester final review answers
World history 1st semester final review answers