Kemoterpia Dr Torday Lszl Ph D SZTE Onkoterpis

























































































































- Slides: 179

Kemoterápia Dr. Torday László Ph. D SZTE Onkoterápiás Klinika Dr. Torday László 2009. 15. Kemoterápia

Vonzó a kemoterápia? ž Igen, nagyon az, de nagyon sok tudást, tanulást, elővigyázatosságot és önbizalmat igényel, de még így is abszolút ÉLETVESZÉLYES tud lenni…

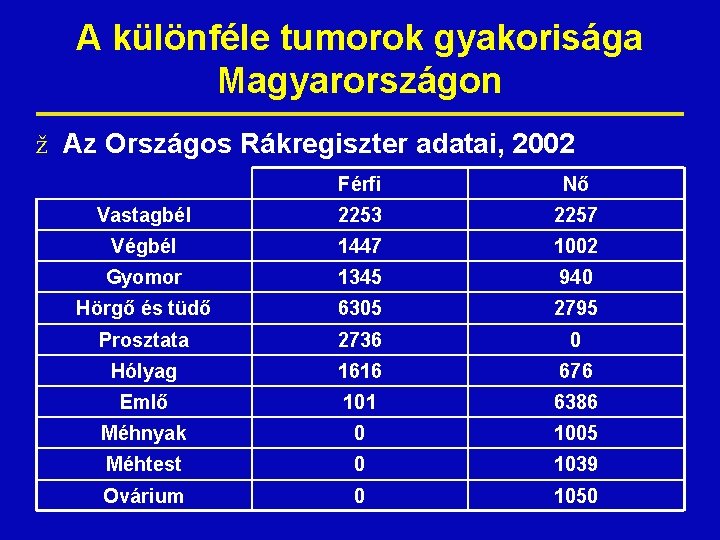
A különféle tumorok gyakorisága Magyarországon ž Az Országos Rákregiszter adatai, 2002 Férfi Nő Vastagbél 2253 2257 Végbél 1447 1002 Gyomor 1345 940 Hörgő és tüdő 6305 2795 Prosztata 2736 0 Hólyag 1616 676 Emlő 101 6386 Méhnyak 0 1005 Méhtest 0 1039 Ovárium 0 1050

Dr. Torday László 2009. 15. Kemoterápia

A kemoterápia alapelvei ž A kemoterápia hatásos használatához meg kell érteni a következő alapelveket: • Tumorbiológia • Citokinetika • Farmakológia • Gyógyszerrezisztencia

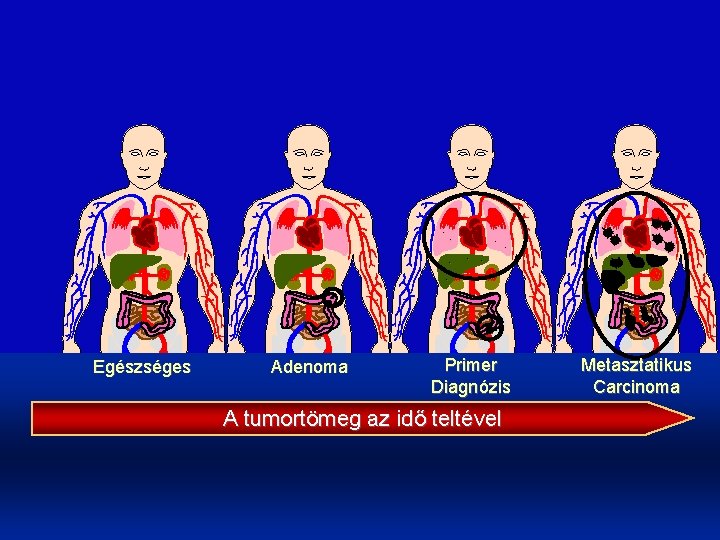
. . . Egészséges Adenoma . . Primer Diagnózis Metasztatikus Carcinoma A tumortömeg az idő teltével Dr. Torday László 2009. 15. Kemoterápia

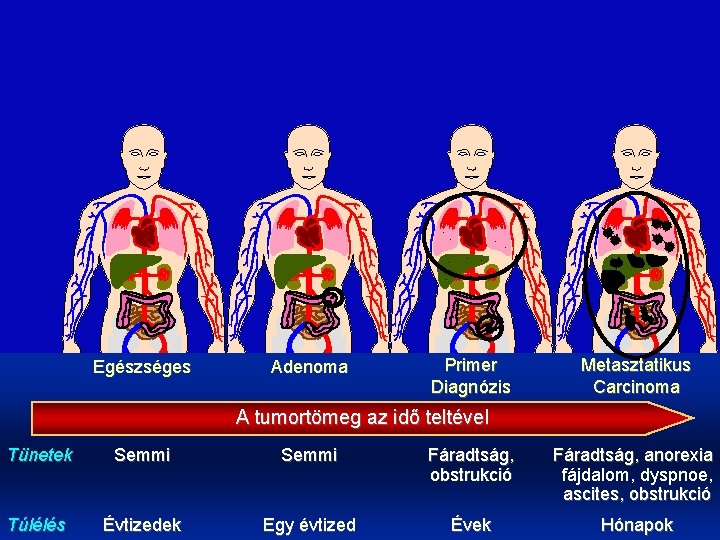
. . . Egészséges Adenoma . . Primer Diagnózis Metasztatikus Carcinoma A tumortömeg az idő teltével Tünetek Semmi Dr. Torday László Évtizedek Túlélés Semmi Fáradtság, obstrukció Egy évtized Évek Fáradtság, anorexia fájdalom, dyspnoe, ascites, obstrukció Hónapok 2009. 15. Kemoterápia

A daganatos sejtek jellemzői ž Klonalitás • • • minden tumoros sejt egy daran genetikailag károsodott sejt utóda a rák genetikai és klonális betegség onkogének: mutált protoonkogének ž Anaplázia • • eredeti szöveti funkciók elvesztése a kiindulási hely gyakran nem határozható meg

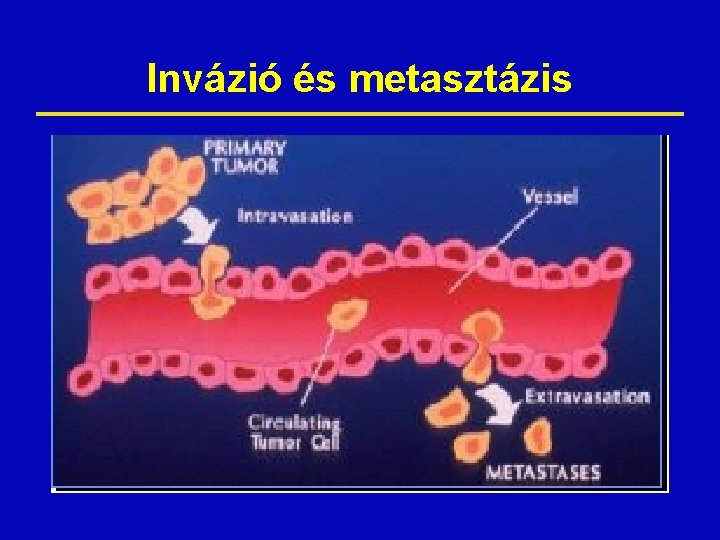
A daganatos sejtek jellemzői ž Kontrollálatlan proliferáció (autonómia): • A daganatos sejtek általában lassabban, vagy ugyanolyan gyorsan osztódnak, mint a normál sejtek (pl. csontvelő, vagy az epitheliális sejtek) • A szignifikáns különbség: hiányoznak a normál szöveti és szervi növekedést szabályozó feed-back mechanizmusok. ž Invazivitás: • A normál szöveti sejtek bizonyos térbeli helyzetet foglalnak el egymáshoz képest, még a szöveti gyógyulás folyamán is. • A daganatos sejtek nem maradnak meg egy bizonyos area vagy szerv határain belül, extenzíven nőnek, behatolnak a szomszédos szövetekbe. ž Metasztatizálás: • A metasztatizáló tumor sejtjei képesek belépni a véráramba, vagy a nyirokkeringésbe. • Ez a test más részeinek kolonizációját teszi lehetővé, s a primer tumortól távol lévő metasztázisok kifejlődéséhez vezet

Invázió és metasztázis

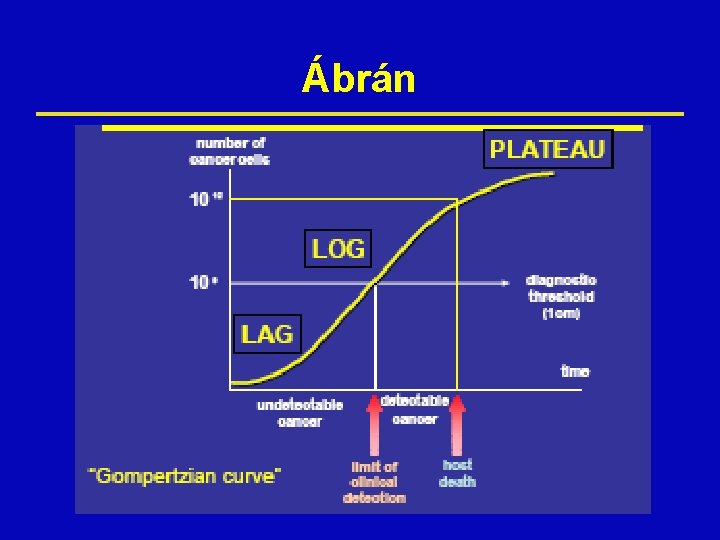
A sejtosztódásról ž Dinamika ž Észlelhetőségi határ • 1 gr tömeg, 109 sejt, 30 osztódási ciklus • + 10 osztódás → 1012 sejt → 1 kg tömeg → halál ž Sejtciklus ž Osztódási fázisok

Tumorbiológia, tumorkinetika ž Normál sejt malignus transzformáció ž ž duplikáció A humán sejtek duplikációs ideje kb. 3 nap A proliferáló frakció kb. 2 -10% A tumorsejtek 80 %-a spontán elpusztul A humán tumorok duplikációs ideje így: kb. 2 -3 hónap • Pl. tüdőráknál ez 100 nap

A méret ž 30 osztódás után a tumor 1 millió sejtet tartalmaz ž Ekkor a méret 1 cm (1 sejt: 10 μm) • Ez pl. a mellkas rtg-vel való kimutathatóság határa ž Hogy a tumor 1 kilogrammos legyen, még 10 megkettőződés szükséges: ekkor 10 cm átmérőjű, és 100 millió sejtet tartalmaz ž Ez már előrehaladott állapot, és már gyakran végzetes.

Ábrán

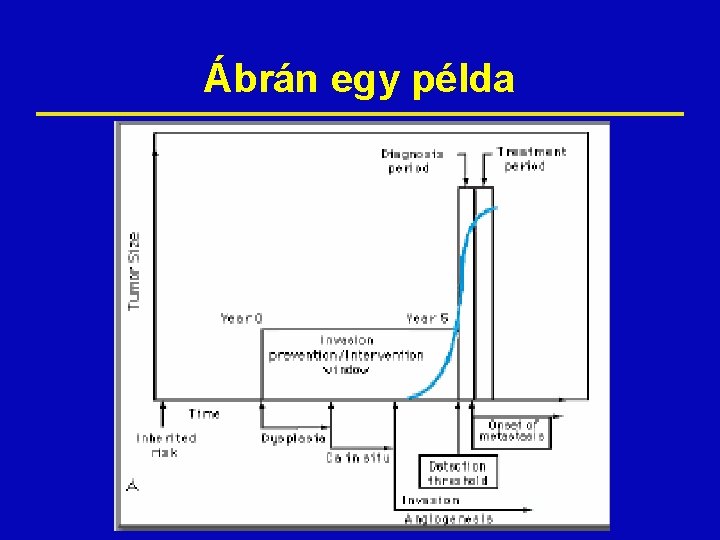
Az idő ž Egészséges sejt ž Malignus sejt ž 30 megkettőződés: kb. 8. 2 év • Detektabilitási limit ž még 10 osztódás: kb. 3 years • Terminális állapot ž A kezelés a 3. év végéig lehetséges ž Az első 8 év alatt számos lehetőség van áttétképzésre, így a loálisan detektálható tumort generalizált betegségnek kell felfogni.

Ábrán egy példa

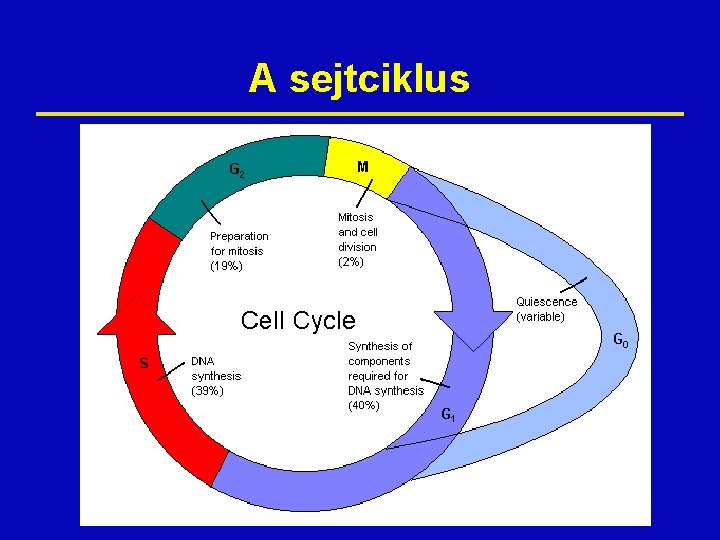
A sejtciklus

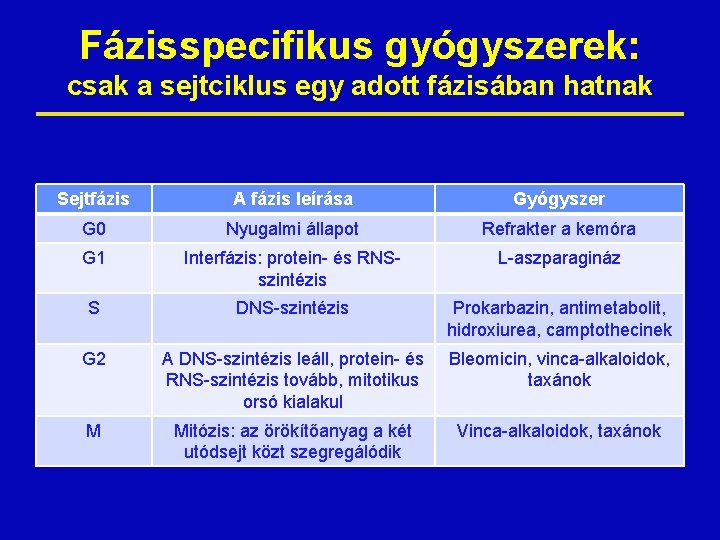
Fázisspecifikus gyógyszerek: csak a sejtciklus egy adott fázisában hatnak Sejtfázis A fázis leírása Gyógyszer G 0 Nyugalmi állapot Refrakter a kemóra G 1 Interfázis: protein- és RNSszintézis L-aszparagináz S DNS-szintézis Prokarbazin, antimetabolit, hidroxiurea, camptothecinek G 2 A DNS-szintézis leáll, protein- és RNS-szintézis tovább, mitotikus orsó kialakul Bleomicin, vinca-alkaloidok, taxánok M Mitózis: az örökítőanyag a két utódsejt közt szegregálódik Vinca-alkaloidok, taxánok

Nem fázisspecifikus szerek ž A sejtciklus bármely pontján megöli az osztódó sejtet: • Alkilálószerek • Platinaszármazékok • Szignáltranszdukciógátlók ž Képes megölni a nem osztódó sejteket is: • Szteroidok • Antitumor antibiotikumok

A tumorellenes kezelések típusai ž Sebészi kezelés ž Radioterápia ž Gyógyszeres terápia • Kemoterápia • Hormonterápia • Immunterápia

A tumorellenes kezelések célja ž Kuratív: • Eredménye a végleges gyógyulás ž Palliáció • Cél: tumorkontroll • Eredmény: a tünetek mérséklése és az élet meghosszabbítása • Nem kuratív, de van átmenet („tail of the curve”)

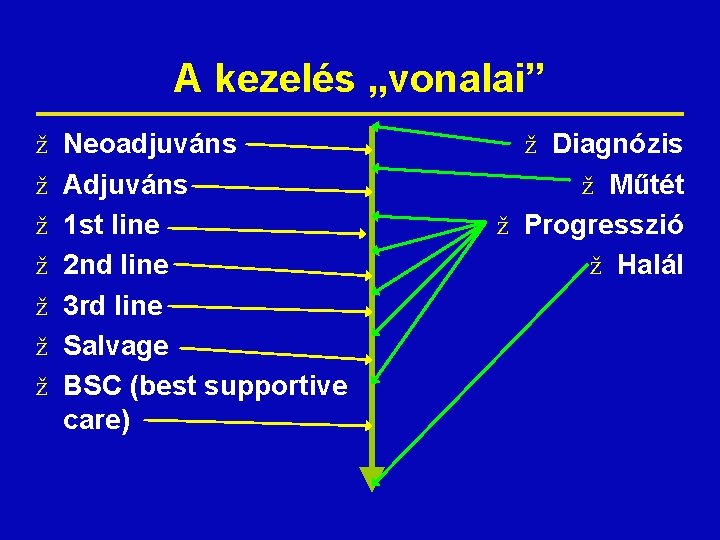
A kezelés „vonalai” ž Neoadjuváns ž Adjuváns ž 1 st line ž 2 nd line ž 3 rd line ž Salvage ž BSC (best supportive care) ž Diagnózis ž Műtét ž Progresszió ž Halál

A tumorellenes kemoterápia elve ž A klasszikus kemoterápia elve: • Használd ki a különbséget! ž Ha a különbség az osztódási rátában van: • A MÉREGTŐL talán előbb a tumorsejtek halnak meg • A gyors osztódási rátájú tumorok jobban kezelhetőek (agresszívebb, de jobb prognózisú? )

Dózis-hatás kapcsolat ž A daganatellenes szerek a daganatsejtekre logaritmikus kinetika szerint hatnak TEHÁT a tumor tömegétől függetlenül egy adott dózis a tumorsejteknek egy adott frakcióját öli meg.

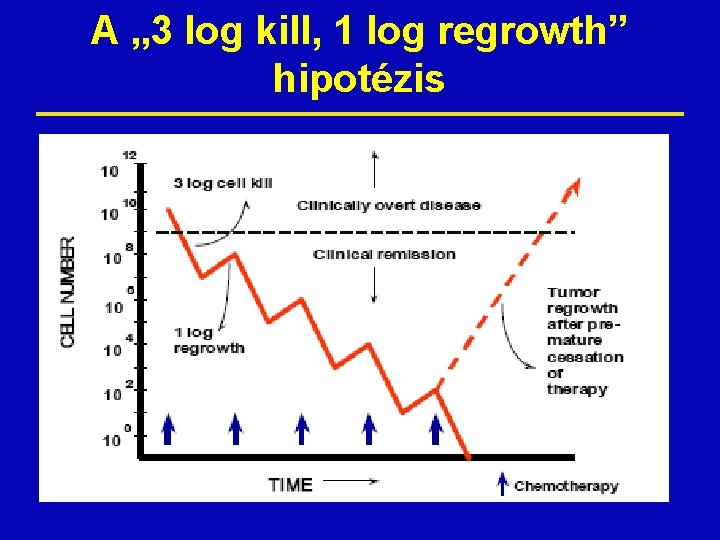
A kemoterápia effektusa Az exponenciális skála szerinti daganatsejtölést a „log kill”-lel jellemezzük (1 log kill a tizedére csökkenő tumor tömegét jelenti). ž Pl. 10 mg/ttkg ciklofoszfamid megöl 3 log kill tumorsejtet, akkor: • 1 kg tumorból összesen 1 g marad (99. 9 % eliminálódik) • A következő kezelés után az 1 g 99. 9%-a elpusztul, marad 1 mg • A hatás mértéke ugyanaz (99. 9 %), még ha a tumormassza 1000 x kevesebb is. ž A logaritmikusan kifejezett sejthalál • egyenesen arányos: • a kemoterápiás ciklusok számával • a duplikációs idővel • fordítottan arányos: • a kezelések közti idővel ž

A „ 3 log kill, 1 log regrowth” hipotézis

A kemoterápia A legjobban korai stádiumban működik, amikor a betegség sejttömege kicsiny!!! Dr. Torday László 2009. 15. Kemoterápia

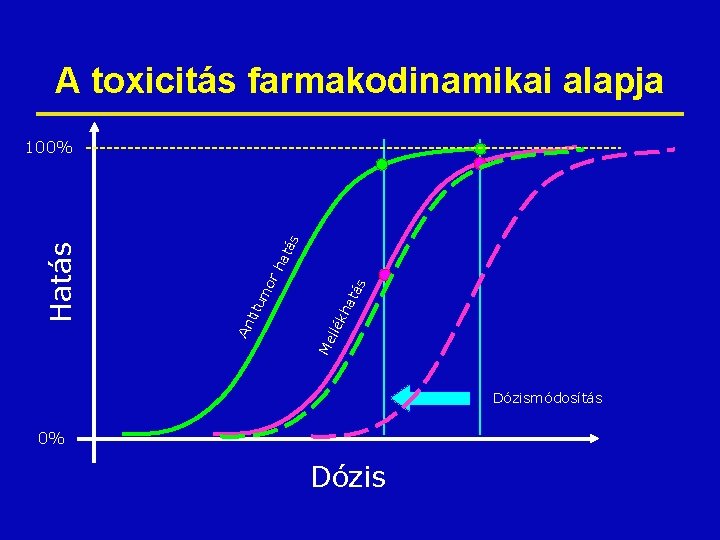
A toxicitás farmakodinamikai alapja Me ll ék h atá s rh atá s mo titu An Hatás 100% Dózismódosítás 0% Dózis

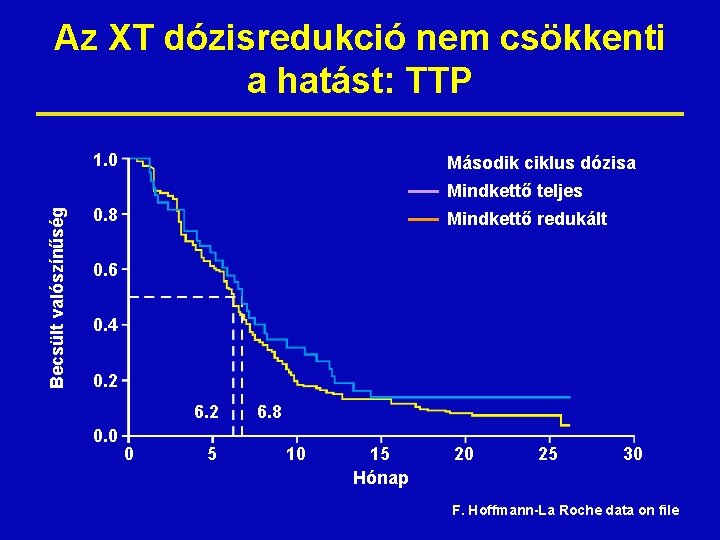
Az XT dózisredukció nem csökkenti a hatást: TTP 1. 0 Második ciklus dózisa Becsült valószínűség Mindkettő teljes 0. 8 Mindkettő redukált 0. 6 0. 4 0. 2 6. 2 0. 0 0 5 6. 8 10 15 Hónap 20 25 30 F. Hoffmann-La Roche data on file

A toxicitásról ž Leggyakoribb toxicitási jelek a gyorsan osztódó szövetelemek károsodása miatt: • Csontvelőlézió • Anémia • Neutropénia • Trombocitopénia • Alopécia • Hasmenés, sztomatitis ž Hányinger, hányás

Összefoglaló

Érfestés onkológus módra

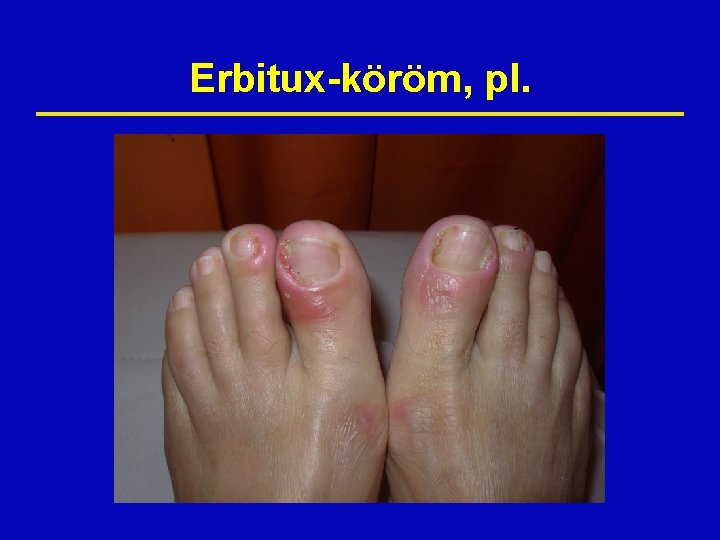
Erbitux-köröm, pl.

A szupportív-palliatív terápia elemei ž Csontvelőtoxicitás ellen: • Transzfúzió, EPO • G-CSF ž Tumoros cachexia ellen: • Magas energiatartalmú táplálás ž Csontmetasztázisok ellen • Biszfonátok ž Hányinger- és hányáscsillapítás • „setron”-ok ž Fájdalomcsillapítás: legyen adekvát!!!

A dózisintenzitás ž A bevitt dózis és a kezelés időtartamának hányadosa (mg/m 2/hét) ž Ez tükrözi a citosztatikum igazi hatását ž Sűrű adagolás • kisebb a csúcskoncentráció • kevesebb mellékhatás

Az életminőség jelentősége ž Qo. L • quality of life • Mit érnek a megnyert hónapok, ha azokat a kórházban kell tölteni, mellékhatásoktól szenvedve? ž Betegpreferencia ž Betegcompliance

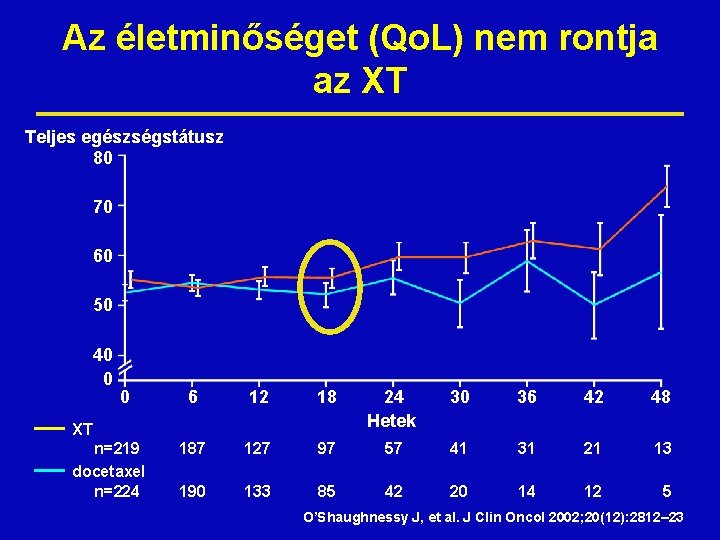
Az életminőséget (Qo. L) nem rontja az XT Teljes egészségstátusz 80 70 60 50 40 0 0 6 12 18 24 Hetek 30 36 42 48 187 127 97 57 41 31 21 13 190 133 85 42 20 14 12 5 XT n=219 docetaxel n=224 O’Shaughnessy J, et al. J Clin Oncol 2002; 20(12): 2812– 23

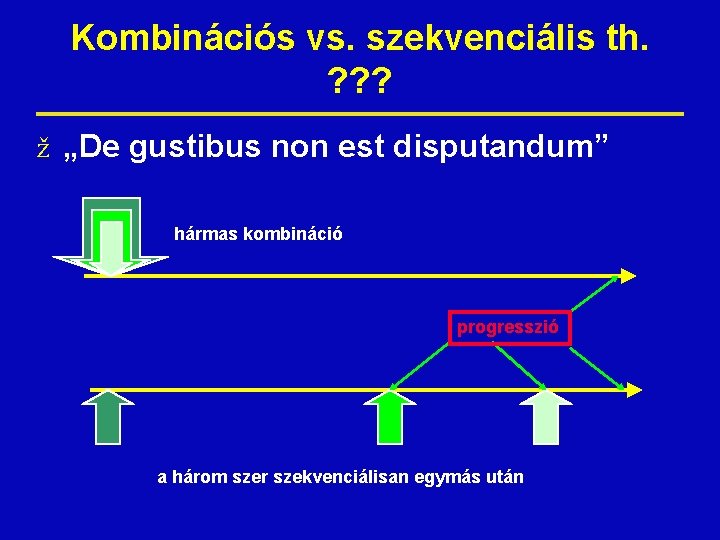
Kombinációs vs. szekvenciális th. ? ? ? ž „De gustibus non est disputandum” hármas kombináció progresszió a három szer szekvenciálisan egymás után

Kombináció vs. mono vs. szekvenciális terápia ž A tumoros sejtpopuláció heterogén • • Kombinációs terápia preferált Monoterápia: egyirányú evolúciós nyomás ž Goldie-Coldman hypothesis • • Nonrandom cytogenetikai változások vezetnek a rezisztenciához Ahogy adaganatos sejtek száma nő, a nehezen eradikálható gyógyszerrezisztens mutánsok megjelenési esélye is növekszik.

Érvek a kombinációs kezelések mellett ž Rezisztens klónok kialakulásának ž ž gátlása A hatás biokémiai erősítése Az osztódó, s a nem osztódó sejtek egyidejű elpusztítása Rescue Sanctuary access

Kombinációs kezelés megtervezése ž Olyan szert kell használni, amelyik a ž ž megcélzott tumortípusra hat A szerek különbözzenek a hatásmechanizmusban A fő toxicitási profil ne legyen átfedő Optimális időzítést és dozírozát kell alkalmazni Ne legyen keresztrezisztencia

A gyógyszerrezisztencia okai (természetes, vagy szerzett) ž Sejtkinetika: • Kevés az osztódó sejt, a nyugalmi állapotban lévőkre nem hat a kemó ž Biokémia: • • • A tumor nem alakítja át a gyógyszert annak aktív formájává A tumor „védett” helyen van MDR pumpa ž Farmakológia: • • Rossz felszívódás Fokozott kiválasztás Gyógyszerinterakciók Rossz penetráció a tumorba

Az tumorellenes terápia klinikai jellemzői ž Válaszráta: RR (PR+CR) • Betegségkontroll ráta: DCR (RR+SD) ž Progresszióig eltelt medián idő: TTP ž Medián teljes túlélés: OS ž Eseménymentes medián túlélés: EFS ž A válasz időtartama: DR

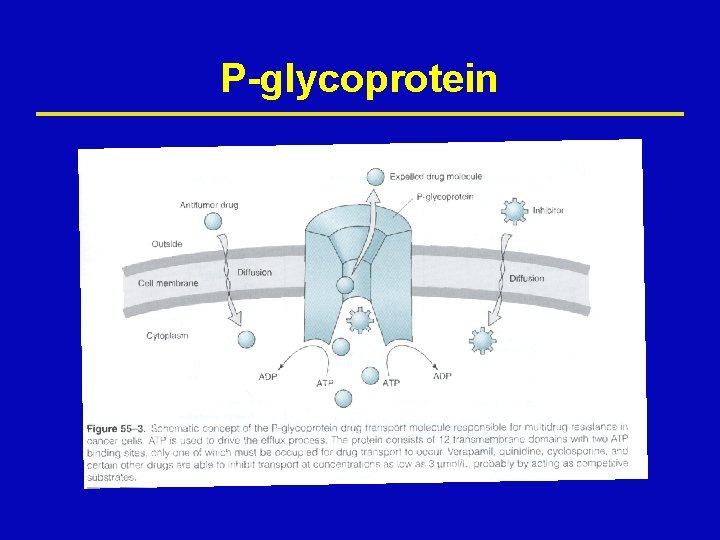
P-glycoprotein

A válaszok definíciója ž Komplett remisszió • A betegség nem mutatható ki képalkotó eljárással ž Parciális remisszió • A tumor mérete nagyobbat csökkent, mint 50% ž Stabil betegség • Nem progresszív betegség, de nem is válasz ž Progresszív betegség • A tumor mérete többet nőtt, mint 25%

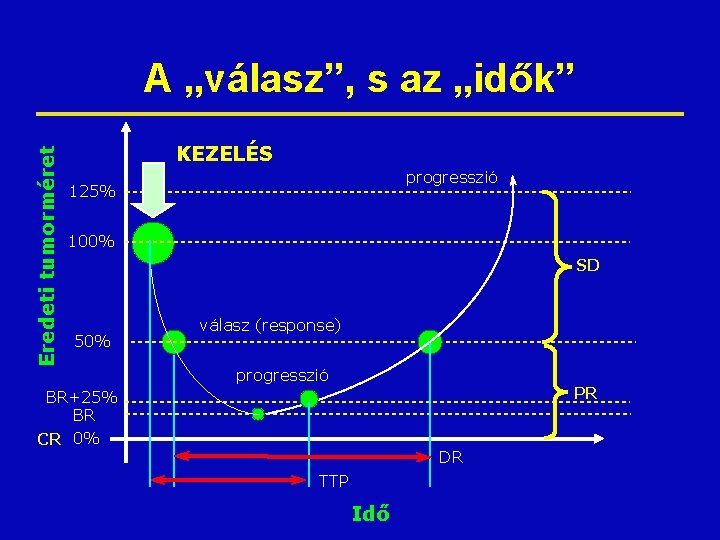
Eredeti tumorméret A „válasz”, s az „idők” KEZELÉS progresszió 125% 100% SD 50% válasz (response) progresszió PR BR+25% BR CR 0% DR TTP Idő

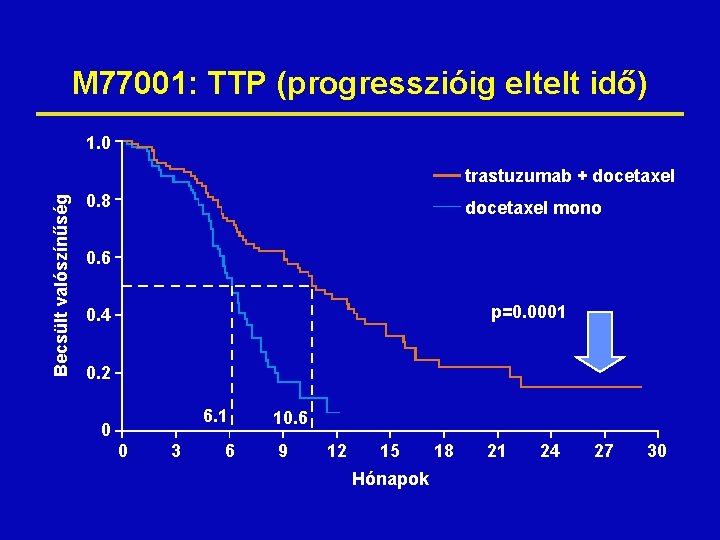
M 77001: TTP (progresszióig eltelt idő) 1. 0 Becsült valószínűség trastuzumab + docetaxel 0. 8 docetaxel mono 0. 6 p=0. 0001 0. 4 0. 2 6. 1 0 0 3 6 10. 6 9 12 15 Hónapok 18 21 24 27 30

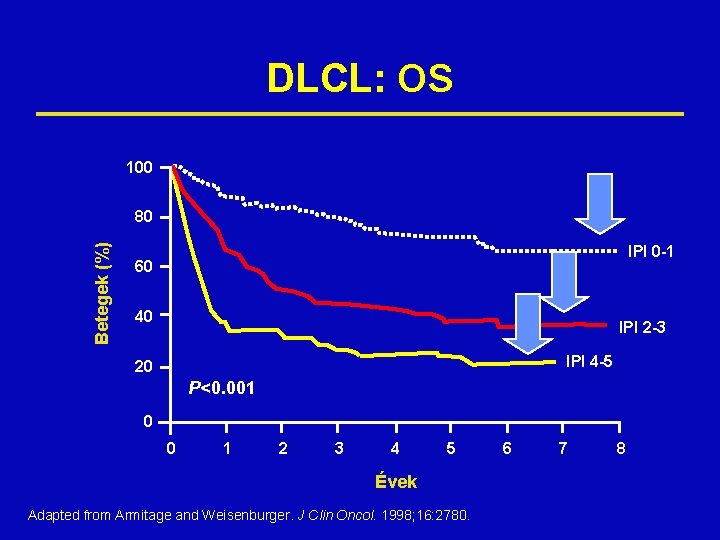
DLCL: OS 100 Betegek (%) 80 IPI 0 -1 60 40 IPI 2 -3 IPI 4 -5 20 P<0. 001 0 0 1 2 3 4 5 Évek Adapted from Armitage and Weisenburger. J Clin Oncol. 1998; 16: 2780. 6 7 8

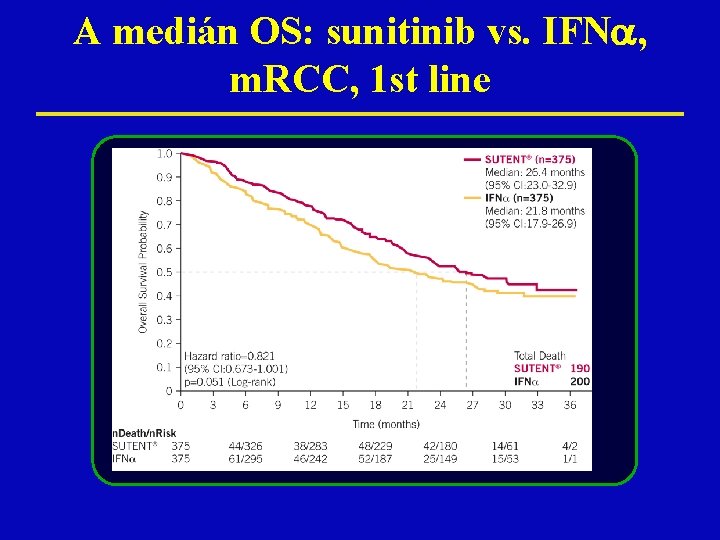
A medián OS: sunitinib vs. IFN , m. RCC, 1 st line

A kemoterápia használatát befolyásoló tényezők ž Betegség: • • • A tumoros betegség lefolyása A betegség stádiuma A tumor kemoterápiára adottt válaszkészsége ž Beteg: • • Kor Általános állapot Tápláltsági állapot Jelenlévő orvosi problémák Pszichológiai faktorok A betegség tünetei Életminőség biztosítása

A kemoterápia megadhatóságát befolyásoló állapotok ž Infekció ž Neutropénia ž Trombocitopénia ž Súlyos fogyatékosság ž Terhesség (első trimeszter ž Nagyműtét (2 hete) ž Rossz betegkövetési lehetőség ž Pszichológiai bajok ž Terminális betegség

Klinikai vizsgálatok Fázis 1 ž Humán tolerancia vizsgálat ž Farmakokinetikai vizsgálat ž Kisszámú egészséges férfi önkéntesen ž Cél: az MTD (maximálisan tolerálható dózis) meghatározása ž Ide tartoznak a bioekvivalenciavizsgálatok is!

Klinikai vizsgálatok Fázis 2 ž Betegeken történik Prospektív Célja a farmakodinámiás hatás detektálása A fázis I. során meghatározott dózist használja Onkológiai betegeken sokszor kevert fázis I-II. Betegszám: 20 -100 Nagyon homogén betegcsoport ž Fázis IIa ž ž ž ž • egykarú Fázis IIb • • Összehasonlító Pivotal tudies

Klinikai vizsgálatok Fázis 3 ž ž ž Optimális dozírozás meghatározása Főbb mellékhatásprofil leírása Indikáció meghatározása Törzskönyvező vizsgálatok Nagy betegszám, prospektív, multicentrikus, összehasonlító, kontrollált, dupla vak • Placebo vagy „gold standard” • ž ž Etikai kérdések Fázis IIIa • törzskönyvező Fázis IIIb • indikációbővítő

Klinikai vizsgálatok Fázis 4 ž Bármely vizsgált az adott indikációban engedélyezett szerrel • Leíró vizsgálatok (descriptive studies) • Spontán AE jelentések • Postmarketing surveillance • Prospektív kohortvizsgálatok

A kemoterápia hatása 01. ž Kurábilis: • • • Akut leukémia Non-Hodgkin lymphoma (egyes agresszív formák) Hodgkin lymphoma Wilm’s tumor Ewing-sarcoma Retinoblastoma Herekarcinóma Choriocarcinoma Ováriumkarcinoma

A kemoterápia hatása 02. ž Javítja a túlélést: • • • Neuroblastoma (gyerekkori) Agresszív Non-Hodgkin lymphoma Kissejtes tüdőrák Emlőrák Kolorektális rák Osteogén sarcoma

A kemoterápia hatása 03. ž Esetenkénti válasz: • • • Lágyrész sarcoma Agytumor Nem kis sejtes tüdőrák Fej-nyaki tumorok Tranzícionális sejtes hólyagrák

A kemoterápia hatása 04. ž Palliáció: • • • Non-Hodgkin lymphoma (alacsony és közepes grádusú) Krónikus leukémia Myeloma multiplex Prosztatarák Endokrin tumorok

A kemoterápia hatása 05. ž Ineffektív: • • • Melanóma Hasnyálmirigyrák Veserák

A kemoterápiás szerek felosztása ž Alkiláló szerek ž Antibiotikumok ž Antimetabolitok ž Biológiai szerek ž Hormonális ágensek ž Növényi eredetű szerek ž Új fejlesztések

Alkiláló szerek ž Nitrogénmustárok • • • Klorambucil Ciklofoszfamid Ifoszfamid Melphalan Meklóretamin ž Thiotepa ž Buszulfán ž Nitrozoureák • • • Carmustin Lomustin Streptozotocin ž Dakarbazin ž Prokarbazin ž Platinaszármazékok • • Cisplatin Carboplatin

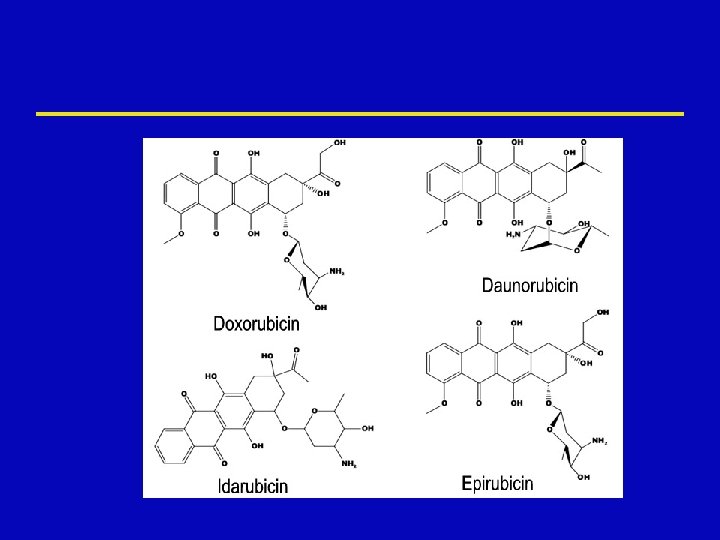
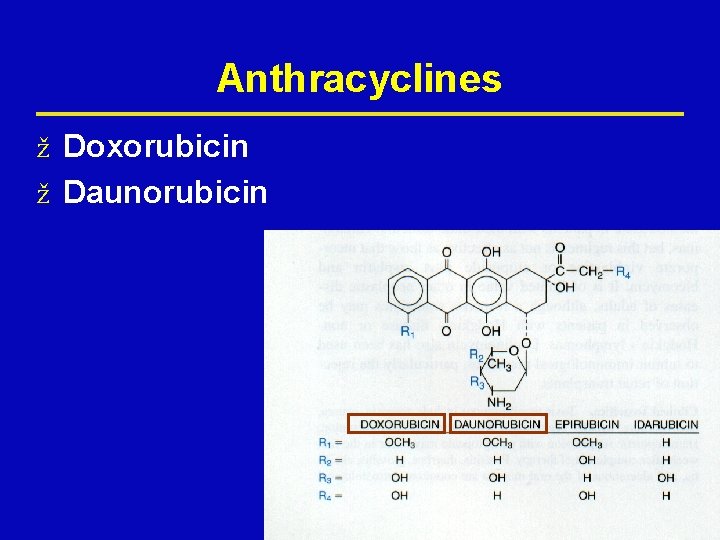
Antibiotikumok ž Doxorubicin ž Epirubicin ž Daunorubicin ž Idarubicin ž Mitoxantron ž Daktinomycin ž Bleomycin ž Mitomycin C ž Plicamycin

Antibiotikumok ž Doxorubicin ž Epirubicin ž Daunorubicin ž Idarubicin ž Mitoxantron ž Daktinomycin ž Bleomycin ž Mitomycin C ž Plicamycin

Antimetabolitok ž 5 -fluorouracil ž Citarabin ž Floxuridin ž Pentosztatin ž Metotrexát ž Fludarabin ž Leukovorin ž Kladribin ž Hidroxiurea ž Aszparagináz ž Thioguanin ž Gemcitabin ž Merkaptopurin

Biológiai szerek ž Interleukin ž Interferon ž BCG ž Levamizol ž CSF ž Oktreitod ž Retinoidok

Hormonális szerek ž Tamoxifen ž Megesztrol acetát ž Anastrazol ž Letrozol ž Goserelin ž Leuprolid ž Bicalutamid ž Flutamid

Növényi eredetű szerek ž Vincristin ž Vinblastin ž Etoposid ž Teniposid ž Paclitaxel ž Docetaxel ž Irinotecan ž Vinorelbin

Új szerek ž Monoklonális ellenanyagok • • • Trastuzumab Rituximab Bevacizumab Cetuximab Panitumumab ž Bcl-abr TKI • Imatinib ž MKI • • Sorafenib Sunitinib ž EGFR TKI • • Gefitinib Erlotinib

SZÜNET!!! Dr. Torday László 2009. 15. Kemoterápia

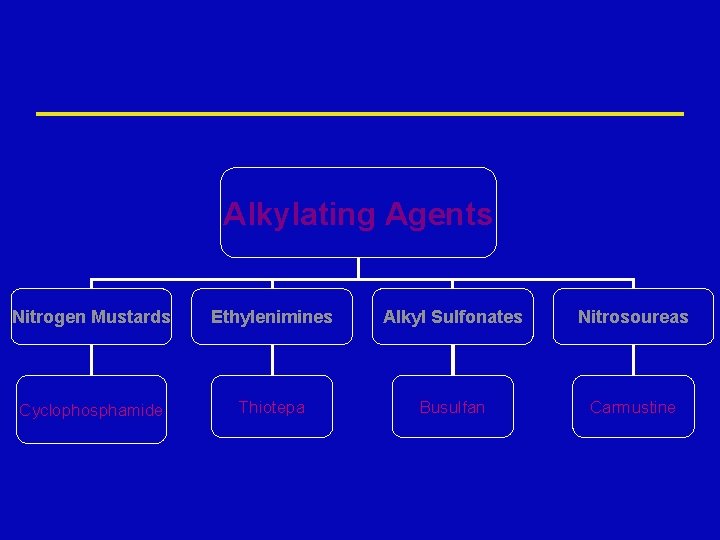
Alkylating Agents Nitrogen Mustards Ethylenimines Alkyl Sulfonates Nitrosoureas Cyclophosphamide Thiotepa Busulfan Carmustine

Alkiláló szerek Alkilezés, alkilálás: • Egy vegyület alkilcsoportja kicserélődik egy másik vegyület hidrogénjére ž Alkiláló antineoplasztikus szerek • Az alkilcsoportot a DNS-re kötik fel (DNS alkilálás) ž Történet: • 1943, Bari, baleset ž

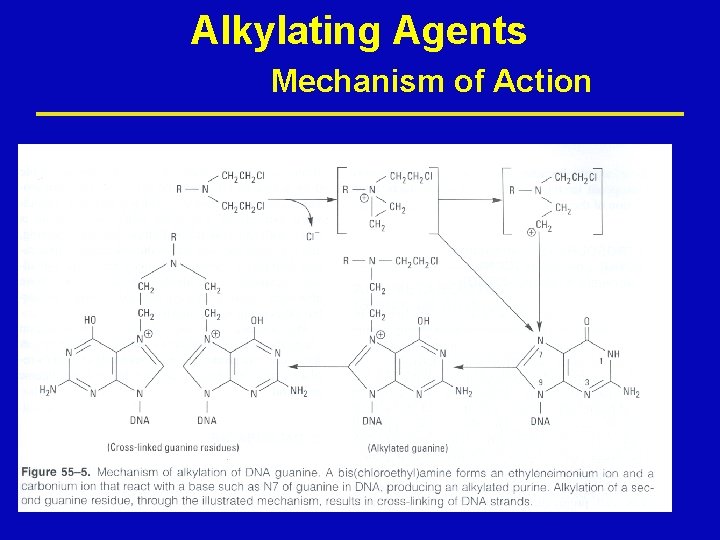
Alkylating Agents Mechanism of Action ž Alkylate within DNA at the N 7 position of guanine ž Resulting in miscoding through abnormal base-pairing with thymine or in depurination by excision of guanine residues, leading to strand breakage ž Cross-linking of DNA and ring cleavage may also occur

Alkylating Agents Mechanism of Action

A fejlesztés útjai

Nitrogen Mustards ž Cyclophosphamide ž Ifosfamide ž Mechlorethamine ž Melphalan ž Chlorambucil

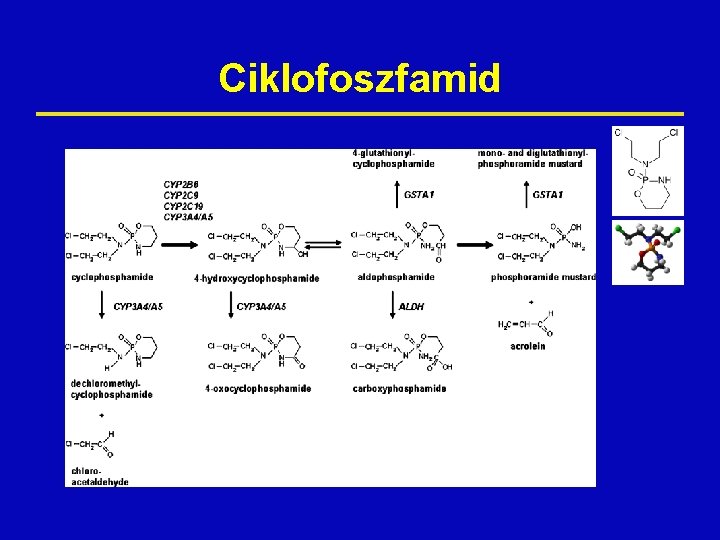
Ciklofoszfamid

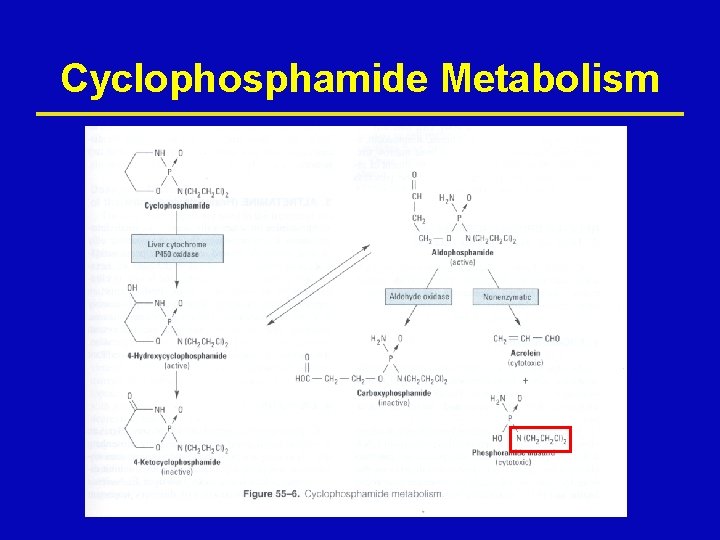
Cyclophosphamide Metabolism

Nitrosoureas ž Carmustine ž Lomustine ž Semustine ž Streptozocin-naturally occuring sugar containing M. O. A. - cross-link through alkylation of DNA All cross the blood brain barrier

Alkylating-Related Agents ž Procarbazine ž Dacarbazine ž Altretamine ž Cisplatin ž Carboplatin

Platinum Coordination Complexes These compounds alkylate N 7 of guanine. They cause nephro- and ototoxicity. To counteract the effects of nephrotoxicity, give mannitol as an osmotic diuretic, or induce chloride diuresis with 0. 1% Na. Cl.

Alkylating Agents Toxicity ž Bone marrow depression, with leukopenia and thrombocytopenia ž Cyclophosphamide/Ifosfamide - hemorrhagic cystitis • Reduced by coadministration with MESNA ž Cisplatin/Carboplatin - ototoxic and nephrotoxic • Nephrotoxicity reduced by chloride diuresis and hydration

Alkylating Agents Therapeutic Uses ž Used to treat a wide variety of hematologic ž ž and solid tumors Thiotepa – ovarian cancer Busulfan – chronic myeloid leukemia Nitrosoureas - brain tumors Streptozocin – insulin-secreting islet cell carcinoma of the pancreas

A platinaszármazékok felfedezése ž Barnett Rosenberg • Az elektromos mező hatását tanulmányozta az Eschericia coli osztódására. • A baktériumok megnőttek, de nem osztódtak! • Egy év múlva kimutatták, hogy ennek az oka a platinaelektródon keletkező elektrolízises termékek képződése. • Elkezdődtek a platinaszármazékok és a sejtosztódás kapcsolatát vizsgáló kutatások. ž 1970, Rosenburg • A platinaszármazékok szignifikáns antitumor aktivitásának kimutatása

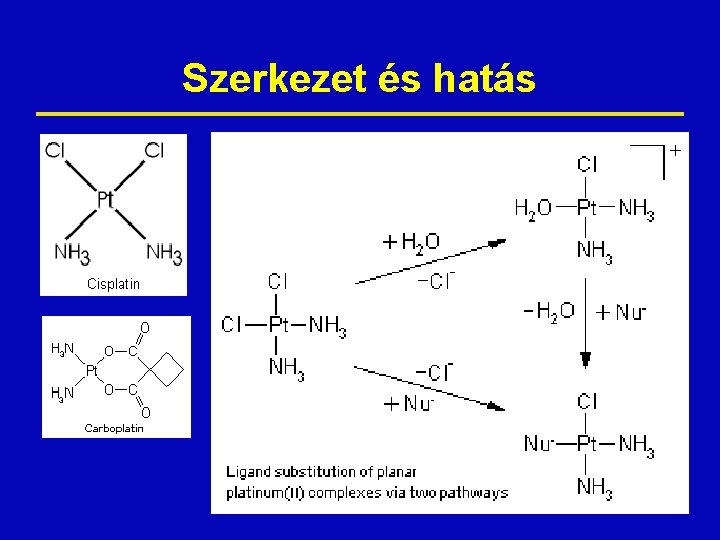
Platinaszármazékok ž Carboplatin ž Cisplatin ž Oxaliplatin ž Platinizáció: DNS szálak keresztkötése a guaninokon keresztül

Szerkezet és hatás

A platinaszármazékok toxicitása ž Nefrotoxicitás • • dózisdependens tubuláris degeneráció a proximális tubulusokban • SH-depléció megfelelő hidráció és diurézis szükséges Ototoxicitás ž Nausea, vomitus ž • extrém súlyos Étvágytalanság, fogyás, hasmenés ž Myelosupresszió ž • ž trombocitopénia, granulopénia Hatás az epidermális és a follikuláris sejtekre • angioödéma, erythema, exfoliatív dermatitis, arcödéme, kipirulás, hyperhidrosis, kiütések, alopecia, hypomelanosis, anaphylaxis, ínyelszíneződés, cellulitis az injekció helyén, az orális nyálkahártya léziói

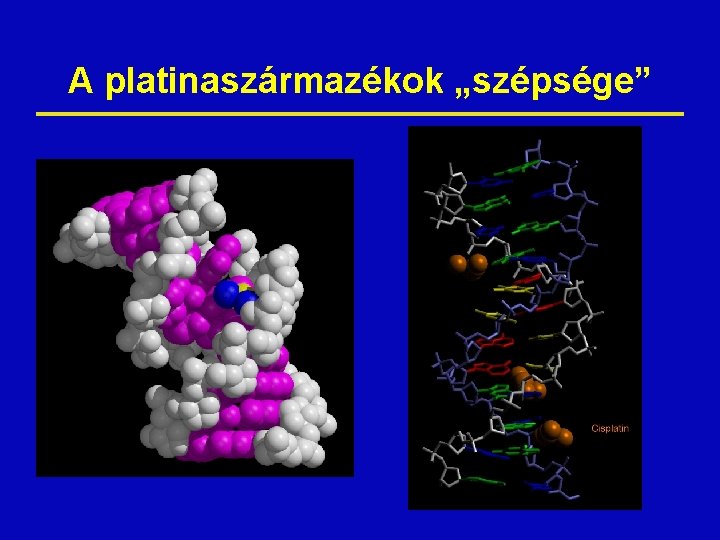
A platinaszármazékok „szépsége”

A platinaszármazékok használata Fej-nyaki tumorok Refrakter non-Hodgkins limfómák Hólyag cc. Tüdő cc. Uterus cc. Cervix cc. Ovárium cc. Hererák (pl. vinblastinnal és bleommycinnel kombinálva a CR 74%, a PR 26%. ) ž Emlőcc. ž ž ž ž

Oxaliplatin

Oxaliplatin a CRC új reménye? ž FOLFOX, XELOX ž CRC adjuváns kezelése (MOSAIC) ž MCRC kezelése (N 9741)

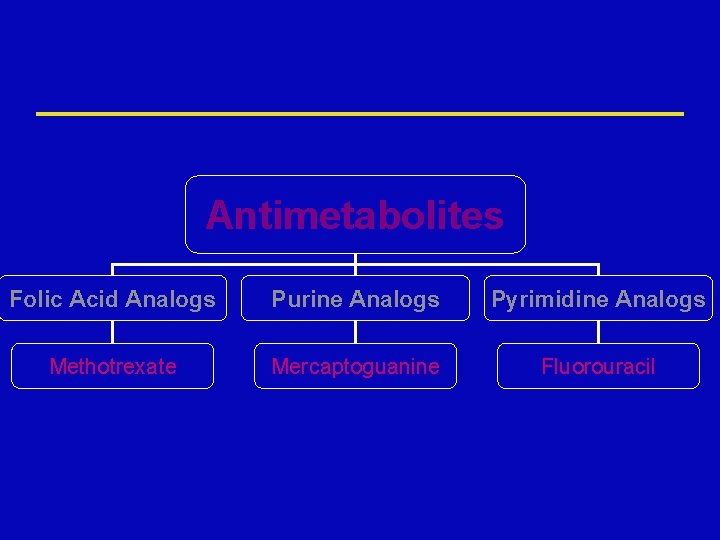
Antimetabolites Folic Acid Analogs Purine Analogs Pyrimidine Analogs Methotrexate Mercaptoguanine Fluorouracil

Folic Acid Analogs ž Methotrexate ž Trimetrexate ž Pemetrexed

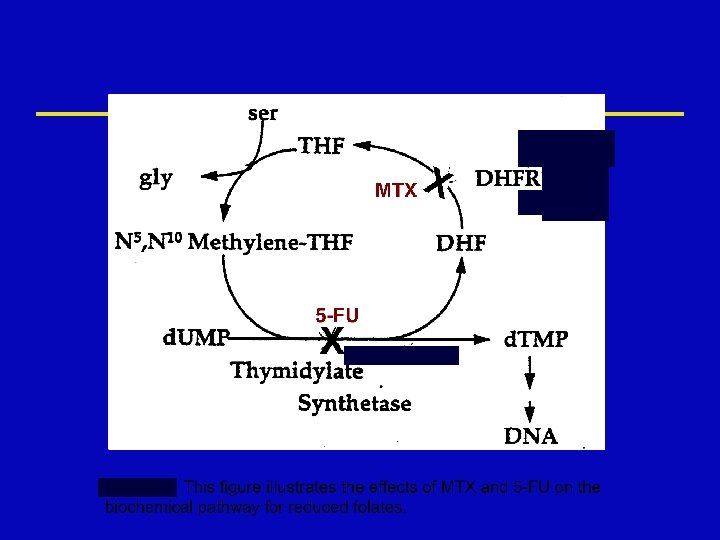
Folate ž An essential dietary factor, from which THF cofactors are formed which provide single carbon groups for the synthesis of precursors of DNA and RNA ž To function as a cofactor folate must be reduced by DHFR to THF

Methotrexate Mechanism of Action n The enzyme DHFR is the 1º site of action n MTX prevents the formation of THF, causing an intracellular deficiency of folate coenzymes and accumulation of the toxic inhibitory substrate, DHF polyglutamate n The one carbon transfer reactions for purine and thymidylate synthesis cease, interrupting DNA and RNA synthesis

Major Enzymatic Reactions Requiring Folates as Substrates* GAR transformylase DHF (1) d. TMP AICAR transformylase AICAR (3) 10 -formyl. THF Formate + b TH Fe 5, 10 -CH 2 THF a DNA *from Bowen d. UMP IMP AMP GMP (2) Methionine c 5 -CH 3 THF d Homocysteine a, thymidylate synthase; b, dihydrofolate reductase; c, methylenetetrahydrofolate reductase; d, methionine synthase; e, serine hydroxymethyl transferase

Resistance

Methotrexate Mechanism of Resistance 1. Decreased drug transport 2. Altered DHFR 3. Decreased polyglutamate formation 4. Increased levels of DHFR

Methotrexate Therapeutic Uses ž Methotrexate- psoriasis, rheumatoid arthritis, acute lymphoblastic leukemia, meningeal leukemia, choriocarcinoma, osteosarcoma, mycosis fungoides, Burkitt’s and non -Hodgkin’s lymphomas, cancers of the breast, head and neck, ovary, and bladder

Trimetrexate Therapeutic Uses ž Trimetrexate- Pneumocystis carinii pneumonia, metastatic colorectal carcinoma, head and neck carcinoma, pancreatic carcinoma, non-small cell carcinoma of the lung

Pemetrexed Therapeutic Uses ž Pemetrexed- Mesothelioma

Methotrexate Toxicity ž Bone marrow suppression • Rescue with leucovorin (folinic acid) ž Nephrotoxic • give sodium bicarbonate to alkalinize the urine

Purine Antagonists ž Mercaptopurine ž Thioguanine ž Fludarabine Phosphate ž Cladribine

Mercaptopurine/Thioguanine ž Must metabolized by HGPRT to the nucleotide form ž This form inhibits numerous enzymes of purine nucleotide interconversion

Fludarabine Phosphate ž M. O. A. - phosphorylated intracellularly by deoxycytidine kinase to the triphosphate form ž The metabolite inhibits DNA polymerase -α and ribonucleotide reductase ž Induces apoptosis ž Tx- non-Hodgkin’s lymphoma and chronic lymphocytic leukemia

Cladribine ž M. O. A. -phosphorylated by deoxycytidine kinase and is incorporated into DNA ž Causes DNA strand breaks ž Tx- hairy cell leukemia, chronic lymphocytic leukemia, and non. Hodgkin’s lymphoma

Pyrimidine Antagonists ž Fluorouracil - S-phase ž Cytarabine ž Gemcitabine ž Capecitabine


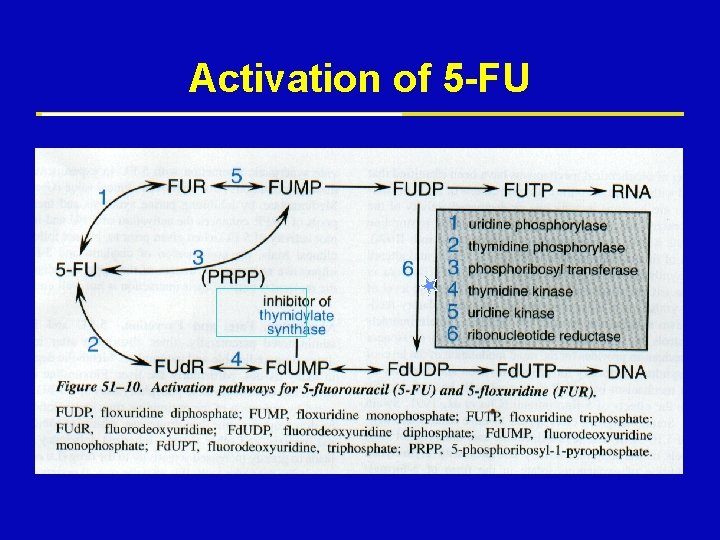
Mechanism of Action 5 -FU ž 5 -FU inhibits thymidylate synthase therefore causing depletion of Thymidylate ž 5 -FU is incorporated into DNA ž 5 -FU inhibits RNA processing

Activation of 5 -FU

Therapeutic Uses of 5 -FU ž Metastatic carcinomas of the breast and the GI tract ž hepatoma ž carcinomas of the ovary, cervix, urinary bladder, prostate, pancreas, and oropharyngeal areas ž Combined with levamisole for Tx of colon cancer

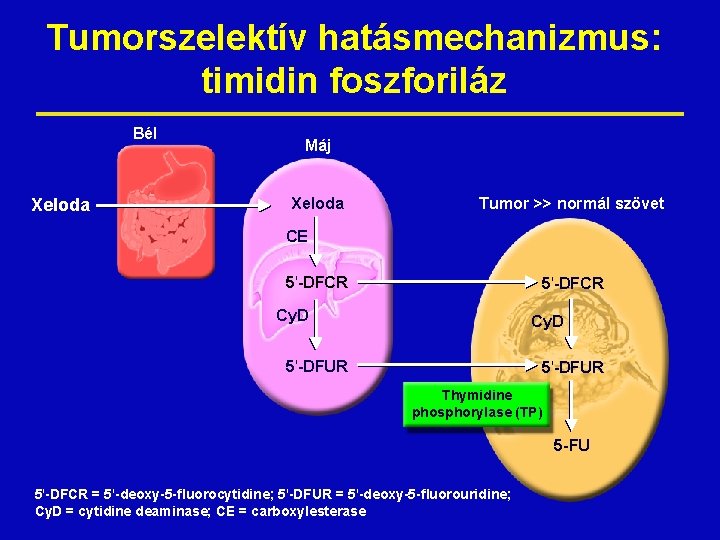
Tumorszelektív hatásmechanizmus: timidin foszforiláz Bél Xeloda Máj Xeloda Tumor >> normál szövet CE 5'-DFCR Cy. D 5'-DFUR Thymidine phosphorylase (TP) 5 -FU 5'-DFCR = 5'-deoxy-5 -fluorocytidine; 5'-DFUR = 5'-deoxy-5 -fluorouridine; Cy. D = cytidine deaminase; CE = carboxylesterase

A timidin foszforiláz (TP) “Tumor-associated angiogenic factor” vagy “platelet-derived endothelial cell growth factor (PD-ECGF) 1” Apoptózisellenes hatású 2 A TP szintje korrelál a – gyors malignus növekedéssel – aggresszíve inváziós potenciál – rossz prognózis 3 A TP aktivitás révén a capecitabine specifikusan ezeken a sejteken hat 1 Moghaddam 2 Kitazono A et al. Proc Natl Acad Sci USA 1995; 92: 998– 1002 M et al. Biochem Biophys Res Commun 1998; 253: 797– 803 3 Takebayashi Y et al. J Natl Cancer Inst 1996; 88: 1110– 17

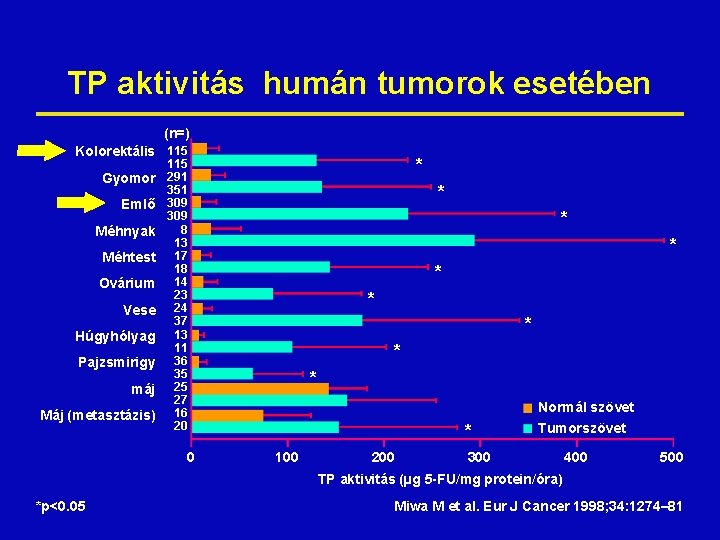
TP aktivitás humán tumorok esetében (n=) Kolorektális 115 Gyomor Emlő Méhnyak Méhtest Ovárium Vese Húgyhólyag Pajzsmirigy máj Máj (metasztázis) * 115 291 351 309 8 13 17 18 14 23 24 37 13 11 36 35 25 27 16 20 0 * * * * * 100 200 Normál szövet Tumorszövet 300 400 500 TP aktivitás (µg 5 -FU/mg protein/óra) *p<0. 05 Miwa M et al. Eur J Cancer 1998; 34: 1274– 81

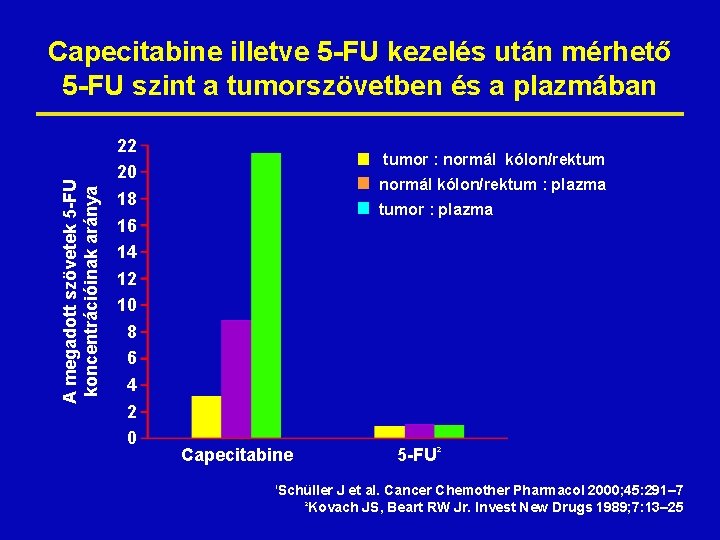
A megadott szövetek 5 -FU koncentrációinak aránya Capecitabine illetve 5 -FU kezelés után mérhető 5 -FU szint a tumorszövetben és a plazmában 22 20 18 16 14 12 10 8 6 4 2 0 tumor : normál kólon/rektum : plazma tumor : plazma Capecitabine 5 -FU 2 Schüller J et al. Cancer Chemother Pharmacol 2000; 45: 291– 7 Kovach JS, Beart RW Jr. Invest New Drugs 1989; 7: 13– 25 1 2

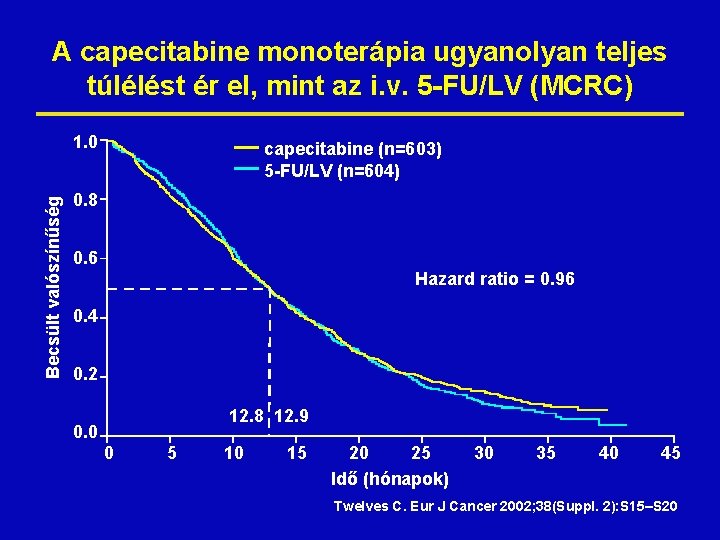
A capecitabine monoterápia ugyanolyan teljes túlélést ér el, mint az i. v. 5 -FU/LV (MCRC) Becsült valószínűség 1. 0 capecitabine (n=603) 5 -FU/LV (n=604) 0. 8 0. 6 Hazard ratio = 0. 96 0. 4 0. 2 12. 8 12. 9 0. 0 0 5 10 15 20 25 Idő (hónapok) 30 35 40 45 Twelves C. Eur J Cancer 2002; 38(Suppl. 2): S 15–S 20

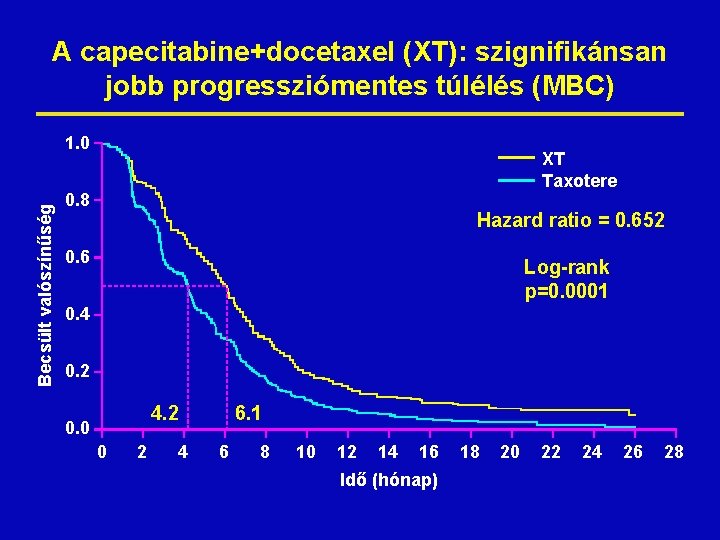
A capecitabine+docetaxel (XT): szignifikánsan jobb progressziómentes túlélés (MBC) Becsült valószínűség 1. 0 XT Taxotere 0. 8 Hazard ratio = 0. 652 0. 6 Log-rank p=0. 0001 0. 4 0. 2 4. 2 0. 0 0 2 4 6. 1 6 8 10 12 14 16 Idő (hónap) 18 20 22 24 26 28

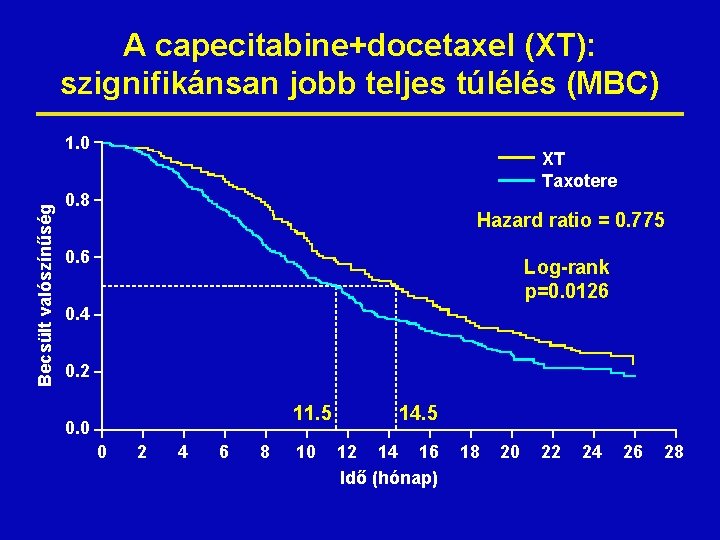
A capecitabine+docetaxel (XT): szignifikánsan jobb teljes túlélés (MBC) Becsült valószínűség 1. 0 XT Taxotere 0. 8 Hazard ratio = 0. 775 0. 6 Log-rank p=0. 0126 0. 4 0. 2 11. 5 0. 0 0 2 4 6 8 10 14. 5 12 14 16 Idő (hónap) 18 20 22 24 26 28

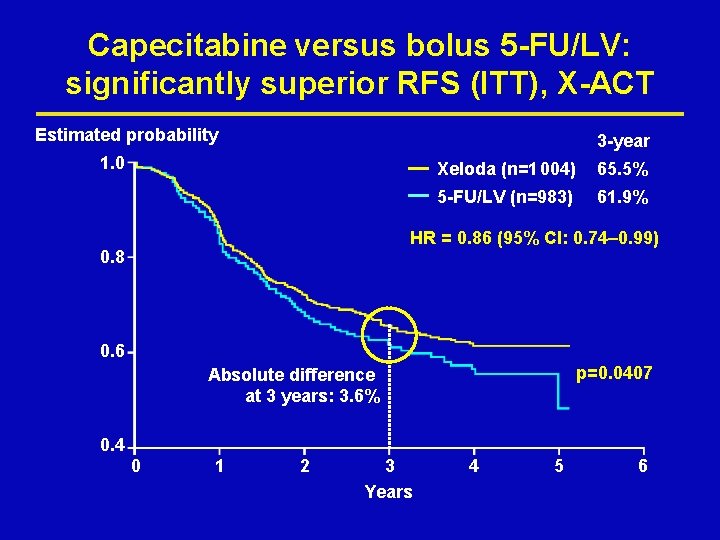
Capecitabine versus bolus 5 -FU/LV: significantly superior RFS (ITT), X-ACT Estimated probability 3 -year 1. 0 Xeloda (n=1 004) 65. 5% 5 -FU/LV (n=983) 61. 9% HR = 0. 86 (95% CI: 0. 74– 0. 99) 0. 8 0. 6 p=0. 0407 Absolute difference at 3 years: 3. 6% 0. 4 0 1 2 3 Years 4 5 6

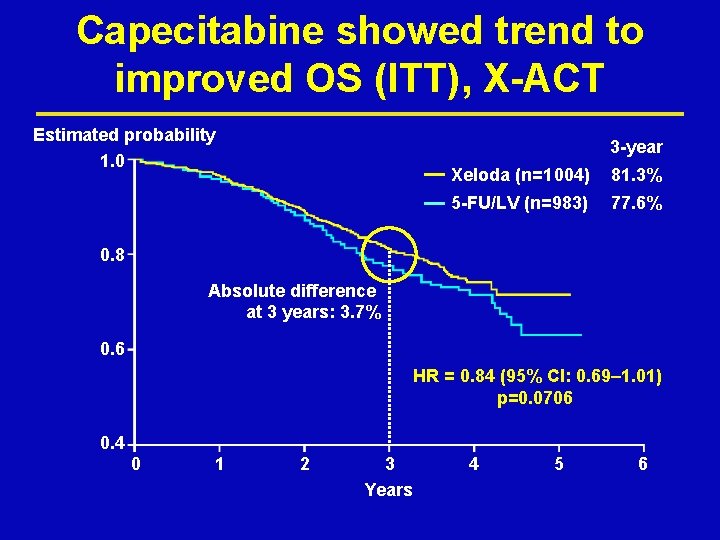
Capecitabine showed trend to improved OS (ITT), X-ACT Estimated probability 1. 0 3 -year Xeloda (n=1 004) 81. 3% 5 -FU/LV (n=983) 77. 6% 0. 8 Absolute difference at 3 years: 3. 7% 0. 6 HR = 0. 84 (95% CI: 0. 69– 1. 01) p=0. 0706 0. 4 0 1 2 3 Years 4 5 6

Cytarabine ž It is activated to 5’ monophosphate (Ara. CMP) by deoxycytidine kinase ž Through a series of reactions it forms the diphosphate (Ara. CDP) and triphosphate (Ara. CTP) nucleotides ž Accumulation of Ara. CTP potently inhibits DNA synthesis ž Inhibition of DNA synthesis is due to competitive (-) of polymerases and interference of chain elongation

Cytarabine ž It is a potent inducer of tumor cell differentiation ž Fragmentation of DNA and evidence of apoptosis is noticed in treated cells ž Ara. C is cell-cycle specific agent, it kills cells in the S-phase

Cytarabine Mechanisms of Resistance ž deficiency of deoxycytidine kinase ž increased CTP synthase activity ž increased cytidine deaminase activity ž decreased affinity of DNA polymerase for Ara. CTP ž decrease ability of the cell to transport Ara. C

Cytarabine Therapeutic Uses ž Induction of remissions in acute leukemia ž Treats meningeal leukemia ž Treatment of acute nonlymphocytic leukemia ž In combination with anthracyclines or mitoxantrone it can treat non-Hodgkin’s lymphomas

Cytarabine Toxicities ž Nausea ž acute myelosuppression ž stomatitis ž alopecia

Gemcitabine ž Gemcitabine is S-phase specific ž it is a deoxycytidine antimetabolite ž it undergoes intracellular conversion to gemcitabine monophosphate via the enzyme deoxycytidine kinase ž it is subsequently phosphorylated to gemcitabine diphosphate and gemcitabine triphosphate

Gemcitabine ž Gemcitabine triphosphate competes with deoxycytidine triphosphate (d. CTP) for incorporation into DNA strands ž do to an addition of a base pair before DNA polymerase is stopped, Gemcitabine inhibits both DNA replication and repair ž Gemcitabine-induced cell death has characteristics of apoptosis

Gemcitabine Therapeutic Uses ž Gemcitabine treats a variety of solid tumors ž very effective in the treatment of pancreatic cancer ž small cell lung cancer ž carcinoma of the bladder, breast, kidney, ovary, and head and neck

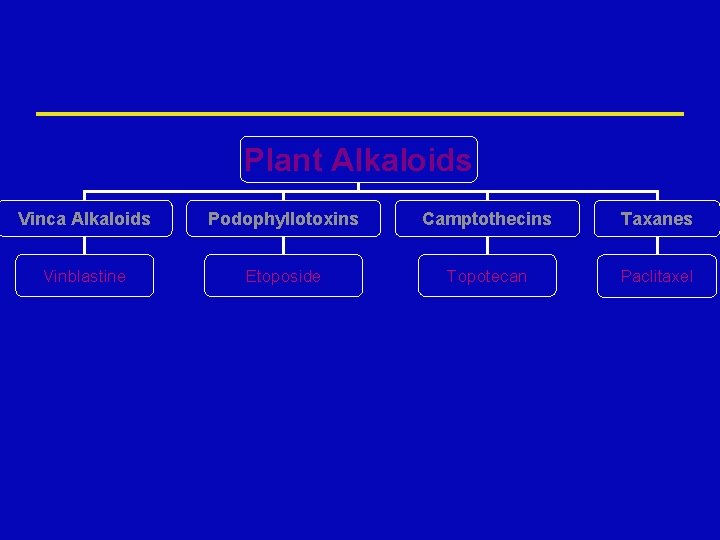
Plant Alkaloids Vinca Alkaloids Podophyllotoxins Camptothecins Taxanes Vinblastine Etoposide Topotecan Paclitaxel

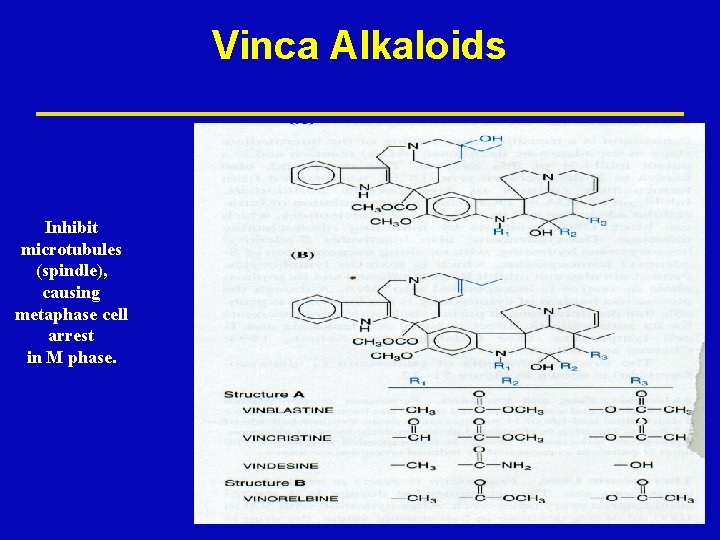
Vinca Alkaloids ž Vinblastine ž Vincristine ž Vinorelbine

Vinca Alkaloids Inhibit microtubules (spindle), causing metaphase cell arrest in M phase. 3 3

Vinca Alkaloids Mechanism of Action ž Binds to the microtubular protein tubulin in a ž ž dimeric form The drug-tubulin complex adds to the forming end of the microtubules to terminate assembly Depolymerization of the microtubules occurs Resulting in mitotic arrest at metaphase, dissolution of the mitotic spindle, and interference with chromosome segregation CCS agents- M phase

Vinblastine Toxicity ž Nausea ž Vomiting ž Marrow depression ž Alopecia

Vinblastine Therapeutic Uses ž Systemic Hodgkin’s disease ž Lymphomas

Vincristine Toxicity ž Muscle weakness ž Peripheral neuritis

Vincristine Therapeutic Uses ž With prednisone for remission of Acute Leukemia

Vinorelbine Toxicity ž Granulocytopenia Therapeutic Uses ž non-small cell lung cancer

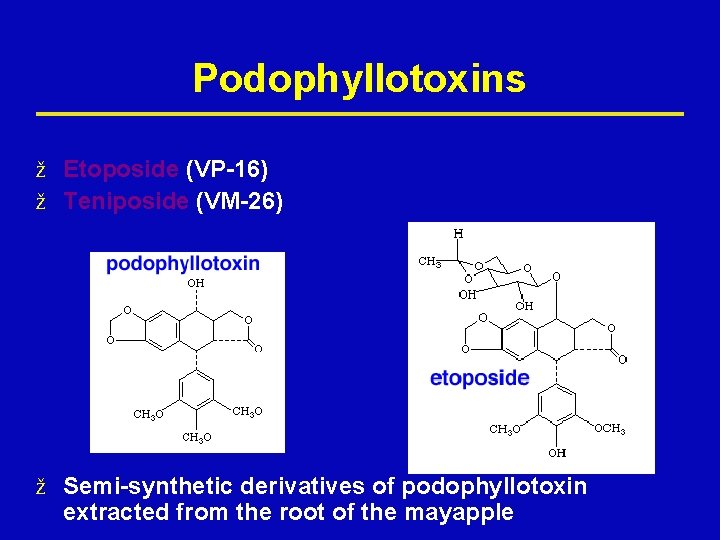
Podophyllotoxins ž Etoposide (VP-16) ž Teniposide (VM-26) ž Semi-synthetic derivatives of podophyllotoxin extracted from the root of the mayapple

Podophyllotoxins Mechanism of Action ž Blocks cells in the late S-G 2 phase of the cell cycle through inhibition of topoisomerase II ž Resulting in DNA damage through strand breakage induced by the formation of a ternary complex of drug, DNA, and enzyme

Podophyllotoxins Toxicity ž Nausea ž Vomiting ž Alopecia ž Hematopoietic and lymphoid toxicity

Podophyllotoxins Therapeutic Uses ž Monocytic Leukemia ž Testicular cancer ž Oat cell carcinoma of the lung

Camptothecins ž Topotecan ž Irinotecan

Camptothecins Mechanism of Action ž Interfere with the activity of Topoisomerase I ž Resulting in DNA damage ž Irinotecan- a prodrug that is metabolized to an active Top I inhibitor, SN-38

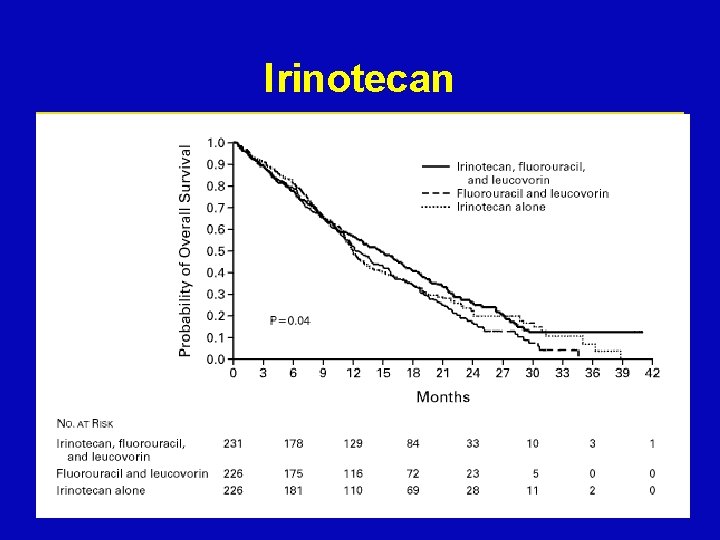
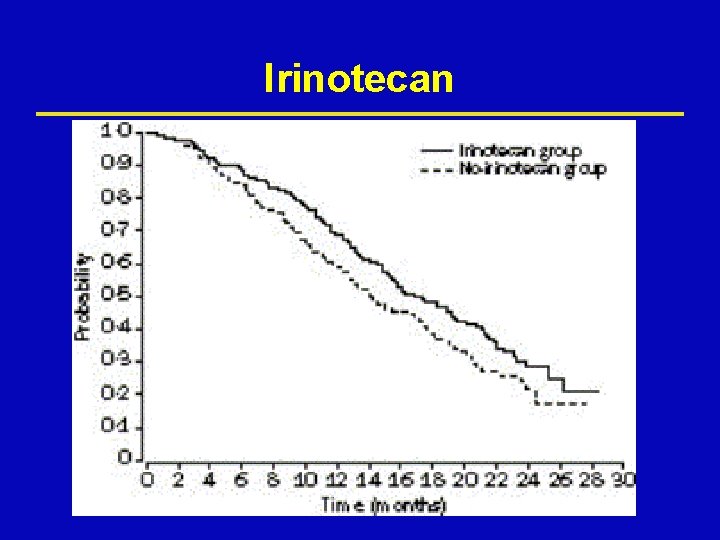
Irinotecan ž DNS topoizomeráz I specifikus inhibítor, a DNS lánc szétdarabolódását okozza ž IFL ž FOLFIRI ž XELIRI Camptotheca acuminata

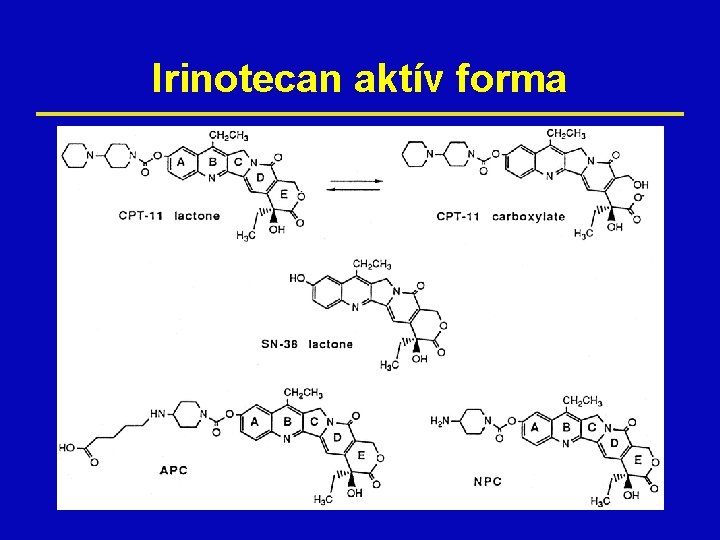
Irinotecan aktív forma

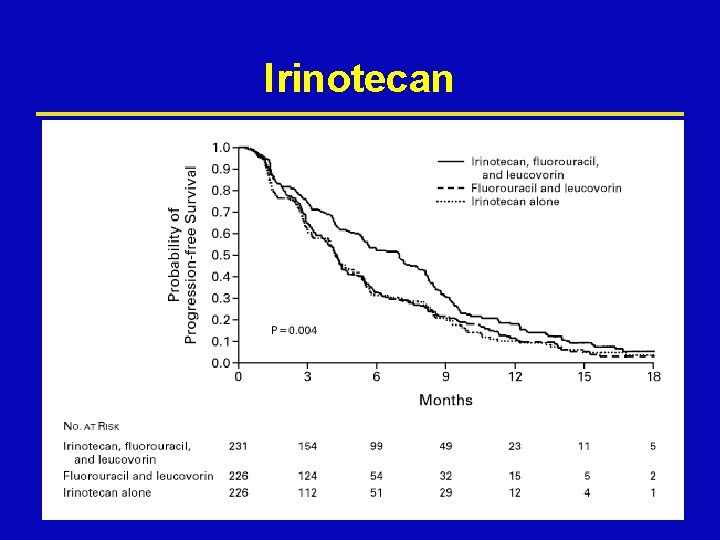
Irinotecan

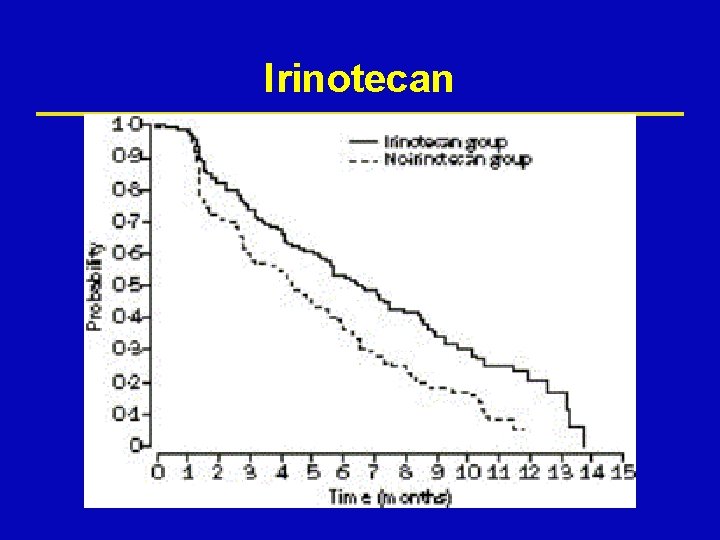
Irinotecan

Irinotecan

Irinotecan

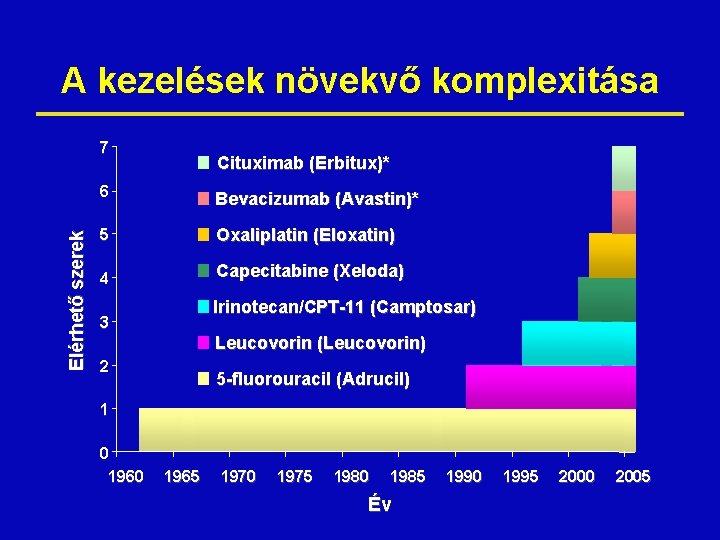
A kezelések növekvő komplexitása Elérhető szerek 7 Cituximab (Erbitux)* 6 Bevacizumab (Avastin)* 5 Oxaliplatin (Eloxatin) 4 Capecitabine (Xeloda) Irinotecan/CPT-11 (Camptosar) 3 Leucovorin (Leucovorin) 2 5 -fluorouracil (Adrucil) 1 0 1965 1970 1975 1980 1985 Év 1990 1995 2000 2005

Camptothecins Toxicity ž Topotecan • Neutropenia, thrombocytopenia, anemia ž Irinotecan • Severe diarrhea, myelosuppression

Camptothecins Therapeutic Uses ž Topotecan- metastatic ovarian cancer (cisplatin-resistant) ž Irinotecan- colon and rectal cancer

Taxanes ž Paclitaxel (Taxol) ž Docetaxel ž Alkaloid esters derived from the Western and European Yew

Taxánstruktúrák

Taxanes Mechanism of Action ž Mitotic “spindle poison” through the enhancement of tubulin polymerization

Taxanes Toxicity ž Paclitaxel • Neutropenia, thrombocytopenia • Peripheral neuropathy ž Docetaxel • Bone marrow suppression • Neurotoxicity • Fluid retention

Taxanes Therapeutic Uses ž Paclitaxel- ovarian and advanced breast cancer ž Docetaxel- advanced breast cancer

Antibiotics ž Anthracyclines- Doxorubicin & ž ž Daunorubicin Dactinomycin Plicamycin Mitomycin Bleomycin


Anthracyclines ž Doxorubicin ž Daunorubicin

Anthracyclines Mechanism of Action ž High-affinity binding to DNA through intercalation, resulting in blockade of DNA and RNA synthesis ž DNA strand scission via effects on Top II ž Binding to membranes altering fluidity ž Generation of the semiquinone free radical and oxygen radicals

Anthracyclines Toxicity ž Bone marrow depression ž Total alopecia ž Cardiac toxicity

Anthracyclines Therapeutic Uses ž Doxorubicin- carcinomas of the breast, endometrium, ovary, testicle, thyroid, and lung, Ewing’s sarcoma, and osteosarcoma ž Daunorubicin- acute leukemia


Dactinomycin Mechanism of Action ž Binds to double stranded DNA through intercalation between adjacent guaninecytosine base pairs ž Inhibits all forms of DNA-dependent RNA synthesis

Dactinomycin Toxicity ž Bone marrow depression ž Oral ulcers ž Skin eruptions ž Immunosuppression

Dactinomycin Therapeutic Uses ž Wilms’ tumors ž Gestational choriocarinoma with MTX

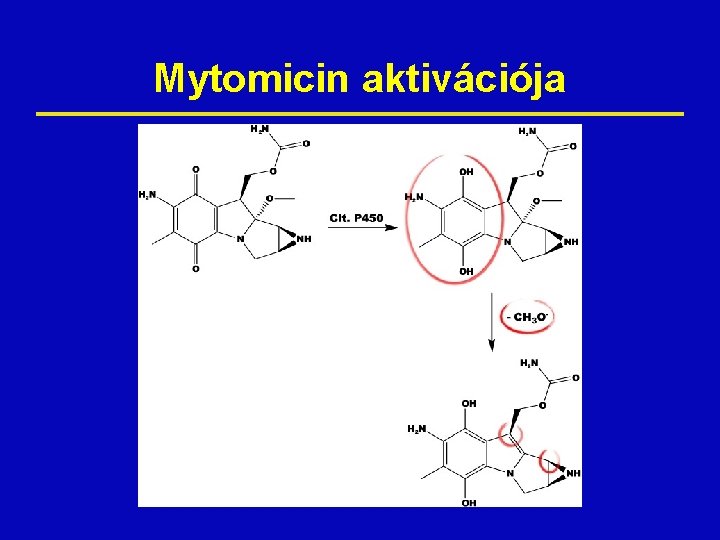
Mytomicin aktivációja

Mitomycin Mechanism of Action ž Bioreductive alkylating agent that undergoes metabolic reductive activation through an enzyme-mediated reduction to generate an alkylating agent that cross-links DNA

Mitomycin Toxicity ž Severe myelosuppression ž Renal toxicity ž Interstitial pneumonitis

Mitomycin Therapeutic Uses ž Squamous cell carcinoma of the cervix ž Adenocarcinomas of the stomach, pancreas, and lung ž 2 nd line in metastatic colon cancer


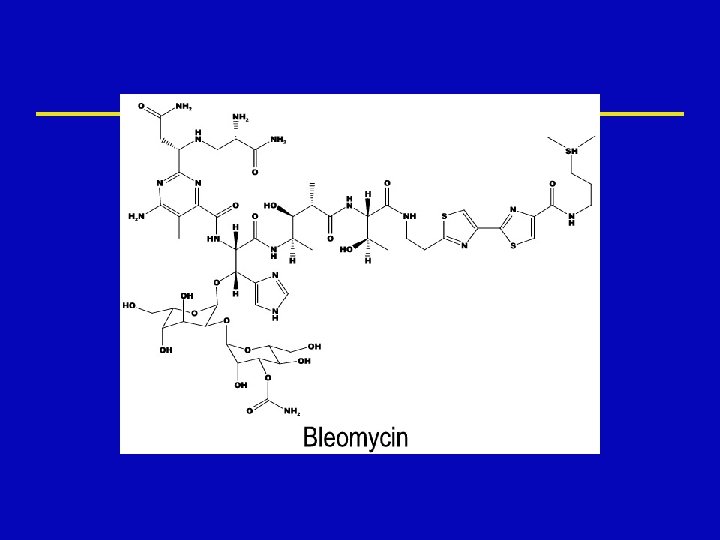
Bleomycin ž Acts through binding to DNA, which results in single and double strand breaks following free radical formation and inhibition of DNA synthesis ž The DNA fragmentation is due to oxidation of a DNA-bleomycin-Fe(II) complex and leads to chromosomal aberrations ž CCS drug that causes accumulation of cells in G 2

Bleomycin Toxicity ž Lethal anaphylactoid reactions ž Blistering ž Pulmonary fibrosis

Bleomycin Therapeutic Uses ž Testicular cancer ž Squamous cell carcinomas of the head and neck, cervix, skin, penis, and rectum ž Lymphomas ž Intracavitary therapy in ovarian and breast cancers

Asparaginase ž An enzyme isolated from bacteria ž Causes catabolic depletion of serum ž ž asparagine to aspartic acid and ammonia Resulting in reduced blood glutamine levels and inhibition of protein synthesis Neoplastic cells require external source of asparagine Treats childhood acute leukemia Can cause anaphylactic shock

Hydroxyurea ž An analog of urea ž Inhibits the enzyme ribonucleotide reductase ž Resulting in the depletion of deoxynucleoside triphosphate pools ž Thereby inhibiting DNA synthesis ž S-phase specific agent ž Treats melanoma and chronic myelogenous leukemia

Mitoxantrone ž Structure resembles the anthracyclines ž Binds to DNA to produce strand breakage ž Inhibits DNA and RNA synthesis ž Treats pediatric and adult acute myelogenous leukemia, non-Hodgkin’s lymphomas, and breast cancer ž Causes cardiac toxicity

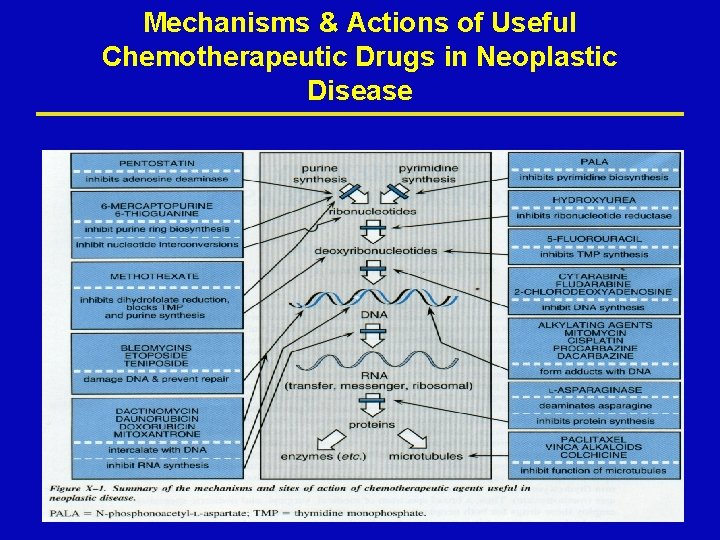
Mechanisms & Actions of Useful Chemotherapeutic Drugs in Neoplastic Disease