Kemisk bindning Ke 1 Kap 9 Varfr sker

Kemisk bindning Ke 1 Kap 9
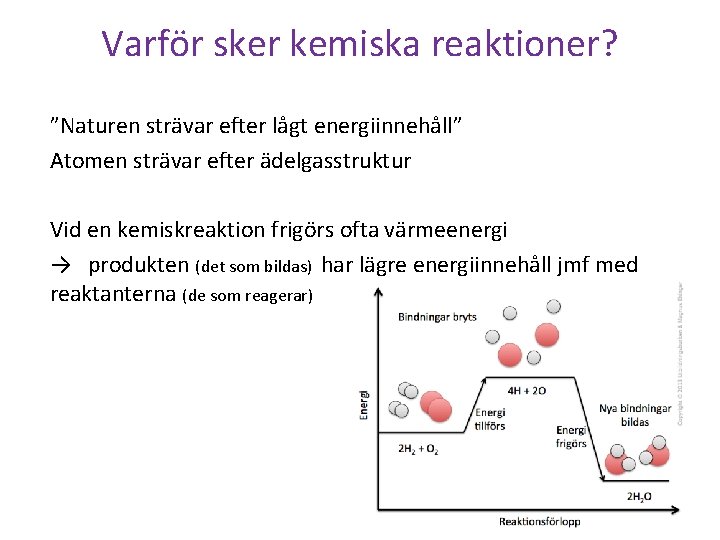
Varför sker kemiska reaktioner? ”Naturen strävar efter lågt energiinnehåll” Atomen strävar efter ädelgasstruktur Vid en kemiskreaktion frigörs ofta värmeenergi → produkten (det som bildas) har lägre energiinnehåll jmf med reaktanterna (de som reagerar)
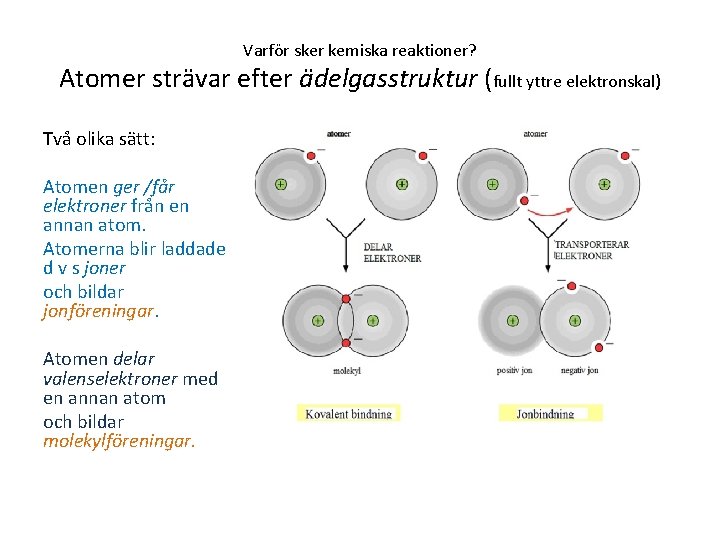
Varför sker kemiska reaktioner? Atomer strävar efter ädelgasstruktur (fullt yttre elektronskal) Två olika sätt: Atomen ger /får elektroner från en annan atom. Atomerna blir laddade d v s joner och bildar jonföreningar. Atomen delar valenselektroner med en annan atom och bildar molekylföreningar.
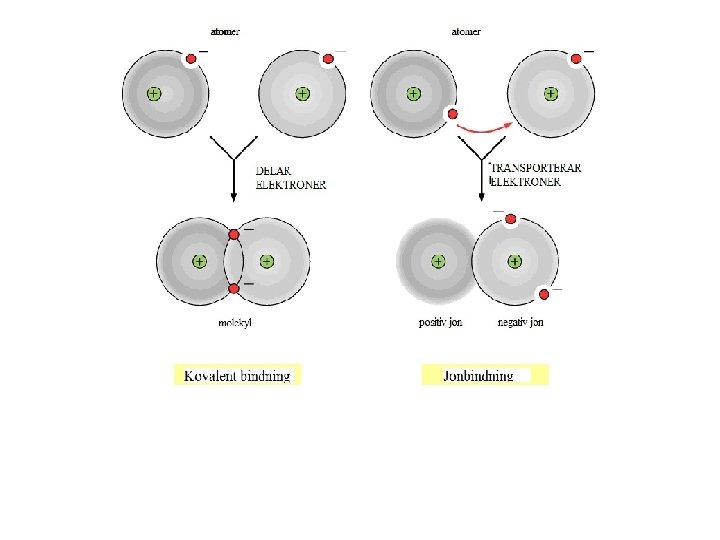

Jonföreningar Jonbindning
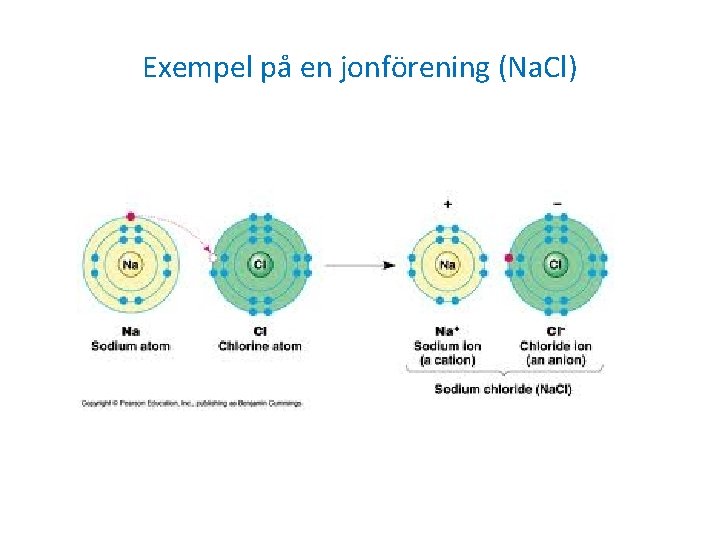
Exempel på en jonförening (Na. Cl)
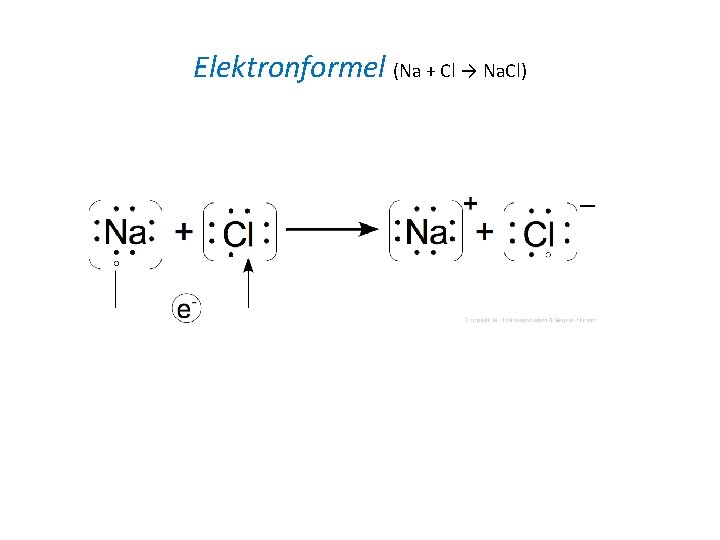
Elektronformel (Na + Cl → Na. Cl)
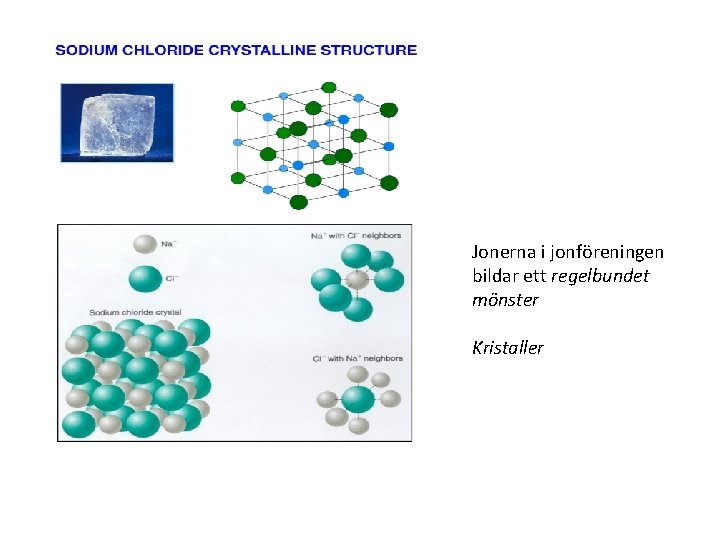
Jonerna i jonföreningen bildar ett regelbundet mönster Kristaller
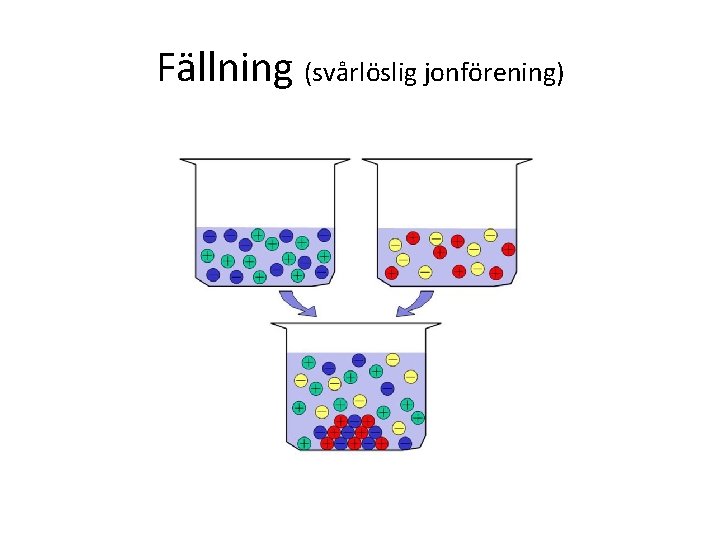
Fällning (svårlöslig jonförening)

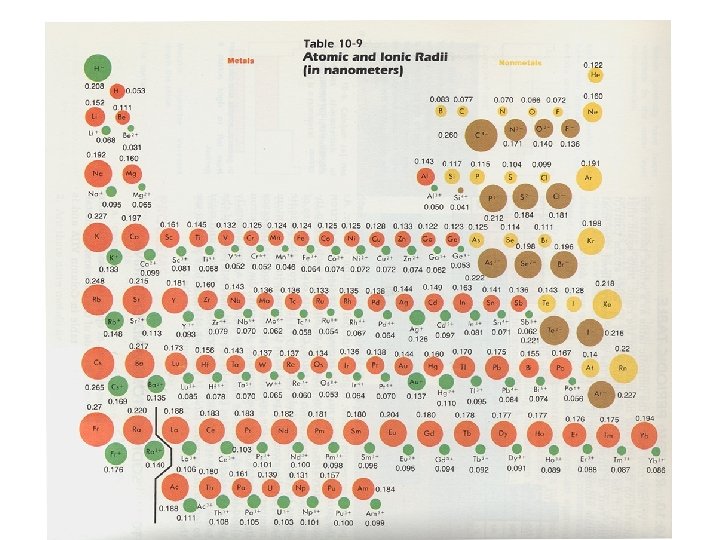
Jonradien vs atomradien Positiva joner – röda, negativa joner – blåa Motsvarande atomradie är brun
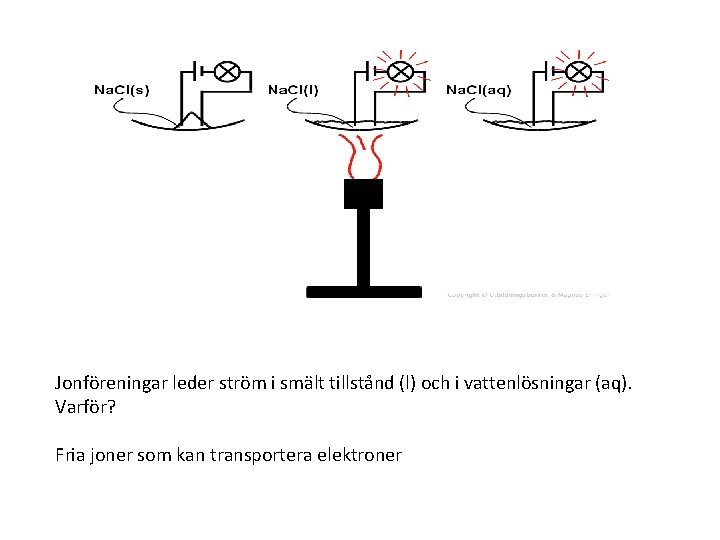
Jonföreningar leder ström i smält tillstånd (l) och i vattenlösningar (aq). Varför? Fria joner som kan transportera elektroner
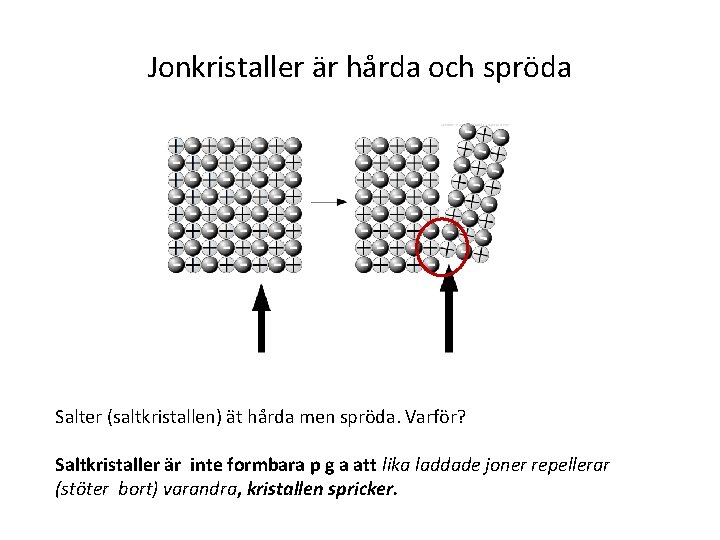
Jonkristaller är hårda och spröda Salter (saltkristallen) ät hårda men spröda. Varför? Saltkristaller är inte formbara p g a att lika laddade joner repellerar (stöter bort) varandra, kristallen spricker.
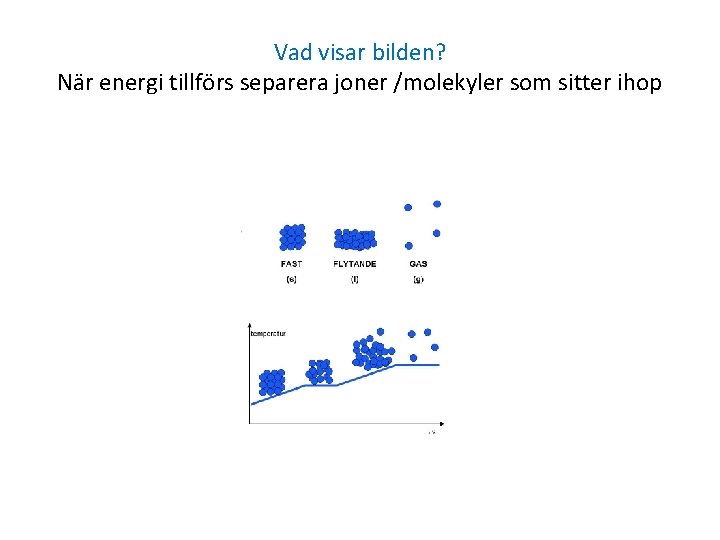
Vad visar bilden? När energi tillförs separera joner /molekyler som sitter ihop

Smältpunkt för olika jonföreningar Varför skiljer sig smältpunkterna åt? Vilket är sambandet mellan smältpunkten och jonbindningens styrka?
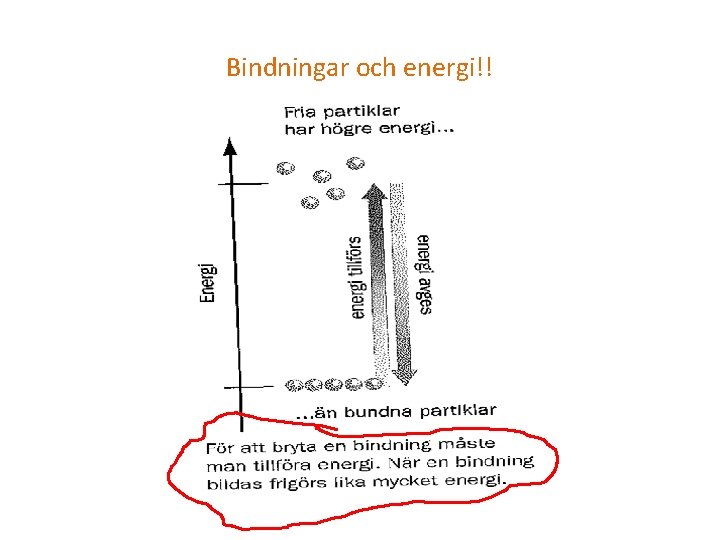
Bindningar och energi!!

1. Na. F har högre smältpunkt (996 C°) jmf med Na. Cl (801 C°) Vad beror det på? Tips! Olika joners storlek/laddning, tabell sid 147 2. Mg. O högre smältpunkt (2852 C°) jmf med Na. Cl (801 C°) ? Vad kan det bero på?

Jonföreningar med starka bindningar hög smältpunkt 1. Na. F högre smältpunkt jmf med Na. Cl Varför? Flouridjonen är mindre, joner kommer närmare varandra och binds hårdare 2. Mg. O högre smp (2852) jmf med Na. Cl (801) ? Varför? Magnesiumjonen 2+, oxidjonen 2 -, jonerna har högre laddning ger starkare bindning

Uppgifter kap 9 jonföreningar, jonbindning Sid 172 uppgift: 901 – 907 Teori: Boken kap 9 sid 144 -149 (Kap 5 sid 67 -72) (Kap 3 sid 34 -38)

Molekylföreningar Kap 9 Kovalentbindning (elektronparbindning)

Snart kan du svara på…. . …varför olika ämnen har olika kokpunkt Etan kokar vid -89°C Etanol kokar vid +79°C
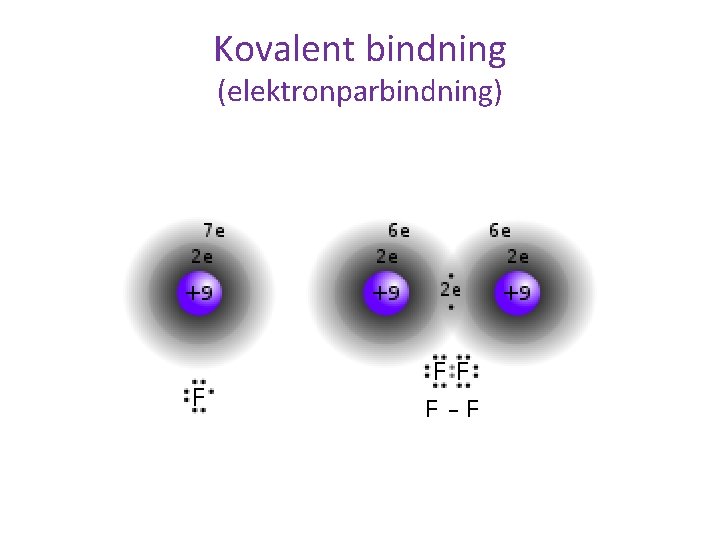
Kovalent bindning (elektronparbindning)
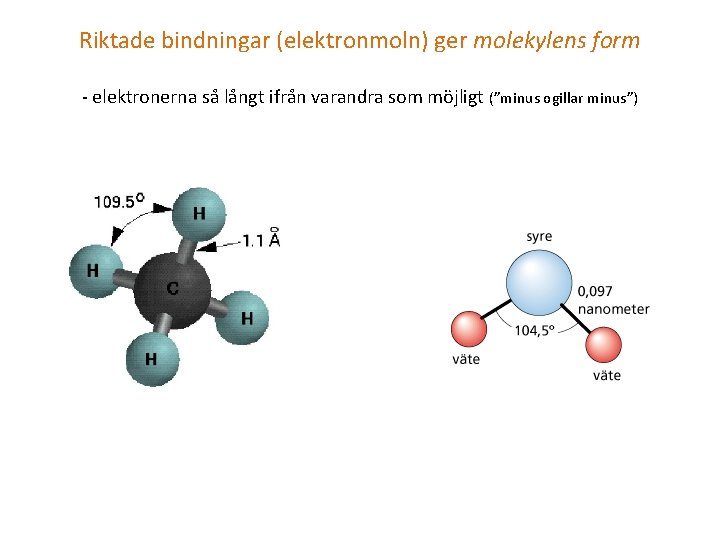
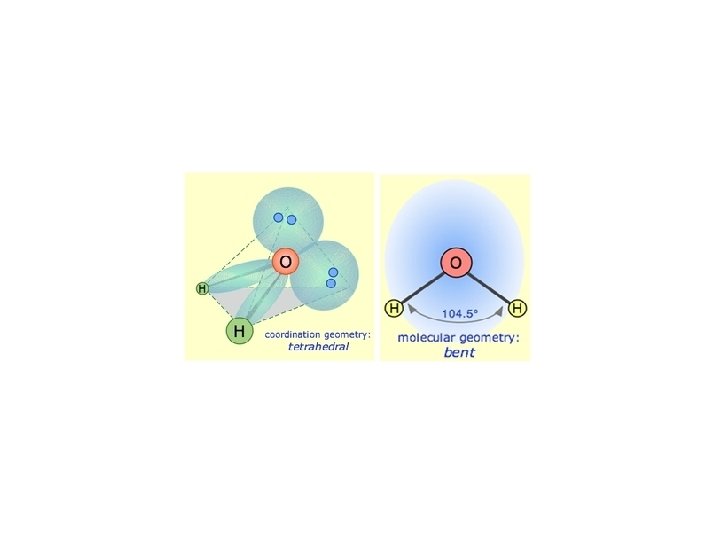
Riktade bindningar (elektronmoln) ger molekylens form - elektronerna så långt ifrån varandra som möjligt (”minus ogillar minus”)
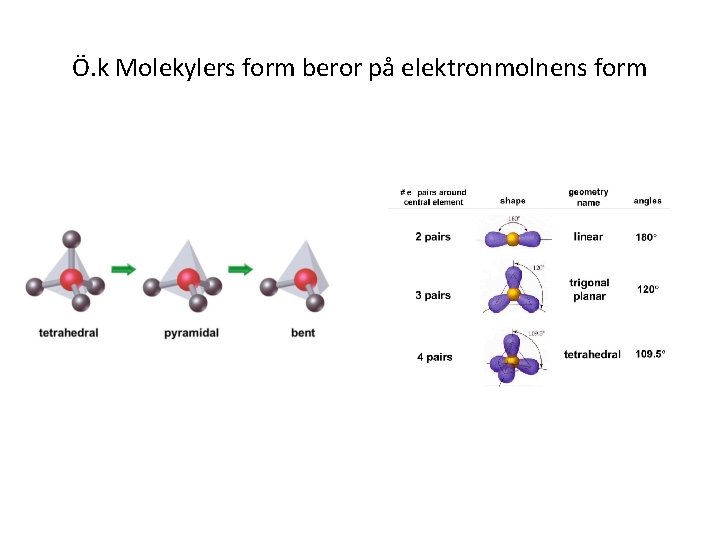
Ö. k Molekylers form beror på elektronmolnens form
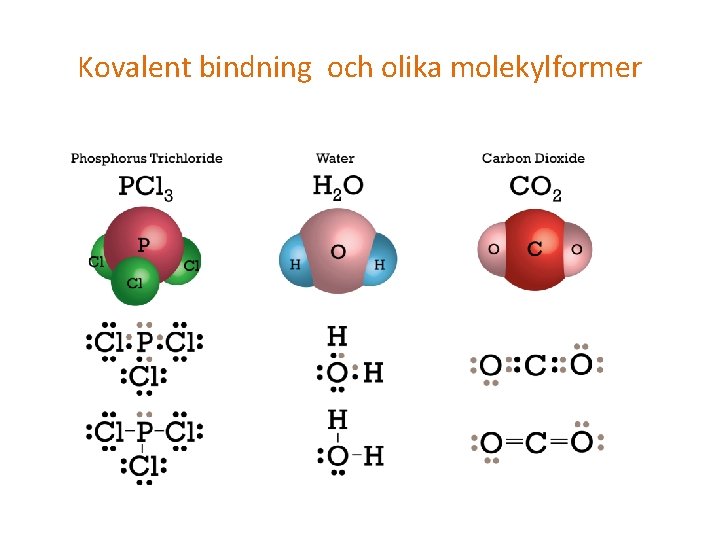
Kovalent bindning och olika molekylformer
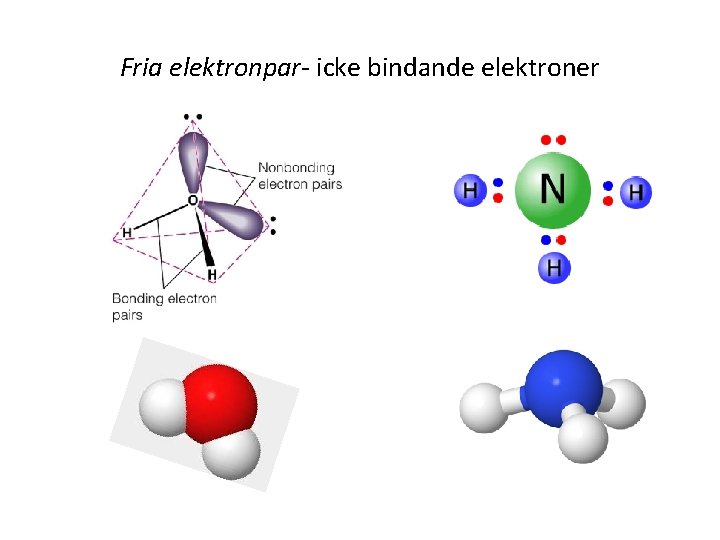
Fria elektronpar- icke bindande elektroner
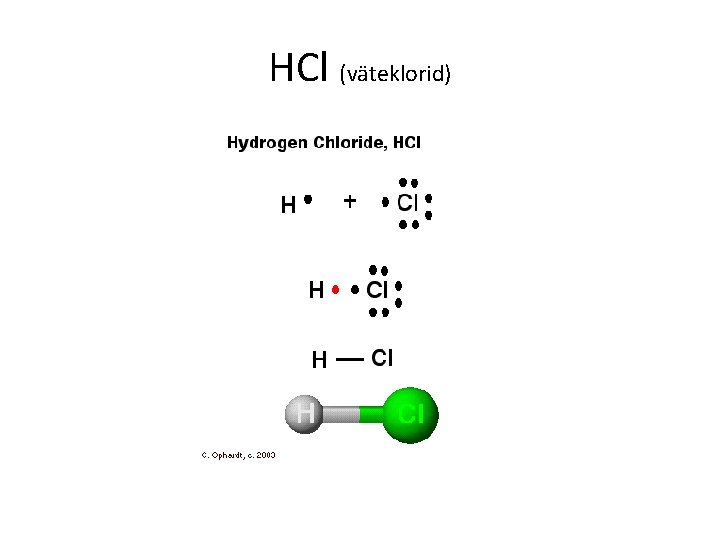
HCl (väteklorid)
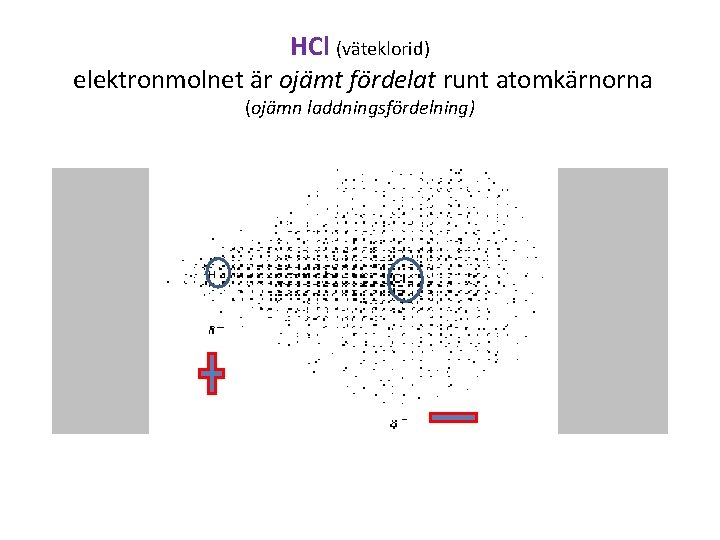
HCl (väteklorid) elektronmolnet är ojämt fördelat runt atomkärnorna (ojämn laddningsfördelning)

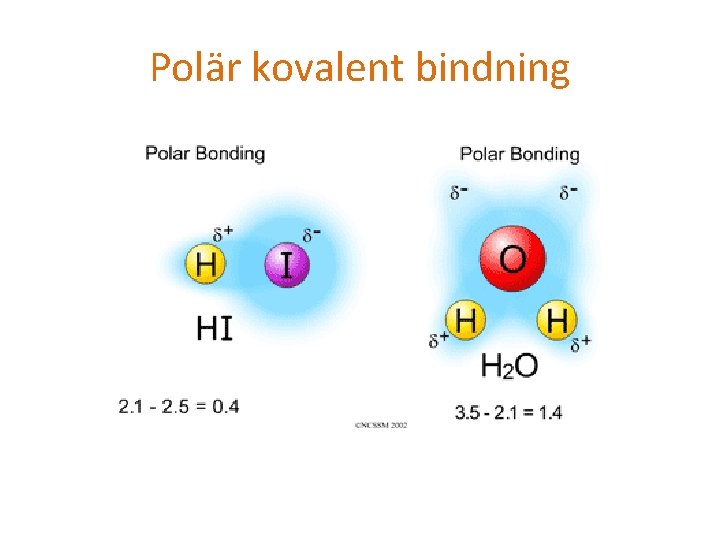
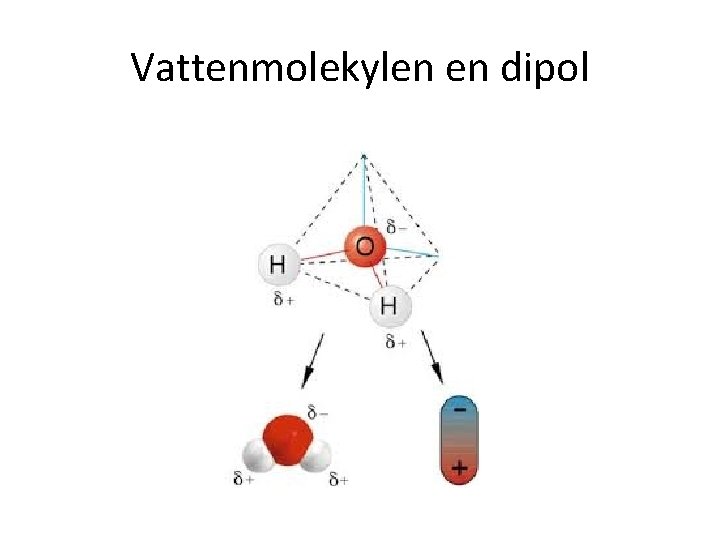
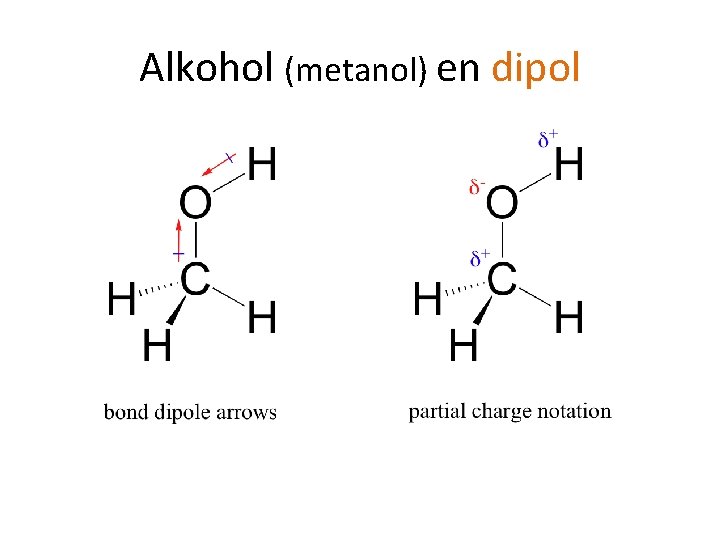
Dipol – en molekyl med ojämn laddningsfördelning Tyngdpunkten för positiv och negativ laddning sammanfaller inte → molekylen får en plus- och en minusladdad sida

Polär kovalent bindning Bindningen i en molekyl som är en dipol kallas för en polär kovalent bindning
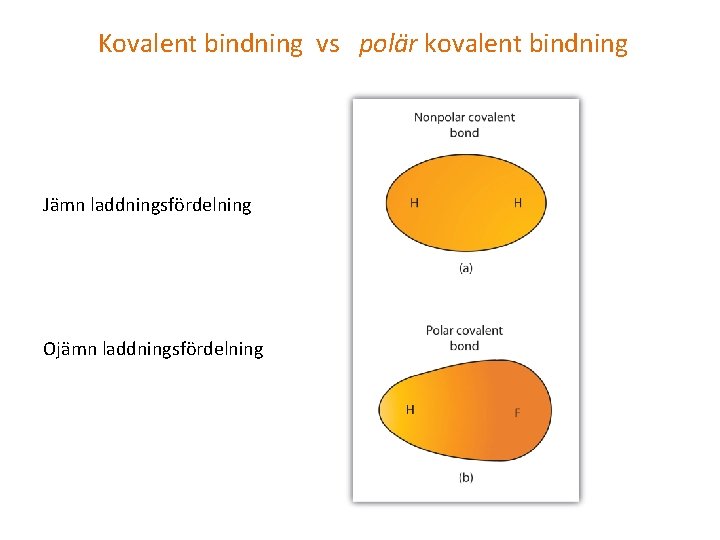
Kovalent bindning vs polär kovalent bindning Jämn laddningsfördelning Ojämn laddningsfördelning

Varför…. Varför är vissa molekyler dipoler men andra inte? Varför har vissa molekyler polär kovalent bindning men andra inte? Varför blir det en ojämn laddningsfördelning?

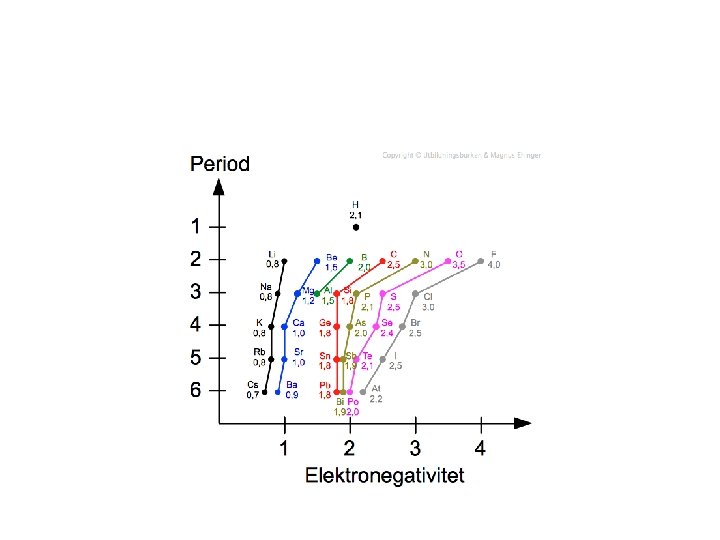
elektronegativitet • Olika atomer har olika starkt ”sug” efter elektroner dvs förmåga att dra till sig elektroner • ”elektronsuget” kallas elektronegativitet • Var i periodiska systemet finns ämnen med starkt elektronsug?

Elektronegativitet - ”elektronsug”
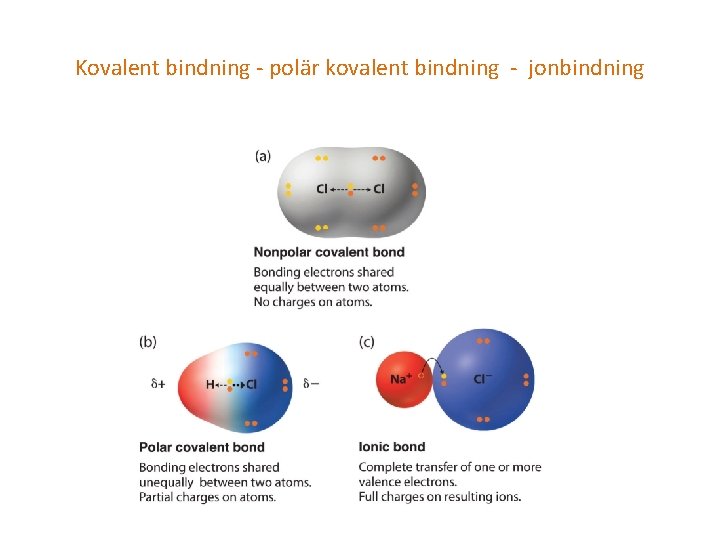
Kovalent bindning - polär kovalent bindning - jonbindning

Skillnaden i elekronegativitet avgör bindningstypen Cl-Cl Skillnad i elektronegativitet: 0 Bindning: Ren kovalent bindning H-Cl Skillnad i elektronegativitet: 0, 9 Bindning: Polär kovalent bindning Na+Cl− Skillnad elektronegativitet: 2, 1 Bindning: Jonbindning

Elektronmolnet – hos olika typer av bindning
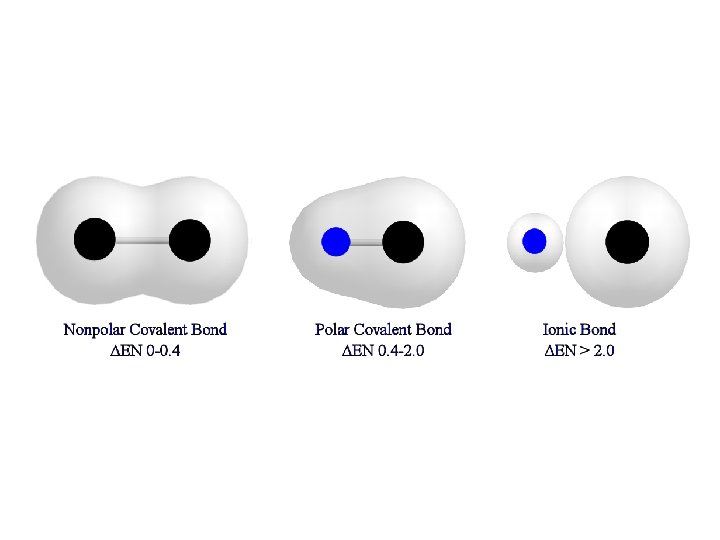
Polär kovalent bindning
Vattenmolekylen en dipol
Alkohol (metanol) en dipol

Demo : Vatten molekylen är dipol – polärt ämne Heptan molekylen ingen dipol – opolärt ämne Laddad pinne
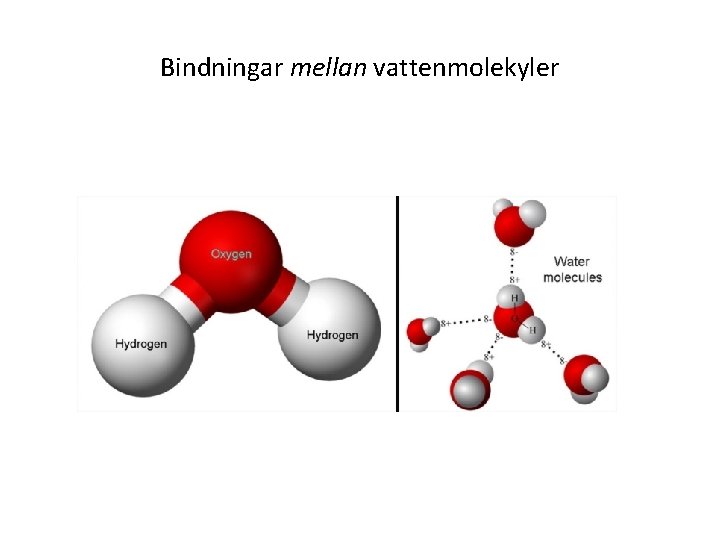
Bindningar mellan vattenmolekyler

• Övning : dipol eller inte (stencil) • 9. 4 polär kovalent bindning • uppgifter: 919 -924 sid 172
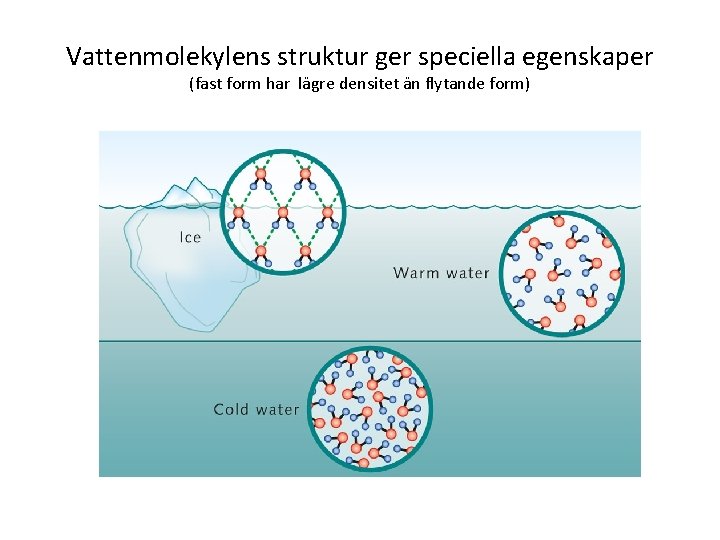
Vattenmolekylens struktur ger speciella egenskaper (fast form har lägre densitet än flytande form)
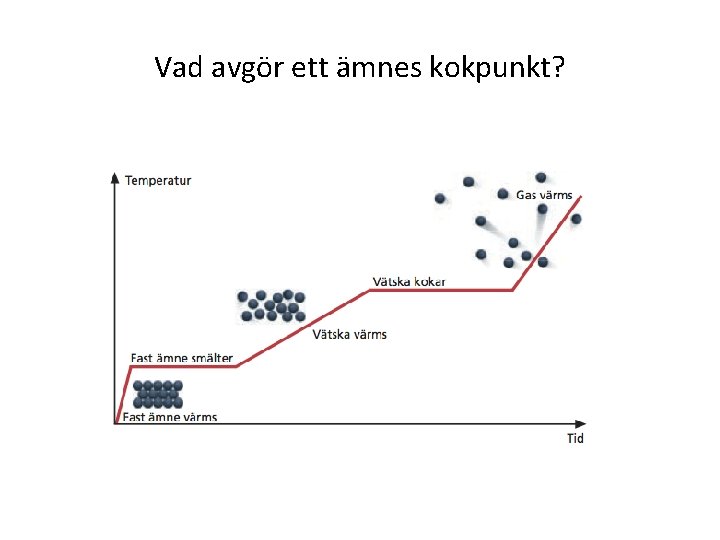
Vad avgör ett ämnes kokpunkt?

Varför skiljer sig de olika ämnenas kokpunkter?

Bindningar mellan molekyler • Dipolbindning - vätebindning • Van der Waal bindning Bindning mellan joner i en jonförening • Jonbindning
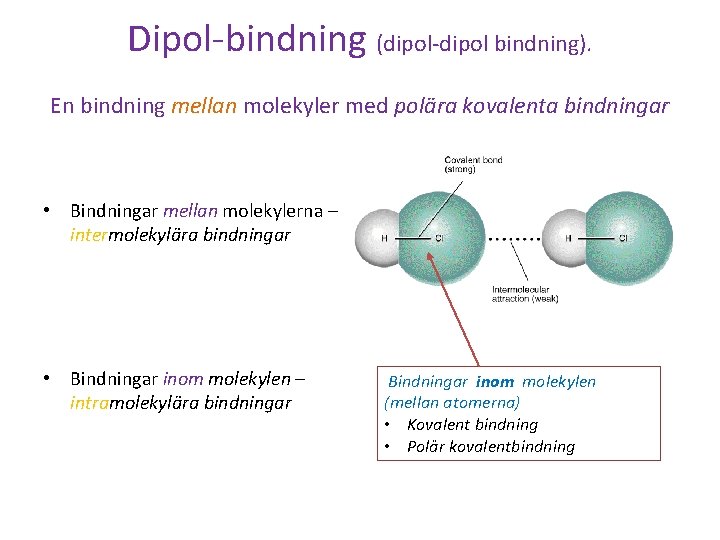
Dipol-bindning (dipol-dipol bindning). En bindning mellan molekyler med polära kovalenta bindningar • Bindningar mellan molekylerna – intermolekylära bindningar • Bindningar inom molekylen – intramolekylära bindningar Bindningar inom molekylen (mellan atomerna) • Kovalent bindning • Polär kovalentbindning
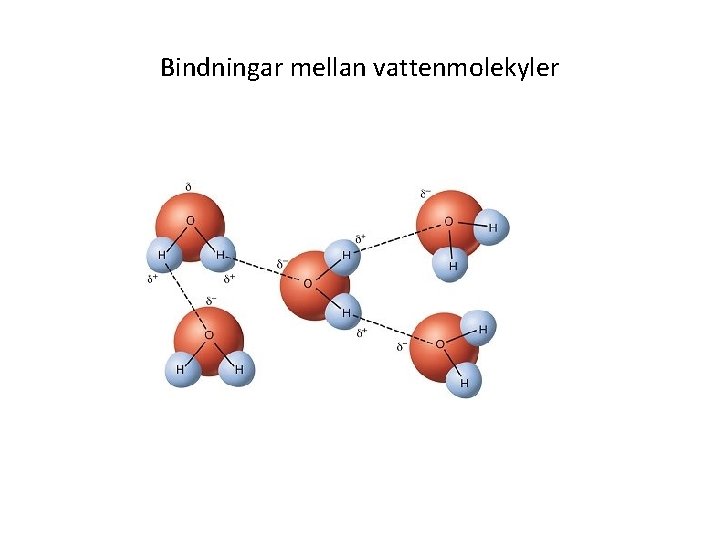
Bindningar mellan vattenmolekyler

Ett ämnes kokpunkt beror på… …styrkan på bindningen mellan partiklarna (molekylerna)
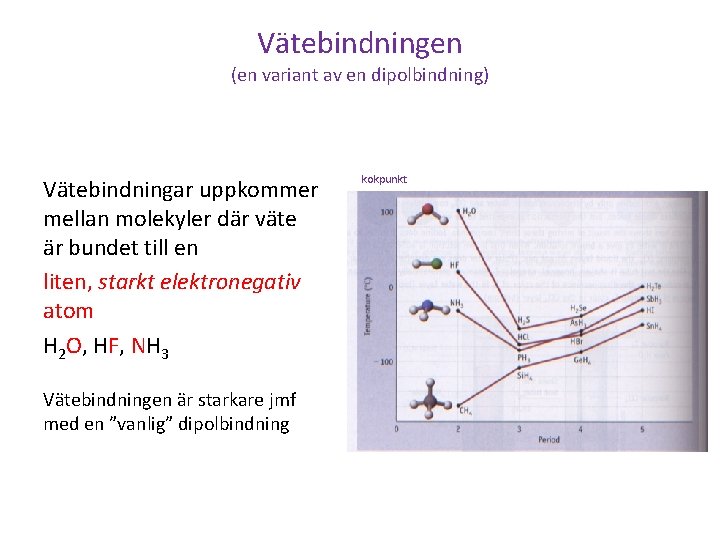
Vätebindningen (en variant av en dipolbindning) Vätebindningar uppkommer mellan molekyler där väte är bundet till en liten, starkt elektronegativ atom H 2 O, HF, NH 3 Vätebindningen är starkare jmf med en ”vanlig” dipolbindning kokpunkt
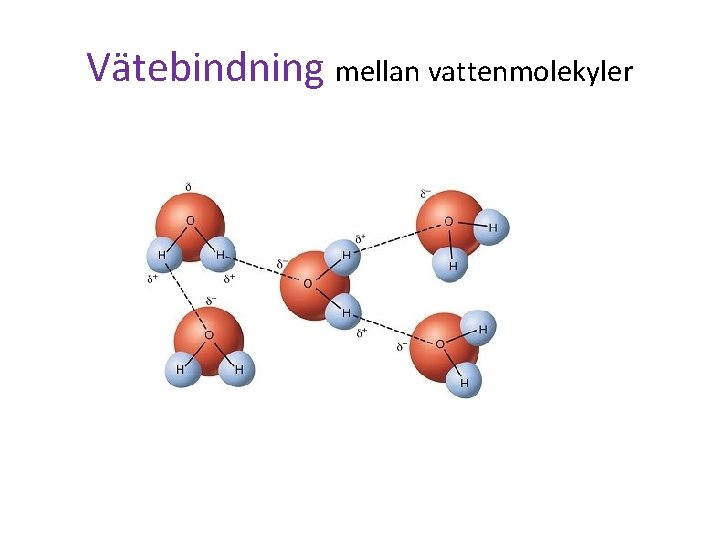
Vätebindning mellan vattenmolekyler

Varför skiljer sig kokpunkten mellan ämnen (molekyler) som inte har polär kovalenta bindningar (inte är dipoler)? Tex som hos alkanerna i tabellen Olika kokpunkter – det måste finnas olika ”starka” bindningar mellan de olika molekylerna.
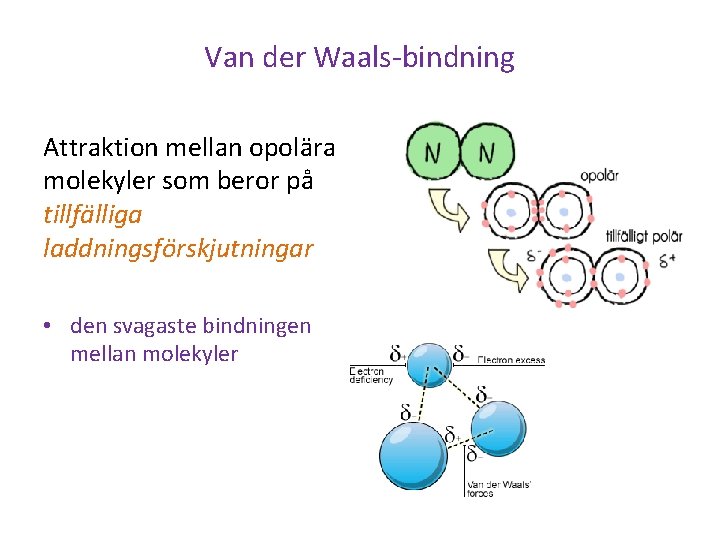
Van der Waals-bindning Attraktion mellan opolära molekyler som beror på tillfälliga laddningsförskjutningar • den svagaste bindningen mellan molekyler
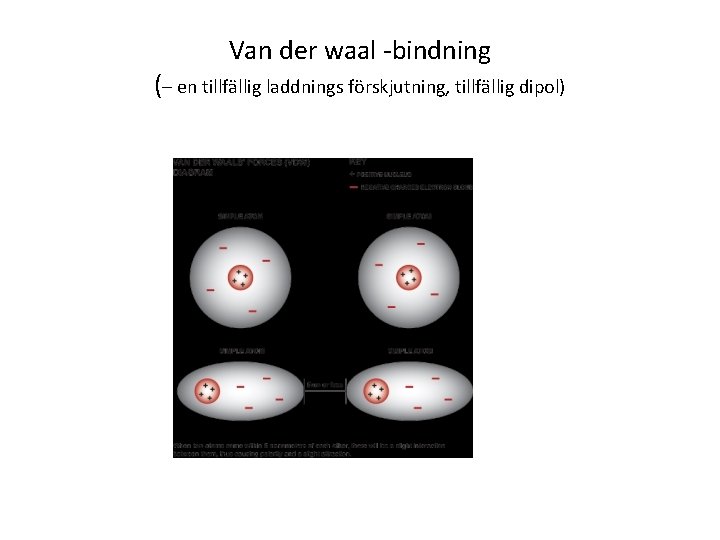
Van der waal -bindning (– en tillfällig laddnings förskjutning, tillfällig dipol)
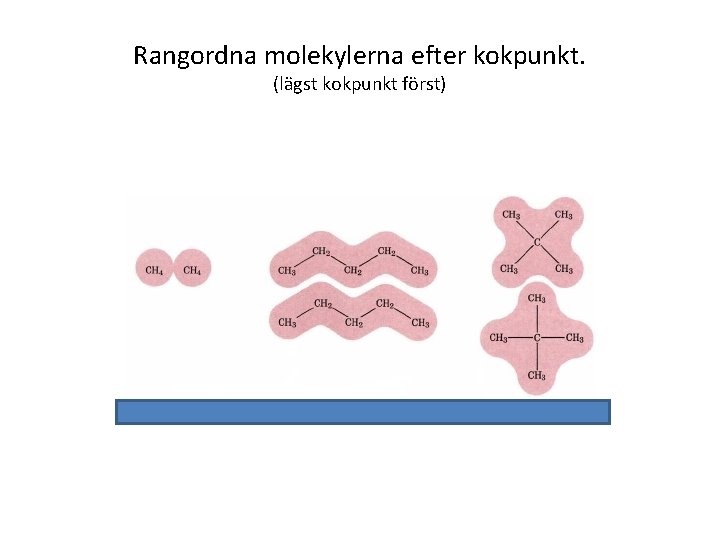
Rangordna molekylerna efter kokpunkt. (lägst kokpunkt först)
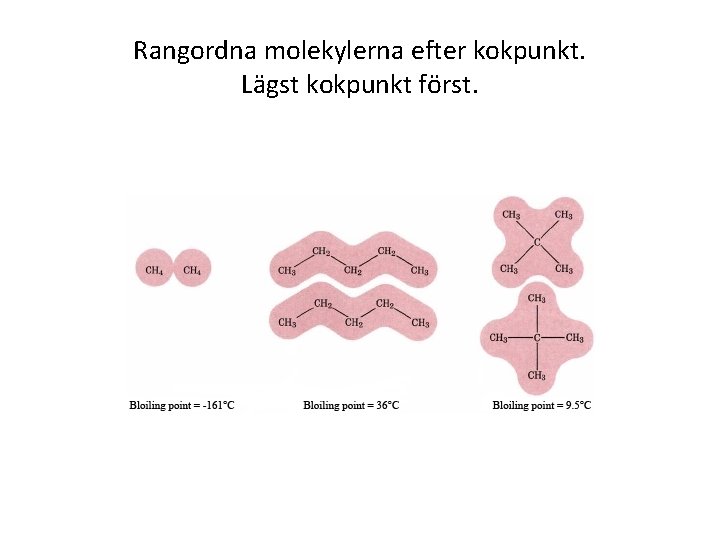
Rangordna molekylerna efter kokpunkt. Lägst kokpunkt först.

Uppgifter/läxa Boken sid 159 -166 →sammanfattning sid 171! Uppgifter sid 172 -174 • 919 -924 dipol, polärkovalentbindning • 938, 939 • 928, 929 (943, 944) dipolbindning (vätebindning) van der waal bindning
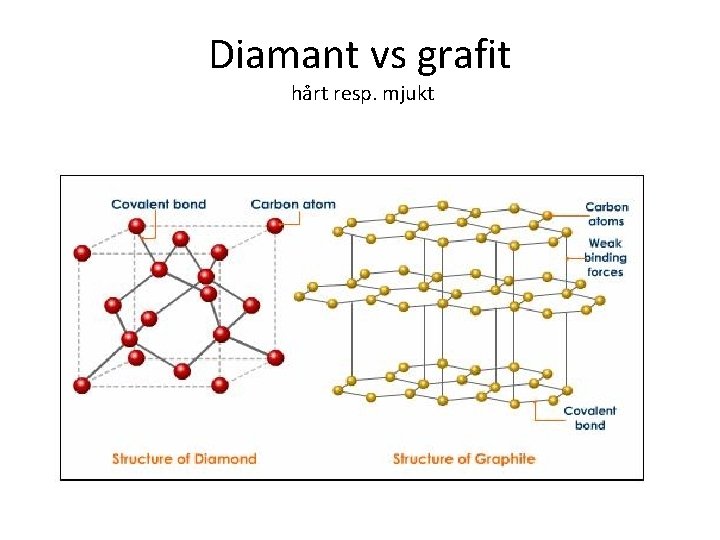
Diamant vs grafit hårt resp. mjukt
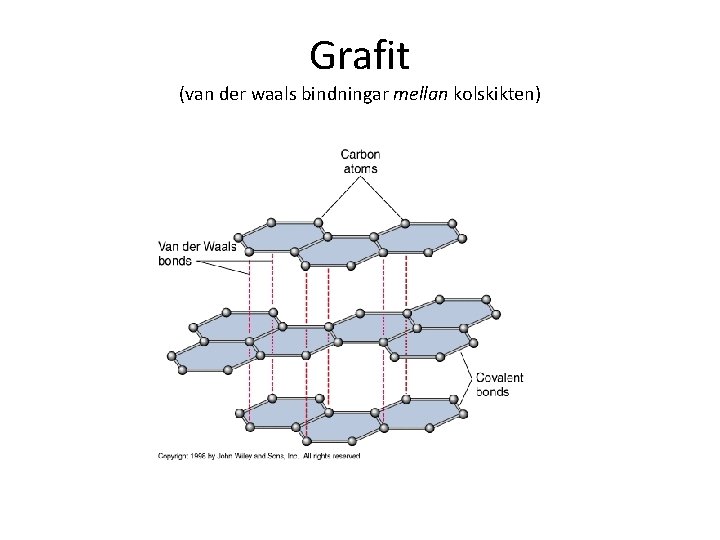
Grafit (van der waals bindningar mellan kolskikten)
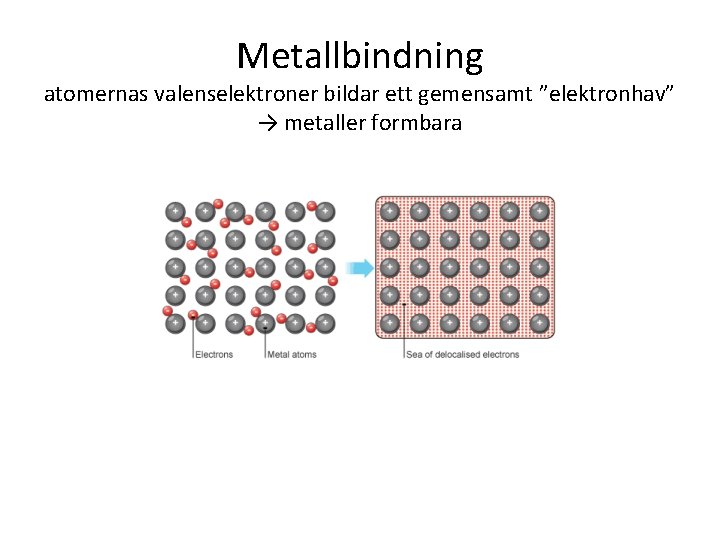
Metallbindning atomernas valenselektroner bildar ett gemensamt ”elektronhav” → metaller formbara
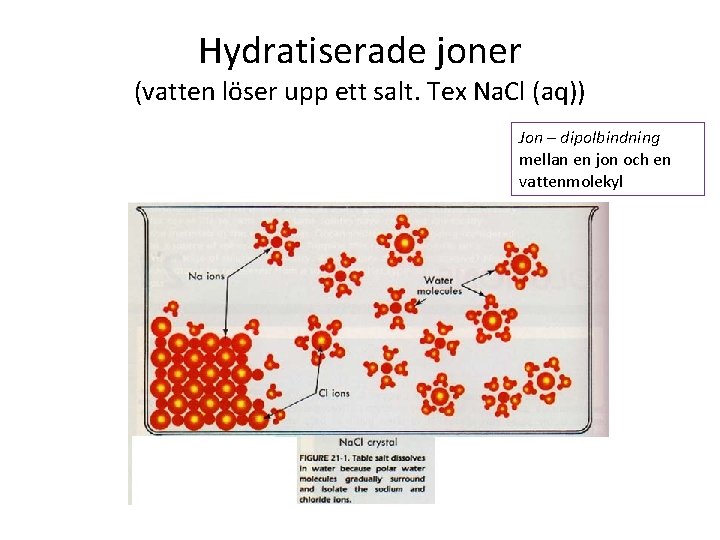
Hydratiserade joner (vatten löser upp ett salt. Tex Na. Cl (aq)) Jon – dipolbindning mellan en jon och en vattenmolekyl

Olika bindningars styrka (bindningsenergi) (k. J/mol)

Sammanfattning kemiskbindning

Sammanfattning bindningar forts.

Polära och opolära ämnen Polariteten hos ett ämne beror på skillnaden i elektrisk laddning mellan olika delar av molekylen/saltet (dipol eller inte) Ämnen kan delas in i två grupper: - polära - opolära Glidande skala ämnen kan tex vara mer eller mindre polära

Polära och opolära ämnen Ett salt (jonförening) består av positiva och negativa joner) Ex. Na. Cl som består av Na+ och Cl- Vatten, H 2 O, är en vinklad molekyl (dipol). Vatten är därför: polärt ämne Jod I 2, är en helt symmetrisk molekyl utan nämnvärda laddningsförskjutningar. Därför är jod: opolärt ämne Heptan C 7 H 16 (symmetrisk laddningsfördelning) opolärt ämne
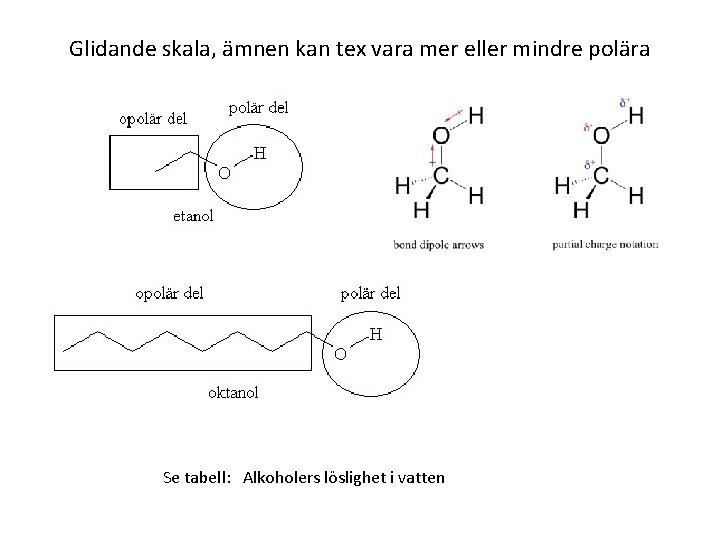
Glidande skala, ämnen kan tex vara mer eller mindre polära Se tabell: Alkoholers löslighet i vatten

”Lika löser lika” En viktig generell regel säger att "lika löser lika". Polära ämnen såsom salter, socker, etanol löser sig i polära lösningsmedel (tex vatten) Opolära ämnen tex fetter löser sig i opolära lösningsmedel (tex bensin, aceton)

Separertratt Separera polära och opolära ämnen Vatten Heptan Jod

Avslutande uppgifter kap 9 (de flesta på C-nivå, ”varför-frågor”) 925 -926 (hydratiserad jon) 928 -929, 938 (van der waal - bindning) 931, 932, 933 (lika löser lika) 940 942 943 T 94 U 91 (ex. på fråga som kan ge A-poäng)
- Slides: 75