Kalciumvegyletek a termszetben Vizek kemnysge sszelltotta Balzs Katalin

Kalciumvegyületek a természetben Vizek keménysége Összeállította: Balázs Katalin

n Található-e a természetben kémiailag tiszta víz? Természetes vizeink kémiai szempontból milyen összetételűek lehetnek? A víz nagyon jó oldószer. Tengervíz Desztillált víz Telített konyhasóoldat Esővíz A felsorolt anyagokat állítsd sorrendbe növekvő oldottanyag-tartalom szerint! Milyen kísérlettel tudnád ellenőrizni, hogy jól oldottad-e meg a feladatot?

Megoldás n 1. desztillált víz 2. esővíz 3. tengervíz 4. telített konyhasóoldat Bepárlással ellenőrizhető a szilárd oldott anyag mennyisége: n KÉRDÉS: Mi lehet a különbség az alább felsorolt természetes vizek összetételében? óceánok vize, tengervíz, folyóvíz, esővíz, ásványvíz
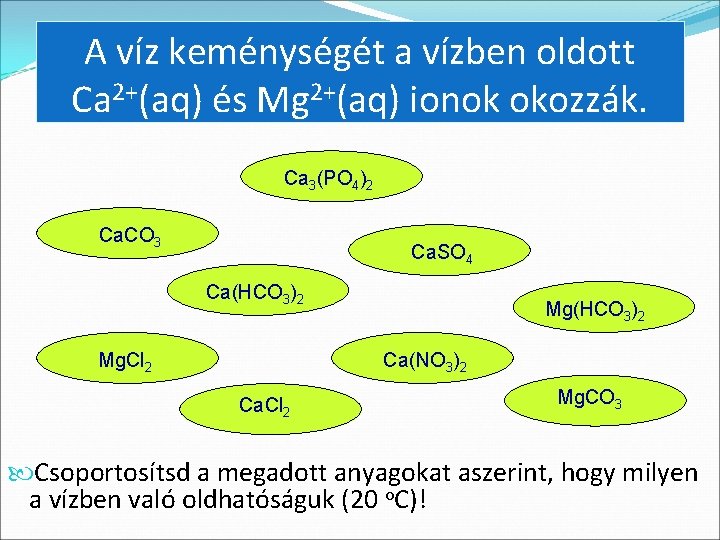
A víz keménységét a vízben oldott Ca 2+(aq) és Mg 2+(aq) ionok okozzák. Ca 3(PO 4)2 Ca. CO 3 Ca. SO 4 Ca(HCO 3)2 Mg. Cl 2 Mg(HCO 3)2 Ca(NO 3)2 Ca. Cl 2 Mg. CO 3 Csoportosítsd a megadott anyagokat aszerint, hogy milyen a vízben való oldhatóságuk (20 o. C)!

Oldhatósági táblázat adatai g/100 g telített oldat 20 o. C 40 o. C 60 o. C Ca. Cl 2 42, 1 52, 9 56, 7 Ca. CO 3 Mg. CO 3 Ca. SO 4 <<0, 01 Oldhatóságukat nem csak a hőmérséklet, hanem a CO 2 koncentrációja is nagyban befolyásolja 0, 202 Ca 3(PO 4)2 Ca(NO 3)2 Ca(HCO 3)2 Mg. Cl 2 0, 210 0, 201 <<0, 01 56, 7 65, 4 78, 1 Tiszta, szilárd vegyületként nem ismeretesek, csak vízben oldott formában. 35, 6 36, 8 37, 9

Megoldás Vízben oldódik: Ca. Cl 2, Ca(HCO 3)2, Mg. Cl 2, Ca(NO 3)2, Mg(HCO 3)2 Vízben nem vagy rosszul oldódik: Mg. CO 3, Ca. SO 4, Ca 3(PO 4)2 n KÉRDÉS: Mit tapasztalsz, ha adott mennyiségű anyag (adott mennyiségű oldószerben, adott hőmérsékleten) n jól oldódik, n rosszul oldódik, n nem oldódik?

Gondolkozz! Ha egy vizes oldatba az alábbi ionokat juttatjuk: KATIONOK 13 mol Ca 2+ 4 mol Na+ ANIONOK 9 mol NO 34 mol SO 422 mol HCO 35 mol Cl 2 mol PO 43 - Mitől függ, hogy mely anyag és mennyi anyag válik ki az oldatból? (A Na-vegyületek vízben jól oldódnak. ) (Az oldatban az összes pozitív töltés mennyisége megegyezik az összes negatív töltés mennyiségével. )

Megoldás Kiválik: 4 mol Ca. SO 4 (ennél több nem, mert nincs több SO 42 -), 1 mol Ca 3(PO 4)2 (ennél több nem, mert csak 2 mol PO 43 - ion van jelen), és oldatban marad 6 mol Ca 2+ Az oldatban marad: 6 mol Ca 2+ 4 mol Na+ 9 mol NO 32 mol HCO 35 mol Cl- Az ionok minőségétől és mennyiségétől függ, hogy milyen és mennyi anyag válik ki az oldatból.

A vízben oldott Ca(HCO 3)2 és Mg(HCO 3)2 adja a víz változó keménységét. Forralással az ennek megfelelő Ca 2+ és Mg 2+ ion mennyisége kicsapható, így eltávolítható. Mely sav sói a hidrogénkarbonátok? Írd fel a Ca- és Mg-hidrogénkarbonát bomlásának reakcióegyenletét! Milyen gáz keletkezik a folyamat során? Milyen módszerrel lehet eltávolítani az oldatból a keletkező, vízben rosszul oldódó csapadékot?

Megoldás A hidrogén-karbonátok a szénsav sói. Reakcióegyenlet: Ca(HCO 3)2 → Ca. CO 3 + H 2 O + CO 2 Mg(HCO 3)2 → Mg. CO 3 + H 2 O + CO 2 A keletkező csapadékot szűréssel lehet eltávolítani:

Gondolkozz! Ha az előző példában szereplő oldatot forraljuk, milyen változás történik az oldat összetételében? Az oldatban van: 6 mol Ca 2+ 9 mol NO 34 mol Na+ 2 mol HCO 35 mol Cl- Megoldás Forralás után: elbomlik 1 mol Ca(HCO 3)2 (mivel összesen 2 mol HCO 3 - van az oldatban) Az oldatban marad: 5 mol Ca 2+ 9 mol NO 34 mol Na+ 5 mol Cl. Az oldat keménysége csökkent.

A vízben oldott egyéb Ca- és Mgvegyületek adják a víz állandó keménységét. Vízlágyító szerrel az ennek megfelelő Ca 2+ és Mg 2+ ion mennyisége kicsapható, így eltávolítható. Kísérlet: szódás vízlágyítás Milyen anyag alkalmas vízlágyító szernek? Sorold fel a legfontosabb tulajdonságait! Írd fel a Ca 2+ és Mg 2+ ion reakcióját szódával és trisóval! Hogyan változik az oldat Ca 2+ és Mg 2+ tartalma?

Megoldás A vízlágyító szer Jól oldódjon vízben A Ca 2+ és Mg 2+ ionnal alkosson vízben oldhatatlan vegyületet (amit le lehet szűrni) Szódás vízlágyítás: Ca 2+ + Na 2 CO 3 = Ca. CO 3 + 2 Na+ Mg 2+ + Na 2 CO 3 = Mg. CO 3 + 2 Na+ Trisós vízlágyítás: 3 Ca 2+ + 2 Na 3 PO 4 = Ca 3(PO 4)2 + 6 Na+ 3 Mg 2+ + 2 Na 3 PO 4 = Mg 3(PO 4)2 + 6 Na+ Így az oldat Ca 2+ és Mg 2+ ion-tartalmát eltávolítottuk, lágy vizet kaptunk.

Gondolkozz! Az előző példában szereplő oldat állandó keménységét is meg akarjuk szüntetni vízlágyító szer alkalmazásával. Hány mól szódát kell alkalmaznunk? Hány mól trisót kell alkalmaznunk? Az oldatban van: 5 mol Ca 2+ 4 mol Na+ 9 mol NO 35 mol Cl- Megoldás Szódás vízlágyítással: 1 mol Ca 2+ eltávolításához 1 mol Na 2 CO 3 kell, 5 mol Ca 2+ eltávolításához 5 mol Na 2 CO 3 kell. Trisós vízlágyítással: 3 mol Ca 2+ eltávolításához 2 mol Na 3 PO 4 kell, 5 mol Ca 2+ eltávolításához 10/3 mol Na 3 PO 4 kell. Az oldat keménysége csökkent.

A természetben hol fordul elő kemény, illetve lágy víz? Ott, ahol a víz Ca- és Mg-tartalmú vegyületekkel érintkezik, és ezeket oldani tudja, kemény víz jön létre. A mészkőhegységekben, dolomitokban, karsztvidéken folyó hegyi patakok vize nagy keménységű. Az óceánok, tengerek vize tartalmaz oldott Ca 2+ és Mg 2+ ionokat. Az esővíz általában nagyon lágy víz, oldott Ca 2+ és Mg 2+ ionokat nem tartalmaz.

Összefoglalás A kemény víz sok oldott Ca 2+ és Mg 2+ iont tartalmaz. Forralással eltávolítható a változó keménységet okozó Ca(HCO 3)2 és Mg(HCO 3)2 tartalom. Vízlágyító szerekkel vagy ioncserélővel az állandó keménység is megszüntethető. A természetben elsősorban a mészkő- és karsztvidékeken fordul elő kemény víz (cseppkőképződés, barlangképződés). A kemény vízből vízkő válhat ki különböző körülmények között, ami a fűtőberendezésekben veszélyessé válhat.
- Slides: 16