KAJIAN TENTANG REAKSI KIMIA ORGANIK PERTEMUAN 3 Harizal










![Konstanta kesetimbangan • Keq = [products] [reactants] • For CH 4 + Cl 2 Konstanta kesetimbangan • Keq = [products] [reactants] • For CH 4 + Cl 2](https://slidetodoc.com/presentation_image_h/f6141a350bdf75cfc82cb9bc1ab7484c/image-13.jpg)





























- Slides: 55

KAJIAN TENTANG REAKSI KIMIA ORGANIK PERTEMUAN 3 Harizal, S. Pd. , M. Sc Program Studi Gizi Universitas Esa Unggul

KEMAMPUAN AKHIR YANG DIHARAPKAN • Mahasiswa mampu menjelaskan kajian umum tentang reaksi kimia organik

Pendahuluan • Reaksi keseluruhan: reaktan produk • Mekanisme: jalur reaksi secara bertahap. • Untuk mempelajari mengenai suatu reaksi, ada dua hal yang harus diperhatikan: – Aspek termodinamika – Aspek kinetika

Klorinasi metana • Membutuhkan panas atau cahaya untuk menginisiasi reaksi. • Cahaya yang paling efektif adalah cahaya biru karena merupakan cahaya yang diserap oleh gas klorin. • Banyak molekul produk terbentuk dengan hanya menyerap satu foton cahaya melalui reaksi radikal berantai).

Reaksi berantai radikal bebas • Terdapat tiga tahap dalam reaksi radikal bebas: – Inisiasi: tahap ini menghasilkan intermediet radikal bebas. – Propagasi: intermediet bereaksi dengan suatu molekul stabil menghasilkan intermediet reaktif lain dan suatu molekul produk) – Terminasi: reaksi samping yang mematikan intermediet reaktif.

Tahap inisiasi: pembentukan atom klorin suatu molekul klorin membelah secara homolitik menghasilkan dua atom klorin (radikal klorin)

Tahap propagasi: pembentukan radikal metil Atom klorin bertumbukan dengan suatu molekul metil dan mengikat satu atom H, membentuk radikal karbon, dan produk samping berupa HCl.

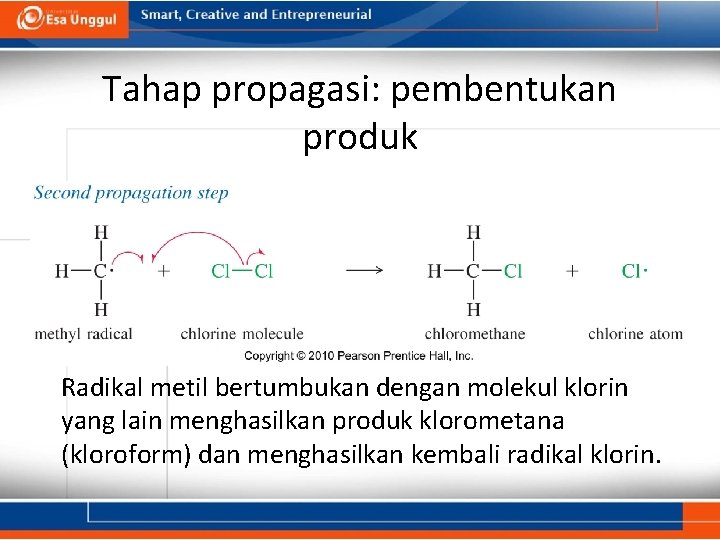
Tahap propagasi: pembentukan produk Radikal metil bertumbukan dengan molekul klorin yang lain menghasilkan produk klorometana (kloroform) dan menghasilkan kembali radikal klorin.

Keseluruhan Reaksi

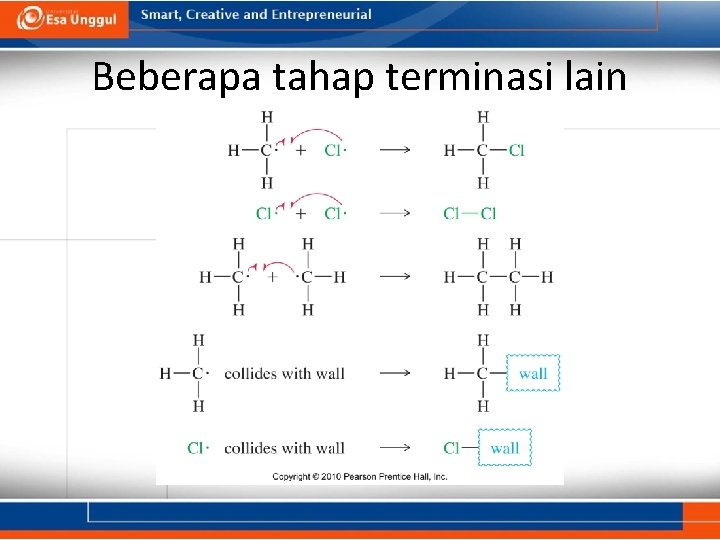
Tahap terminasi • Tahap terminasi merupakan suatu tahap dmana dua spesi radikal bebas berikatan satu sama lain membentuk senyawa nonradikal. • Penggabungan radikal bebas dengan pengotor atau tumbukan radikal bebas degan dinding tempat reaksi juga termasuk tahap terminasi.

Beberapa tahap terminasi lain

Struktur lewis radikal bebas • Radikal bebas memiliki suatu elektron tak berpasangan. • Halogen memiliki 7 elektron valensi sehingga salah satu elektronnya tidak berpasangan.
![Konstanta kesetimbangan Keq products reactants For CH 4 Cl 2 Konstanta kesetimbangan • Keq = [products] [reactants] • For CH 4 + Cl 2](https://slidetodoc.com/presentation_image_h/f6141a350bdf75cfc82cb9bc1ab7484c/image-13.jpg)
Konstanta kesetimbangan • Keq = [products] [reactants] • For CH 4 + Cl 2 CH 3 Cl + HCl Keq = [CH 3 Cl][HCl] = 1. 1 x 1019 [CH 4][Cl 2] • Nilai Keq yang besar menunjukkan reaksi cenderung bergerak ke arah produk.

Perubahan energi bebas § G = (energi produk) - (energi reaktan) § G merupakan banyaknya energi yang tersedia untuk melakukan kerja. § Nilai negatif menunjukkan bahwa reaksi terjadi secara spontan. Go = -RT(ln. Keq) = -2. 303 RT(log 10 Keq) dimana R = 8. 314 J/K-mol dan T = temperatur sistem (K).

Faktor yang mempengaruhi G Perubahan energi bebas bergantung pada: – Entalpi • H = (entalpi produk) - (entalpi reaktan) – Entropi • S = (entropi produk) - (entropi reaktan) G = H - T S

Entalpi • Ho = panas yang dilepaskan atau yang diserap selama reaksi kimia pada keadaan standar. • Eksotermik (- H): panas dilepaskan. • Endotermik (+ H): panas diserap. • Reaksi cenderung membentuk produk jika memiliki entalpi yang rendah.

Entropi • So = perubahan derajat ketidakteraturan atau kebebasan bergerak dari molekul yang ada di dalam sistem. • Peningkatan panas, volume, atau jumlah partikel akan meningkatkan entropi. • Reaksi akan berlangsung spontan jika memiliki derajat ketidakteraturan yang tinggi dan entalpi yang rendah: • Dalam persamaan Go = Ho - T So nilai entropi biasanya memiliki nilai yang relatif kecil.

Contoh Soal 1 Hitung nilai G° untuk reaksi klorinasi metana. Penyelesaian G° = – 2. 303 RT(log Keq) Keq untuk reaksi klorinasi adalah 1. 1 x 1019, dan log Keq = 19. 04 Pada temperatur 25 °C (sekitar 298 ° Kelvin), nilai RT sebesar RT = (8. 314 J/kelvin. mol)(298 kelvin) = 2478 J/mol, atau 2. 48 k. J/mol Substitusi hasil tersebut dihasilkan: G° = (– 2. 303)(2. 478 k. J/mol)(19. 04) = – 108. 7 k. J/mol (– 25. 9 kcal/mol) Dari hasil perhitungan tersebut diperoleh hasil G° yang sangat negatif yang menunjukkan bahwa reaksi klorinasi terjadi secara spontan dan akan terjadi hingga reaksi selesai.

Entalpi pemutusan ikatan • Pemutusan ikatan membutuhkan energi (endotermik) • Pembentukan ikatan melepaskan energi (eksotermik) • Entalpi pemutusan ikatan dapat digunakan untuk mengestimasi H suatu reaksi. • Entalpi pemutusan energi untuk pemutusan ikatan secara homolitik pada suatu molekul gas. • Pemutusan homolitik: ketika pemutusan ikatan terjadi, tiap atom mendapatkan satu elektron. • Pemutusan heterolitik: ketika pemutusan ikatan terjadi, atom yang paling elektronegatif mendapatkan kedua atom.

Pemutusan Homolitik dan Heterolitik

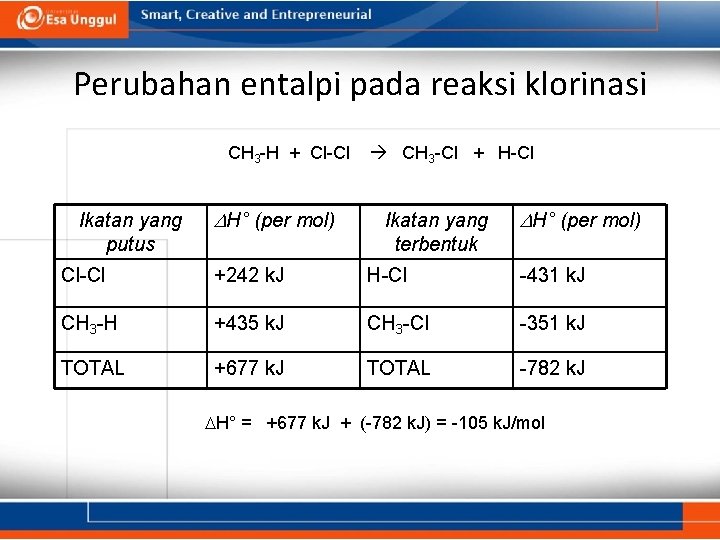
Perubahan entalpi pada reaksi klorinasi CH 3 -H + Cl-Cl Ikatan yang putus DH° (per mol) CH 3 -Cl + H-Cl Ikatan yang terbentuk DH° (per mol) Cl-Cl +242 k. J H-Cl -431 k. J CH 3 -H +435 k. J CH 3 -Cl -351 k. J TOTAL +677 k. J TOTAL -782 k. J H° = +677 k. J + (-782 k. J) = -105 k. J/mol

Kinetika reaksi • Kinetika merupakan kajian mengenai laju reaksi. • Laju reaksi merupakan suatu ukuran peningkatan konsentrasi produk atau penurunan konsentrasi reaktan tiap satuan waktu. • Persamaan laju reaksi atau hukum laju reaksi menunjukkanhubungan antara konsentrasi reaktan dan laju reaksi yang teramati. • Hukum laju reaksi ditentukan secara eksperimen.

Hukum Laju Reaksi • Untuk suatu reaksi A + B C + D, laju reaksi = kr[A]a[B]b – a merupakan orde reaksi untuk reaktan A – b merupakan orde reaksi untuk reaktan B – a + b merupakan orde total • Orde reaksi merupakan jumlah molekul reaktan yang ada pada tahap penentu laju reaksi.

Energi aktivasi • Nilai k bergantung pada temperatur sebagaimana diketahui dari persamaan Arrhenius: dimana A = konstanta (faktor frekwensi) Ea = energi aktivasi R = konstanta gas, 8. 314 J/kelvin. mol T = temperatur absolut Ea merupakan energi kinetik yang dibutuhkan untuk melakukan suatu reaksi.

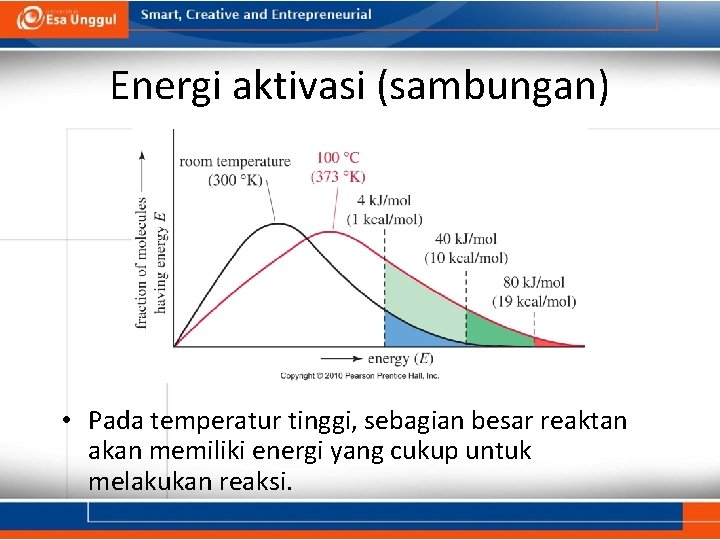
Energi aktivasi (sambungan) • Pada temperatur tinggi, sebagian besar reaktan akan memiliki energi yang cukup untuk melakukan reaksi.

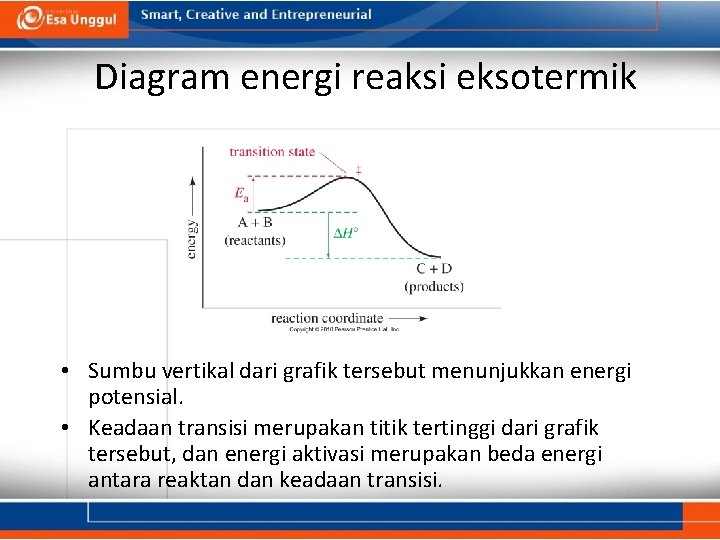
Diagram energi reaksi eksotermik • Sumbu vertikal dari grafik tersebut menunjukkan energi potensial. • Keadaan transisi merupakan titik tertinggi dari grafik tersebut, dan energi aktivasi merupakan beda energi antara reaktan dan keadaan transisi.

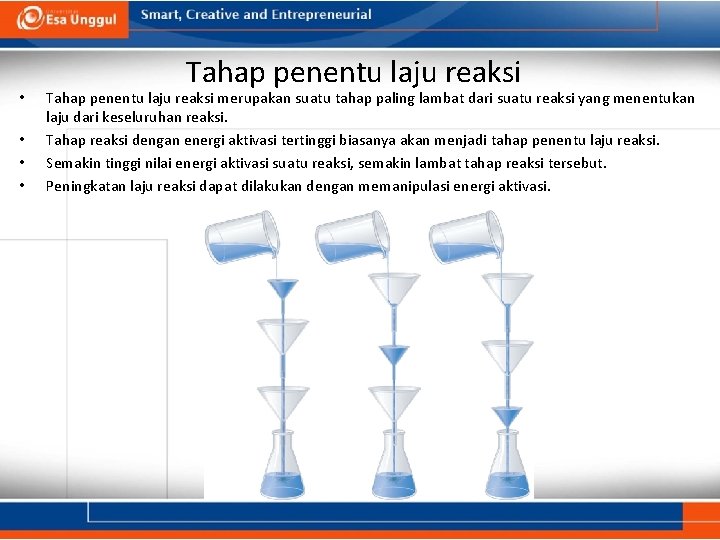
• • Tahap penentu laju reaksi merupakan suatu tahap paling lambat dari suatu reaksi yang menentukan laju dari keseluruhan reaksi. Tahap reaksi dengan energi aktivasi tertinggi biasanya akan menjadi tahap penentu laju reaksi. Semakin tinggi nilai energi aktivasi suatu reaksi, semakin lambat tahap reaksi tersebut. Peningkatan laju reaksi dapat dilakukan dengan memanipulasi energi aktivasi.

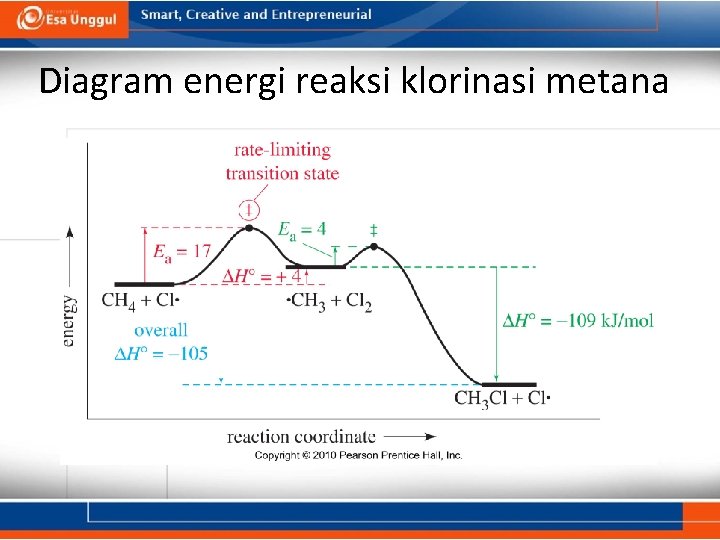
Diagram energi reaksi klorinasi metana

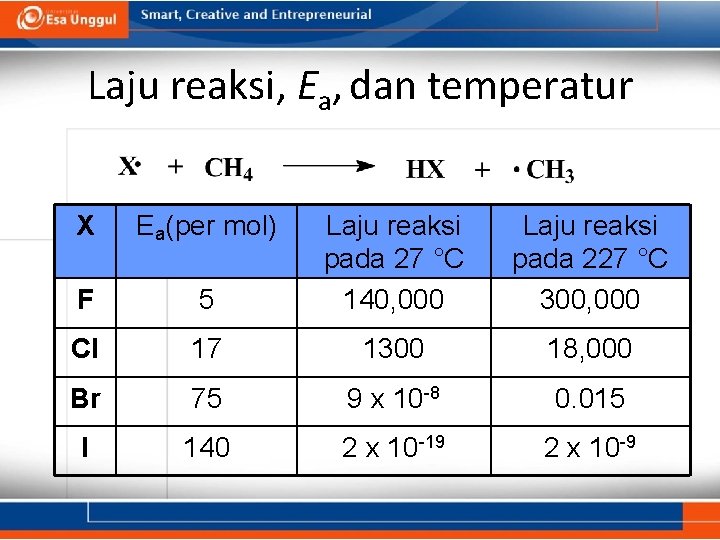
Laju reaksi, Ea, dan temperatur X Ea(per mol) 5 Laju reaksi pada 27 °C 140, 000 Laju reaksi pada 227 °C 300, 000 F Cl 17 1300 18, 000 Br 75 9 x 10 -8 0. 015 I 140 2 x 10 -19 2 x 10 -9

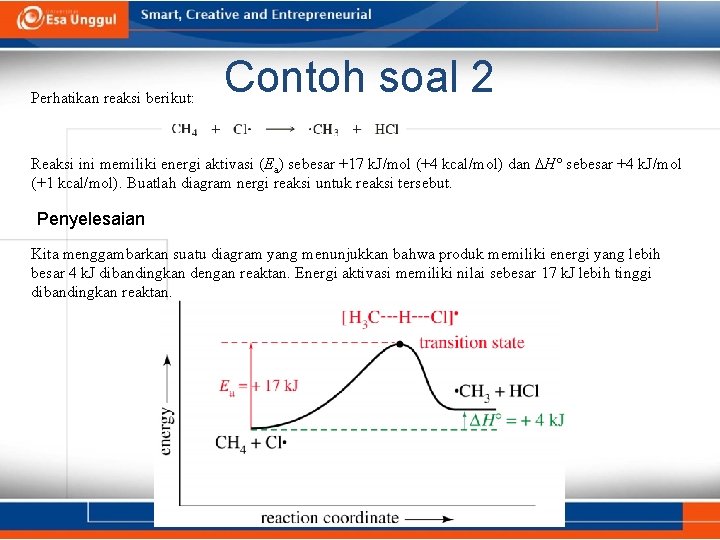
Perhatikan reaksi berikut: Contoh soal 2 Reaksi ini memiliki energi aktivasi (Ea) sebesar +17 k. J/mol (+4 kcal/mol) dan H° sebesar +4 k. J/mol (+1 kcal/mol). Buatlah diagram nergi reaksi untuk reaksi tersebut. Penyelesaian Kita menggambarkan suatu diagram yang menunjukkan bahwa produk memiliki energi yang lebih besar 4 k. J dibandingkan dengan reaktan. Energi aktivasi memiliki nilai sebesar 17 k. J lebih tinggi dibandingkan reaktan. Chapter 4 30

Kesimpulan • Semakin tinggi nilai Ea, laju reaksi akan semakin rendah. • Semakin tinggi temperatur, laju reaksi akan semakin besar, misalnya: – Florin bereaksi dengan metana dengan menghasilkan ledakan. – Klorin bereaksi dengan metana dengan laju reaksi sedang. – Bromin hanya bereaksi dengan metana jika dipanaskan. – Iodin tidak dapat bereaksi dengan metana.

Hidrogen primer, sekunder, dan tertier

Mekanisme klorinasi alkana

Energi pemutusan ikatan untuk radikal bebas

Contoh soal 3 Atom hidrogen tersier bereaksi dengan radikal Cl • sekitar 5, 5 kali lebih cepat dibandingkan dengan hidrogen primer. Prediksikan rasio produk yang dihasilkan dari klorinasi isobutana. Penyelesaian Terdapat sembilan hidrogen primer dan satu hidrogen tersierpada molekul isobutana. (9 hidrogen primer) x (reaktivitas relatif 1. 0) = 9. 0 jumlah relatif hidrogen yang bereaksi (1 hidrogen tersier) x (reaktivitas relatif 5. 5) = 5. 5 jumlah relatif hidrogen yang bereaksi

Contoh soal 3 (sambungan) Penyelesaian meskipun hidrogen primer relatif kurang reaktif, namun, jumlahnya relatif lebih banyak dibanding dengan hidrogen tersier sehingga menghasilkan produk yang lebih banyak. Rasio produk yang dihasilkan akan menjadi 9. 0: 5, 5; atau sekitar 1, 6: 1.

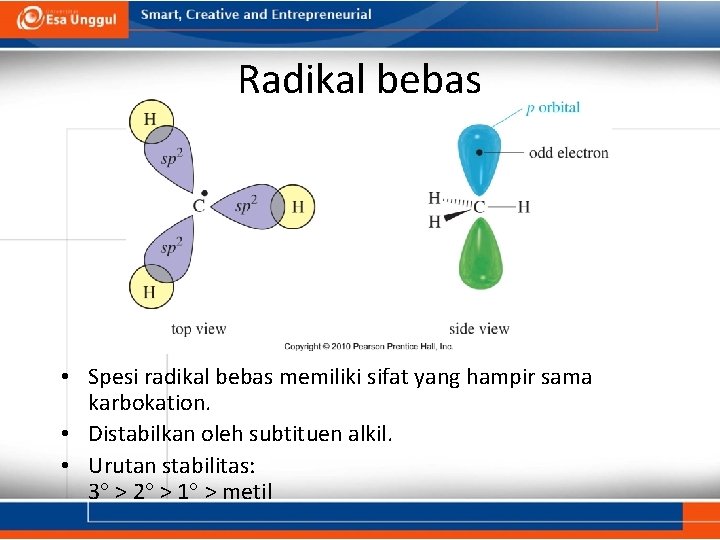
Stabilitas radikal • Radikal yang memiliki stabilitas yang tinggi, akan cenderung memiliki waktu yang cukup untuk bereaksi dengan molekul lain sehingga menghasilkan produk yang lebih banyak. • Radikal bebas memiliki stabilitas yang lebih jinggi jika memiliki substituen yang banyak.

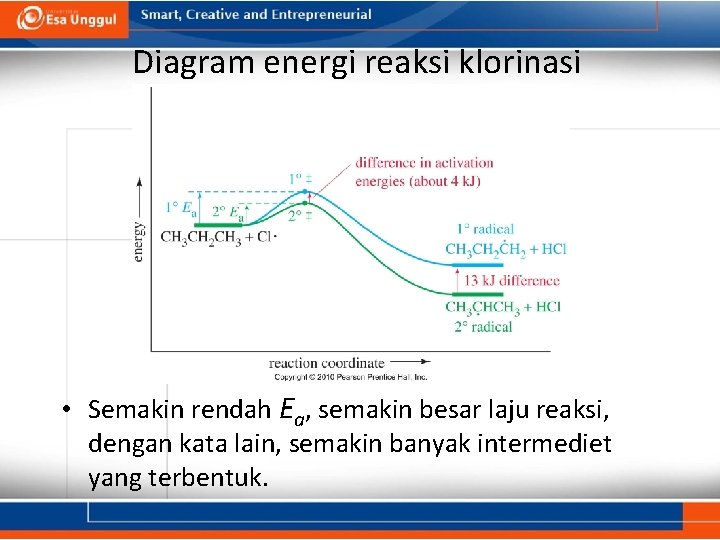
Diagram energi reaksi klorinasi • Semakin rendah Ea, semakin besar laju reaksi, dengan kata lain, semakin banyak intermediet yang terbentuk.

Laju reaksi substitusi pada brominasi propana

Diagram reaksi untuk brominasi propana

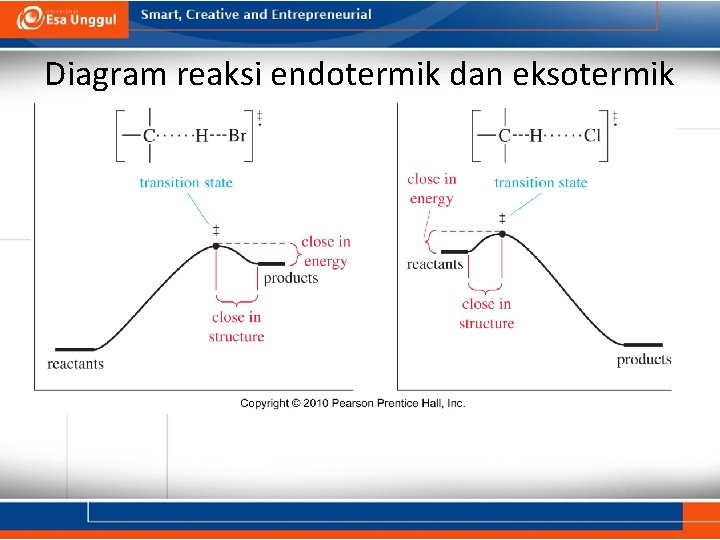
Postulat Hammond • Postulat Hammond menyatakan bahwa struktur geometri keadaan transisi akan menyerupai geometri reaktan atau produk yang memiliki tingkat energi yang hampir mirip dengan keadaan transisi. • Fenomena sebenarnya juga dapat dilihat pada beberapa senyawa yang memiliki struktur yang mirip, juga memiliki energi yang hampir sama. • Struktur keadaan transisi menyerupai struktur dari spesi yang memiliki tingkat energi yang hampir sama. • Reaksi endotermik: geometri keadaan transisi menyerupai produk. • Reaksi eksotermik: geometri transisi menyerupai reaktan.

Diagram energi: krorinasi vs brominasi

Diagram reaksi endotermik dan eksotermik

Inhibitor Radikal • Inhibitor radikal sering ditambahkan ke dalam makanan untuk mencegah pembusukan melalui reaksi radikal berantai. • Tanpa adanya suatu inhibitor, tiap tahap inisiasi akan mengakibatkan suatu reaksi berantai sehingga banyak molekul yang ikut bereaksi. • Dalam hal ini, inhibitor akan bereaksi dengan radikal bebas untuk membentuk suatu molekul stabil. • Vitamin E dan vitamin C biasanya digunakan untuk melindungi sel organisme dari radikal bebas.

Inhibitor radikal (sambungan) • Reaksi radikal berantai merupakan reaksi yang cepat dan memiliki banyak tahap eksotermik yang menghasilkan banyak spesi radikal reaktif yang lebih stabil. • Ketika suatu inhibitor ke dalam suatu reaksi, inhibitor akan bereaksi dengan radikal dan membentuk intermediet yang stabil sehingga reaksi selanjutkan akan terjadi secara lambat dan endotermik.

Intermediet karbon reaktif

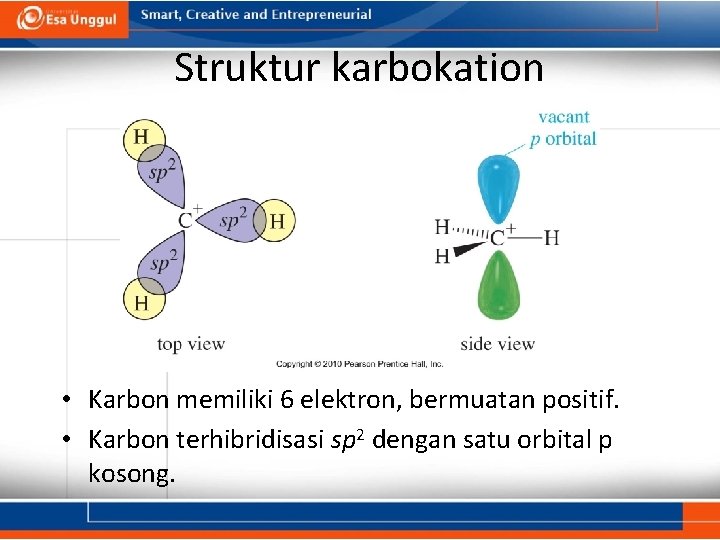
Struktur karbokation • Karbon memiliki 6 elektron, bermuatan positif. • Karbon terhibridisasi sp 2 dengan satu orbital p kosong.

Stabilitas karbokation

Stabilitas karbokation (sambungan) • Karbokation dapat distabilkan oleh karbokation melalui dua cara: 1. efek induktif: mendonasikan kerapatan elektron melalui ikatan sigma. 2. hiperkonjugasi: tumpang tindih orbital ikatan sigma dengan orbital p kosong.

Radikal bebas • Spesi radikal bebas memiliki sifat yang hampir sama karbokation. • Distabilkan oleh subtituen alkil. • Urutan stabilitas: 3 > 2 > 1 > metil

Stabilitas radikal karbon

Karbanion • Kabrbanion memiliki 8 elektron: 6 elektron ikatan dan 1 pasangan elektron bebas. • Karbon memilki sebuah muatan negatif. • Didestabilisasi oleh gugus alkil. • Urutan stabilitas: Metil >1 >2 >3

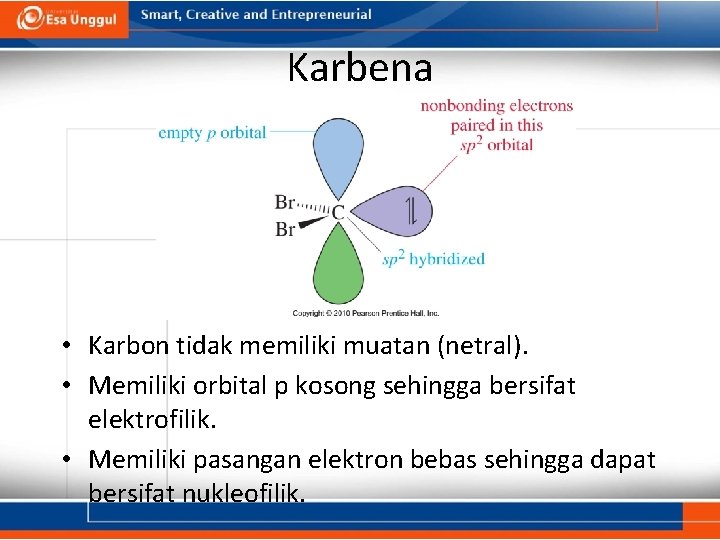
Karbena • Karbon tidak memiliki muatan (netral). • Memiliki orbital p kosong sehingga bersifat elektrofilik. • Memiliki pasangan elektron bebas sehingga dapat bersifat nukleofilik.

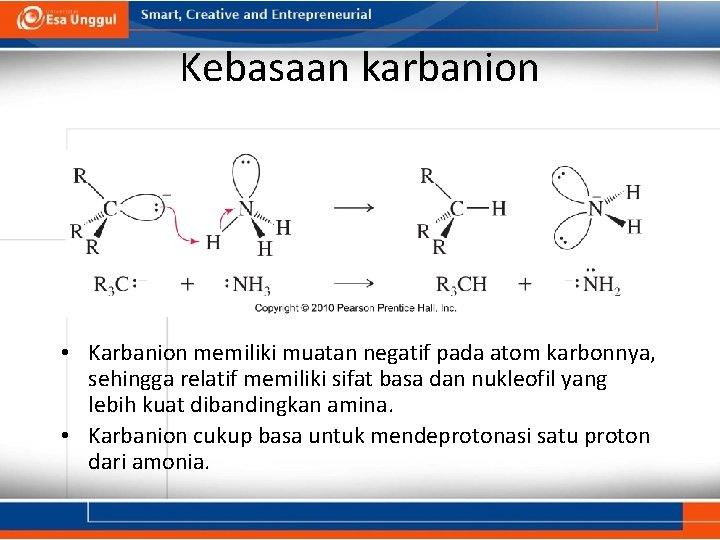
Kebasaan karbanion • Karbanion memiliki muatan negatif pada atom karbonnya, sehingga relatif memiliki sifat basa dan nukleofil yang lebih kuat dibandingkan amina. • Karbanion cukup basa untuk mendeprotonasi satu proton dari amonia.

Karbena sebagai intermediet reaksi • Suatu basa kuat dapat digunakan untuk mendeprotonasi satu proton dari tribromometana (CHBr 3) menghasilkan karbanion yang terstabilkan secara induktif. • Karbanion ini melepaskan ion bromida untuk menghasilkan dibromokarbena. Karbena terhibridisasi sp 2 dengan geometri trigonal. • karbena memiliki pasangan elektron bebas dan orbital p kosong sehingga dapat bereaksi sebagai nukleofil ataupun elektrofik.