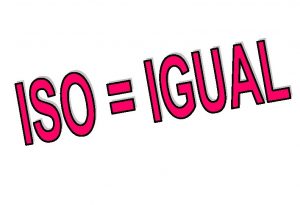ISTOPOS TOMO ES LA PARTE MAS PEQUEA DE




























- Slides: 31

ISÓTOPOS

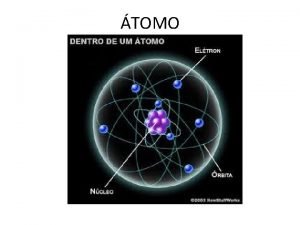
ÀTOMO • ES LA PARTE MAS PEQUEÑA DE UN ELEMENTO QUE SIGUE CONSERVANDO LAS PROPIEDADES DE ÈSTE.

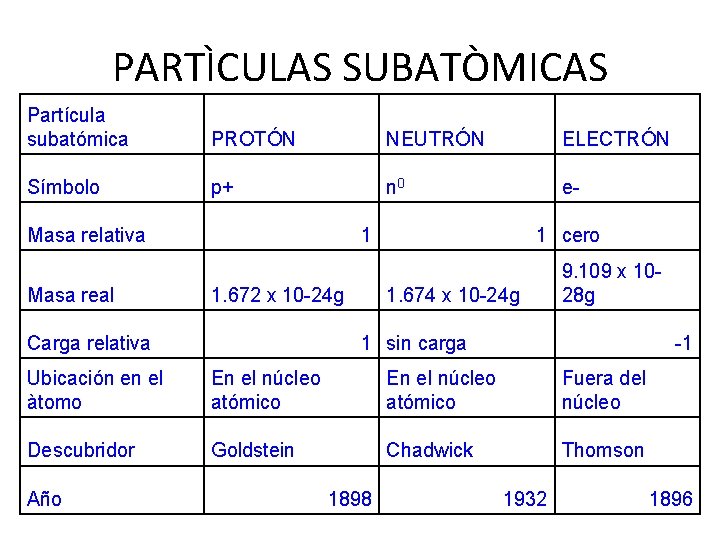
PARTÌCULAS SUBATÒMICAS Partícula subatómica PROTÓN NEUTRÓN ELECTRÓN Símbolo p+ n 0 e- Masa relativa Masa real 1 1. 672 x 10 -24 g Carga relativa 1 cero 1. 674 x 10 -24 g 9. 109 x 1028 g 1 sin carga -1 Ubicación en el àtomo En el núcleo atómico Fuera del núcleo Descubridor Goldstein Chadwick Thomson Año 1898 1932 1896

ISÓTOPOS SON ÀTOMOS DE UN MISMO ELEMENTO QUE TIENEN EL MISMO NÙMERO DE PROTONES PERO DIFERENTE NÙMERO DE NEUTRONES

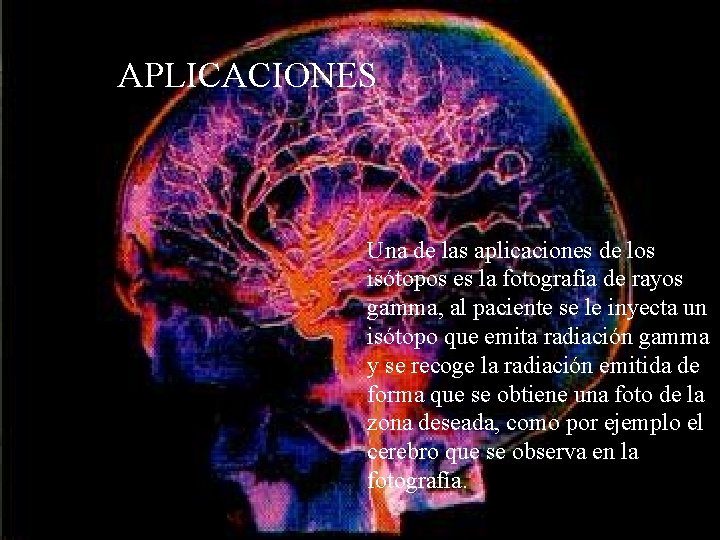
Isótopos usados en medicina APLICACIONES Una de las aplicaciones de los isótopos es la fotografía de rayos gamma, al paciente se le inyecta un isótopo que emita radiación gamma y se recoge la radiación emitida de forma que se obtiene una foto de la zona deseada, como por ejemplo el cerebro que se observa en la fotografía.

RADIOISÓTOPO EJEMPLOS USOS Carbono 14 Fechado radiactivo de fósiles y seres vivos. Uranio 238 Determinación de la edad de las rocas. Tecnecio 99 Formación de imágenes de cerebro, tiroides, hígado, riñón, pulmón y sistema cardiovascular Yodo 131 Diagnóstico de enfermedades de la tiroides. Fósforo 32 Detección de cáncer en la piel. Rastreo genético de DNA. Hierro 59 Detección de anemia Talio 201 Formación de imágenes del corazón

• EN 1913 H. MOSELEY DESCUBRIÒ QUE LA LONGITUD DE ONDA DE LOS RAYOS “X” EN CADA ELEMENTO DEPENDÌA DE EL NÙMERO DE PROTONES EN EL NÙCLEO Y A ESTE NÙMERO DE PROTONES LO LLAMÒ: NÙMERO ATÒMICO ( Z )

Número atómico • Es el número de protones de un átomo. Se representa con la letra (Z )y se escribe como subíndice a la izquierda del símbolo del elemento: ZX. • Ejemplos: 1 H, 8 O, 26 Fe.

EL NÙMERO ATÒMICO TAMBIEN ES IGUAL AL NÙMERO DE ELECTRONES EN EL ÀTOMO

UN ATOMO ES ELECTRICAMENTE NEUTRO CUANDO EL NÙMERO DE PROTONES ES IGUAL AL NÙMERO DE ELECTRONES

EL NÙMERO DE PROTONES DETERMINA LA IDENTIDAD DEL ELEMENTO

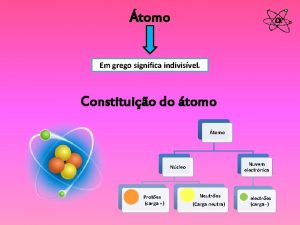
A LAS PARTÌCULAS QUE COMPONEN EL NÙCLEO SE LES LLAMA: NUCLEONES PROTONES Y NEUTRONES

AL NÙMERO TOTAL DE NUCLEONES SE LE LLAMA: NÙMERO MÀSICO ( A )

PARA DETERMINAR EL NÙMERO DE NEUTRONES : No. NEUTRONES = A - Z

NOTACIÒN ISÒTOPICA

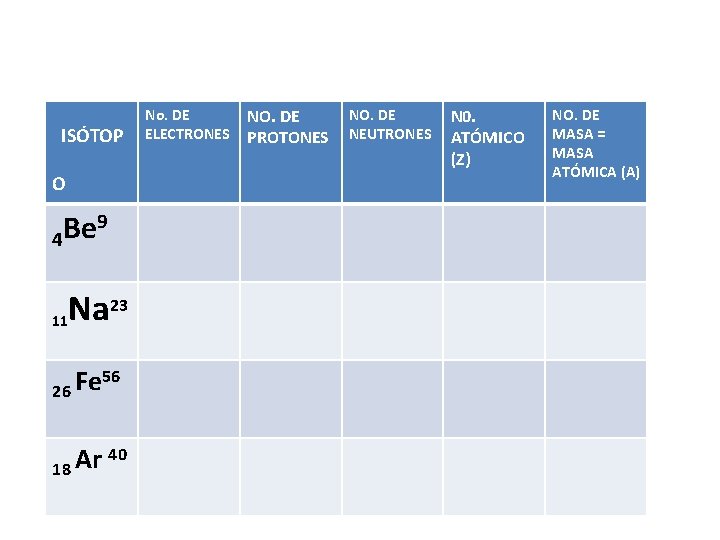
ISÓTOP O 9 Be 4 23 Na 11 56 Fe 26 40 Ar 18 No. DE ELECTRONES NO. DE PROTONES NO. DE NEUTRONES N 0. ATÓMICO (Z) NO. DE MASA = MASA ATÓMICA (A)















235 92 U
 Pequea valley sd
Pequea valley sd Pequeã±a empresa
Pequeã±a empresa Pequeã±a empresa
Pequeã±a empresa Os atomos sao formados por protons neutrons e eletrons
Os atomos sao formados por protons neutrons e eletrons Que son los isótopos
Que son los isótopos Que es un isotopo estable
Que es un isotopo estable Istopos
Istopos Cómo se escribe 15 enteros 204 milésimos
Cómo se escribe 15 enteros 204 milésimos Missa parte por parte
Missa parte por parte Te invitamos hacer parte
Te invitamos hacer parte Este parte aquele parte
Este parte aquele parte Era para falar ontem mas não encontrei em parte alguma
Era para falar ontem mas não encontrei em parte alguma Vuele bajo facundo cabral
Vuele bajo facundo cabral Ejercicios tildes
Ejercicios tildes Mientras mas ruido hace la carreta mas vacia esta
Mientras mas ruido hace la carreta mas vacia esta Cosa con e
Cosa con e Mas o más
Mas o más Para que mi amor no sea un sentimiento
Para que mi amor no sea un sentimiento Ignoraba porque hacía todo aquello
Ignoraba porque hacía todo aquello Leo primero tomo 1 primero basico
Leo primero tomo 1 primero basico La lengua subestandar
La lengua subestandar Standard screening tomohd
Standard screening tomohd Tomo gibanica
Tomo gibanica Perlawanan sutan syahrir
Perlawanan sutan syahrir Tomo cerovšek
Tomo cerovšek Asumo riesgos y tomo la iniciativa
Asumo riesgos y tomo la iniciativa Tomo el jugo en un a. cuchillo b. vaso c. plato
Tomo el jugo en un a. cuchillo b. vaso c. plato Esde tomo único
Esde tomo único Codigo nacional de electricidad tomo iv
Codigo nacional de electricidad tomo iv 1 tomo
1 tomo Igor bratož
Igor bratož Tomo goto
Tomo goto