Istituto DIstruzione Superiore N Miraglia Liceo Classico N





















- Slides: 25

Istituto D’Istruzione Superiore “N. Miraglia” Liceo Classico “N. Carlomagno Lauria (PZ) P e s s a l C B a rim Il viag g i o dell’at omo d i carbo nio Ann o sc ol 2007 astico /08 1

L’ ATOMO DI CARBONIO 2

Il nostro è un viaggio affascinante e parte da molto lontano. In una stella, attraverso un processo di fusione nucleare, grazie all’elevata contrazione gravitazionale e all’altissima temperatura (superiore a 100 milioni di kelvin), 3 atomi di elio si trasformano in un atomo di carbonio ( processo 3α). La stella esplode e gran parte della materia stellare è proiettata nello spazio a elevatissima velocità. Gli atomi di carbonio sono catturati da una nebulosa rotante in contrazione che si condensa nel Sole e nei pianeti; poi sono inglobati dal pianeta Terra. 3

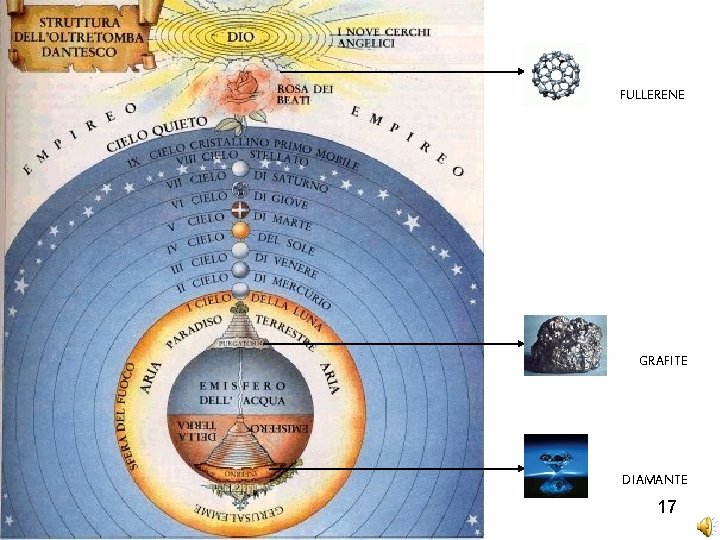
Ha inizio un viaggio straordinario che ripercorre gli stessi luoghi dell’universo dantesco. Il viaggio del carbonio sembra seguire le cantiche de “La Divina Commedia”. Ma se è vero che per il Sommo Poeta il peregrinare nell’oltremondo è costituito dal progressivo avvicinamento alla luce, per il nostro atomo di carbonio il discorso è diverso: dalla luce delle stelle al fullerene. Tuttavia, come per l’umanità di Dante, anche quello del carbonio è un lento cammino dall’immobilità del diamante alla sua massima espressione, dalla prigionia della struttura cristallina al compimento estremo della sua stessa natura. Il carbonio è l’elemento della vita; esso svolge un ruolo fondamentale in qualunque molecola organica. Ma è nostro intento occuparci della sua natura inorganica e delle forme allotropiche; le stesse che incontreremo, in momenti diversi, nel nostro piccolo-grande viaggio. Il carbonio rivive l’esperienza del Sommo Poeta e raggiunge l’Inferno, il Purgatorio e il Paradiso. 4

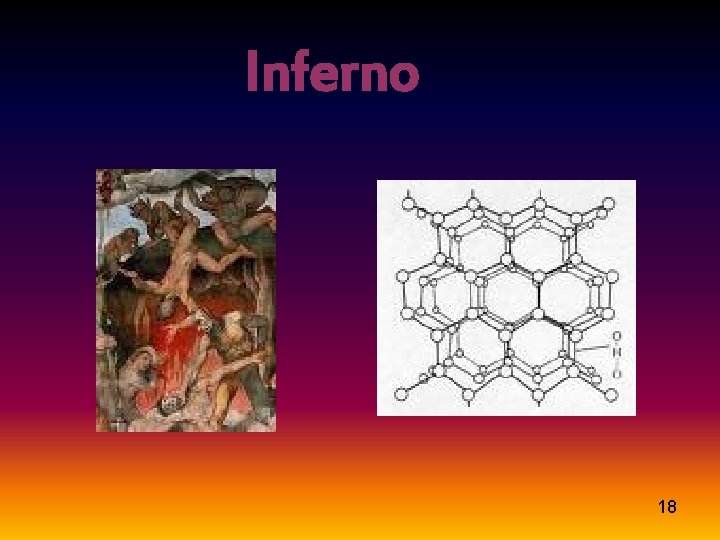
Nell’ Inferno l’atmosfera è cupa e dura, la pressione e la temperatura sono alte: l’atomo qui diventa diamante, immobile e lucente; i suoi orbitali atomici subiscono un’ibridizzazione sp 3 e assumono una struttura tetraedrica combinandosi con altri 4 atomi di carbonio. È duro allo stesso modo dei peccatori incontrati da Dante ed ugualmente è passivo ed inattivo. La durezza (nella scala di Mohs è pari a 10) è dovuta alla presenza di legami covalenti estesi a tutta la struttura e orientati ai vertici di un tetraedro (angolo di legame 109, 5°), che lo collegano a qualunque coppia di atomi adiacenti. Il diamante è trasparente, ha elevata conducibilità termica con punto di fusione a 3820 K. 5

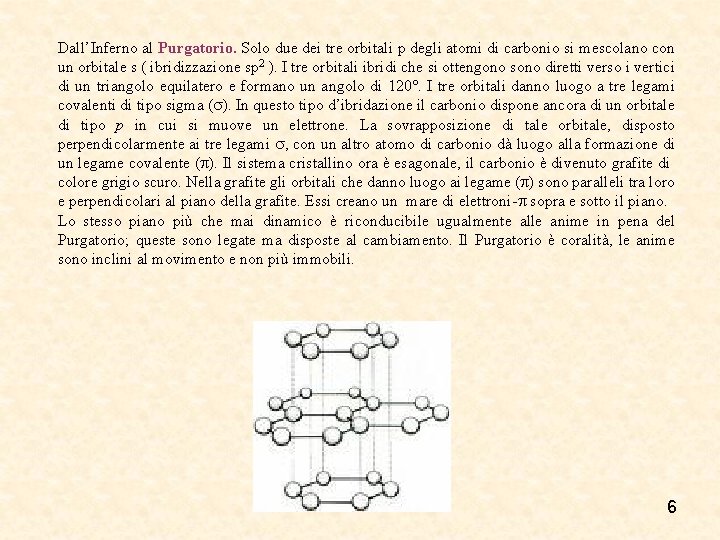
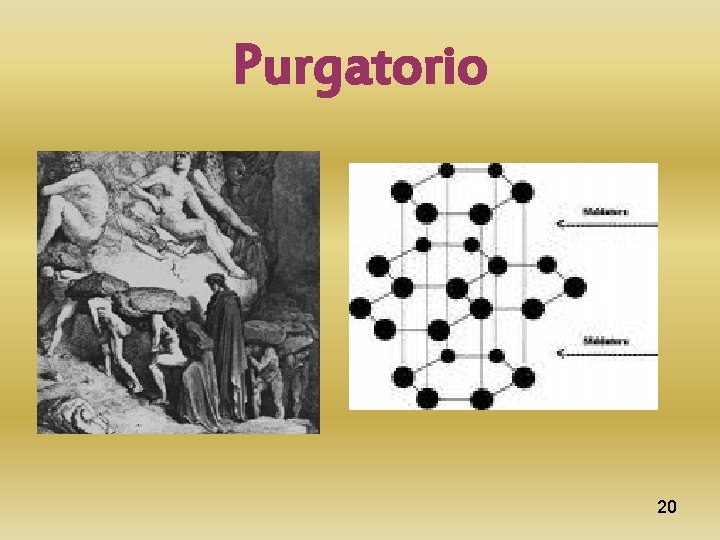
Dall’Inferno al Purgatorio. Solo due dei tre orbitali p degli atomi di carbonio si mescolano con un orbitale s ( ibridizzazione sp 2 ). I tre orbitali ibridi che si ottengono sono diretti verso i vertici di un triangolo equilatero e formano un angolo di 120°. I tre orbitali danno luogo a tre legami covalenti di tipo sigma ( ). In questo tipo d’ibridazione il carbonio dispone ancora di un orbitale di tipo p in cui si muove un elettrone. La sovrapposizione di tale orbitale, disposto perpendicolarmente ai tre legami , con un altro atomo di carbonio dà luogo alla formazione di un legame covalente ( ). Il sistema cristallino ora è esagonale, il carbonio è divenuto grafite di colore grigio scuro. Nella grafite gli orbitali che danno luogo ai legame ( ) sono paralleli tra loro e perpendicolari al piano della grafite. Essi creano un mare di elettroni- sopra e sotto il piano. Lo stesso piano più che mai dinamico è riconducibile ugualmente alle anime in pena del Purgatorio; queste sono legate ma disposte al cambiamento. Il Purgatorio è coralità, le anime sono inclini al movimento e non più immobili. 6

Ma la grafite allo stesso tempo è anche la fase stabile del carbonio in condizioni superficiali; inoltre è una delle sostanze più soffici (1 -2 nella scala Mohs) Il minerale si presenta in masse compatte, fogliacee, granulose, in aggregati sferici o riempimenti terrosi. Ha un’ alta temperatura di fusione (3500°C) la sua temperatura di ebollizione è di 4832°C. La grafite è insolubile negli acidi; reagisce solo con l'HNO 3 bollente. L'impiego industriale di tale minerale interessa molteplici settori. I prodotti sono materiali refrattari, lubrificanti, ma anche l'indurimento dell'acciaio e la realizzazione di matite Un equivalente artificiale della grafite può essere ottenuto riscaldando, ad elevatissima temperatura, l’antracite in appositi forni elettrici. 7

Il carbonio è giunto in Paradiso. Come Dante ha attraversato il mondo dei peccatori e di coloro che sperano nella salvezza; ora, a contatto con la luce, si prepara a realizzarsi nel compimento più estremo, perfetto e immortale della sua potenzialità. Il risultato è emblematico e sorprendente. Gli atomi di carbonio, si evolvono in un esempio di superordine, il fullerene, assumendo la forma di cupola geodetica. Il fullerene C 60 è costituito da 12 pentagoni e 20 esagoni; ciascun pentagono è circondato da cinque esagoni. Il fullerene rappresenta la molecola più simmetrica nello spazio euclideo tridimensionale, nonché “la più rotonda”. 8

Fino al tardo ventesimo secolo, la grafite ed il diamante erano gli unici allotropi conosciuti del carbonio. Poi, negli esperimenti con fasci molecolari, si osservarono molecole con massa corrispondente a quella di 60, 70 o anche oltre, atomi di carbonio. Harold Kroto, dall'University of Sussex James Heath, Sean O'Brien, Robert Curl e Richard Smalley, dalla Rice University, scoprirono il C 60 e gli altri fullereni nel 1985. Kroto, Curl e Smalley hanno ricevuto il premio Nobel per la chimica nel 1996, per il loro ruolo nella scoperta di questi composti. Il C 60 fu successivamente notato in ambienti fuori dai laboratori (ad esempio nella classica fuliggine della candela). Si tratta di molecole che prendono una forma simile a quella di una sfera vuota, di un'ellissoide o di un tubolare. Per questo motivo il nome originario della molecola era “soccerene”, da soccer, vista la somiglianza della sua struttura con quella di un pallone da calcio. Gli atomi di carbonio si dispongono infatti ai vertici di un particolare poliedro semiregolare: l'icosaedro troncato. Il fullerene è strutturalmente simile alla grafite, ma si differenzia per alcuni anelli di forma pentagonale (o a volte ottagonale) che impediscono una struttura planare. 9

Nella struttura del C 60 ogni vertice dell’icosaedro troncato è occupato da un atomo di carbonio ed ogni atomo è legato ad altri tre, grazie ad un doppio legame covalente e a due legami singoli. Nel fullerene il carbonio ibridato sp 2 è caratterizzato da un doppio legame, uno sigma ed uno pi greco. Nella struttura del C 60 , non planare, l’angolo tra il legame e l’asse che contiene l’orbitale (legame ) è di 101. 6°. Il cluster C 60 ha una notevole stabilità: ha la forma di una gabbia ‘sferica’ cava, di diametro 7. 1 Å, Il nome "fullerene", coniato per la molecola, deriva dalle cupole geodesiche di forma simile disegnate in precedenza dal famoso architetto americano Buckminster Fuller. Più completamente, il nome assegnato alla molecola C 60 è buckminsterfullerene. 10

La mente umana subisce immediatamente il fascino di tale molecola. Sono numerosi gli studiosi che, con crescente interesse, sono intenti a scoprire, di volta in volta qualche aspetto celato della molecola. E così un gruppo di ricercatori, guidato dall’ingegnere ambientale Joseph Hughes del Georgia Institute of Technology, scopre che i nano-C 60 si dissolvono facilmente nell’acqua sotto forma di aggregati con un diametro compreso fra i 25 e i 500 nanometri. Tali ricercatori espongono il nano-C 60 anche a due tipi comuni di batteri del suolo. Arrivano alla conclusione che a piccole concentrazioni delle particelle (0, 5 parti per milione) viene inibita la respirazione e la crescita dei batteri. Le proprietà antibatteriche degli aggregati di C 60 sollevano numerose e interessanti questioni. Gli studiosi tuttora ritengono che sia possibile sfruttare tali proprietà. Tuttavia saranno necessarie ulteriori ricerche per verificare i possibili effetti negativi di questi materiali sulla salute degli ecosistemi. 11

Il fullerene può essere usato per immagini mediche e per la cura del cancro. Gli anticorpi, legati alla buckyball, possono trasportare gli atomi radioattivi fino alle cellule tumorali da trattare. Per le immagini mediche, al paziente verrà immessa una dosa minore di traccianti radioattivi, in quanto, se contenuti all’interno della gabbia di fullerene, si previene che possano interagire con il corpo, in particolare con il sistema immunitario. I fullereni possono essere utilizzati come inibitori dei siti attivi delle proteasi (utili ai virus per la loro proliferazione, incoraggianti risultati sono stati ottenuti in soluzione acquosa di HIV) Le memorie flash, dispositivi onnipresenti nei telefoni cellulari, nelle fotocamere digitali così come in molte applicazioni nell’elettronica di consumo, potrebbero guadagnare notevolmente in efficienza grazie all’integrazione dei fullereni. 12

Le attuali tendenze di ricerca sui fullereni includono lo studio di nanotubi di carbonio (tubi vuoti di grafite), fullereni endoedrici (atomi singoli intrappolati in gabbie di fullerene), fulleriti (sistemi di fullereni drogati allo stato solido) Il drogaggio con piccole quantità di metalli alcalini (A), dà composti come ad esempio A 3 C 60, i quali sono dei conduttori metallici. Questo drastico cambiamento nella conducibilità è dovuto al trasferimento di elettroni di valenza dai localizzati atomi alcalini all'intero solido. Ma c'è di più. Alle basse temperature (20 -40 K), la maggior parte dei fulleriti drogati diventano superconduttori (non mostrano alcuna resistenza al passaggio della corrente elettrica). I nanotubi possono essere considerati come costituiti da uno strato di grafite avvolto su sè stesso. È possibile ottenere nanotubi a singola parete o multipla nei quali la distanza fra i vari strati è identica a quella riscontrabile tra i piani di grafite La struttura, dopo un successivo rilassamento, tende ad arrotolarsi su sé stessa, ottenendo la tipica struttura cilindrica: questi sono i nanotubi di carbonio. I nanotubi possono essere visti analogamente al fullerene come una delle forme allotropiche del carbonio. 13

Il corpo del nanotubo è formato da soli esagoni, mentre le strutture di chiusura sono formate da esagoni e pentagoni, esattamente come i fullereni. Per questa ragione i nanotubi possono essere considerati come una specie di fullereni giganti. Proprio per questa conformazione di esagoni e pentagoni, i nanotubi presentano spesso dei difetti strutturali o delle imperfezioni che deformano il cilindro. Il diametro di un nanotubo è compreso tra un minimo di 0, 7 nm e un massimo di 10 nm. L’elevatissimo rapporto tra lunghezza e diametro consente di considerarli come delle nanostrutture virtualmente monodimensionali, e conferisce a queste molecole delle proprietà veramente peculiari. Il primo a scoprire un nanotubo è nel 1991 il giapponese Sumio Iijima, ricercatore della NEC Corporation, la nota industria elettronica nipponica. I nanotubi hanno un diametro 50 mila volte inferiore a quello di un capello, con le pareti costituite da un foglio di grafite monostrato avvolto su se stesso una o più volte. Con il carbonio, e ora anche con altri elementi, i ricercatori riescono a costruire dei nanotubi, che a parità di sezione sono sei volte più rigidi dell’acciaio e 100 volte più resistenti alla rottura. I nanotubi oggi promettono applicazioni nella realizzazione dei materiali più vari, nell’elettronica, nella biologia. 14

Estremamente resistenti, leggeri, conduttori, capaci di interagire sia con la materia vivente che con le onde elettromagnetiche: le straordinarie capacità ipotizzate per questi materiali sono oggi oggetto di verifica in molti laboratori. I procedimenti di sintesi hanno fatto grandi progressi negli ultimi anni e si comincia a preparare la via dello sfruttamento industriale. Un gruppo di ricerca all’Università di Cambridge ha messo a punto nel 2004 un processo per produrre nanotubi in carbonio di lunghezza illimitata, riuscendo per la prima volta a costruire i tubi e contemporaneamente a “filarli” in fibre. Oggi le industrie pilota producono qualche chilo di nanotubi al giorno, ma per il 2010 si conta di arrivare a diverse tonnellate al giorno, riducendo di mille volte il loro costo. Si pensa di utilizzarli per realizzare plastiche antistatiche o schermi elettromagnetici, inserendo nei polimeri plastici piccole quantità di nanotubi. Le applicazioni meccaniche invece hanno bisogno ancora di conferme. 15

I nanotubi possono essere utilizzati per trasportare la materia a livello molecolare, portando le molecole proprio sul substrato desiderato e questa proprietà potrebbe essere utilizzata sia in medicina sia nella realizzazione di microcircuiti. I nanotubi in carbonio, inoltre, potranno sostituire i filamenti di tungsteno delle normali lampadine, dando un’illuminazione più brillante a tensioni più basse e con un ciclo di utilizzo più lungo. E c’è chi, come gli ingegneri della Nasa, sogna di realizzare un ascensore verso lo spazio utilizzando cavi intrecciati con nanotubi. Finisce qui il nostro viaggio. Un progressivo avvicinamento alla compiutezza, un graduale perfezionamento. L’atomo di carbonio ha ripercorso la via della letteratura e della grandezza; la lettura del viaggio da noi ideato speriamo possa coinvolgervi allo stesso modo. 16

FULLERENE GRAFITE DIAMANTE 17

Inferno 18

Scagliato da siderali spazi, Nel ventre della terra fu’ annegato. Provai del fuoco gli amari strazi Bloccato in un eterno morire, Sì aspro e duro e freddo diamante Privato di quel dolce divenire, E da forze ostili così pressato Che nel pensier ritorna la paura. Non ero solo ma ben aggregato Ond’il Creato è di vita amante. Immobil con compagni sempiterni: Da quel momento non andammo avante. Ad altri quattro di egual natura. Non era più possibile sfuggire Dall’aspra tetraedrica struttura, “Vexilla regis prodeunt inferni”. Dell’uomo son eterna maraviglia Che muta e tronca i vincoli fraterni, Sì da distrugger l’umana famiglia. 19

Purgatorio 20

Per correr miglior acque alza la vela La navicella di combinazioni Con atomi che tessono la tela Di grafite legati da elettroni, Non fortemente sì da impedire Di una nobil struttura le tensioni In tormentoso e aspro divenire. Di rocce metamorfiche scistose, Lì dove non mi lasciano dormire Degli uomini le tecniche smaniose, Mi abbandono al ciclo naturale. Mi muovo in anelli silenziosi E mi distinguo solo in orbitale Di elettroni dal centro allontanati Presi in un destino esagonale. Come color che insiem son nati Per un disegno voluto da Dio Si muovono i miei atomi aggregati O per un bimbo intento al disio… 21

Paradiso 22

La gloria di Colui che tutto move Mi organizzò in una bella forma Che l’alta fantasia già commove. Le geometrie perfette erano l’orma D’amor che move il Sole e le altre stelle. Di due forme la sfera adorna, Poligoni a guisa di sorelle sicchè divenni poi fullerene, pentagoni ed esagoni eran quelle. La sfera da fuliggine proviene Immagine sferica di perfezione Di tutto a tutti la speme contiene: Di povertà e dolore è attenuazione. La sofferenza umana discerne e cura, Di cellule maligne è punizione, Al mortale HIV può far paura. La fama d’energia può saziare, Quand’alcali metalli in sua natura Son: fullerite la fanno nomare. Quella circulazion quando collassa La più sottile corda sa creare. Del carbonio la forma universale, Che in sé ogni divenire ammassa, Figura e emblema di forza vitale, Consegna all’om l’universal messaggio. 23

Ministero dell’Istruzione, dell’Università e della Ricerca Istituto di Istruzione Secondaria Superiore “N. Miraglia” LICEO CLASSICO “N. CARLOMAGNO” Via Cerse dello Speziale 85045 LAURIA (PZ) Seg. e Fax 0973 823966 Realizzazione a cura della classe IB Battaglia Veronica Bruno Dario Candela Valentina Cascini Caterina Castelluccio Veronica Celano Maria Teresa Celano Noemi Cifarelli Elena Civale Davide Clores Domenica Cozzi Maria Francesca Docente di Lingua e Lettere italiane Prof. ssa Rita Galietta Di Sanzo Domenico Giovinazzo Giuseppina Mandarino Francesco Mastrolorenzo Raffaele Olivieri Emanuele Ricciardi Giacomina Salamone Anna Viceconti Luca Viceconti Marilena Vitale Katia Docente di Chimica e Scienze naturali Prof. ssa Gabriella Zaccara Dirigente Scolastico Prof. Nicola Ricciardi 24

Bibliografia e “sitografia” • • • La “Divina Commedia” - Dante Alighieri a cura di T. De Salvo – Ed. Zanichelli Il Sistema Periodico - Primo Levi – Einaudi Editore Fullerene Science Module Authors: Professor John R. Bleeke and Dr. Regina F. Frey Department of Chemistry, Washington University St. Louis, MO 63130 • Fullerene - a cura di Attilio Scala – Tesina di informazione sul fullerene e sulle sue applicazioni - Corso di Tecnologia di Chimica Applicata, tenuto dal prof. Antonio Apicella - Ingegneria dei Materiali – “Università "Federico II" di Napoli. • Nanotubi a base di carbonio - L. Colonna, A. Gianturco, I. Zelano - Informatica per la chimica Università degli Studi di Torino - Facoltà di Scienze MFN Laurea specialistica in metodologie chimiche avanzate Anno accademico 2006/2007 • 'Buckyball' Molecule May Block AIDS Step Malcom W. Browne - New York Times August 3, 1993 • Microlaser o nanotubi? di Giovanni Bachelet e Luciano Colombo- Galileo Giornale di scienza e problemi globali • Fullerene - www. wikipedia. it • Diamante - www. wikipedia. it • Grafite - www. wikipedia. it • Nuove meraviglie per i nanotubi di carbonio Le applicazioni potrebbero riguardare sia i dispositivi elettronici sia gli aerei - Folco Claudi (13 settembre 2000) Le Scienze edizione italiana di Scientific American. • I fullereni: un esempio di superordine: http: //www. chimicando. it/contributi/fullereni. pdf • Struttura del fullerene : http: //it. geocities. com/bobby_fenolo/Fullerene/struttura_c 60. htm • Fullereni nell'ambiente : Le nanoparticelle potrebbero danneggiare gli ecosistemi batterici (13 maggio 2005) Le Scienze edizione italiana di Scientific American. • Nuovo corso di Chimica - F. Tottola, A. Allegrezza, M. Righetti - Minerva Italica • Geografia Generale M. Crippa, M. Fiorani – Arnoldo Mondadori Scuola Le immagini sono state tratte da siti web, alcuni dei quali sopracitati. Musiche: Quarta corda J. S. Back- Celine Dion Titanic 25
 Impedenza meccanica
Impedenza meccanica Istituto di istruzione superiore cristoforo marzoli
Istituto di istruzione superiore cristoforo marzoli Istituto superiore tropea
Istituto superiore tropea Open day antonietti iseo
Open day antonietti iseo Istituto superiore mario boella
Istituto superiore mario boella Liceo cardano pavia
Liceo cardano pavia Istituto superiore di studi penitenziari
Istituto superiore di studi penitenziari Istituto superiore di tecniche investigative
Istituto superiore di tecniche investigative Istituto superiore mario boella
Istituto superiore mario boella Liceo scientifico statale vito volterra
Liceo scientifico statale vito volterra Liceo classico b zucchi
Liceo classico b zucchi Liceo classico voghera
Liceo classico voghera Liceo classico giacomo leopardi recanati
Liceo classico giacomo leopardi recanati Virgilio mantova liceo
Virgilio mantova liceo Liceo zucchi
Liceo zucchi Liceo classico antonio canova
Liceo classico antonio canova Liceo scientifico galvani bologna
Liceo scientifico galvani bologna Liceo classico recanati
Liceo classico recanati Liceo classico dante alighieri ravenna
Liceo classico dante alighieri ravenna Liceo linguistico
Liceo linguistico Liceo classico dettori cagliari
Liceo classico dettori cagliari Liceo classico valdagno
Liceo classico valdagno Liceo classico silvio pellico cuneo
Liceo classico silvio pellico cuneo Liceo classico piero gobetti
Liceo classico piero gobetti Liceo classico tommaso campailla
Liceo classico tommaso campailla Istituto santi savarino partinico
Istituto santi savarino partinico