ISOMERIA Prof Ren Machado Isomeria Este fenmeno ocorre






























- Slides: 40

ISOMERIA Prof. : Renê Machado

Isomeria Este fenômeno ocorre com duas ou mais substâncias orgânicas diferentes que apresentam a mesma fórmula molecular. Ex. com a fórmula C 3 H 6 O, tem-se os compostos: CH 3 – CH 3 e CH 3 – CH 2 – C – H | | O (propanona) (propanal) que pertencem a funções diferentes.

Existem vários isômeros, que se dividem em dois tipos: Isomeria plana: compostos que apresentam diferença na fórmula estrutural plana. Ø Ø Isomeria espacial: composto que apresentam igual fórmula estrutural plana e diferentes fórmulas estruturais espaciais.

1) Isomeria plana Existem varias formas de isomeria plana: De cadeia De posição De função ou funcional De compensação ou metameria De tautomerização ou tautomeria

a) Isomeria de cadeia Ocorre em compostos, que pertencem a mesma função orgânica e diferem na cadeia principal. Ex. C 4 H 10 CH 3 – CH 2 – CH 3 (butano) CH 3 – CH 3 (metil - propano) | CH 3 Ambos são hidrocarbonetos, porém diferem na cadeia principal, onde uma tem 4 carbonos (sendo normal) e a outra tem 3 carbonos (sendo ramificada).

Ex. C 4 H 8 CH 3 – CH 2 – CH = CH 2 ( 1 -buteno) CH 2 – CH 2 | ( ciclo butano ) CH 2 – CH 2 Ambos são hidrocarbonetos, porém diferem na cadeia principal, onde uma tem 4 carbonos (sendo fechada e insaturada) e a outra também tem 4 carbonos (sendo aberta e saturada).

Ex. C 2 H 7 N CH 3 – CH 2 – NH 2 (etilamina) CH 3 – N – CH 3 (N - metilamina) | H Ambos são aminas, porém diferem na cadeia principal, onde uma é homogênea e a outra é heterogênea.

Ex. C 7 H 16 CH 3 – CH 2 – CH 3 | (3 -metil-hexano) CH 3 CH 2 – CH 2 – CH 3 | (3 -etil-pentano) CH 2– CH 3 Ambos são hidrocarbonetos, porém diferem na cadeia principal, onde uma tem 6 carbonos (sendo um ramificação com 2 carbonos) e a outra tem 5 carbonos (sendo um ramificação com 1 carbono).

b) Isomeria de posição Ocorre em compostos, que pertencem a mesma função orgânica, com igual cadeia principal que diferem na posição de uma ramificação, ou de uma insaturação (dupla ou tripla ligação), ou de um grupo funcional.

Ex. C 6 H 14 2 CH 3 – CH 2– CH 3 | (2 -metil-pentano ) CH 3 3 CH 3 – CH 2– CH 3 | ( 3 -metil-pentano ) CH 3 Ambos são hidrocarbonetos, porém diferem na posição da ramificação. Uma está no carbono número 2 e outra no carbono 3 da cadeia principal.

Ex. C 5 H 10 CH 3 – C = CH – CH 3 | ( 2 -metil – but - 2 - eno ) CH 3 CH 2 = C – CH 2 – CH 3 | ( 2 -metil – but - 1 -eno ) CH 3 Ambos são hidrocarbonetos com ramificações em igual posição, porém diferem na posição da insaturação. Uma está no carbono número 1 e outra no carbono 2 da cadeia principal.

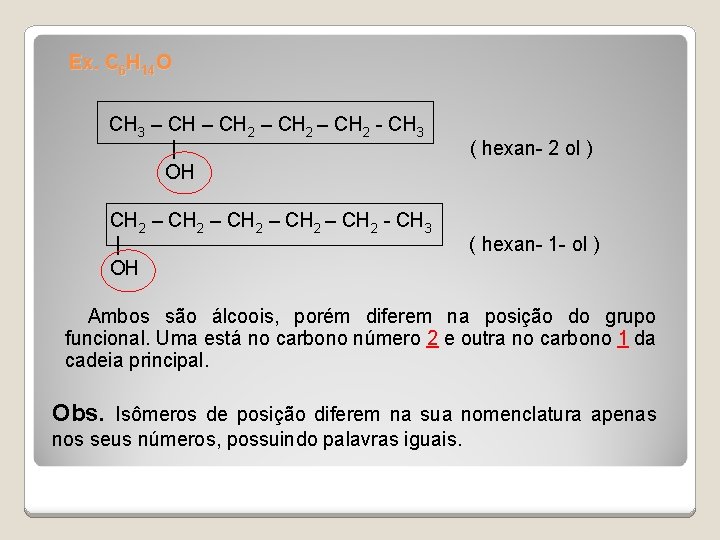
Ex. C 6 H 14 O CH 3 – CH 2 - CH 3 | ( hexan- 2 ol ) OH CH 2 – CH 2 - CH 3 | ( hexan- 1 - ol ) OH Ambos são álcoois, porém diferem na posição do grupo funcional. Uma está no carbono número 2 e outra no carbono 1 da cadeia principal. Obs. Isômeros de posição diferem na sua nomenclatura apenas nos seus números, possuindo palavras iguais.

c) isomeria de função ou funcional Ocorre em compostos, que pertencem a funções orgânicas e diferentes, independente de sua cadeia principal. Ø álcool e éter (Cn. H 2 n+2 O) Ex. C 4 H 10 O CH 3 – CH 2 – CH 3 | ( 2 -butanol ) OH CH 3 – CH 2 – O – CH 2 – CH 3 ( etoxi-etano )

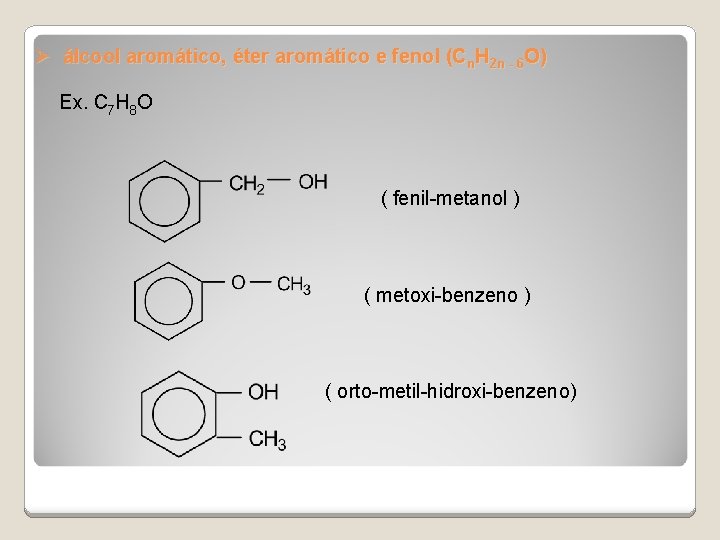
Ø álcool aromático, éter aromático e fenol (Cn. H 2 n - 6 O) Ex. C 7 H 8 O ( fenil-metanol ) ( metoxi-benzeno ) ( orto-metil-hidroxi-benzeno)

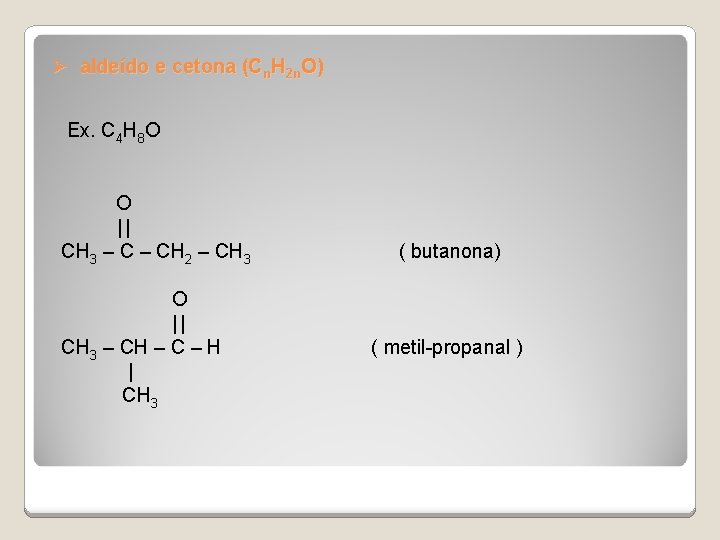
Ø aldeído e cetona (Cn. H 2 n. O) Ex. C 4 H 8 O O | | CH 3 – CH 2 – CH 3 ( butanona) O | | CH 3 – CH – C – H ( metil-propanal ) | CH 3

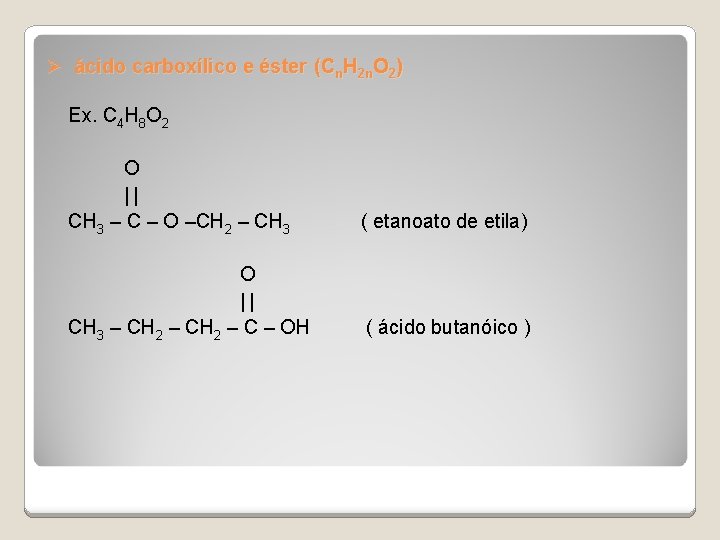
Ø ácido carboxílico e éster (Cn. H 2 n. O 2) Ex. C 4 H 8 O 2 O | | CH 3 – C – O –CH 2 – CH 3 ( etanoato de etila) O | | CH 3 – CH 2 – C – OH ( ácido butanóico )

d) isomeria de compensação ou metameria É um tipo especial de isomeria de posição que corre em compostos, que pertencem a mesma função orgânica, diferem na posição de um heteroátomo. Lembrete: Um heteroátomo é um elemento organógeno ligado entre dois carbonos.

Ex. C 4 H 10 O CH 3 – CH 2 – O – CH 2 – CH 3 ( etoxi-etano ) CH 3 – CH 2 – O – CH 3 ( 1 - metoxi-propano) Ex. C 5 H 13 N CH 3 – CH 2 – N – CH 3 ( N, N-dimetil propanamina) | CH 3 – CH 2 – N – CH 2 –CH 3( N-etil N-metil propanamina) | CH 3 Obs. É retirado um carbono de um dos lados do heteroátomo e compensado do outro lado do heteroátomo.

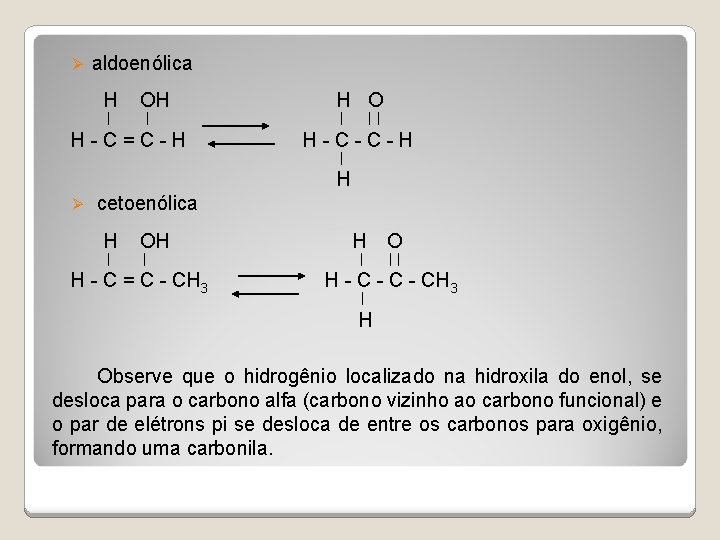
e) tautomeria ou tautomerização É um caso particular de isomeria de função, em que os compostos estabelecem um equilíbrio químico. Esse tipo também é chamado de isomeria dinâmica, que possui duas formas: ü aldoenólica: entre aldeído e enol ü cetoenólica: entre cetona e enol

Ø aldoenólica H OH H O H - C = C - H H - C - H H Ø cetoenólica H OH H O H - C = C - CH 3 H - C - CH 3 H Observe que o hidrogênio localizado na hidroxila do enol, se desloca para o carbono alfa (carbono vizinho ao carbono funcional) e o par de elétrons pi se desloca de entre os carbonos para oxigênio, formando uma carbonila.

Alguns aldeídos e cetonas não irão realizar tautomeria, pois não possuem hidrogênio alfa (átomo de hidrogênio ligado a carbono alfa). CH 3 O CH 3 -C - H CH 3

2) Isomeria espacial Divide-se em geométrica e ótica e também é chamada de estereoisomeria.

Isomeria Geométrica ou Cis-Trans.

isomeria geométrica em composto de cadeia alifática. Para que ocorra isomeria geométrica é necessário que o composto seja derivado de um alceno, ou seja, apresente um dupla ligação na cadeia e ligantes diferentes em cada um dos carbonos insaturados da dupla (R 1 R 2 e R 3 R 4) Obs. : pode haver ligantes iguais em carbonos diferentes da dupla. R 1 R 3 C = C R 2 R 4

Será considerado isômero : Cis: se os ligantes de maiores massas moleculares estiverem para o mesmo lado do plano. R 1 e R 3 ou R 2 e R 4. Trans: se os ligantes de maiores massas moleculares estiverem para lados opostos do plano (transversais). R 1 e R 4 ou R 2 e R 3.

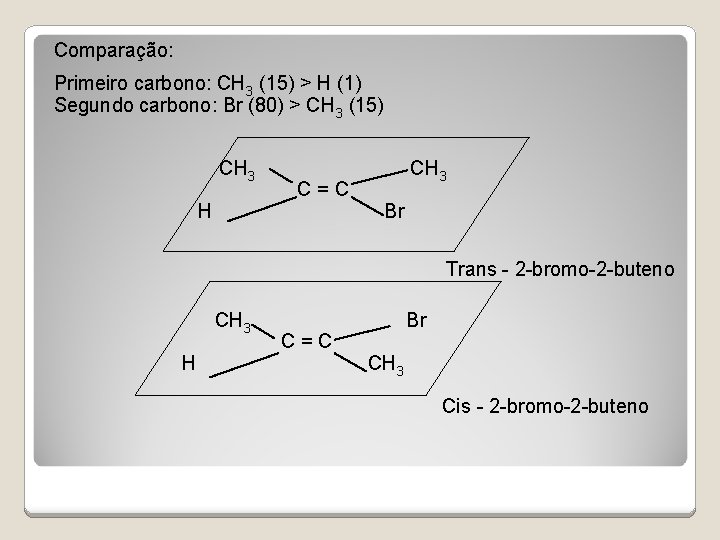
Ex. : 2 -bromo-but -2 - eno CH 3 – CH = CH – CH 3 Br Através da fórmula estrutural plana não é possível identificar o tipo de isomeria geométrica, mostrando, somente, que o composto forma isomeria geométrica. Dadas as massa moleculares: Br = 80, CH 3 = 15 e H = 1 Observe que no primeiro carbono insaturado o grupo formado pelo metil apresenta maior massa molecular e no segundo carbono insaturado o grupo formado pelo bromo tem massa molecular maior .

Comparação: Primeiro carbono: CH 3 (15) > H (1) Segundo carbono: Br (80) > CH 3 (15) CH 3 C = C H Br Trans - 2 -bromo-2 -buteno CH 3 Br C = C H CH 3 Cis - 2 -bromo-2 -buteno

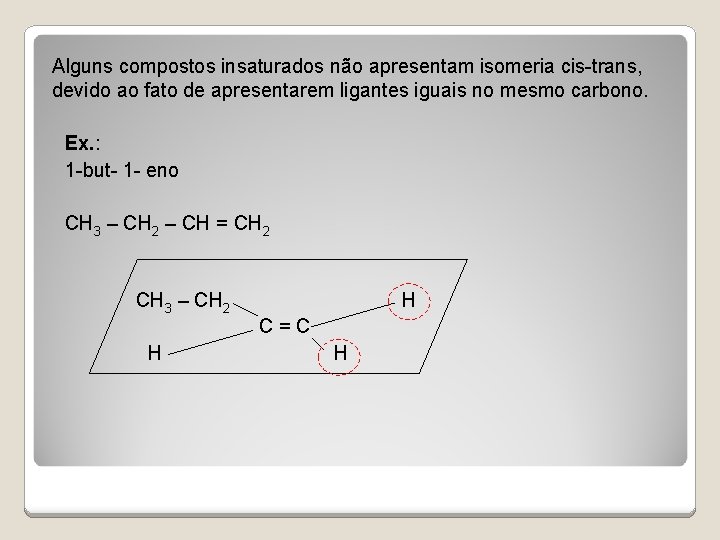
Alguns compostos insaturados não apresentam isomeria cis-trans, devido ao fato de apresentarem ligantes iguais no mesmo carbono. Ex. : 1 -but- 1 - eno CH 3 – CH 2 – CH = CH 2 CH 3 – CH 2 H C = C H H

isomeria geométrica em composto de cadeia fechada. Para que ocorra isomeria geométrica é necessário que o composto seja derivado de um cicloalcano, e ligantes diferentes em cada um dos carbonos vizinhos (R 1 R 2 e R 3 R 4) R 1 R 3 R 2 R 4

Será considerado isômero : Cis: se os ligantes de maiores massas moleculares estiverem para o mesmo lado do plano. R 1 e R 3 ou R 2 e R 4. Trans: se os ligantes de maiores massas moleculares estiverem para lados opostos do plano (transversais). R 1 e R 4 ou R 2 e R 3. Ex. C 4 H 6 C 2 ( em compostos cíclicos ) C C C cis 1, 2 -dicloro ciclo butano trans 1, 2 -dicloro ciclo butano

Isomeria óptica.

Isomeria óptica. Os estereoisômeros ópticos desviam o plano da luz polarizada para lados opostos. Luz natural : como toda luz, possui um campo magnético e um campo elétrico perpendiculares entre si e que giram em torno do eixo de propagação. Luz polarizada: é proveniente de uma luz natural que atravessou um prisma polarizador e tem seu campo elétrico e seu campo magnético ainda perpendiculares entre si, porém agora, não giram mais em torno do eixo de propagação. Essa diferença não é possível de ser distinguida a olho nu.

Um composto para ser opticamente ativo precisa conter um carbono quiral (assimétrico). Carbono quiral: carbono saturado que apresenta 4 grupos ligantes diferentes entre si. R 2 R 1 – C – R 3 R 4 onde R 1 R 2 R 3 R 4

Ex. 1 2 -butanol (álcool com menor massa molecular que apresenta carbono quiral). Grupos ligantes: H CH 3 OH C 2 H 5 CH 3 – CH 2 – CH 3 OH O 2 -butanol apresenta dois estereoisômeros, chamados de enantiômeros ou antípodas ópticas.

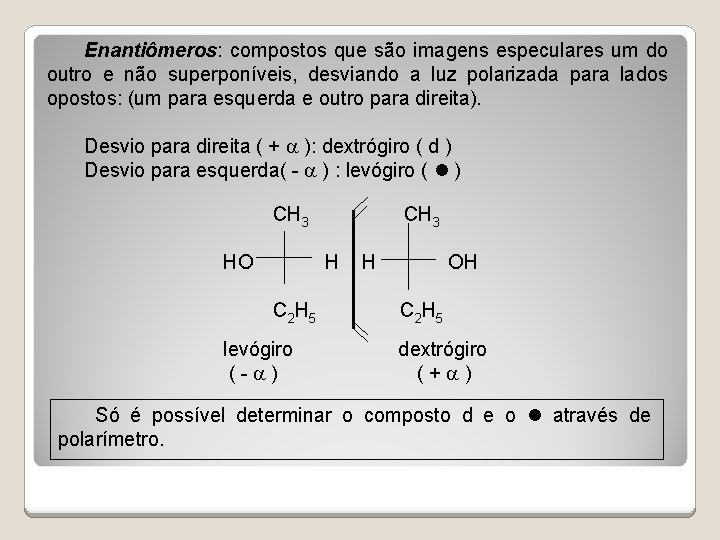
Enantiômeros: compostos que são imagens especulares um do outro e não superponíveis, desviando a luz polarizada para lados opostos: (um para esquerda e outro para direita). Desvio para direita ( + ): dextrógiro ( d ) Desvio para esquerda( - ) : levógiro ( ) CH 3 HO H H OH C 2 H 5 levógiro dextrógiro ( - ) ( + ) Só é possível determinar o composto d e o através de polarímetro.

ESTRUTURAS DE FISCHER Trabalhar com fórmulas espaciais como o fizemos para o d-2 -butanol e -2 -butanol fica muito difícil. Para facilitar o estudo e compreensão das substâncias que apresentam carbono quiral (assimétrico) e conseqüentemente isomeria óptica, passaremos a utilizar as Fórmulas de Projeção de Fischer. As convenções de Fischer são as seguintes: 1º) A molécula é representada em forma de cruz. 2º) Fica subentendido que cada carbono quiral (assimétrico) está localizada na intercessão das hastes que formam a cruz. 3º) Na linha vertical ficará a cadeia carbônica principal.

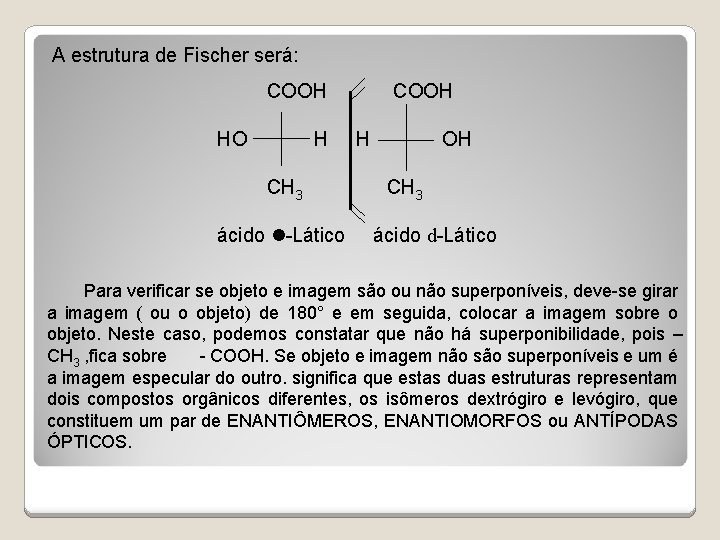
Exemplo : Consideremos a estrutura do ácido 2 - hidroxipropanóico (ácido lático): CH 3 – CH – COOH | CH 3

A estrutura de Fischer será: COOH HO H H OH CH 3 ácido -Lático ácido d-Lático Para verificar se objeto e imagem são ou não superponíveis, deve-se girar a imagem ( ou o objeto) de 180° e em seguida, colocar a imagem sobre o objeto. Neste caso, podemos constatar que não há superponibilidade, pois – CH 3 , fica sobre - COOH. Se objeto e imagem não superponíveis e um é a imagem especular do outro. significa que estas duas estruturas representam dois compostos orgânicos diferentes, os isômeros dextrógiro e levógiro, que constituem um par de ENANTIÔMEROS, ENANTIOMORFOS ou ANTÍPODAS ÓPTICOS.

Podemos calcular o número de isômeros opticamente ativos através da fórmula: n 2 onde: n = número de carbonos quirais diferentes na molécula.

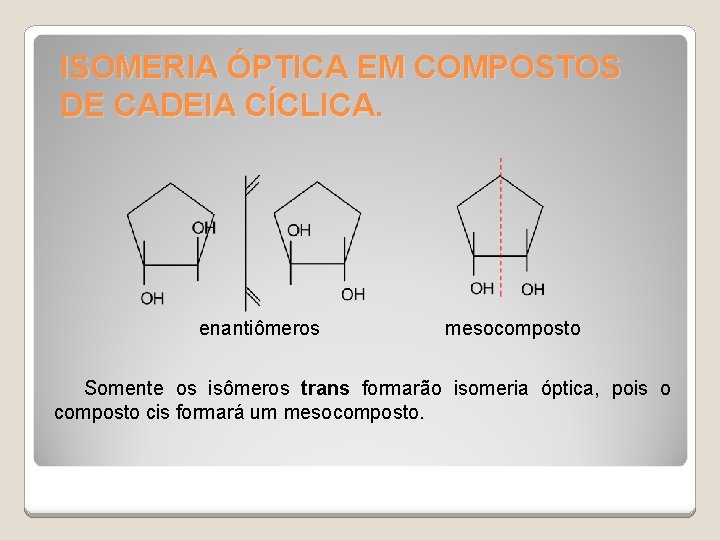
ISOMERIA ÓPTICA EM COMPOSTOS DE CADEIA CÍCLICA. enantiômeros mesocomposto Somente os isômeros trans formarão isomeria óptica, pois o composto cis formará um mesocomposto.
 Fenmeno
Fenmeno Fiecare este robul lucrului de care este biruit
Fiecare este robul lucrului de care este biruit Una coquita
Una coquita Leptoteno
Leptoteno Meninges netter
Meninges netter Plantas diversidade
Plantas diversidade Função intestino delgado e grosso
Função intestino delgado e grosso Onde ocorre a clivagem
Onde ocorre a clivagem Como ocorre
Como ocorre Ciclo de krebs
Ciclo de krebs Durante a respiração sistêmica no homem ocorre
Durante a respiração sistêmica no homem ocorre Brisa maritima como ocorre
Brisa maritima como ocorre Slides cmsp
Slides cmsp Eminencia pontina
Eminencia pontina Respiração branquial
Respiração branquial Onde ocorre a fecundação
Onde ocorre a fecundação Aminoácidos estrutura quimica
Aminoácidos estrutura quimica Ies hnos machado
Ies hnos machado Ledo vaccaro
Ledo vaccaro Colinas plateadas, grises alcores que género literario es
Colinas plateadas, grises alcores que género literario es Matilde machado
Matilde machado Visvel
Visvel Matilde machado
Matilde machado Allá en las tierras altas por donde traza el duero
Allá en las tierras altas por donde traza el duero Ledo vaccaro machado
Ledo vaccaro machado Modernismo machado
Modernismo machado Ricardo zanatta machado
Ricardo zanatta machado Etapas de antonio machado
Etapas de antonio machado Senti tu mano en la mia tu mano de compañera
Senti tu mano en la mia tu mano de compañera Ariane machado lima
Ariane machado lima Biografia breve de antonio machado
Biografia breve de antonio machado He andado muchos caminos autor
He andado muchos caminos autor Vivo sin vivir en mi que figura literaria es
Vivo sin vivir en mi que figura literaria es Gabriela na escola ruth rocha
Gabriela na escola ruth rocha Ledo vaccaro machado
Ledo vaccaro machado Antonio machado colinas plateadas
Antonio machado colinas plateadas Etapas antonio machado
Etapas antonio machado Competencia de stackelberg
Competencia de stackelberg Poemas de antonio machado cortos
Poemas de antonio machado cortos Anoche cuando dormía de antonio machado
Anoche cuando dormía de antonio machado Leddo vacaro
Leddo vacaro