Islatravir ISL phase 2 DRIVE 2 Simplify Etude


- Slides: 8

Islatravir (ISL) phase 2 § DRIVE 2 Simplify

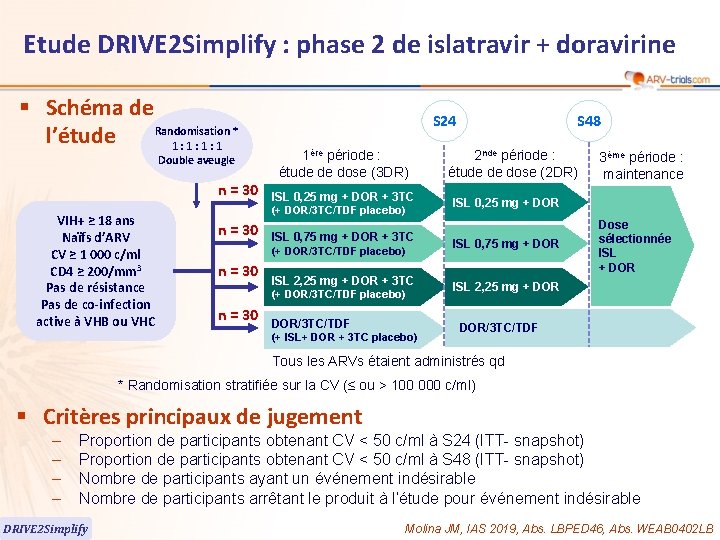
Etude DRIVE 2 Simplify : phase 2 de islatravir + doravirine § Schéma de Randomisation * l’étude 1: 1: 1: 1 Double aveugle n = 30 VIH+ ≥ 18 ans Naïfs d’ARV CV ≥ 1 000 c/ml CD 4 ≥ 200/mm 3 Pas de résistance Pas de co-infection active à VHB ou VHC S 24 1ère période : étude de dose (3 DR) ISL 0, 25 mg + DOR + 3 TC (+ DOR/3 TC/TDF placebo) n = 30 ISL 0, 75 mg + DOR + 3 TC (+ DOR/3 TC/TDF placebo) n = 30 ISL 2, 25 mg + DOR + 3 TC (+ DOR/3 TC/TDF placebo) n = 30 DOR/3 TC/TDF (+ ISL+ DOR + 3 TC placebo) S 48 2 nde période : étude de dose (2 DR) 3ème période : maintenance ISL 0, 25 mg + DOR ISL 0, 75 mg + DOR Dose sélectionnée ISL + DOR ISL 2, 25 mg + DOR/3 TC/TDF Tous les ARVs étaient administrés qd * Randomisation stratifiée sur la CV (≤ ou > 100 000 c/ml) § Critères principaux de jugement – – Proportion de participants obtenant CV < 50 c/ml à S 24 (ITT- snapshot) Proportion de participants obtenant CV < 50 c/ml à S 48 (ITT- snapshot) Nombre de participants ayant un événement indésirable Nombre de participants arrêtant le produit à l’étude pour événement indésirable DRIVE 2 Simplify Molina JM, IAS 2019, Abs. LBPED 46, Abs. WEAB 0402 LB

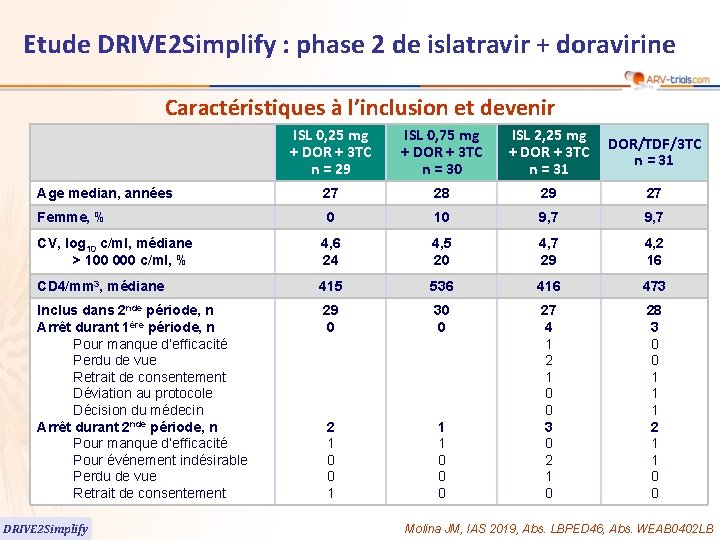
Etude DRIVE 2 Simplify : phase 2 de islatravir + doravirine Caractéristiques à l’inclusion et devenir ISL 0, 25 mg + DOR + 3 TC n = 29 ISL 0, 75 mg + DOR + 3 TC n = 30 ISL 2, 25 mg + DOR + 3 TC n = 31 DOR/TDF/3 TC n = 31 Age median, années 27 28 29 27 Femme, % 0 10 9, 7 CV, log 10 c/ml, médiane > 100 000 c/ml, % 4, 6 24 4, 5 20 4, 7 29 4, 2 16 CD 4/mm 3, médiane 415 536 416 473 Inclus dans 2 nde période, n Arrêt durant 1ère période, n Pour manque d’efficacité Perdu de vue Retrait de consentement Déviation au protocole Décision du médecin Arrêt durant 2 nde période, n Pour manque d’efficacité Pour événement indésirable Perdu de vue Retrait de consentement 29 0 30 0 2 1 0 0 1 1 1 0 0 0 27 4 1 2 1 0 0 3 0 2 1 0 28 3 0 0 1 1 1 2 1 1 0 0 DRIVE 2 Simplify Molina JM, IAS 2019, Abs. LBPED 46, Abs. WEAB 0402 LB

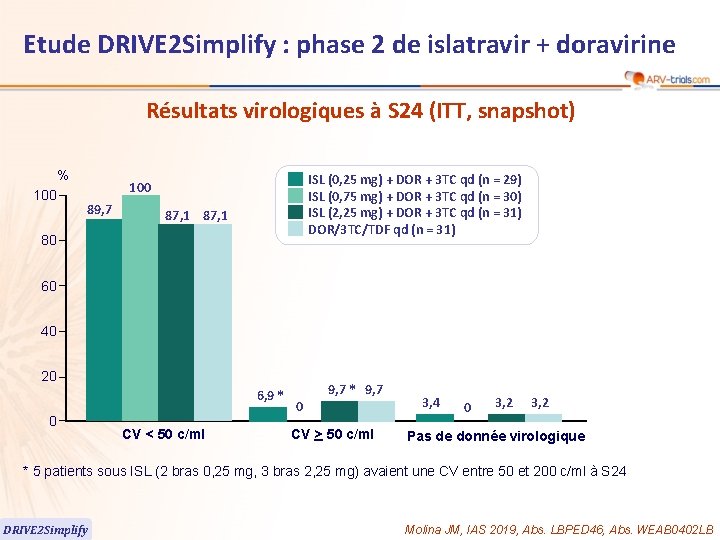
60 Etude DRIVE 2 Simplify : phase 2 de islatravir + doravirine Résultats virologiques à S 24 (ITT, snapshot) % 100 ISL (0, 25 mg) + DOR + 3 TC qd (n = 29) ISL (0, 75 mg) + DOR + 3 TC qd (n = 30) ISL (2, 25 mg) + DOR + 3 TC qd (n = 31) DOR/3 TC/TDF qd (n = 31) 100 89, 7 87, 1 80 60 40 20 6, 9 * 0 CV < 50 c/ml 9, 7 * 9, 7 0 CV > 50 c/ml 3, 4 0 3, 2 Pas de donnée virologique * 5 patients sous ISL (2 bras 0, 25 mg, 3 bras 2, 25 mg) avaient une CV entre 50 et 200 c/ml à S 24 DRIVE 2 Simplify Molina JM, IAS 2019, Abs. LBPED 46, Abs. WEAB 0402 LB

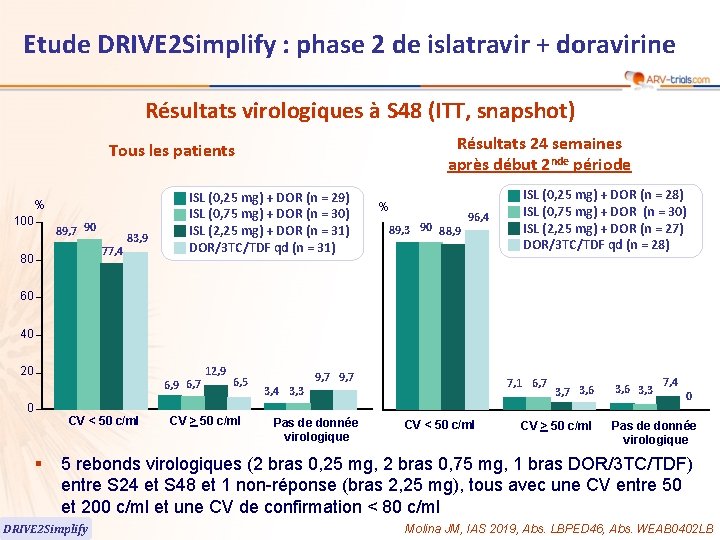
61 Etude DRIVE 2 Simplify : phase 2 de islatravir + doravirine Résultats virologiques à S 48 (ITT, snapshot) Résultats 24 semaines après début 2 nde période Tous les patients % 100 89, 7 90 77, 4 80 83, 9 ISL (0, 25 mg) + DOR (n = 29) ISL (0, 75 mg) + DOR (n = 30) ISL (2, 25 mg) + DOR (n = 31) DOR/3 TC/TDF qd (n = 31) % 89, 3 90 88, 9 96, 4 ISL (0, 25 mg) + DOR (n = 28) ISL (0, 75 mg) + DOR (n = 30) ISL (2, 25 mg) + DOR (n = 27) DOR/3 TC/TDF qd (n = 28) 60 40 20 6, 9 6, 7 0 CV < 50 c/ml § 12, 9 6, 5 CV > 50 c/ml 3, 4 3, 3 9, 7 Pas de donnée virologique 7, 1 6, 7 CV < 50 c/ml 3, 7 3, 6 CV > 50 c/ml 3, 6 3, 3 7, 4 0 Pas de donnée virologique 5 rebonds virologiques (2 bras 0, 25 mg, 2 bras 0, 75 mg, 1 bras DOR/3 TC/TDF) entre S 24 et S 48 et 1 non-réponse (bras 2, 25 mg), tous avec une CV entre 50 et 200 c/ml et une CV de confirmation < 80 c/ml DRIVE 2 Simplify Molina JM, IAS 2019, Abs. LBPED 46, Abs. WEAB 0402 LB

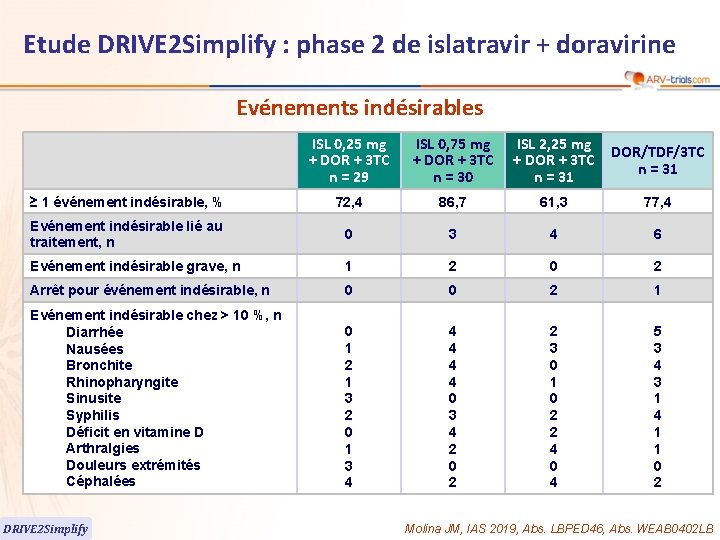
Etude DRIVE 2 Simplify : phase 2 de islatravir + doravirine Evénements indésirables ISL 0, 25 mg + DOR + 3 TC n = 29 ISL 0, 75 mg + DOR + 3 TC n = 30 ISL 2, 25 mg + DOR + 3 TC n = 31 DOR/TDF/3 TC n = 31 ≥ 1 événement indésirable, % 72, 4 86, 7 61, 3 77, 4 Evénement indésirable lié au traitement, n 0 3 4 6 Evénement indésirable grave, n 1 2 0 2 Arrêt pour événement indésirable, n 0 0 2 1 Evénement indésirable chez > 10 %, n Diarrhée Nausées Bronchite Rhinopharyngite Sinusite Syphilis Déficit en vitamine D Arthralgies Douleurs extrémités Céphalées 0 1 2 1 3 2 0 1 3 4 4 4 0 3 4 2 0 2 2 3 0 1 0 2 2 4 0 4 5 3 4 3 1 4 1 1 0 2 DRIVE 2 Simplify Molina JM, IAS 2019, Abs. LBPED 46, Abs. WEAB 0402 LB

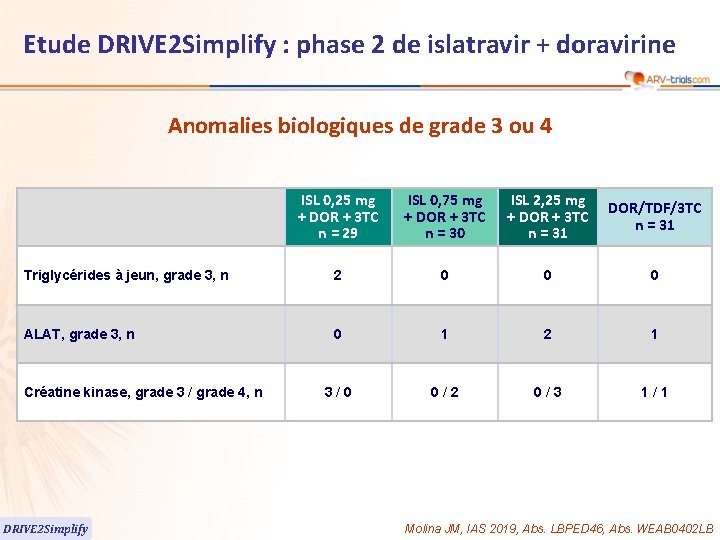
Etude DRIVE 2 Simplify : phase 2 de islatravir + doravirine Anomalies biologiques de grade 3 ou 4 ISL 0, 25 mg + DOR + 3 TC n = 29 ISL 0, 75 mg + DOR + 3 TC n = 30 ISL 2, 25 mg + DOR + 3 TC n = 31 DOR/TDF/3 TC n = 31 Triglycérides à jeun, grade 3, n 2 0 0 0 ALAT, grade 3, n 0 1 2 1 3/0 0/2 0/3 1/1 Créatine kinase, grade 3 / grade 4, n DRIVE 2 Simplify Molina JM, IAS 2019, Abs. LBPED 46, Abs. WEAB 0402 LB

Etude DRIVE 2 Simplify : phase 2 de islatravir + doravirine § Conclusion – Les sujets ayant initié ISL + DOR en association avec 3 TC puis ayant switché à S 24 pour ISL + DOR ont obtenu un taux d’efficacité virologique élevé à S 48, en terme de proportion avec CV < 50 c/ml, similaire à celui obtenu avec DOR/3 TC/TDF – Aucun participant n’a présent les critères de réalisation d’un test de résistance (toutes les CV confirmées comme échec virologique étaient < 80 c/ml) – ISL + DOR a été bien toléré – Taux d’événement indésirable lié au traitement globalement de 7, 8 % – Faible taux d’arrêt pour événement indésirable (2, 2 %) DRIVE 2 Simplify Molina JM, IAS 2019, Abs. LBPED 46, Abs. WEAB 0402 LB