IOD Vorkommen im Meerwasser als I 2 10
















![In einer Gesättigten Lösung ist [Ba. SO 4] konstant, da zwischen dem Bariumsulfat in In einer Gesättigten Lösung ist [Ba. SO 4] konstant, da zwischen dem Bariumsulfat in](https://slidetodoc.com/presentation_image_h/2c2d2e808305211a21dcc5ee30f70139/image-33.jpg)



























![• Thomasmehl hauptsächlich: Ca 5[Si. O 4(PO 4)2] • Glühphosphat (Rhenaniaphosphat) hauptsächlich: 3 • Thomasmehl hauptsächlich: Ca 5[Si. O 4(PO 4)2] • Glühphosphat (Rhenaniaphosphat) hauptsächlich: 3](https://slidetodoc.com/presentation_image_h/2c2d2e808305211a21dcc5ee30f70139/image-89.jpg)










- Slides: 106

IOD Vorkommen: im Meerwasser als I- (2. 10 -4 %); im Chilesalpeter als Na. IO 3 (bis zu 0, 1 % I) Eigenschaften: grauschwarze, metall. glänzende schuppige Kristalle; Molekülgitter; Dampf blauviolett; Lösungen: blauviolett in nichtpolaren, braun in polaren Lösungsmitteln. Darstellung: +V + IV -I + VI a) Technisch: HIO 3 + 3 H 2 SO 3 Hl + 3 H 2 SO 4 +V -I 0 3 H 2 O + 3 I 2 HIO 3 + 5 HI Bei geeigneter Wahl der Ausgangsmengen: +V + IV + VI 0 5 H 2 SO 4 + H 2 O + I 2 2 HIO 3 + 5 H 2 SO 3 b) im Labor 1) 2 KI + Mn. O 2 + 2 H 2 SO 4 K 2 SO 4 + Mn. SO 4 + 2 H 2 O + I 2 2) KI + ½ Cl 2 KCl + ½ I 2 Verwendung: Photographie (Ag. I), Medizin, Metallurgie

Versuche Mg + I 2 Mg. I 2 2 Al + 3 I 2 Al 2 I 6

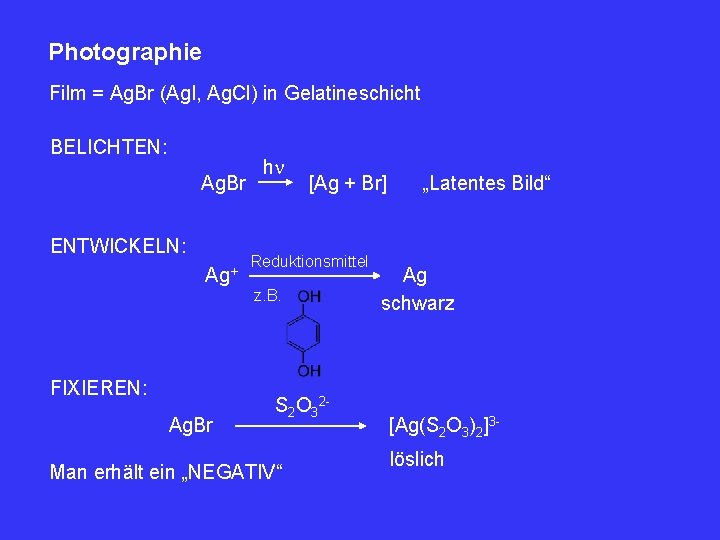
Photographie Film = Ag. Br (Ag. I, Ag. Cl) in Gelatineschicht BELICHTEN: Ag. Br ENTWICKELN: Ag+ h [Ag + Br] Reduktionsmittel z. B. FIXIEREN: Ag. Br S 2 O 32 - Man erhält ein „NEGATIV“ „Latentes Bild“ Ag schwarz [Ag(S 2 O 3)2]3 löslich

HALOGENWASSERSTOFFE HF HCl HBr HI Fp (°C) -83, 1 -114, 8 -86, 9 -50, 7 Kp (°C) 19, 5 -84, 9 -66, 8 -35, 4 Farblose, stechend riechende Gase; therm. Stabilität nimmt ab vom F → I; wässrige Lösungen sind starke Säuren; Salze = Halogenoide. Darstellung: a) H 2 + X 2 b) Sulfat – Salzsäure - Verfahren Na. Cl + H 2 SO 4 Na. Cl + Na. HSO 4 2 HX 20°C 800°C ergibt bes. reines Produkt HCl + Na. HSO 4 HCl + Na 2 SO 4

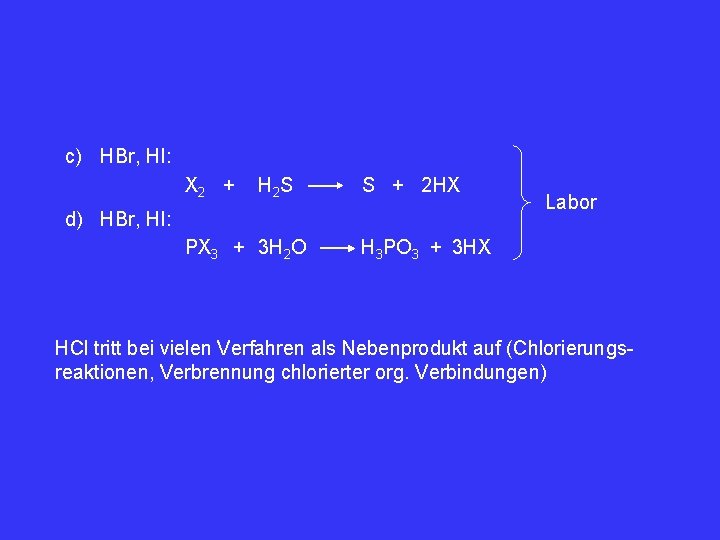
c) HBr, HI: X 2 + H 2 S S + 2 HX d) HBr, HI: PX 3 + 3 H 2 O Labor H 3 PO 3 + 3 HX HCl tritt bei vielen Verfahren als Nebenprodukt auf (Chlorierungsreaktionen, Verbrennung chlorierter org. Verbindungen)

Anionennachweis • I • Ansäuern mit verd. Salpetersäure + Silbernitrat ->gelber, käsiger Niederschlag • Br • Ansäuern mit verd. Salpetersäure + Silbernitrat -> blaßgelber, käsiger Niederschlag • Cl • Ansäuern mit verd. Salpetersäure + Silbernitrat -> weißer, käsiger Niederschlag • Der Niederschlag färbt sich (Licht) durch Abscheidung von metallischem Silber dunkel.

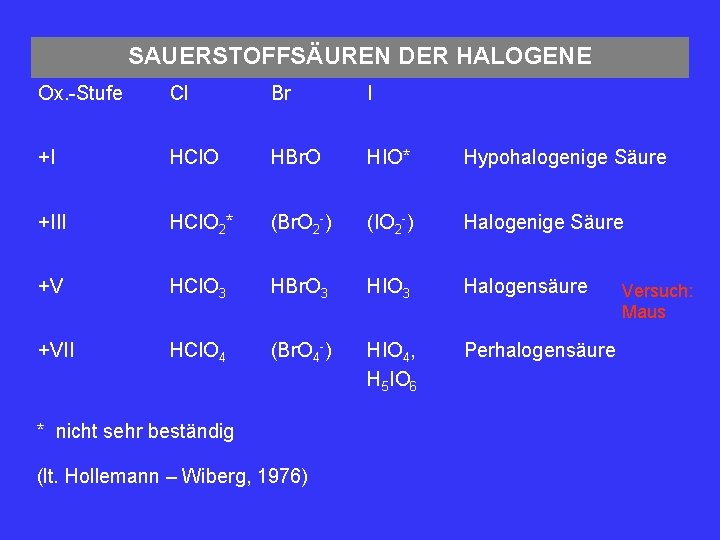
SAUERSTOFFSÄUREN DER HALOGENE Ox. -Stufe Cl Br I +I HCl. O HBr. O HIO* Hypohalogenige Säure +III HCl. O 2* (Br. O 2 -) (IO 2 -) Halogenige Säure +V HCl. O 3 HBr. O 3 HIO 3 Halogensäure +VII HCl. O 4 (Br. O 4 -) HIO 4, H 5 IO 6 Perhalogensäure * nicht sehr beständig (lt. Hollemann – Wiberg, 1976) Versuch: Maus

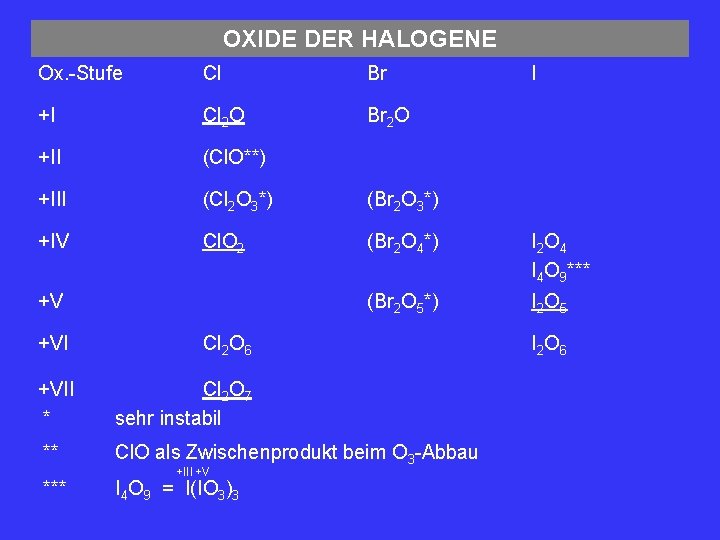
OXIDE DER HALOGENE Ox. -Stufe Cl Br +I Cl 2 O Br 2 O +II (Cl. O**) +III (Cl 2 O 3*) (Br 2 O 3*) +IV Cl. O 2 (Br 2 O 4*) I 2 O 4 I 4 O 9*** (Br 2 O 5*) I 2 O 5 +V +VI Cl 2 O 6 +VII * Cl 2 O 7 sehr instabil ** Cl. O als Zwischenprodukt beim O 3 -Abbau *** +III +V I 4 O 9 = I(IO 3)3 I I 2 O 6

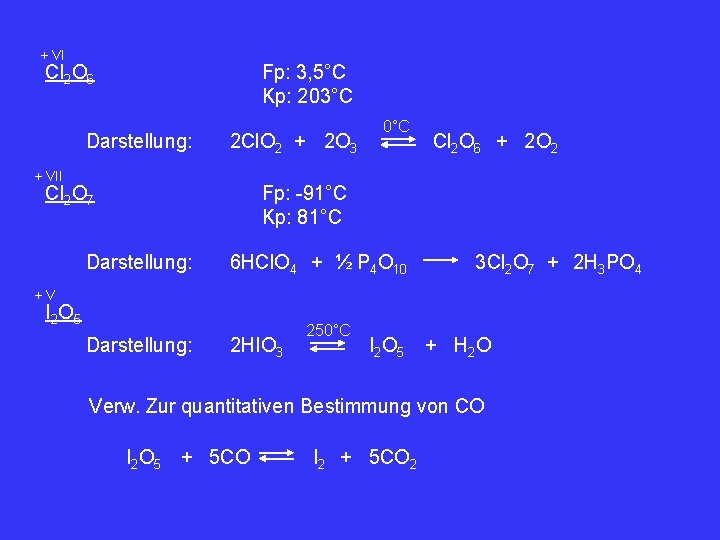
+ VI Cl 2 O 6 Fp: 3, 5°C Kp: 203°C Darstellung: 2 Cl. O 2 + 2 O 3 + VII Cl 2 O 7 0°C Cl 2 O 6 + 2 O 2 Fp: -91°C Kp: 81°C Darstellung: 6 HCl. O 4 + ½ P 4 O 10 3 Cl 2 O 7 + 2 H 3 PO 4 +V I 2 O 5 Darstellung: 2 HIO 3 250°C I 2 O 5 + H 2 O Verw. Zur quantitativen Bestimmung von CO I 2 O 5 + 5 CO I 2 + 5 CO 2

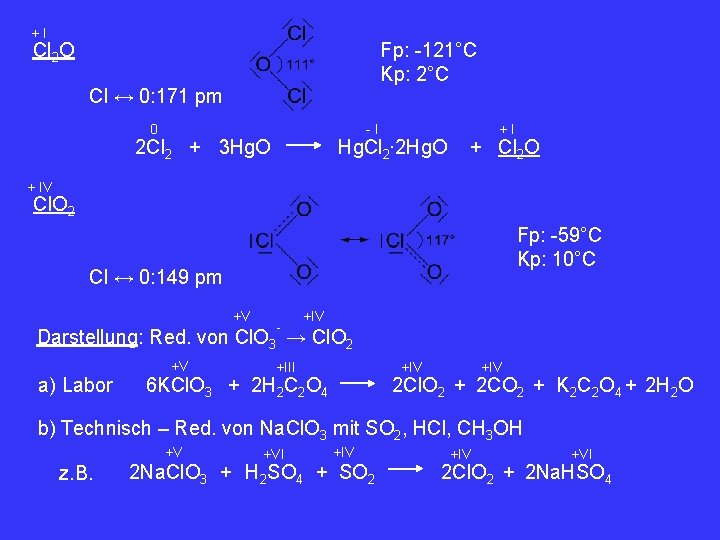
+I Cl 2 O Fp: -121°C Kp: 2°C Cl ↔ 0: 171 pm 0 -I Hg. Cl 2∙ 2 Hg. O 2 Cl 2 + 3 Hg. O +I + Cl 2 O + IV Cl. O 2 Fp: -59°C Kp: 10°C Cl ↔ 0: 149 pm +V - +IV Darstellung: Red. von Cl. O 3 → Cl. O 2 +V a) Labor +III +IV 6 KCl. O 3 + 2 H 2 C 2 O 4 +IV 2 Cl. O 2 + 2 CO 2 + K 2 C 2 O 4 + 2 H 2 O b) Technisch – Red. von Na. Cl. O 3 mit SO 2, HCl, CH 3 OH +V z. B. +VI +IV 2 Na. Cl. O 3 + H 2 SO 4 + SO 2 +IV +VI 2 Cl. O 2 + 2 Na. HSO 4

Sauerstoffsäuren der Halogene Oxid. -Stufe Formel Name +I HXO Hypohalogenige Säure (Hypohalogenite) + III HXO 2 Halogenige Säure (Halogenite) +V HXO 3 Halogensäure (Halogenate) + VII HXO 4 Perhalogensäure (Perhalogenate)

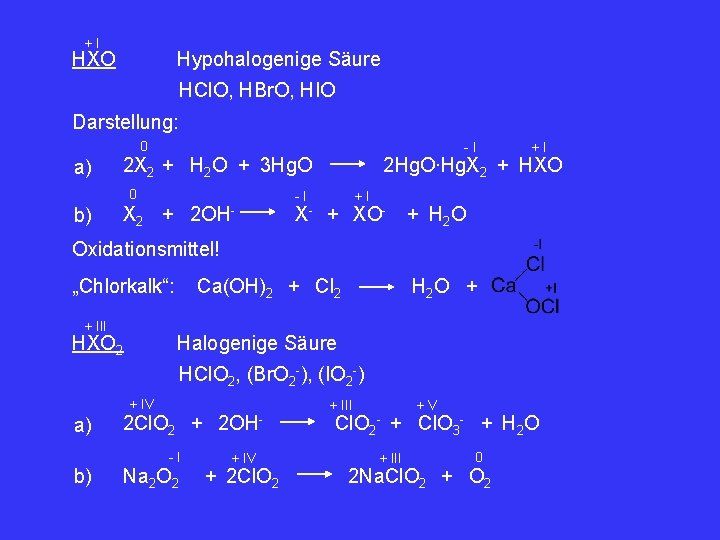
+I HXO Hypohalogenige Säure HCl. O, HBr. O, HIO Darstellung: 0 a) 2 OH- X 2 + -I X- +I 2 Hg. O∙Hg. X 2 + HXO 2 X 2 + H 2 O + 3 Hg. O 0 b) -I +I + XO- + H 2 O Oxidationsmittel! „Chlorkalk“: + III HXO 2 Ca(OH)2 + Cl 2 H 2 O + Halogenige Säure HCl. O 2, (Br. O 2 -), (IO 2 -) + IV a) 2 Cl. O 2 + 2 OH-I b) Na 2 O 2 + IV + 2 Cl. O 2 + III +V Cl. O 2 - + Cl. O 3 - + H 2 O + III 0 2 Na. Cl. O 2 + O 2


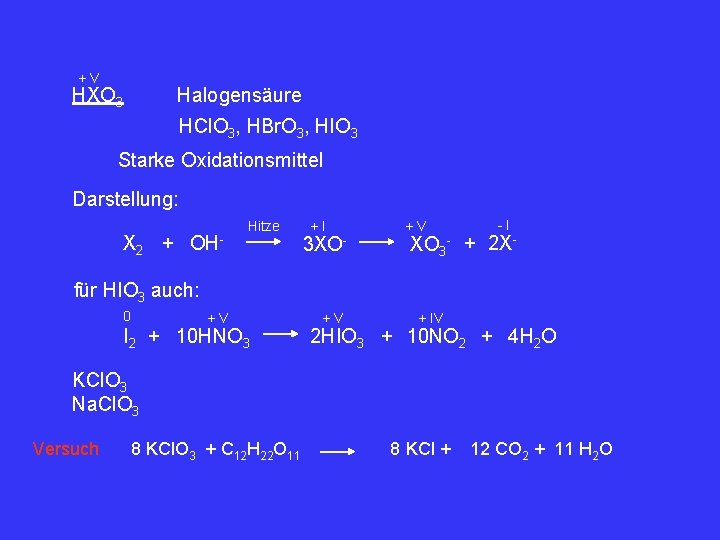
+V HXO 3 Halogensäure HCl. O 3, HBr. O 3, HIO 3 Starke Oxidationsmittel Darstellung: X 2 + OH- Hitze +I 3 XO- +V -I XO 3 - + 2 X- für HIO 3 auch: 0 +V I 2 + 10 HNO 3 +V + IV 2 HIO 3 + 10 NO 2 + 4 H 2 O KCl. O 3 Na. Cl. O 3 Versuch 8 KCl. O 3 + C 12 H 22 O 11 8 KCl + 12 CO 2 + 11 H 2 O

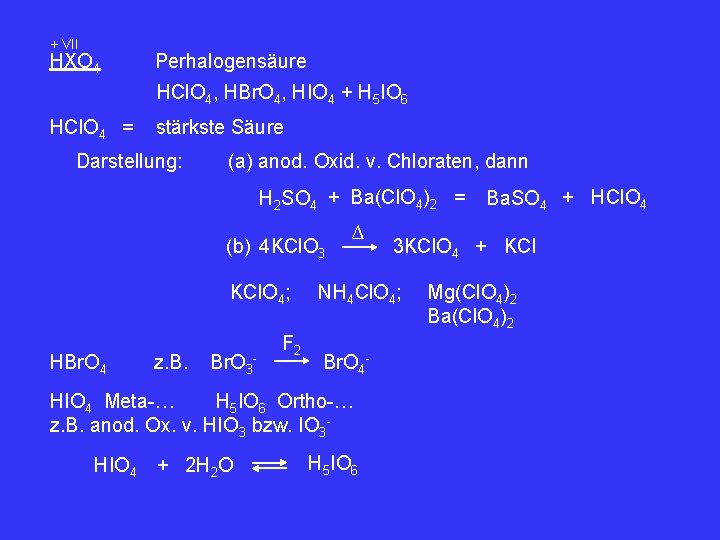
+ VII HXO 4 Perhalogensäure HCl. O 4, HBr. O 4, HIO 4 + H 5 IO 6 HCl. O 4 = stärkste Säure Darstellung: (a) anod. Oxid. v. Chloraten, dann H 2 SO 4 + Ba(Cl. O 4)2 = (b) 4 KCl. O 3 KCl. O 4; HBr. O 4 z. B. Br. O 3 - F 2 ∆ HIO 4 Meta-… H 5 IO 6 Ortho-… z. B. anod. Ox. v. HIO 3 bzw. IO 3 HIO 4 + 2 H 2 O 3 KCl. O 4 + KCl NH 4 Cl. O 4; Br. O 4 - H 5 IO 6 Ba. SO 4 + HCl. O 4 Mg(Cl. O 4)2 Ba(Cl. O 4)2

Interhalogenverbindungen Cl. F (Br. F) (IF) (Br. Cl) ICl Darstellung: Cl. F 3 Br. F 3 IBr Cl. F 5 Br. F 5 IF 5 manche direkt → Cl 2(g) + F 2(g) Br 2(l) + 3 F 2(g) 2 Cl. F(g) 2 Br. F 3(l) andere → KI(s) + 4 F 2(g) KF(s) + IF 7(g) äußerst reaktive Oxidationsmittel! Eigendiss. Bei Br. F 3: 2 Br. F 3 Br. F 2+ + Br. F 4 - IF 7 (ICl 3)2

Schwefel Vorkommen: • elementar • als Sulfat (Ca. SO 4∙ 2 H 2 O, Ca. SO 4, Ba. SO 4) • als Sulfid - Kiese (z. B. Fe. S 2) - Glanze (z. B. Pb. S) - Blenden (z. B. (Zn. S) • in Steinkohle → Kokereigas • in Erdöl, Erdgas • in Eiweißstoffen Gewinnung: a) „Frasch-Verfahren“ b) aus H 2 S – „CLAUS-Verfahren“ 1. ) H 2 S + 3/2 O 2 2. ) SO 2 + 2 H 2 S 1200°C ~250°C - aus Wassergas Kat. H 2 O + SO 2 3 S + 2 H 2 O Luft - mit „Luxmasse“ (~ Fe(OH)3) + H 2 S 40°C Aktivkohle Luft Fe 2 S 3 H 2 O + S Fe 2 O 3 + S (oder Fe 2 O 3 + SO 2)

Frasch-Verfahren

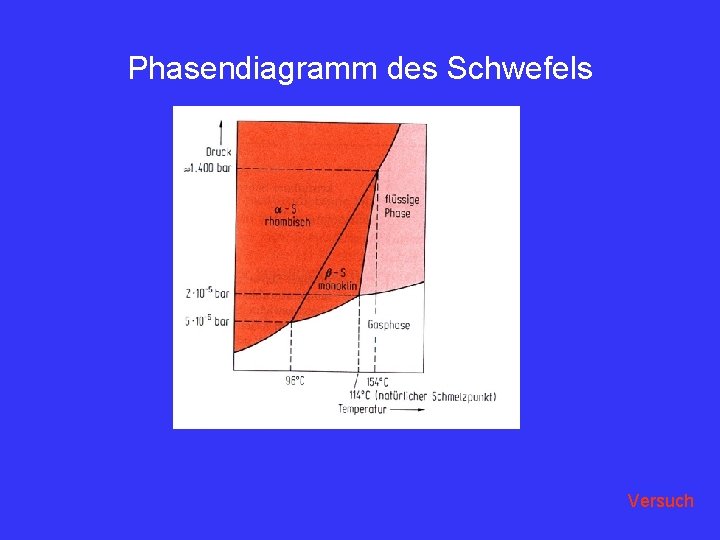
Phasendiagramm des Schwefels Versuch

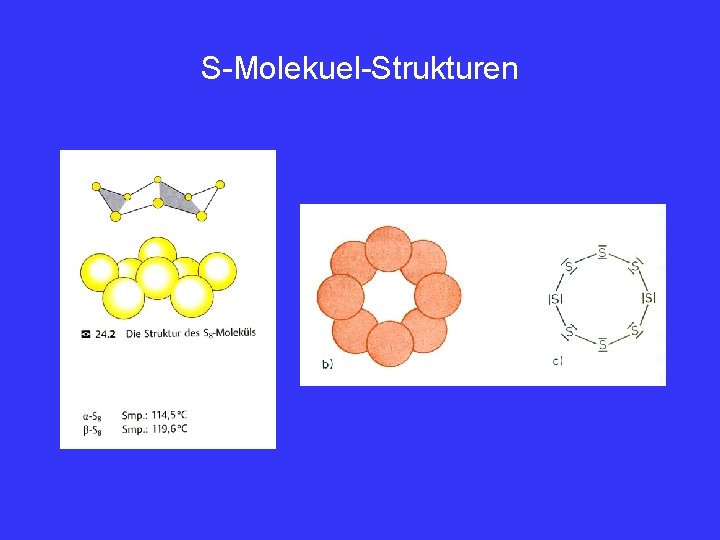
S-Molekuel-Strukturen

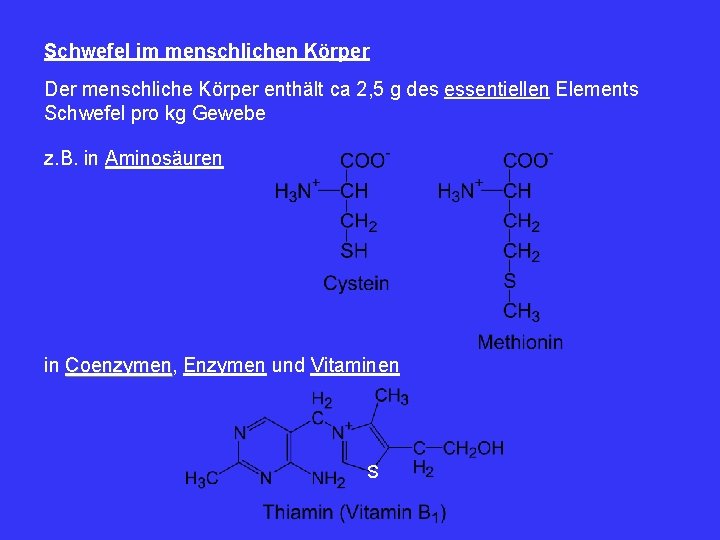
Schwefel im menschlichen Körper Der menschliche Körper enthält ca 2, 5 g des essentiellen Elements Schwefel pro kg Gewebe z. B. in Aminosäuren in Coenzymen, Coenzymen Enzymen und Vitaminen S

Schwefel in Pflanzen Der Schwefel wird von den Pflanzen in Form des Sulfations (Oxidationsstufe +6) aufgenommen und zur Oxidationsstufe des Sulfids (-2) reduziert. Zur Sulfatreduktion und Biosynthese der schwefelhaltigen Aminosäuren sind nur Bakterien, Pilze und Pflanzen befähigt. Ein schwefelhaltiger Pflanzeninhaltsstoff ist z. B. der Tränen-Faktor der Zwiebel:

- II H 2 S und Sulfide H 2 S ist äußers giftiges Gas Geruch nach faulen Eiern! (Faulgase) Ag H 2 S Pb 2+ Ag 2 S ; Kp: -61°C (212 K) H 2 S MAK: 10 ppm (15 mg m-3) Pb. S Bleipapier Versuch wässrige Lösung von H 2 S → schwache Säure Hydrogensulfide (HS-) Sulfide (S 2 -) Darsellung v H 2 S: 1. ) 2 HCl + Fe. S H 2 S + Fe. Cl 2 (im Labor, „Kipp“) 2. ) Erhitzen von S mit Paraffinen auf 120 -180°C 3. ) S + H 2 600°C H 2 S Versuch

H 2 S n Sn 2 - Polysulfane Polysulfide (n = 2, 3, 4, 5, …) Ansäuern v. Polysulfidlösungen: Na 2 Sn + 2 HCl 2 Na. Cl + H 2 S + (n-1)S unter Kühlung in Überschuss HCl(conc. ) Fe. S Eisensulfide Ox Fe. S 2 Pyrit Fe-Disulfid → H 2 S 2 ……. H 2 S 8 („gelbes Rohöl“)

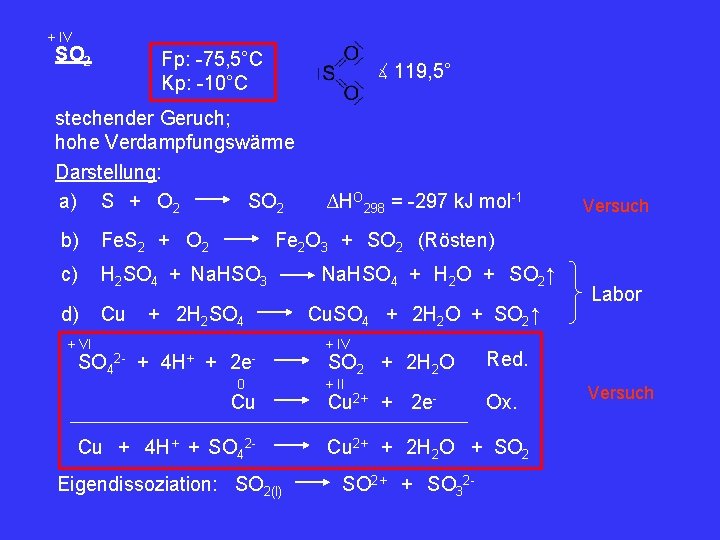
+ IV SO 2 Fp: -75, 5°C Kp: -10°C ∡ 119, 5° stechender Geruch; hohe Verdampfungswärme Darstellung: a) S + O 2 SO 2 b) Fe. S 2 + O 2 c) H 2 SO 4 + Na. HSO 3 d) Cu + VI SO 4 2 - + + Versuch Fe 2 O 3 + SO 2 (Rösten) + 2 H 2 SO 4 4 H+ ∆HO 298 = -297 k. J mol-1 2 e 0 Cu Cu + 4 H+ + SO 42 Eigendissoziation: SO 2(l) Na. HSO 4 + H 2 O + SO 2↑ Cu. SO 4 + 2 H 2 O + SO 2↑ + IV SO 2 + 2 H 2 O Red. Cu 2+ + 2 e- Ox. + II Cu 2+ + 2 H 2 O + SO 2+ + SO 32 - Labor Versuch

SO 2(g) löst sich in den Wolkentropfen: SO 2 + H 2 O H+ + HSO 3 - (Hydrogensulfit-Ion) Das Hydrogensulfit-Ion wird durch im Wolkenwasser gelöstes H 2 O 2 oder O 3 oxidiert: HSO 3 - + H 2 O 2 HSO 3 - + O 3 HSO 4 - + H 2 O HSO 4 - + O 2 H+ + SO 42 - (Sulfat-Ion) normaler Regen: p. H = 5, 6 durch gelöstes CO 2 + H 2 O H+ + HCO 3 - saurer Regen: p. H ≈ 4 durch zusätzlich gelöste Schwefelsäure

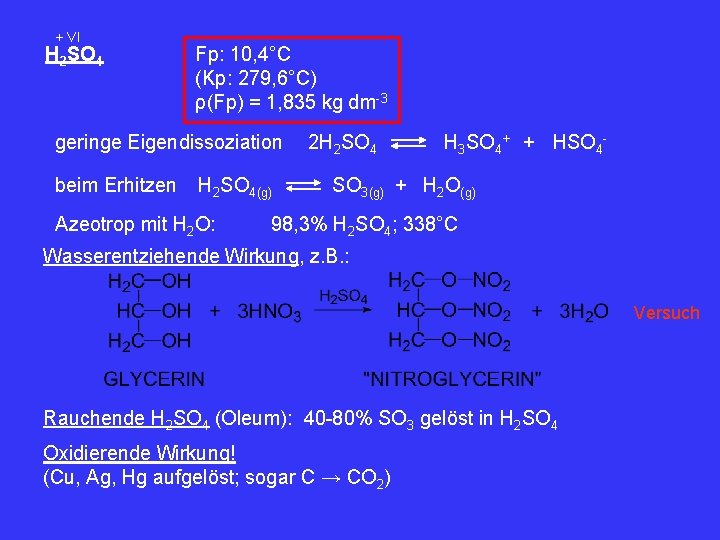
+ VI H 2 SO 4 Fp: 10, 4°C (Kp: 279, 6°C) ρ(Fp) = 1, 835 kg dm-3 geringe Eigendissoziation beim Erhitzen H 2 SO 4(g) Azeotrop mit H 2 O: 2 H 2 SO 4 H 3 SO 4+ + HSO 4 - SO 3(g) + H 2 O(g) 98, 3% H 2 SO 4; 338°C Wasserentziehende Wirkung, z. B. : Versuch Rauchende H 2 SO 4 (Oleum): 40 -80% SO 3 gelöst in H 2 SO 4 Oxidierende Wirkung! (Cu, Ag, Hg aufgelöst; sogar C → CO 2)

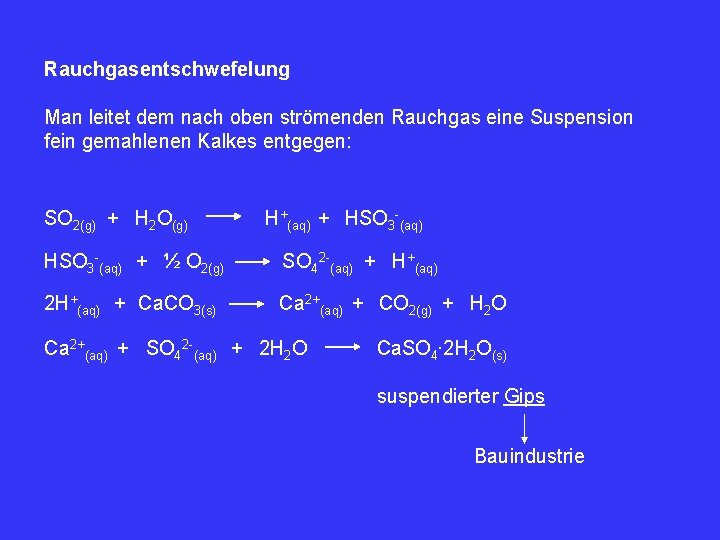
Rauchgasentschwefelung Man leitet dem nach oben strömenden Rauchgas eine Suspension fein gemahlenen Kalkes entgegen: SO 2(g) + H 2 O(g) H+(aq) + HSO 3 -(aq) + ½ O 2(g) SO 42 -(aq) + H+(aq) 2 H+(aq) + Ca. CO 3(s) Ca 2+(aq) + CO 2(g) + H 2 O Ca 2+(aq) + SO 42 -(aq) + 2 H 2 O Ca. SO 4∙ 2 H 2 O(s) suspendierter Gips Bauindustrie

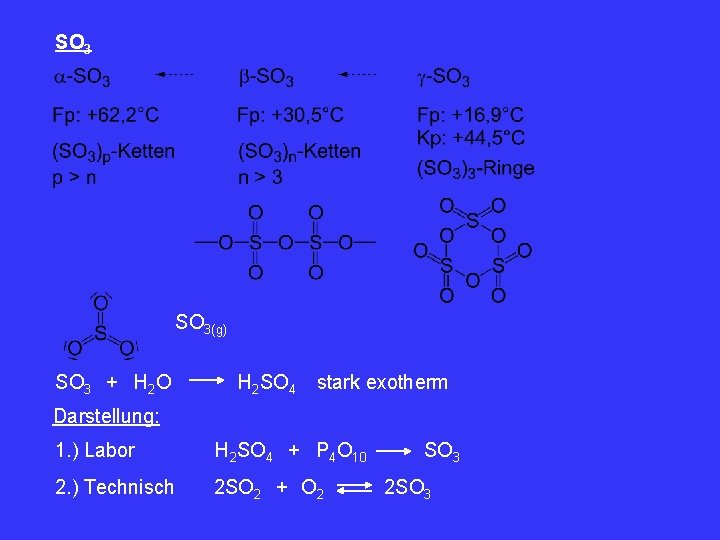
SO 3(g) SO 3 + H 2 O H 2 SO 4 stark exotherm Darstellung: 1. ) Labor H 2 SO 4 + P 4 O 10 2. ) Technisch 2 SO 2 + O 2 SO 3 2 SO 3

Sauerstoffsäuren des Schwefels SO 2 + 2 H 2 O H 3 O+ + HSO 3 - Hydrogensulfit Typ H 2 SOn Oxidationsstufe des Schwefels H 2 SO 2 II III H 2 S 2 O 4 Dithionige Säure Sulfoxylsäure Typ H 2 S 2 On (H 2 SO 3) Schweflige Säure IV V H 2 S 2 O 5 Dischwefelige Säure H 2 S 2 O 6 Dithionsäure H 2 SO 4 Schwefelsäure VI H 2 S 2 O 7 Dischwefelsäure H 2 SO 5 Peroxoschwefelsäure (Carosche Säure) VI (mit Peroxogruppe) H 2 S 2 O 8 Peroxo-dischwefelsäure ∆H = -98, 3 k. J 2 SO 2 + O 2 2 SO 3 In der Technik mittels eines Katalysators, Kontakt-Verfahren. V 2 O 5 + SO 2 2 VO 2 + ½ O 2 2 VO 2 + SO 3 V 2 O 5

SO 3 wird in H 2 SO 4 konz. gelöst, ergibt rauchende Schwefelsäure (Oleum). Hieraus durch Verdünnen die handelsübliche 98%ige Schwefelsäure. Große Verdünnungsenthalpie der Schwefelsäure! Schwefelsäure als Trockenmittel. Reaktion konzentrierter Schwefelsäure mit Zucker, Papier, Baumwolle u. ä. Wasserfreie Schwefelsäure löst einige Edelmetalle, z. B. Kupfer, Quecksilber, unter Oxidation. 2 H 2 SO 4 + Cu Cu. SO 4 + SO 2 + 2 H 2 O Sulfate von Pb, Ba, Sr, Ca sind schwer löslich. Verwendung der Schwefelsäure für organische Synthesen, hauptsächlich aber Düngemittel, Superphosphat. Tetraedrisches SO 42—Ion. Versuch

Salze, Elektrolyte Stoffe, die beim Auflösen in Wasser oder anderen stark polaren Lösungsmitteln in Ionen dissoziieren, nennt man Elektrolyte. Starke Elektrolyte dissoziieren praktisch vollständig, schwache Elektrolyte dissoziieren nur zu einem geringen Teil. Lösungen von Elektrolyten bzw. deren Schmelzen leiten den elektrischen Strom durch Wanderung von Ionen. Löslichkeitsprodukt Schwerlösliche Salze in Wasser: z. B. Bariumsulfat in Wasser: Ba. SO 4 K= Ba 2+ + SO 42 - [Ba 2+]∙[SO 42 -] [Ba. SO 4] K∙[Ba. SO 4] = [Ba 2+]∙[SO 42 -]
![In einer Gesättigten Lösung ist Ba SO 4 konstant da zwischen dem Bariumsulfat in In einer Gesättigten Lösung ist [Ba. SO 4] konstant, da zwischen dem Bariumsulfat in](https://slidetodoc.com/presentation_image_h/2c2d2e808305211a21dcc5ee30f70139/image-33.jpg)
In einer Gesättigten Lösung ist [Ba. SO 4] konstant, da zwischen dem Bariumsulfat in Lösung und dem Bariumsulfat, das als Bodenkörper vorhanden ist, ein dynamisches heterogenes Gleichgewicht besteht, das dafür sorgt, dass [Ba. SO 4] konstant bleibt. Das heißt: K∙[Ba. SO 4] = konstant = Lp = Löslichkeitsprodukt = [Ba 2+]∙[SO 42 -] Lp = [Ba 2+]∙[SO 42 -] Das Löslichkeitsprodukt ist temperaturabhängig. Einheit: mol 2/l 2, mol 3/l 3, usw. Lp. Ba. SO 4 = 1 x 10 -10; Lp. Pb. S = 1 x 10 -29 (beide bei 25°C) Ba. SO 4 als Kontrastmittel bei Röntgenuntersuchungen des Magen-Darm-Traktes. Aber: Tödliche Dosis von Ba. Cl 2 oder Ba. CO 3: 2 -4 g/Mensch. Bleisaum am Zahnfleischrand bei Bleivergiftungen, graubläuliches Band, entsteht durch Einwirkung bakteriell gebildeten H 2 S auf Blei-Ionen. Mineralsubstanz des Knochens, Hydroxylapatit, Ca 5(PO 4)3 OH. Fluorapatit, Ca 5(PO 4)3 F, durch Aufnahme kleiner Fluormengen, Zahnheilkunde, Knochenstoffwechsel. Aber: Dentalfluorose, Fluorosteopathie. Harnsteine aus Magnesiumammoniumphodphat, Mg, NH 4 PO 4∙ 6 H 2 O, Apatit, Calciumoxalat. Harnsäure.


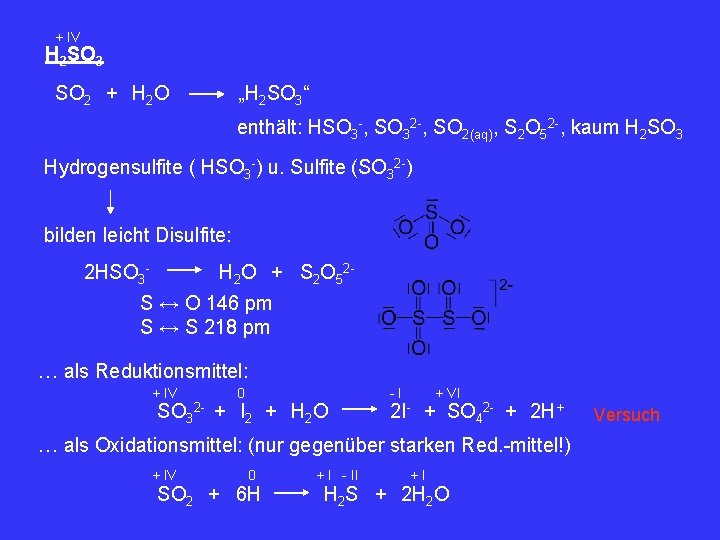
+ IV H 2 SO 3 SO 2 + H 2 O „H 2 SO 3“ enthält: HSO 3 -, SO 32 -, SO 2(aq), S 2 O 52 -, kaum H 2 SO 3 Hydrogensulfite ( HSO 3 -) u. Sulfite (SO 32 -) bilden leicht Disulfite: 2 HSO 3 - H 2 O + S 2 O 52 - S ↔ O 146 pm S ↔ S 218 pm … als Reduktionsmittel: + IV SO 3 2 - 0 + I 2 + H 2 O -I 2 I- + VI + SO 42 - + 2 H+ … als Oxidationsmittel: (nur gegenüber starken Red. -mittel!) + IV 0 SO 2 + 6 H + I - II +I H 2 S + 2 H 2 O Versuch

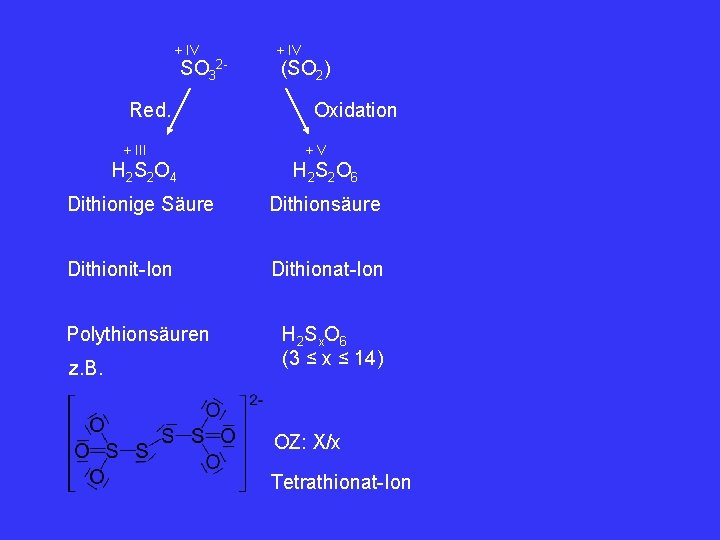
+ IV SO 32 - Red. + III + IV (SO 2) Oxidation +V H 2 S 2 O 4 H 2 S 2 O 6 Dithionige Säure Dithionsäure Dithionit-Ion Dithionat-Ion Polythionsäuren z. B. H 2 S x O 6 (3 ≤ x ≤ 14) OZ: X/x Tetrathionat-Ion

O. Z. Typ H 2 SOn Typ H 2 S 2 On + II (H 2 SO 2 Sulfoxylsäure) (H 2 S 2 O 3 Thioschwefelsäure) + II = {+V + (-I)}/2 + III + IV H 2 S 2 O 4 Dithionige Säure H 2 SO 3 Schwefelige Säure +V H 2 S 2 O 5 Dischwefelige Säure H 2 S 2 O 6 Dithionsäure H 2 SO 4 + VI H 2 S 2 O 7 Dischwefelsäure H 2 S 2 O 8 Peroxodischwefelsäure H 2 SO 5 Peroxo(mono)schwefelsäure Polythionsäuren: H 2 S x O 6 formelle mittlere O. Z. = X/x x = 3 – 14

Technische Darstellung von H 2 SO 4 1. ) SO 2 -Luft-Gemisch a) Rösten von Sulfiden b) Verbrennen von S oder H 2 S c) Gips-Schwefelsäure-Verfahren (Müller-Kühne) Ca. SO 4 + Si. O 2 + C CO + Ca. Si. O 3 + SO 2 2. ) Reinigung des Röstgases „Elektrofiltration“ (früher „Staubkammern“) ∆H = -188 k. J 3. ) 2 SO 2 + O 2 2 SO 3 exotherm! Katalysatoren! „Kontaktverfahren“ – (Pt), V 2 O 5 („Bleikmmerverfahren“ – NO) 4. ) SO 3 absorbiert in 98% H 2 SO 4; kontinuierlich mit H 2 O verdünnt („Kontaktsäure“)

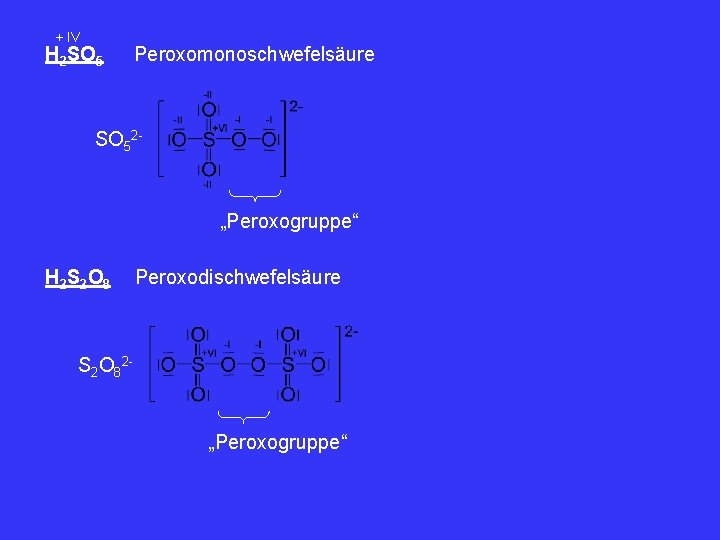
+ IV H 2 SO 5 Peroxomonoschwefelsäure SO 52 - „Peroxogruppe“ H 2 S 2 O 8 Peroxodischwefelsäure S 2 O 82 - „Peroxogruppe“

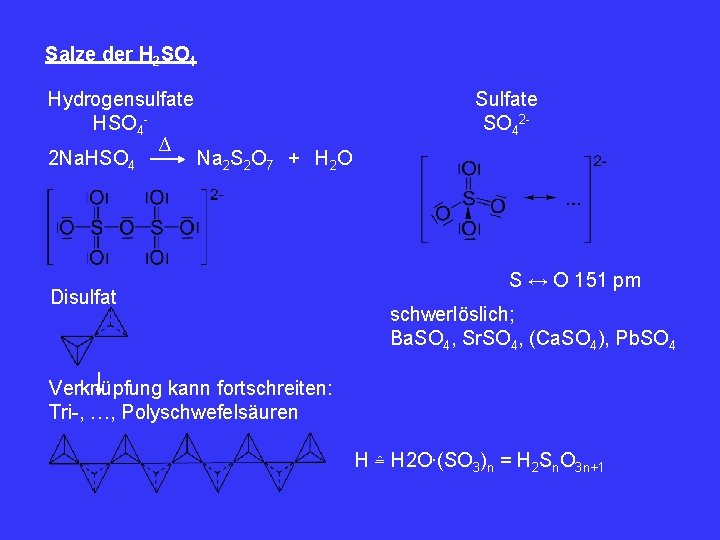
Salze der H 2 SO 4 Hydrogensulfate HSO 4∆ 2 Na. HSO 4 Na 2 S 2 O 7 + H 2 O Disulfat Sulfate SO 42 - S ↔ O 151 pm schwerlöslich; Ba. SO 4, Sr. SO 4, (Ca. SO 4), Pb. SO 4 Verknüpfung kann fortschreiten: Tri-, …, Polyschwefelsäuren H ≙ H 2 O∙(SO 3)n = H 2 Sn. O 3 n+1

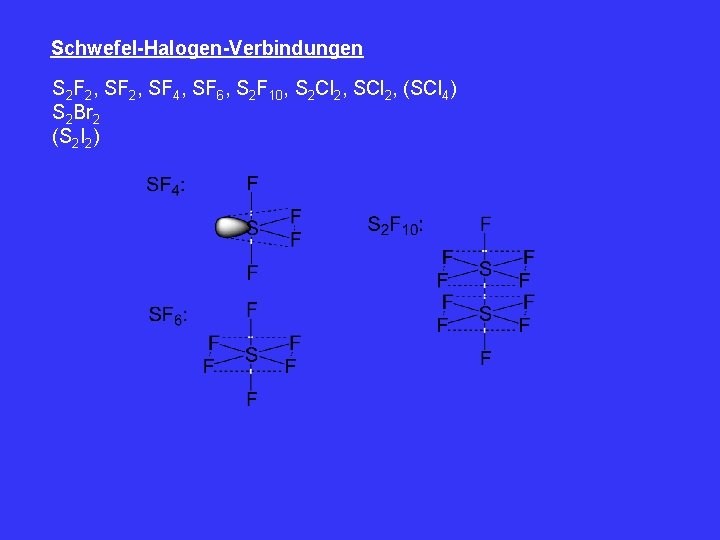
Schwefel-Halogen-Verbindungen S 2 F 2, SF 4, SF 6, S 2 F 10, S 2 Cl 2, SCl 2, (SCl 4) S 2 Br 2 (S 2 I 2)

Thioschwefelsäure, „H 2 S 2 O 3“ Thiosulfate, „S 2 O 32 -“ tetraedrisch Darstellung von Thiosulfaten: a) SO 32 - + S S 2 O 32 - b) Ca. S 2 + 3/2 O 2 Ca. S 2 O 3 Reaktionen: S 2 O 32 - + H+ „H 2 S 2 O 3“ S + SO 2 + H 2 O 2 S 2 O 32 - + Ag. Br(s) 2 S 2 O 32 - + I 2 2 S 2 O 32 - + 2 Fe 3+ S 2 O 32 - [Ag(S 2 O 3)2]3 - + Br 2 I- + S 4 O 622 Fe 2+ + S 4 O 62 - + 4 Cl 2 + 5 H 2 O Versuch 2 SO 42 -+ 8 Cl- + 10 H+ Versuch

Schwefelsäuren

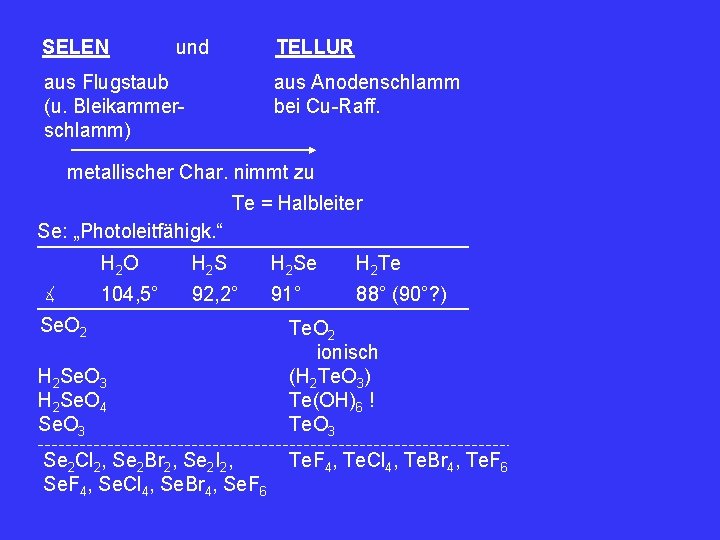
SELEN und TELLUR aus Flugstaub (u. Bleikammerschlamm) aus Anodenschlamm bei Cu-Raff. metallischer Char. nimmt zu Te = Halbleiter Se: „Photoleitfähigk. “ ∡ H 2 O H 2 S H 2 Se H 2 Te 104, 5° 92, 2° 91° 88° (90°? ) Se. O 2 H 2 Se. O 3 H 2 Se. O 4 Se. O 3 Se 2 Cl 2, Se 2 Br 2, Se 2 I 2, Se. F 4, Se. Cl 4, Se. Br 4, Se. F 6 Te. O 2 ionisch (H 2 Te. O 3) Te(OH)6 ! Te. O 3 Te. F 4, Te. Cl 4, Te. Br 4, Te. F 6

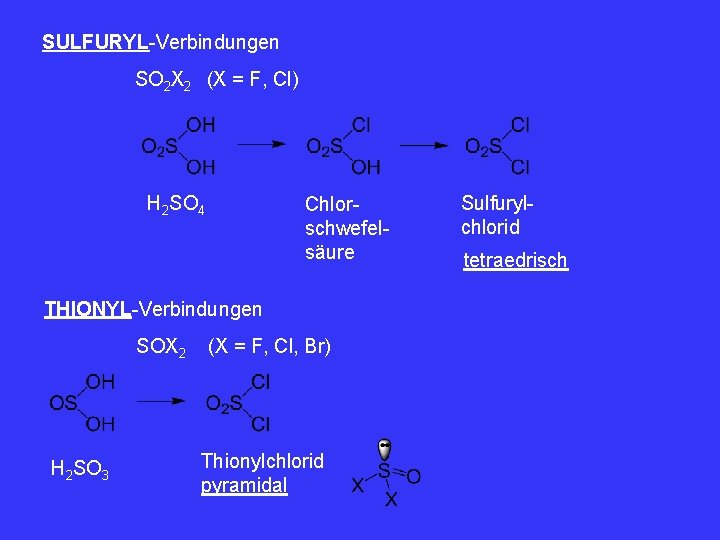
SULFURYL-Verbindungen SO 2 X 2 (X = F, Cl) H 2 SO 4 Chlorschwefelsäure THIONYL-Verbindungen SOX 2 H 2 SO 3 (X = F, Cl, Br) Thionylchlorid pyramidal Sulfurylchlorid tetraedrisch

5. Hauptgruppe N, P, As, Sb, Bi Ionisierungsenergien, Elektronegativität, Stabilität der Hydride XH 3 nimmt ab Metallischer Charakter, Dichte, Kp, Atomradien, Koordinationszahl, Stabilität v XCl 3 nimmt zu ns 2 np 3 Oxidationszahl von –III bis +V Stabilität der Oz +V nimmt ab

STICKSTOFF, N 2 Vorkommen: Luft (78, 1 Vol. %), Chilesalpeter (Na. NO 3), Nukleinsäuren, Eiweiß, … Eigenschaften: Gas; farb-, geruch-, geschmacklos; in H 2 O halb so gut löslich wie O 2, nicht brennbar ∆H = 942 k. J mol-1 E(N≡N) ≈ 6 x. E(N–N)! N 2 sehr reaktionsträge! viele N-Vbdgn. zerfallen exotherm u. explosionsartig Darstellung: a) frakt. Dest. v. flüssiger Luft b) chem. Entfernung v. O 2 aus Luft Cu + O 2 Cu. O ; C + O 2 CO 2 c) chem. Zersetzung -III +IV +III 0 (NH 4)2 Cr 2 O 7 Cr 2 O 3 + 4 H 2 O + N 2 NH 4 Cl + Na. NO 2 Na. Cl -III +III 70°C NH 4 NO 2 NH 3 + HNO 2 + NH 4 NO 2 N 2 + 2 H 2 O Versuch

NH 3 (O. Z. -III) farbloses, stechend riechendes Gas Fp: -77, 8°C (195, 3 K) Kp: -33, 4°C (239, 8 K) hohe Verdampfungswärme; hohe Löslichkeit in H 2 O, Lsg. ist eine schwache Base; NH 3 verbrennt an Luft → N 2 (od. NO) Versuch NH 3(l) gutes polares Lsgsm. (DK = 23 bei -33°C) 2 NH 3(l) NH 4 - + NH 2 - K ≈ 10 -30 (-50°C) Lsgn. v. Alkali- und Erdalkalimetallen in NH 3(l)! „Solvatisierte Elektronen“ - Atome durch Metalle ersetzbar: a) Amide b) Imide c) Nitride NH 2 N 3 - (MNH 2) (M 2 NH) (M 3 N) Versuch

Darstellung v. NH 3 Labor: a) 2 NH 4 Cl + Ca(OH)2 Ca. Cl 2 + 2 NH 3 + 2 H 2 O Versuch b) Erhitzen v. konz. NH 3 -Lösungen Technik: a) Haber-Bosch-Verfahren 3 H 2 + N 2 2 NH 3 ∆H = -92 k. J 1) Ausgangsstoffe 4 N 2 + O 2 + 2 C 4 N 2 + 2 CO „Generatorgas“ H 2 O + C ∆H = -221, 0 k. J H 2 + CO „Wassergas“ ∆H = +131, 4 k. J CO entfernt: CO + H 2 O CO 2 + H 2 S entfernt; wird mit H 2 O unter Druck herausgewaschen

Großtechnische Gewinnung des Ammoniaks, Haber-Bosch-Verfahren N 2 + 3 H 2 2 NH 3 ∆H = -91, 6 k. J Möglichst hoher Druck, möglichst niedrige Temperatur. In der Praxis 200 bar und 500°C. Ausbeute an Ammoniak ca. 18%. Als Katalysator dient eine eisenhaltige Kontaktmasse. Ausgangsstoffe aus Wassergas und Generatorgas. Eigenschaften des Ammoniak: farbloses, stechend riechendes Das, löst zahlreiche anorganische und organische Substanzen, Reaktion mit Wasser: NH 3 + H 2 O NH 4+ + OHtetraedrisches Ammoniumion NH 4+ kann K+ im Gitteraufbau ersetzen. Hauptverwendung: zur Herstellung von Dünger

HN 3, Stickstoffwasserstoffsäure mittlere Oz. pro N: -I/3 Darstellung: a) N 2 O + 2 Na. NH 2 190°C Na. N 3 + Na. OH + NH 3 Na. N 3 + verd. H 2 SO 4 b) N 2 H 4 + HNO 2 HN 3 + 2 H 2 O Azide → „Pseudohalogenide“ 2 HN 3 3 N 2 + H 2 ∆H = -538, 7 k. J Pb(N 3)2 Initialzünder Na. N 3 in „Airbags“ Versuch 2 Na. N 3 2 Na + 3 N 2

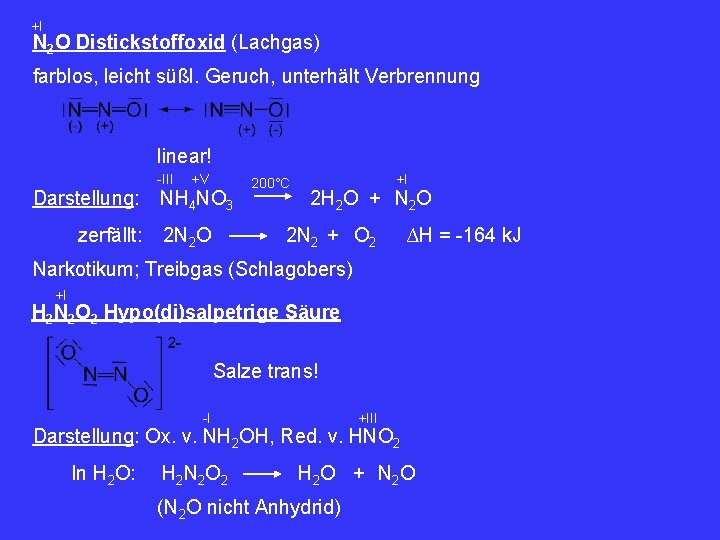
+I N 2 O Distickstoffoxid (Lachgas) farblos, leicht süßl. Geruch, unterhält Verbrennung linear! -III Darstellung: zerfällt: +V NH 4 NO 3 2 N 2 O 200°C +I 2 H 2 O + N 2 O 2 N 2 + O 2 ∆H = -164 k. J Narkotikum; Treibgas (Schlagobers) +I H 2 N 2 O 2 Hypo(di)salpetrige Säure Salze trans! -I +III Darstellung: Ox. v. NH 2 OH, Red. v. HNO 2 In H 2 O: H 2 N 2 O 2 H 2 O + N 2 O (N 2 O nicht Anhydrid)

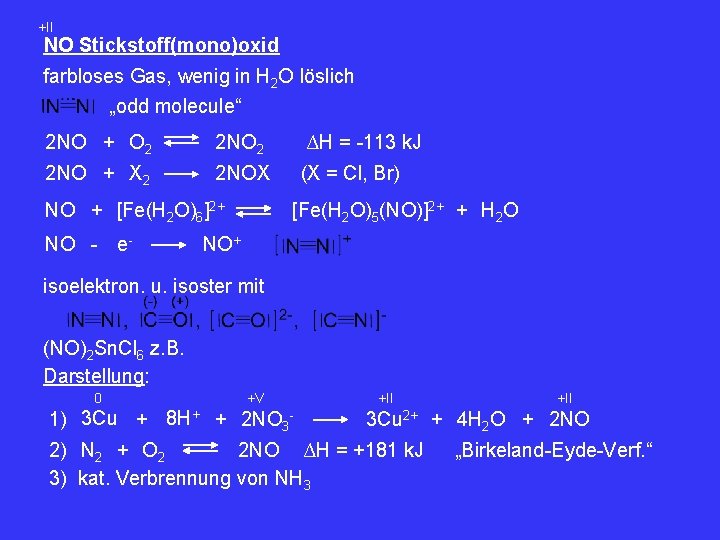
+II NO Stickstoff(mono)oxid farbloses Gas, wenig in H 2 O löslich „odd molecule“ 2 NO + O 2 2 NO + X 2 2 NOX NO + [Fe(H 2 O)6]2+ NO - e- ∆H = -113 k. J (X = Cl, Br) [Fe(H 2 O)5(NO)]2+ + H 2 O NO+ isoelektron. u. isoster mit (NO)2 Sn. Cl 6 z. B. Darstellung: 0 +V 1) 3 Cu + 8 H+ + 2 NO 3 - +II 3 Cu 2+ + 4 H 2 O + 2 NO 2) N 2 + O 2 2 NO ∆H = +181 k. J 3) kat. Verbrennung von NH 3 „Birkeland-Eyde-Verf. “

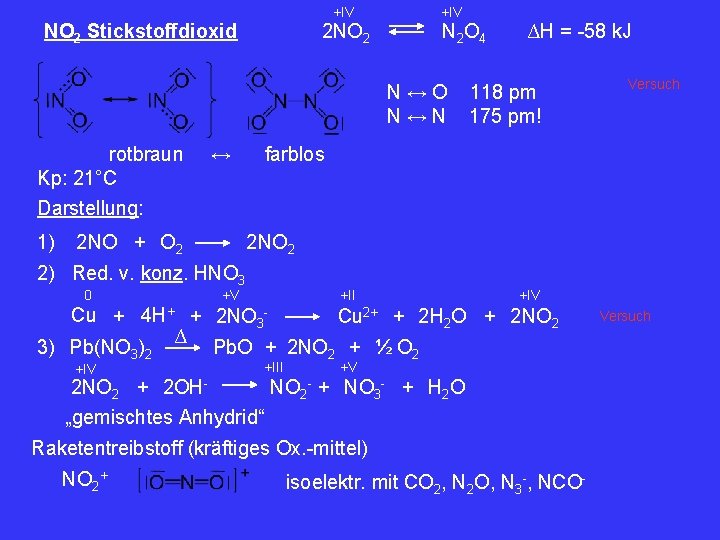
+IV 2 NO 2 Stickstoffdioxid +IV N 2 O 4 N↔O N↔N rotbraun Kp: 21°C Darstellung: 1) ↔ 2 NO + O 2 118 pm 175 pm! 2 NO 2 +V +II +IV Cu + 4 H+ + 2 NO 3 Cu 2+ + 2 H 2 O + 2 NO 2 ∆ 3) Pb(NO 3)2 Pb. O + 2 NO 2 + ½ O 2 +IV 2 NO 2 + +III 2 OH- +V NO 2 + NO 3 - + H 2 O - „gemischtes Anhydrid“ Raketentreibstoff (kräftiges Ox. -mittel) NO 2+ Versuch farblos 2) Red. v. konz. HNO 3 0 ∆H = -58 k. J isoelektr. mit CO 2, N 2 O, N 3 -, NCO- Versuch

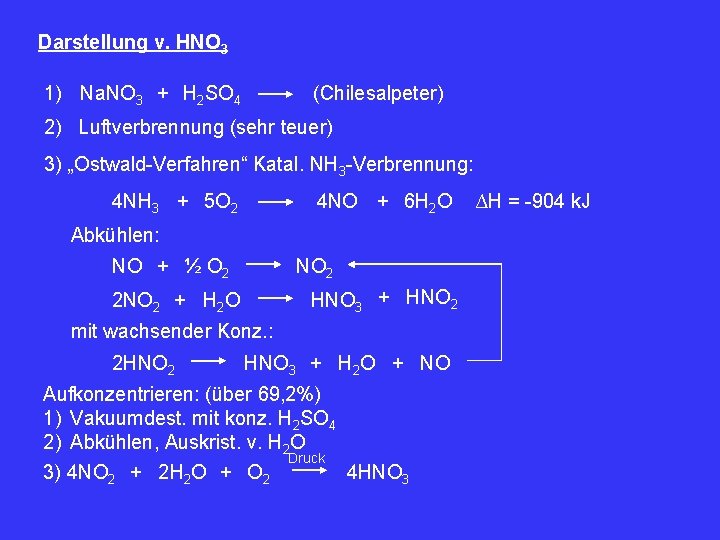
Darstellung v. HNO 3 1) Na. NO 3 + H 2 SO 4 (Chilesalpeter) 2) Luftverbrennung (sehr teuer) 3) „Ostwald-Verfahren“ Katal. NH 3 -Verbrennung: 4 NH 3 + 5 O 2 4 NO + 6 H 2 O Abkühlen: NO + ½ O 2 NO 2 HNO 3 + HNO 2 2 NO 2 + H 2 O mit wachsender Konz. : 2 HNO 2 HNO 3 + H 2 O + NO Aufkonzentrieren: (über 69, 2%) 1) Vakuumdest. mit konz. H 2 SO 4 2) Abkühlen, Auskrist. v. H 2 O Druck 3) 4 NO 2 + 2 H 2 O + O 2 4 HNO 3 ∆H = -904 k. J

Ammoniumnitrat- Explosion in Oppau 1921 561 Todesopfer, mehr als 7000 Obdachlose in der Nachbarschaft

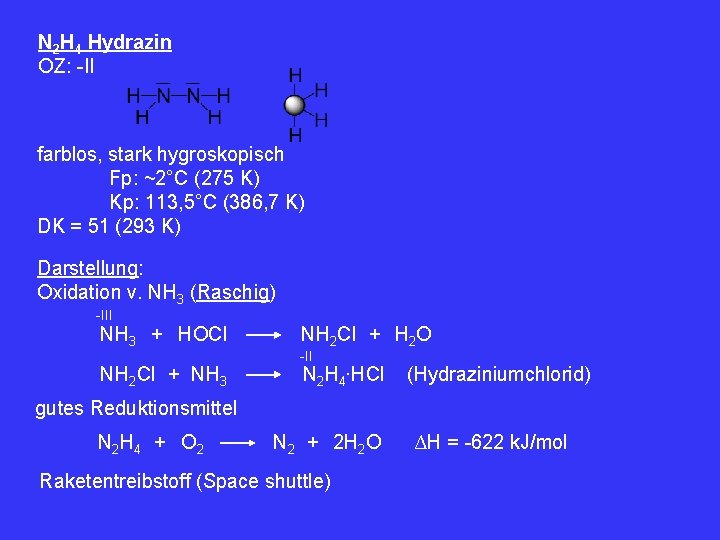
N 2 H 4 Hydrazin OZ: -II farblos, stark hygroskopisch Fp: ~2°C (275 K) Kp: 113, 5°C (386, 7 K) DK = 51 (293 K) Darstellung: Oxidation v. NH 3 (Raschig) -III NH 3 + HOCl NH 2 Cl + NH 3 NH 2 Cl + H 2 O -II N 2 H 4∙HCl (Hydraziniumchlorid) gutes Reduktionsmittel N 2 H 4 + O 2 N 2 + 2 H 2 O Raketentreibstoff (Space shuttle) ∆H = -622 k. J/mol

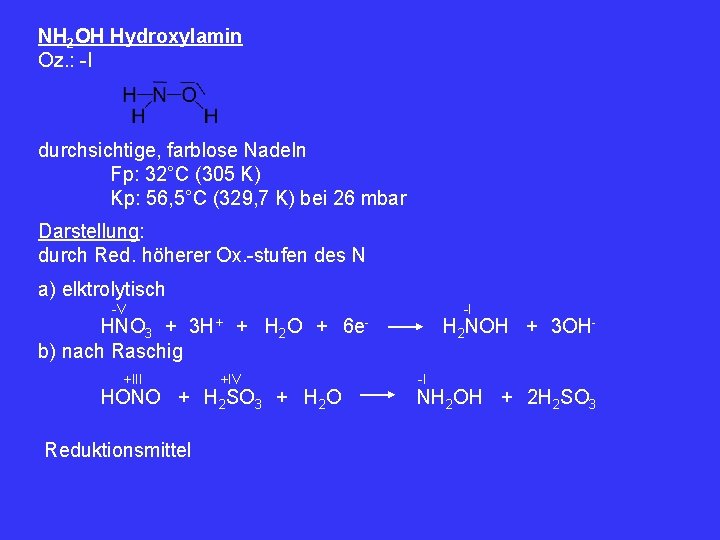
NH 2 OH Hydroxylamin Oz. : -I durchsichtige, farblose Nadeln Fp: 32°C (305 K) Kp: 56, 5°C (329, 7 K) bei 26 mbar Darstellung: durch Red. höherer Ox. -stufen des N a) elktrolytisch -V HNO 3 + b) nach Raschig 3 H+ +III + H 2 O + +IV HONO + H 2 SO 3 + H 2 O Reduktionsmittel -I 6 e- H 2 NOH + 3 OH-I NH 2 OH + 2 H 2 SO 3

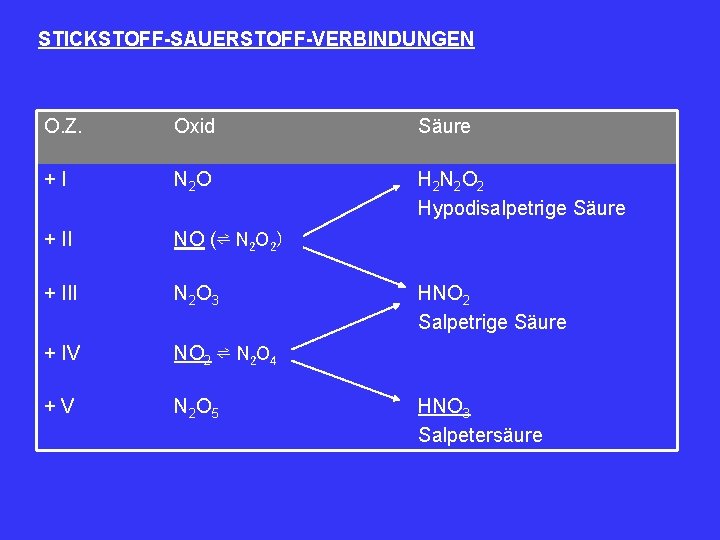
STICKSTOFF-SAUERSTOFF-VERBINDUNGEN O. Z. Oxid Säure +I N 2 O H 2 N 2 O 2 Hypodisalpetrige Säure + II NO (⇌ N 2 O 2) + III N 2 O 3 + IV NO 2 ⇌ N 2 O 4 +V N 2 O 5 HNO 2 Salpetrige Säure HNO 3 Salpetersäure

+III N 2 O 3 Distickstofftrioxid Fp: -102°C (171 K) blassblaue Kristalle durch Abkühlen eine Gemisches aus NO + NO 2 +III HNO 2 Salpetrige Säure freie Säure nicht bekannt, wässrige Lösung rel. unbeständig Darstellung: 1) 2) 3) +II +IV +III NO + NO 2 + 2 Na. OH 2 Na. NO 2 + H 2 O Na. NO 3 + Pb Na. NO 2 + Pb. O ∆ 2 Na. NO 3 2 Na. NO 2 + O 2 Reduz. Wirkung - gegen starke Ox. -mittel Oxid. Wirkung: +III 2 NO 2 - + -I 2 I- + 4 H+ +II 0 2 NO + I 2 + 2 H 2 O

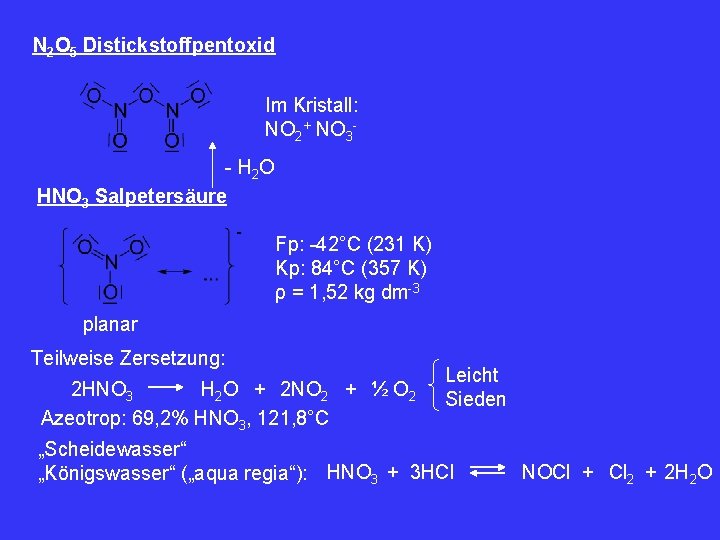
N 2 O 5 Distickstoffpentoxid Im Kristall: NO 2+ NO 3 - H 2 O HNO 3 Salpetersäure Fp: -42°C (231 K) Kp: 84°C (357 K) ρ = 1, 52 kg dm-3 planar Teilweise Zersetzung: 2 HNO 3 H 2 O + 2 NO 2 + ½ O 2 Azeotrop: 69, 2% HNO 3, 121, 8°C Leicht Sieden „Scheidewasser“ „Königswasser“ („aqua regia“): HNO 3 + 3 HCl NOCl + Cl 2 + 2 H 2 O

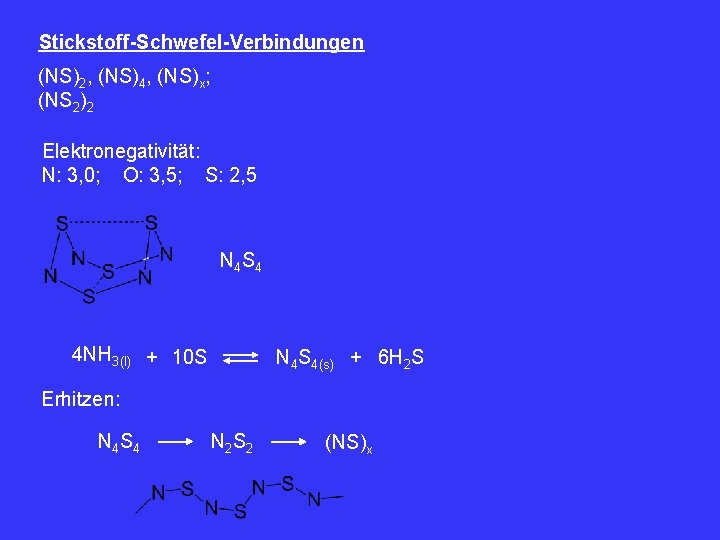
Stickstoff-Schwefel-Verbindungen (NS)2, (NS)4, (NS)x; (NS 2)2 Elektronegativität: N: 3, 0; O: 3, 5; S: 2, 5 N 4 S 4 4 NH 3(l) + 10 S N 4 S 4(s) + 6 H 2 S Erhitzen: N 4 S 4 N 2 S 2 (NS)x

NH 2(SO 3 H) Amidosulfonsäure (-schwefelsäure) -I -IV NH 2 OH + 2 H 2 SO 3 (Au 2(NSO 3 K)3) alle H-Atome ersetzbar -III -VI NH 2(SO 3 H) + 2 H 2 O

Halogenverbindungen des Stickstofftriiodid-Monoammoniakat 8 NI 3 NH 3 5 N 2 + 6 NH 4 I + 9 I 2

Phosphor • Vorkommen – Apatit Ca 5(PO 4)3(OH, F, Cl) – Fluorapatit Ca 5(PO 4)3 F – Hydroxylapatit Ca 5(PO 4)3(OH) – Phosphorit Gemenge mit Apatit – In organischen Geweben

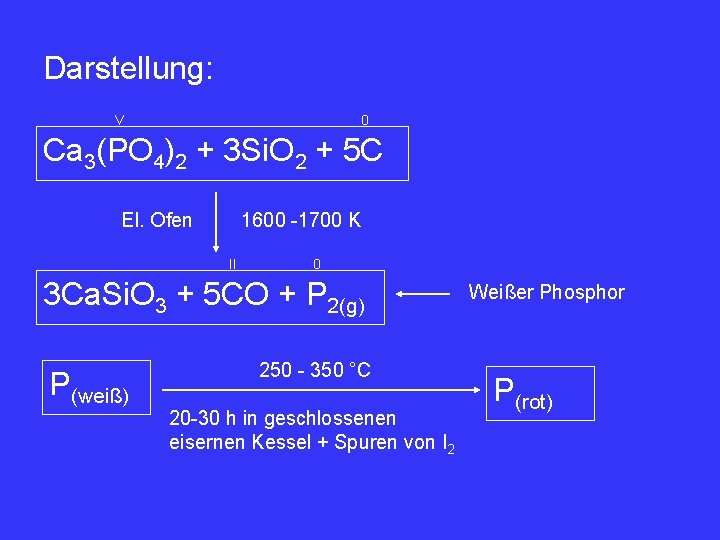
Darstellung: V 0 Ca 3(PO 4)2 + 3 Si. O 2 + 5 C El. Ofen 1600 -1700 K II 0 3 Ca. Si. O 3 + 5 CO + P 2(g) P(weiß) 250 - 350 °C 20 -30 h in geschlossenen eisernen Kessel + Spuren von I 2 Weißer Phosphor P(rot)

Eigenschaften: • • Oxide sauer Oz. V stabiler als bei N Max. Kz. gegenüber O ist 4 Mehrere Modifikationen

Weißer Phosphor • • Fp = 44, 1 °C Kp = 280, 5 °C Ab 800 °C: P 4 2 P 2 ( P P ) Ab 2000 °C: P 2 2 P Sehr reaktionsfähig Entzündet sich bei ~40°C Sehr giftig ! (0, 15 g sind für den Menschen tödlich; Gegengift = verd. Cu. SO 4 – Lsg) • Instabilste Modifikation Versuch Filterpapier mit w P

P(weiß) P(rot) Monotrope Umwandlung

Lumineszenz Absorption von Licht – Abstrahlung nach allen Richtungen kann auch schrittweise und bei kleineren Frequenzen erfolgen. • Fluoreszenz – Leuchten nur während der Erregung (z. B. bestrahlen mit UV. Leuchten im sichtbaren Bereich. ) • Phosphoreszenz – allmähliches Abklingen des Leuchtens nach abschalten der Erregung. • Chemolumineszenz – Energie die bei Reaktion frei wird, wird als Lichtenergie abgestrahlt; z. B. : P(w) + O 2 P 4 O 6 P 4 O 10 + hv Versuch weißer P im Kolben+ CO 2 einleiten

Roter & violetter Phosphor • • Fp = ~ 620 °C (~893 K ), unter Druck Hochpolymer „Reaktionsträger“ ! Hellroter Phosphor: unregelmäßiges Längeres räumliches Netzwerk Erhitzen • Violetter Phosphor: kompliziertes monoklines Schichtgitter • P(rot) brennt erst oberhalb von 240 °C

Schwarzer Phosphor • Stabilste (? ) Modifikation • Aus P(weiß) bei 200 °C & 12 kbar • Aus P(weiß) durch mehrtägiges erhitzen bei 380 °C mit Hg Spuren

Streichhölzer • Früher: Streicholz: P(w) + Na. NO 3(Pb 3 O 4) + brennbarem Bindemittel (Leim, Dextrin, …) an jeder reibfläche entzündbar; sehr giftig ! Seit 1903 verboten • Heute: Streichholz: Sb 2 S 5 + KCl. O 3 + Bindemittel Holz: Paraffingetränkt + Na 3 PO 4 Reibfläche: P(rot) + Glaspulver • Versuch: P (rot) + KCl. O 3

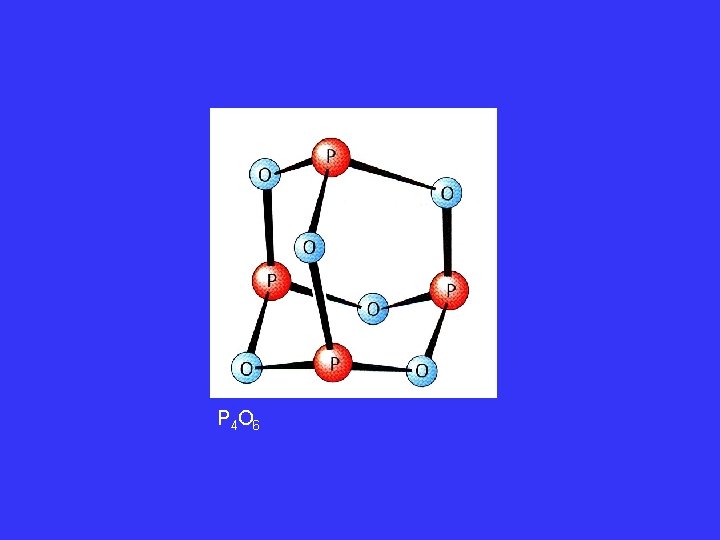
Oxide • P 4 O 6 „Phosphortrioxid“ – Fp: 24 °C (297 K) – Kp: 173 °C (446 K) P 4 + 3 O 2 III P 4 O 6 + 6 H 2 O P 4 O 6(l) ΔH = -2193 k. J mol-1 III 4 H 3 PO 3 Anhydrid d. Phosphorigen Säure

P 4 O 6

• P 4 O 8 (P 4 O 7. 7. . . P 4 O 9) „Phosphortetroxid“ III 4 P 4 O 6 0 ~450 °C Luftausschluß IV 4 P(rot) + 3 P 4 O 8 Gemischtes Anhydrid: IV P 4 O 8 + 6 H 2 O III V 2 H 3 PO 3 + 2 H 3 PO 4

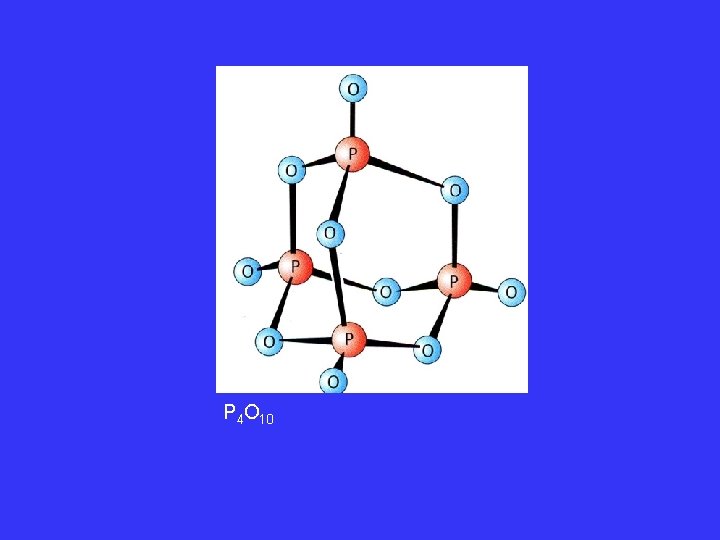
• P 4 O 10 „Phosphorpentoxid“ Vollständige Verbrennung: Versuch P 4 + 5 O 2 P 4 O 10 ΔH = -2193 k. J mol-1 Wasseranziehend (Trocknungsmittel) V V H 2 O ½ P 4 O 10 2 HPO 3 H 4 P 2 O 7 Anhydrid d. Phosphorsäure H 2 O 2 H 3 PO 4

P 4 O 10

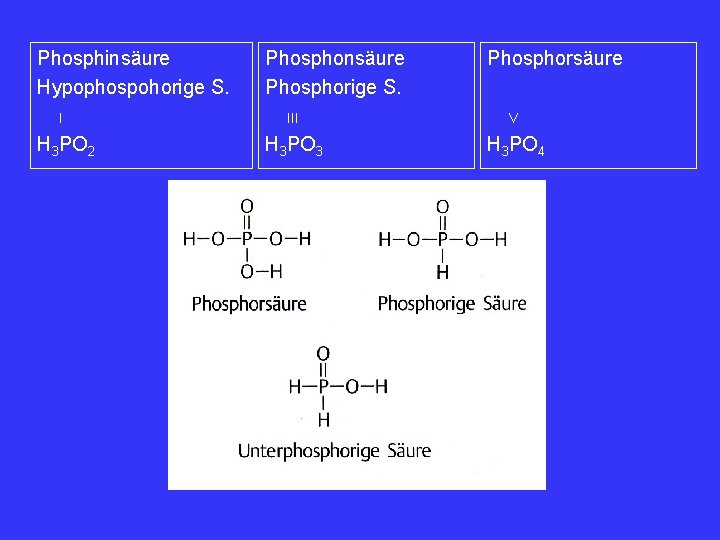
Phosphinsäure Hypophospohorige S. I H 3 PO 2 Phosphonsäure Phosphorige S. Phosphorsäure III V H 3 PO 3 H 3 PO 4

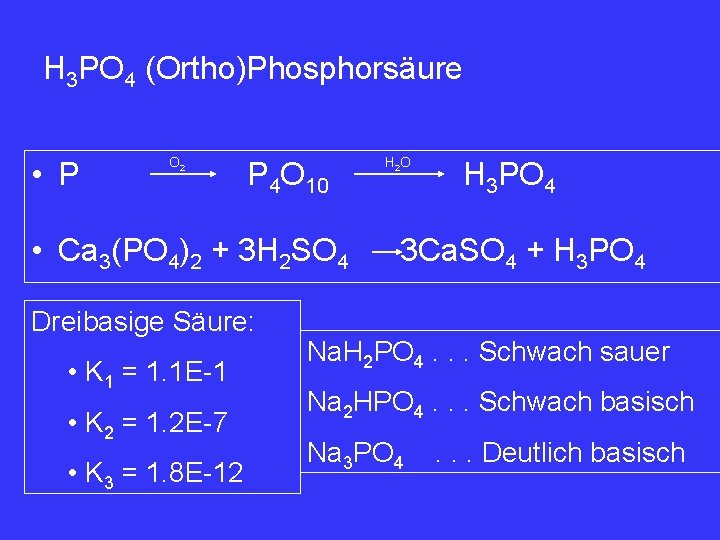
H 3 PO 4 (Ortho)Phosphorsäure • P O 2 P 4 O 10 • Ca 3(PO 4)2 + 3 H 2 SO 4 Dreibasige Säure: • K 1 = 1. 1 E-1 • K 2 = 1. 2 E-7 • K 3 = 1. 8 E-12 H 2 O H 3 PO 4 3 Ca. SO 4 + H 3 PO 4 Na. H 2 PO 4. . . Schwach sauer Na 2 HPO 4. . . Schwach basisch Na 3 PO 4 . . . Deutlich basisch

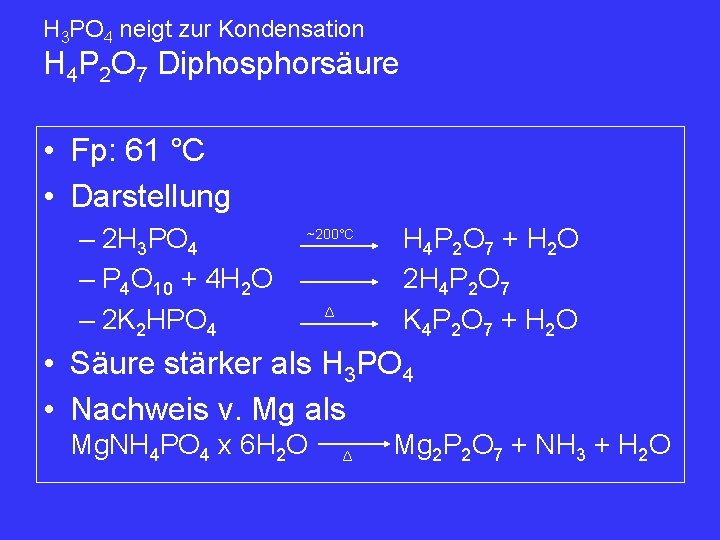
H 3 PO 4 neigt zur Kondensation H 4 P 2 O 7 Diphosphorsäure • Fp: 61 °C • Darstellung – 2 H 3 PO 4 – P 4 O 10 + 4 H 2 O – 2 K 2 HPO 4 ~200°C Δ H 4 P 2 O 7 + H 2 O 2 H 4 P 2 O 7 K 4 P 2 O 7 + H 2 O • Säure stärker als H 3 PO 4 • Nachweis v. Mg als Mg. NH 4 PO 4 x 6 H 2 O Δ Mg 2 P 2 O 7 + NH 3 + H 2 O

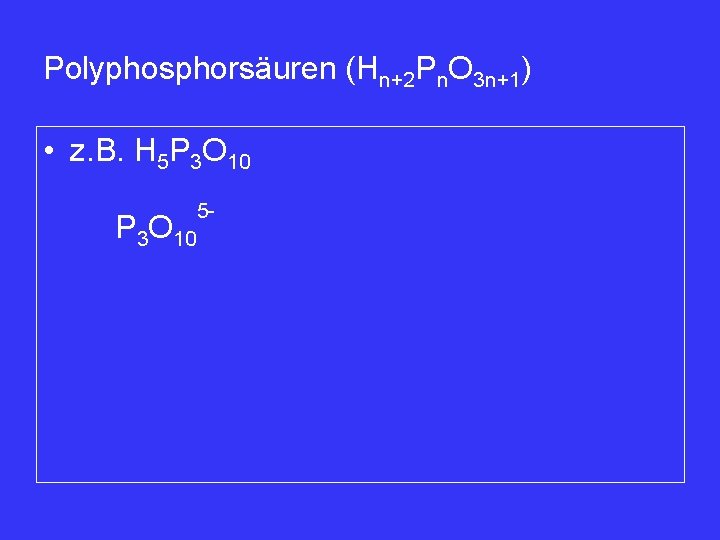
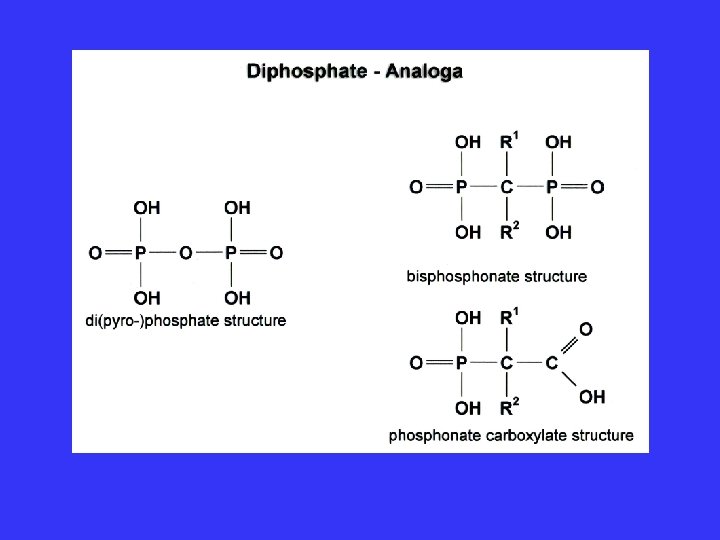
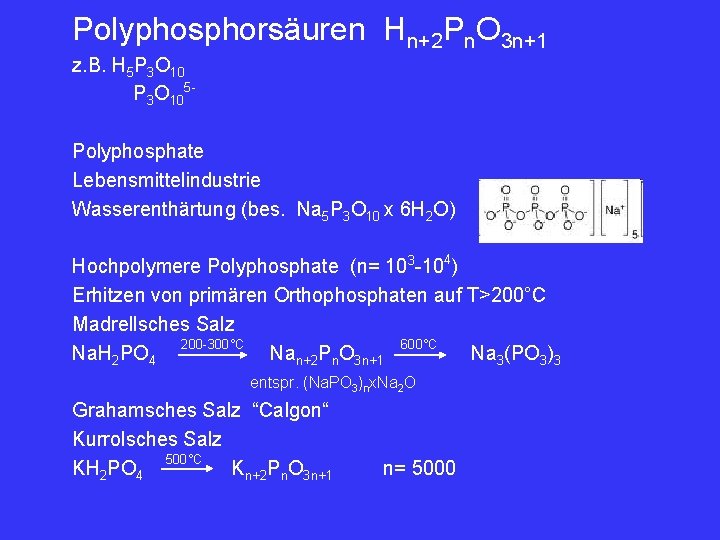
Polyphosphorsäuren (Hn+2 Pn. O 3 n+1) • z. B. H 5 P 3 O 10 5 -

P - Hydride • PH 3 Phosphan – < H-P-H = 93, 7° – Farblos – Sehr giftig – Geruch nach Knoblauch – Weniger basisch als NH 3

– Darstellung Phosphan 0 -III - Versuch I - P 4 + 3 OH + 3 H 2 O PH 3 + 3 H 2 PO 2 Ca 3 P 2 + 6 H 2 O 3 Ca(OH)2 + 2 PH 3 4 PCl 3 + 3 Li. Al. H 4 Ether 4 PH 3 + 3 Li. Cl + 3 Al. Cl 3 Phosphan und Diphosphan P 2 H 4 sind farblose selbstentzündliche Gase

Halogenverbindungen • PX 3 (X = F, Cl, Br, I) – Sp 3 – Hybrid – Darstellung aus den Elementen – Hydrolyse PCl 3 + 3 H 2 O Versuch H 3 PO 3 + 3 HCl

Typische Prüfungsfrage!

• PX 5 (X = F, Cl, Br, I) – sp 3 d – Hybrid – Darstellung aus Elementen + PCl 5(s): [PCl 4] [PCl 6] + PBr 5(s): [PBr 4] Br - • POX 3 (X = F, Cl, Br, I) – PCl 5 + H 2 O – 3 PCl 5 + ½ P 4 O 10 POCl 3 + 2 HCl 5 POCl 3

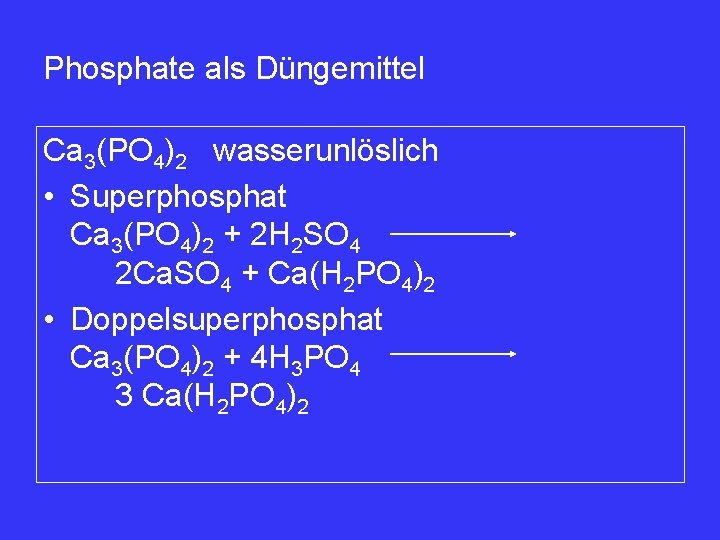
Phosphate als Düngemittel Ca 3(PO 4)2 wasserunlöslich • Superphosphat Ca 3(PO 4)2 + 2 H 2 SO 4 2 Ca. SO 4 + Ca(H 2 PO 4)2 • Doppelsuperphosphat Ca 3(PO 4)2 + 4 H 3 PO 4 3 Ca(H 2 PO 4)2
![Thomasmehl hauptsächlich Ca 5Si O 4PO 42 Glühphosphat Rhenaniaphosphat hauptsächlich 3 • Thomasmehl hauptsächlich: Ca 5[Si. O 4(PO 4)2] • Glühphosphat (Rhenaniaphosphat) hauptsächlich: 3](https://slidetodoc.com/presentation_image_h/2c2d2e808305211a21dcc5ee30f70139/image-89.jpg)
• Thomasmehl hauptsächlich: Ca 5[Si. O 4(PO 4)2] • Glühphosphat (Rhenaniaphosphat) hauptsächlich: 3 Ca. Na. PO 4 x Ca 2 Si. O 4 • Nitrophoska (NH 4)2 SO 4(NH 4 Cl) + KNO 3 + (NH 4)2 HPO 4

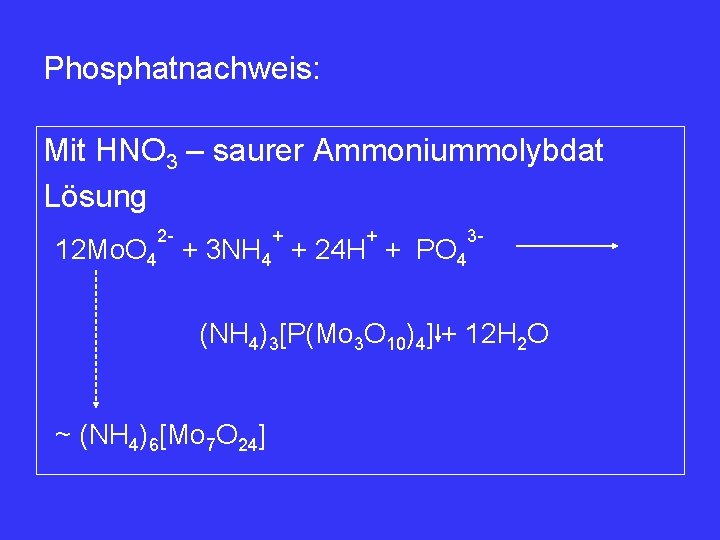
Phosphatnachweis: Mit HNO 3 – saurer Ammoniummolybdat Lösung 2 - + + 12 Mo. O 4 + 3 NH 4 + 24 H + PO 4 3 - (NH 4)3[P(Mo 3 O 10)4] + 12 H 2 O ~ (NH 4)6[Mo 7 O 24]

• Polyphosphate – Lebensmittelindustrie – Wasserenthärtung (bes. Na 5 P 3 O 10 x 6 H 2 O) • Hochpolymere Polyphosphate (n=1 E 31 E 4) – Erhitzen von primären Orthophosphaten auf T> 200°C – „Madrellsches Salz“ • Na. H 2 PO 4 Nan+2 Pn. O 3 n+1 = (Na. PO 3)n x Na 2 O Na 3(PO 3)3




Polyphosphorsäuren Hn+2 Pn. O 3 n+1 z. B. H 5 P 3 O 105 Polyphosphate Lebensmittelindustrie Wasserenthärtung (bes. Na 5 P 3 O 10 x 6 H 2 O) Hochpolymere Polyphosphate (n= 103 -104) Erhitzen von primären Orthophosphaten auf T>200°C Madrellsches Salz 200 -300°C 600°C Na. H 2 PO 4 Nan+2 Pn. O 3 n+1 Na 3(PO 3)3 entspr. (Na. PO 3)nx. Na 2 O Grahamsches Salz “Calgon“ Kurrolsches Salz 500°C KH 2 PO 4 Kn+2 Pn. O 3 n+1 n= 5000

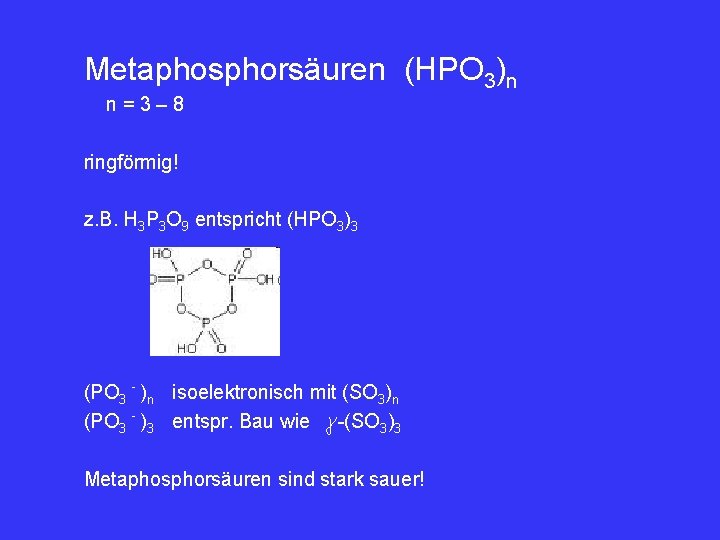
Metaphosphorsäuren (HPO 3)n n=3– 8 ringförmig! z. B. H 3 P 3 O 9 entspricht (HPO 3)3 (PO 3 - )n isoelektronisch mit (SO 3)n (PO 3 - )3 entspr. Bau wie -(SO 3)3 Metaphosphorsäuren sind stark sauer!

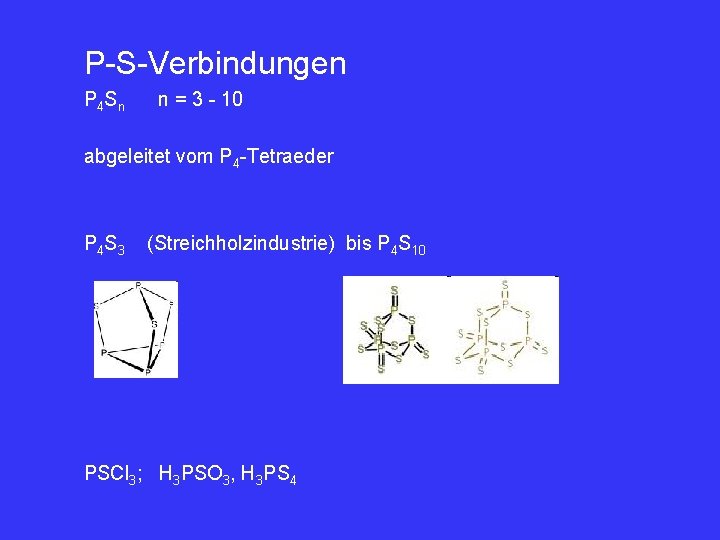
P-S-Verbindungen P 4 Sn n = 3 - 10 abgeleitet vom P 4 -Tetraeder P 4 S 3 (Streichholzindustrie) bis P 4 S 10 PSCl 3; H 3 PSO 3, H 3 PS 4

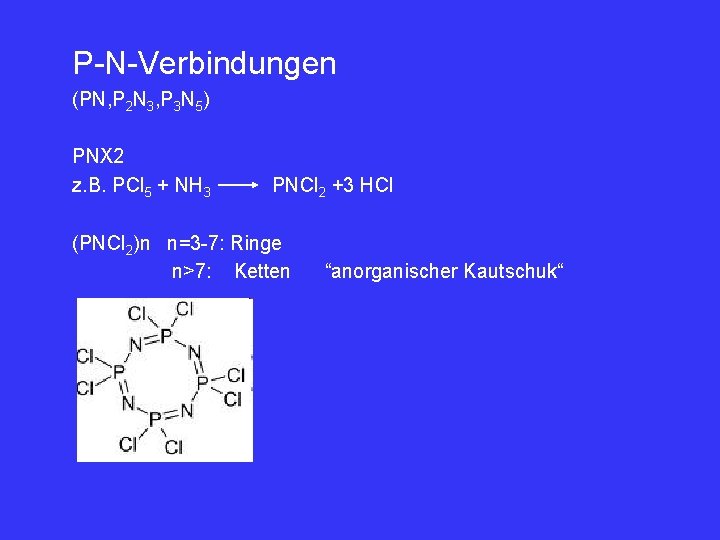
P-N-Verbindungen (PN, P 2 N 3, P 3 N 5) PNX 2 z. B. PCl 5 + NH 3 PNCl 2 +3 HCl (PNCl 2)n n=3 -7: Ringe n>7: Ketten “anorganischer Kautschuk“

As, Sb, Bi VORKOMMEN selten gediegenes As, Sb, Bi hauptsächlich Arsenide und Antimonide als Sulfide z. B. As 4 S 6 Auripigment As 4 S 4 Realgar Sb 2 S 3 Grauspießglanz Bi 2 S 3 Wismutglanz Als Oxide z. B. As 4 O 6 Arsenikblüte Bi 2 O 3 Wismutocker

• As, Sb, Bi Eigenschaften: Metallischer Charakter nimmt vom As zum Bi zu Gelbes As geht beim Erwärmen oder Belichten in amorphes schwarzes As und Sb in eine stabile metallische Form über (Bi nur in metallischer Form) Rhomboedrisch; Schichtstruktur! Dampf: As 4; Sb 2, Sb 4 mit stark oxidierenden Säuren: As H 3 As. O 4; Sb “H 3 Sb. O 4“ mit weniger stark oxidierenden Säuren: As H 3 As. O 3; Sb “H 3 Sb. O 3“ Bi Bi 3+ Salze!

• As, Sb, Bi Verwendung As in Legierungen (Schrottkugeln) 0, 5% As in Pb As-Verbindungen in der Chemotherapie und Schädlingsbekämpfung Sb in Legierungen Lettermetall (85%Pb, 15%Sb, 3%Sn) Britanniametall (88 -90% Sn, 7 -20 Sb Rest Cu) Lagermetalle (z. B 50 -90% Sn, 7 -20 Sb Rest Cu) Bi in niedrigschmelzenden Legierungen z. B Woodsches Metall Fp=70°C (4 T Bi, 2 T Pb, 1 T Sn, 1 T Cd) Bi- Verbindungen für medizinische und kosmetische Zwecke

As. H 3 Sb. H 3 Bi. H 3 giftige übelriechende Gase; Beständikeit nimmt vom As zum Bi ab Mg 3 X 2 + 6 HCl 3 Mg. Cl 2 + 2 XH 3 Marsh`sche Arsenprobe Zn + H 2 SO 4 Zn. SO 4 + 2<H> /*3 H 3 As. O 3 + 6<H> As. H 3 + 3 H 2 O Verbrennung von As. H 3 bei Sauerstoffmangel: As. H 3 + 3 O 2 4 As + 6 H 2 O “Arsenspiegel“ Bei Sauerstoffüberschuß: 4 As. H 3 + 6 O 2 As 4 O 6 + 6 H 2 O




 Halogene reaktionsfähigkeit
Halogene reaktionsfähigkeit Bauxitvorkommen
Bauxitvorkommen Kupfer vorkommen
Kupfer vorkommen Als anna abends
Als anna abends Trein van het leven
Trein van het leven Tina klügel
Tina klügel Deutsch als plurizentrische sprache
Deutsch als plurizentrische sprache Wat is een spierfibril
Wat is een spierfibril Gestalt in film
Gestalt in film Libre office als pdf speichern
Libre office als pdf speichern Konjunktionen als
Konjunktionen als Lusi als store
Lusi als store Als de here het huis niet bouwt
Als de here het huis niet bouwt Wellensittich und spatzen
Wellensittich und spatzen Als algoritmo
Als algoritmo Embacher franz
Embacher franz Grssen
Grssen Hdi als arbeitgeber
Hdi als arbeitgeber Partizip 1 als nomen
Partizip 1 als nomen Hauskanalsanierung
Hauskanalsanierung Zeven tienduizendsten als kommagetal
Zeven tienduizendsten als kommagetal Private als courses
Private als courses Der mensch als mängelwesen
Der mensch als mängelwesen Inge liebel-fryszer
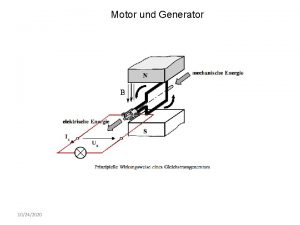
Inge liebel-fryszer Schrittmotor generator
Schrittmotor generator Pept exam paper
Pept exam paper Feuer freund und feind
Feuer freund und feind Als algoritmo
Als algoritmo Als disease
Als disease Bruch als teil mehrerer ganzer
Bruch als teil mehrerer ganzer Csu als algorithm
Csu als algorithm Thomsonsche schwingungsgleichung herleitung
Thomsonsche schwingungsgleichung herleitung Gesten sagen mehr als tausend worte
Gesten sagen mehr als tausend worte Welches lied sangen die engel in der heiligen nacht
Welches lied sangen die engel in der heiligen nacht Starten als arts
Starten als arts Geoökozonen
Geoökozonen Ich mag dich weil
Ich mag dich weil Healthy living als module
Healthy living als module Partizip 2 als attribut
Partizip 2 als attribut Als ziekte
Als ziekte Global player vw
Global player vw Dr lichtenstern pocking
Dr lichtenstern pocking Die indefinitpronomen
Die indefinitpronomen Linee guida als
Linee guida als Aesp
Aesp Als gott die frau erschuf
Als gott die frau erschuf Mireille keller
Mireille keller Als
Als Notengebung oberstufe
Notengebung oberstufe Als internet
Als internet Als precoce
Als precoce Als apex
Als apex Als algoritmo
Als algoritmo Als ik kon toveren
Als ik kon toveren Als assist
Als assist Geef vrede heer, geef vrede bladmuziek
Geef vrede heer, geef vrede bladmuziek Stødbare rytmer
Stødbare rytmer Besser zweimal fragen als einmal irre gehen
Besser zweimal fragen als einmal irre gehen Als chemistry formula
Als chemistry formula Widerstand als sicherung
Widerstand als sicherung Hond als bedrijfskosten
Hond als bedrijfskosten Fußball als religion referat
Fußball als religion referat Als erstes groß oder klein
Als erstes groß oder klein Rns60 als
Rns60 als Linz bundesland
Linz bundesland Als ze me zoeken dan ben ik snoeken
Als ze me zoeken dan ben ik snoeken Outlook besser nutzen
Outlook besser nutzen Of als onderschikkend voegwoord
Of als onderschikkend voegwoord Sluwe sjaantje sloeg de slome
Sluwe sjaantje sloeg de slome Kleiner espresso
Kleiner espresso Ssalr approach lights
Ssalr approach lights Als gott die frau erschuf
Als gott die frau erschuf Ernst ludwig kirchner zelfportret als soldaat
Ernst ludwig kirchner zelfportret als soldaat Deutsch als unterrichtssprache
Deutsch als unterrichtssprache Wetter 3de
Wetter 3de Transition als ko-konstruktiver prozess
Transition als ko-konstruktiver prozess Schulabschluss kfz mechatroniker
Schulabschluss kfz mechatroniker Programacin
Programacin Bulbaris paresis
Bulbaris paresis Inhaltsbezogene grammatik
Inhaltsbezogene grammatik Rytmy do defibrylacji
Rytmy do defibrylacji Als
Als Als algorithm
Als algorithm Besser schlecht gefahren als gut gelaufen
Besser schlecht gefahren als gut gelaufen ニューロン
ニューロン Ifp-transitionsmodell
Ifp-transitionsmodell Difference between education and literacy
Difference between education and literacy Wahlplakate für klassensprecher
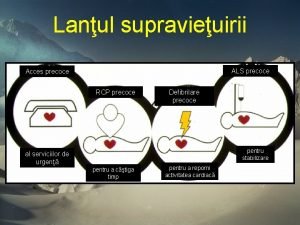
Wahlplakate für klassensprecher Reversible årsager til hjertestop
Reversible årsager til hjertestop Een leven zonder dromen is als een tuin zonder bloemen
Een leven zonder dromen is als een tuin zonder bloemen Welk getal ligt precies in het midden
Welk getal ligt precies in het midden Buch als quelle angeben
Buch als quelle angeben Als a wenn
Als a wenn Bmv ambu
Bmv ambu Als dank für nicht bewiesene waffenbrüderschaft
Als dank für nicht bewiesene waffenbrüderschaft Akk pronomen
Akk pronomen Hoe ik ook denk een mooier geschenk
Hoe ik ook denk een mooier geschenk