INTRODUCTION LA CRISTALLOGRAPHIE La structure cristalline des mtaux


































- Slides: 89

INTRODUCTION À LA CRISTALLOGRAPHIE

La structure cristalline (des métaux) L’ état cristallin: Modèle du solide parfait le plus ordonné possible 3ème principe de la thermodynamique : S = 0 J à 0 K

La structure cristalline (des métaux) L’ état cristallin : Modèle du solide parfait le plus ordonné possible 3ème principe de la thermodynamique : S = 0 J à 0 K ◊ Constitué par un arrangement triplement périodique d’entités (atomes, ions, molécules) ◊ Distances interatomiques constantes, formes propres

La structure cristalline (des métaux) L’ état cristallin : Modèle du solide parfait le plus ordonné possible 3ème principe de la thermodynamique : S = 0 J à 0 K ◊ Constitué par un arrangement triplement périodique d’entités (atomes, ions, molécules) ◊ Distances interatomiques constantes, formes propres L’étude de l’organisation interne des entités s’appelle la cristallographie (l'abbé René Just Haüy en 1774)

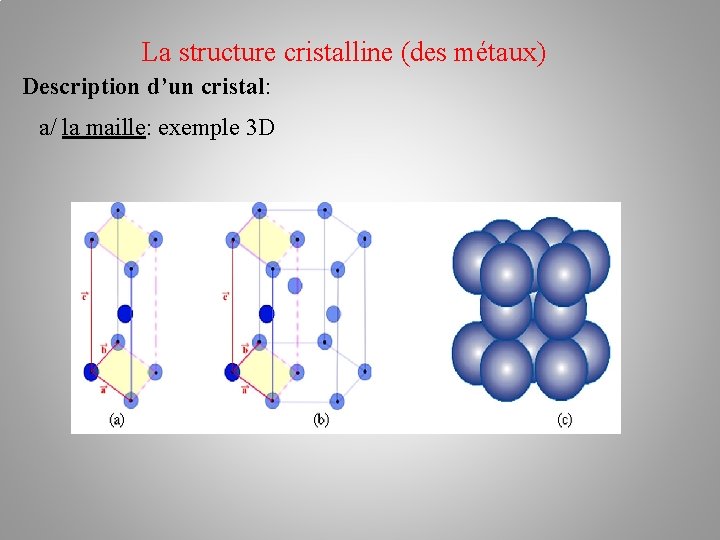
La structure cristalline (des métaux) Description d’un cristal: a/ la maille: C’est l’unité de base à partir de laquelle on peut engendrer tout le cristal en faisant différentes translations suivant les trois axes critallins (Ox, Oy, Oz)

La structure cristalline (des métaux) Description d’un cristal: a/ la maille: C’est l’unité de base à partir de laquelle on peut engendrer tout le cristal en faisant différentes translations suivant les trois axes critallins (Ox, Oy, Oz)

La structure cristalline (des métaux) Description d’un cristal: a/ la maille: C’est l’unité de base à partir de laquelle on peut engendrer tout le cristal en faisant différentes translations suivant les trois axes critallins (Ox, Oy, Oz) Le plus simple : un parallélépipède de sommet A, B, C, sur les trois axes (Ox, Oy, Oz). L ‘origine est une entité de la structure tout comme les sommets!

La structure cristalline (des métaux) Description d’un cristal: a/ la maille: C’est l’unité de base à partir de laquelle on peut engendrer tout le cristal en faisant différentes translations suivant les trois axes critallins (Ox, Oy, Oz) Le plus simple : un parallélépipède de sommet A, B, C, sur les trois axes (Ox, Oy, Oz). L ‘origine est une entité de la structure tout comme les sommets! Six paramètres géométriques: OA=a, OB=b, OC=c. , , , trois angles

La structure cristalline (des métaux) Description d’un cristal: a/ la maille: exemple d’une maille 2 D

La structure cristalline (des métaux) Description d’un cristal: a/ la maille: exemple 3 D

La structure cristalline (des métaux) Description d’un cristal: b/ Le réseau: Pour simplifier la description d’un cristal, on remplace les entités par des points géométriques appellés noeuds. Le disposition 3 D de ces noeuds constitue le réseau cristallin.

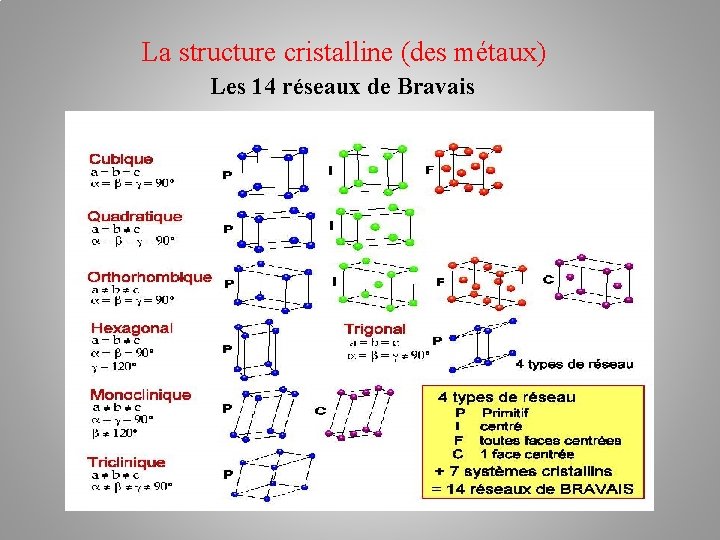
La structure cristalline (des métaux) Les 14 réseaux de Bravais

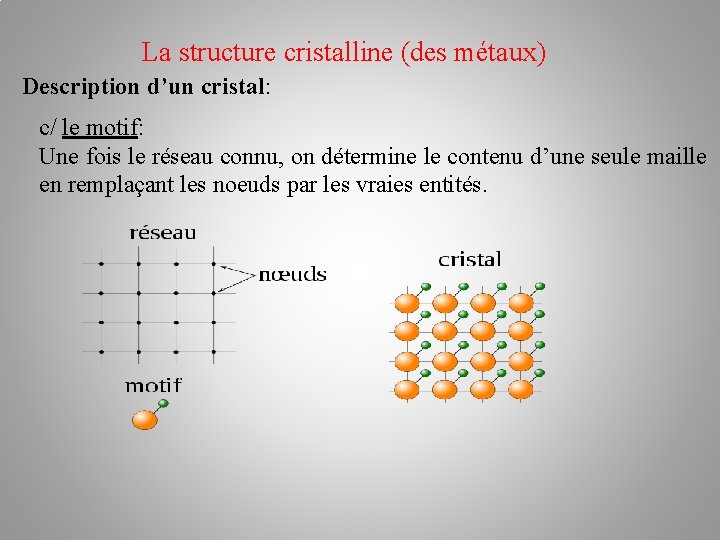
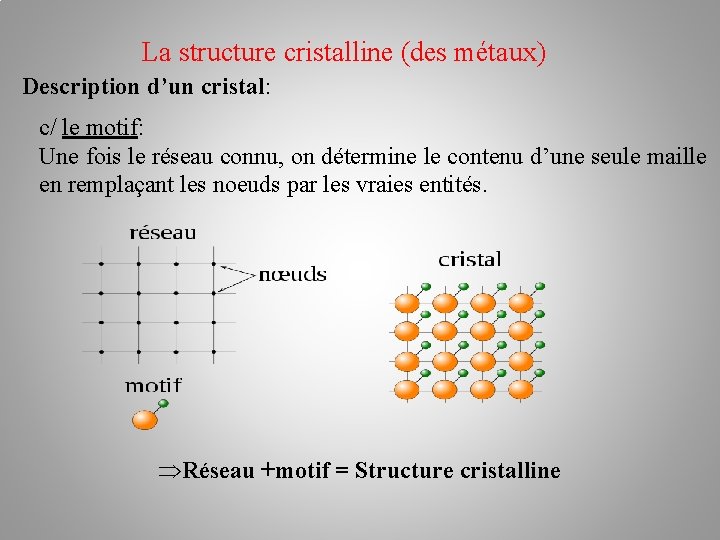
La structure cristalline (des métaux) Description d’un cristal: c/ le motif: Une fois le réseau connu, on détermine le contenu d’une seule maille en remplaçant les noeuds par les vraies entités.

La structure cristalline (des métaux) Description d’un cristal: c/ le motif: Une fois le réseau connu, on détermine le contenu d’une seule maille en remplaçant les noeuds par les vraies entités.

La structure cristalline (des métaux) Description d’un cristal: c/ le motif: Une fois le réseau connu, on détermine le contenu d’une seule maille en remplaçant les noeuds par les vraies entités. Réseau +motif = Structure cristalline

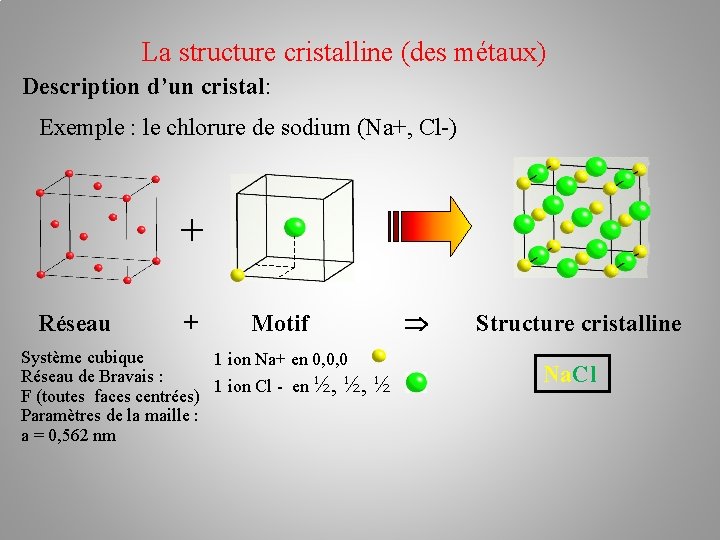
La structure cristalline (des métaux) Description d’un cristal: Exemple : le chlorure de sodium (Na+, Cl-) + Réseau + Motif Système cubique 1 ion Na+ en 0, 0, 0 Réseau de Bravais : 1 ion Cl - en ½, ½, ½ F (toutes faces centrées) Paramètres de la maille : a = 0, 562 nm Structure cristalline Na. Cl

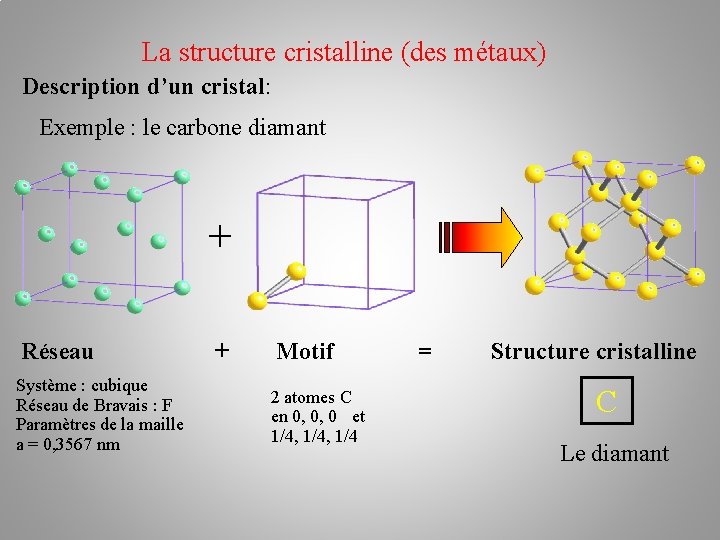
La structure cristalline (des métaux) Description d’un cristal: Exemple : le carbone diamant + Réseau Système : cubique Réseau de Bravais : F Paramètres de la maille a = 0, 3567 nm + Motif 2 atomes C en 0, 0, 0 et 1/4, 1/4 = Structure cristalline C Le diamant

La structure cristalline (des métaux) Remarques : Il existe quatre modèles de cristaux suivant leurs liaisons: Les cristaux métalliques (Fe, Zn, . . ) Les cristaux ioniques (Na. Cl, …) Les cristaux covalents (carbone-diamant, …) Les cristaux moléculaires (la glace III) L’allotropie (du grec allos autre et tropos manière) est la faculté de certains corps simples d’exister sous plusieurs formes cristallines ou moléculaires différentes. Le diamant et le graphite sont des variétés allotropiques du carbone!

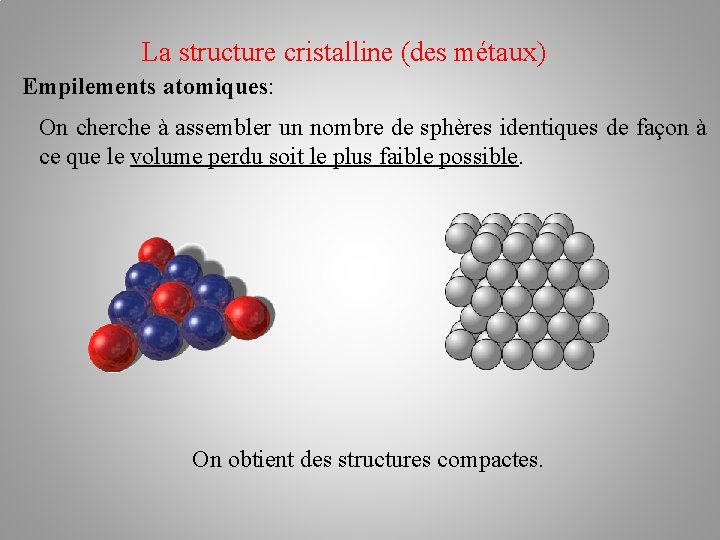
La structure cristalline (des métaux) Empilements atomiques: On cherche à assembler un nombre de sphères identiques de façon à ce que le volume perdu soit le plus faible possible. On obtient des structures compactes.

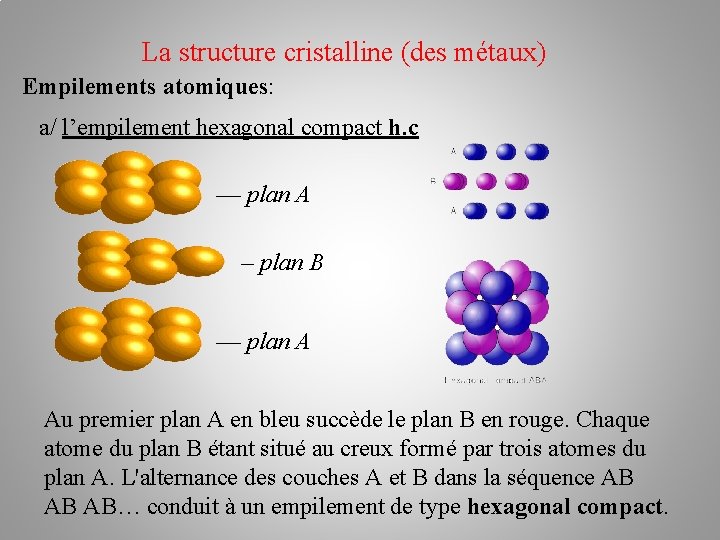
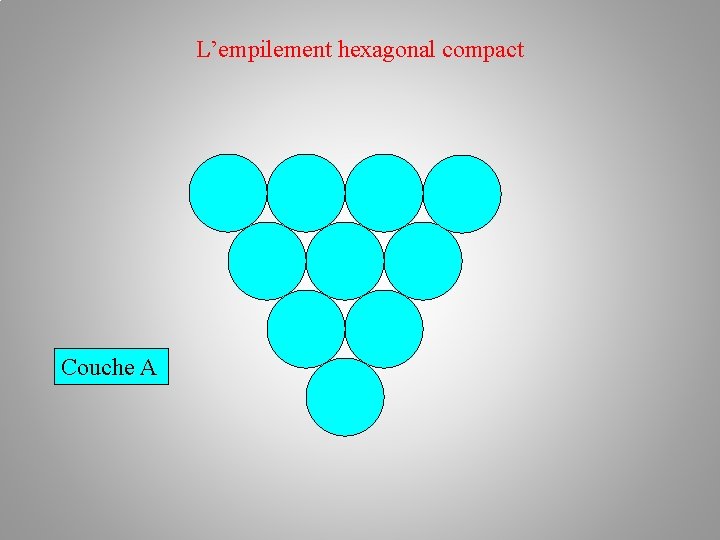
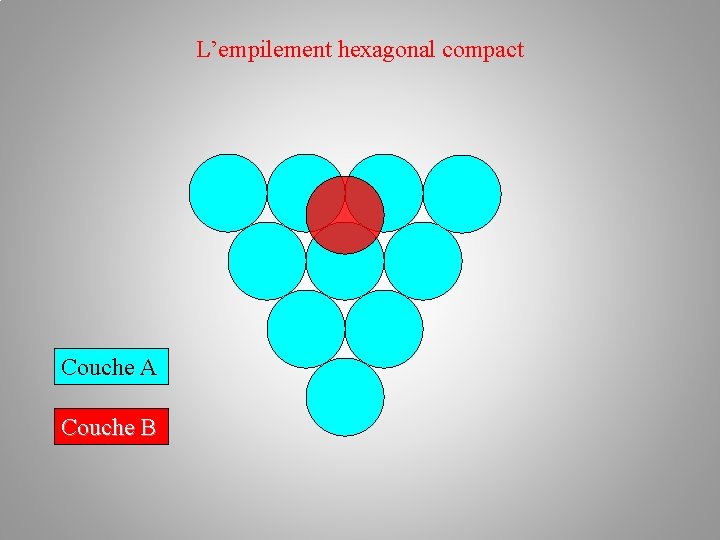
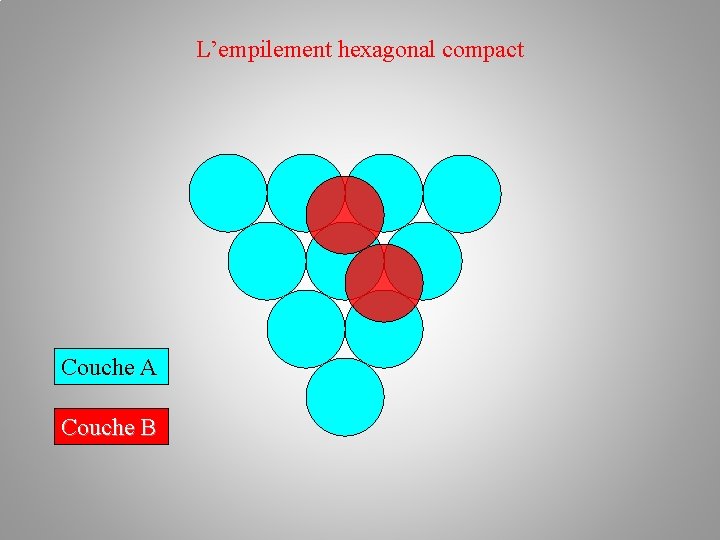
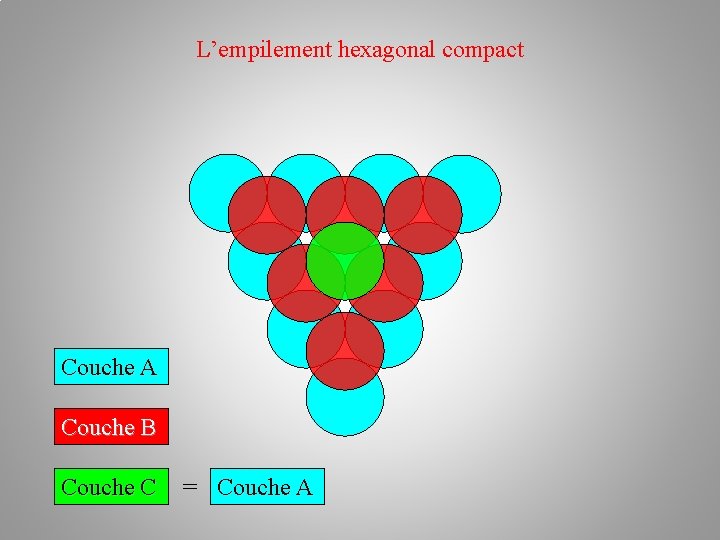
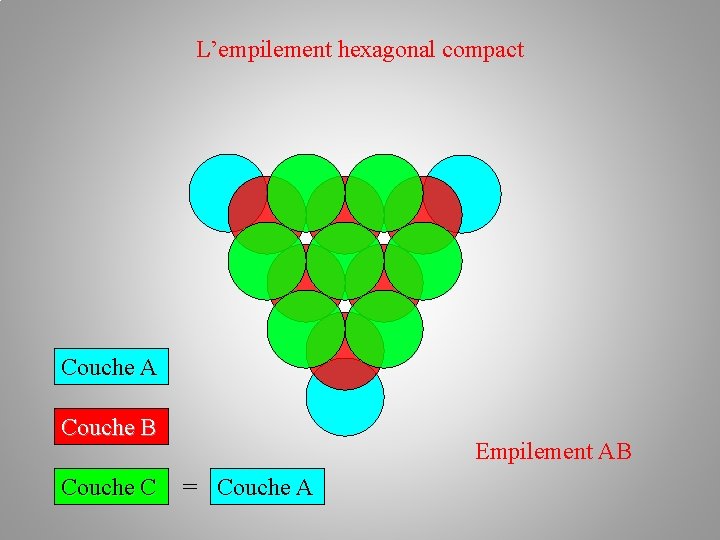
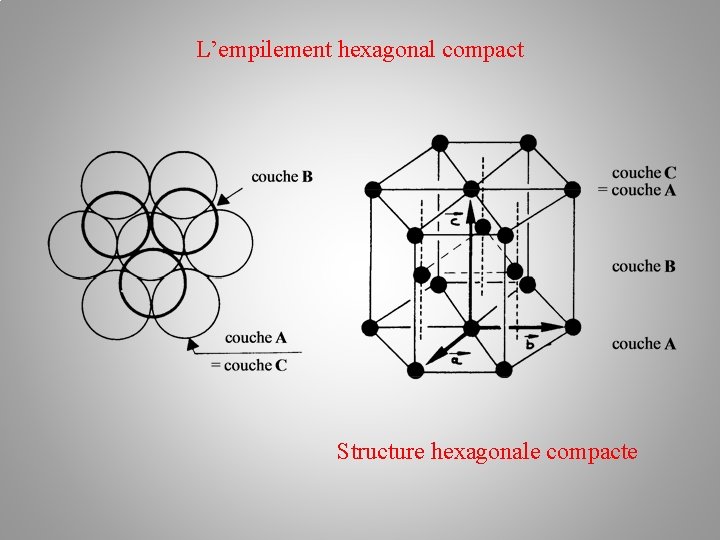
La structure cristalline (des métaux) Empilements atomiques: a/ l’empilement hexagonal compact h. c –– plan A – plan B –– plan A Au premier plan A en bleu succède le plan B en rouge. Chaque atome du plan B étant situé au creux formé par trois atomes du plan A. L'alternance des couches A et B dans la séquence AB AB AB… conduit à un empilement de type hexagonal compact.

L’empilement hexagonal compact Couche A

L’empilement hexagonal compact Couche A

L’empilement hexagonal compact Couche A

L’empilement hexagonal compact Couche A

L’empilement hexagonal compact Couche A

L’empilement hexagonal compact Couche A Couche B

L’empilement hexagonal compact Couche A Couche B

L’empilement hexagonal compact Couche A Couche B

L’empilement hexagonal compact Couche A Couche B

L’empilement hexagonal compact Couche A Couche B Couche C = Couche A

L’empilement hexagonal compact Couche A Couche B Couche C Empilement AB = Couche A

L’empilement hexagonal compact Structure hexagonale compacte

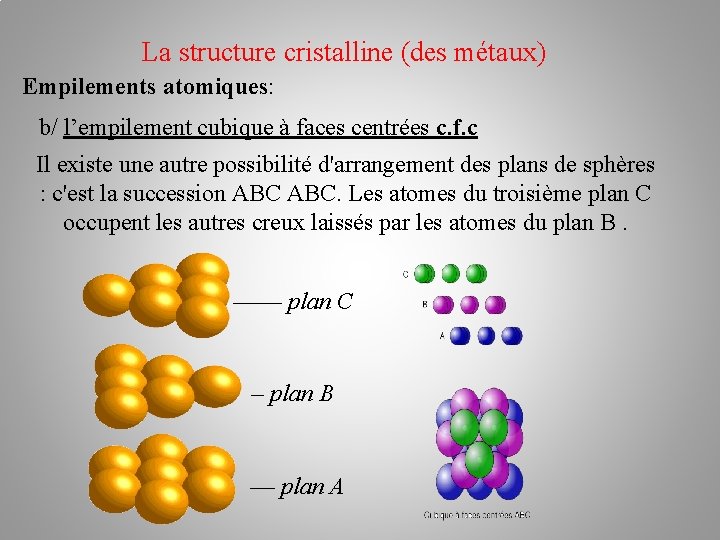
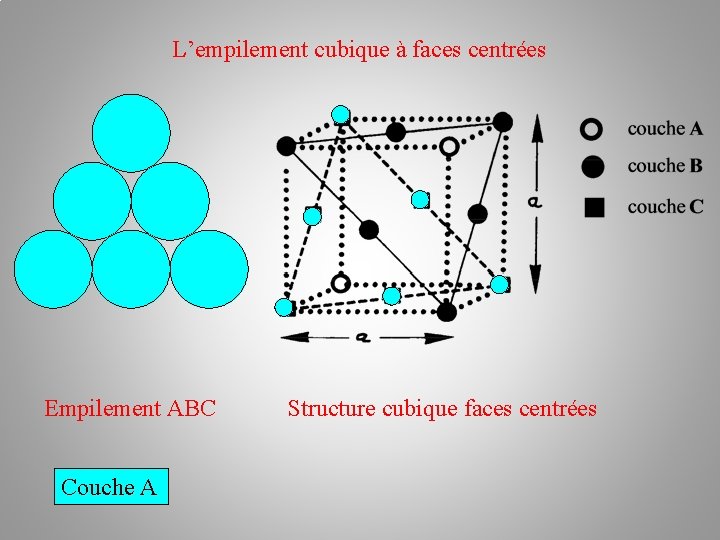
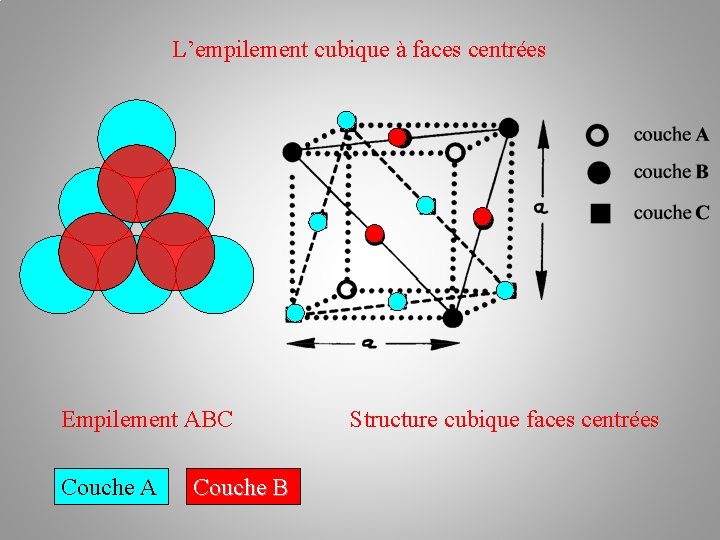
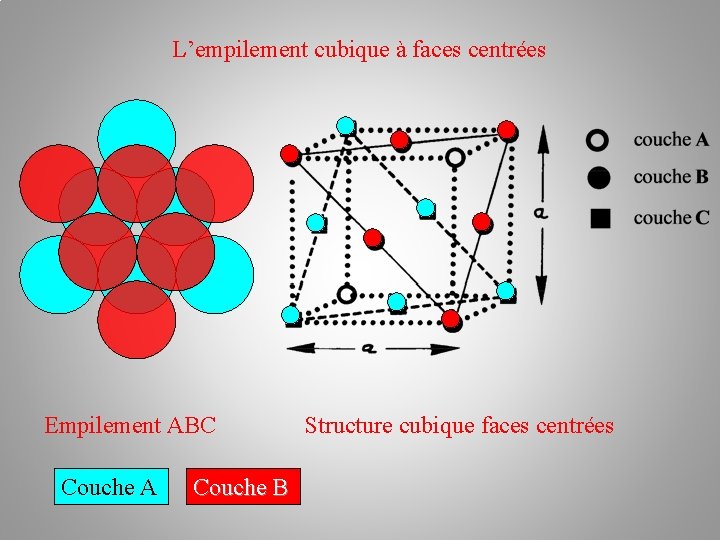
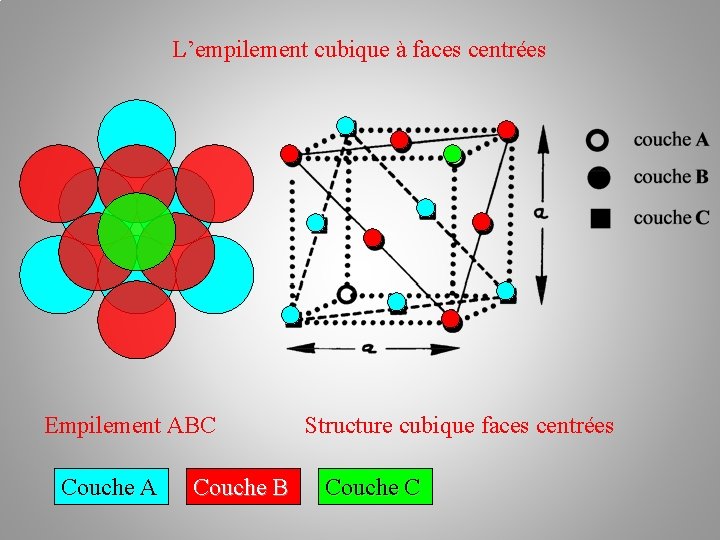
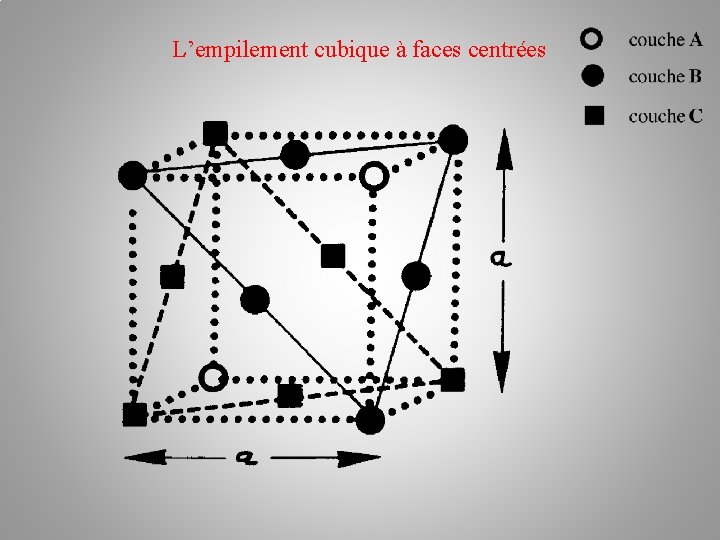
La structure cristalline (des métaux) Empilements atomiques: b/ l’empilement cubique à faces centrées c. f. c Il existe une autre possibilité d'arrangement des plans de sphères : c'est la succession ABC. Les atomes du troisième plan C occupent les autres creux laissés par les atomes du plan B. –––– plan C – plan B –– plan A

L’empilement cubique à faces centrées Couche A

L’empilement cubique à faces centrées Couche A Couche B

L’empilement cubique à faces centrées Couche A Couche B Couche C = Couche A

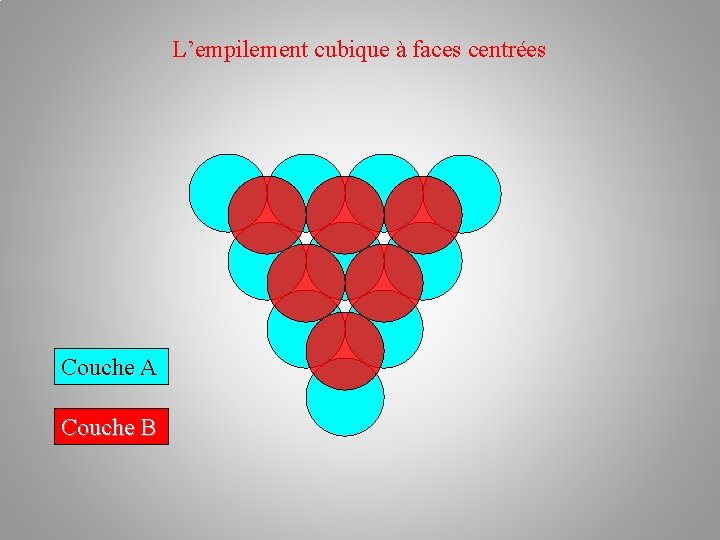
L’empilement cubique à faces centrées Couche A Couche B Couche C ≠ Couche A

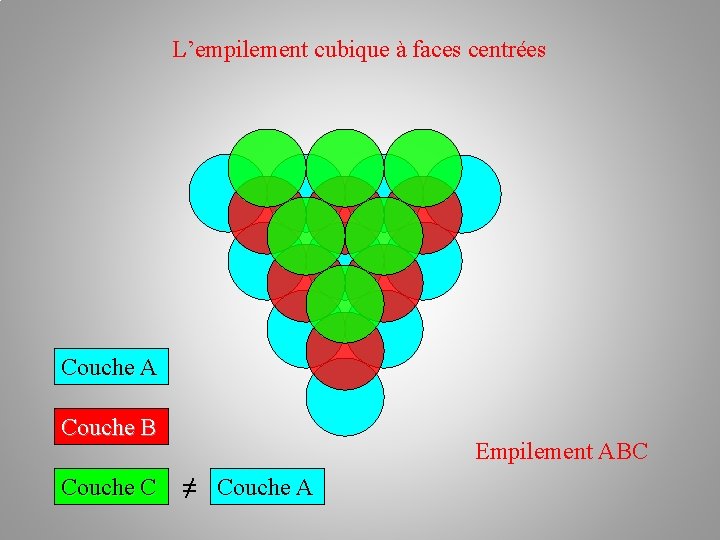
L’empilement cubique à faces centrées Couche A Couche B Couche C Empilement ABC ≠ Couche A

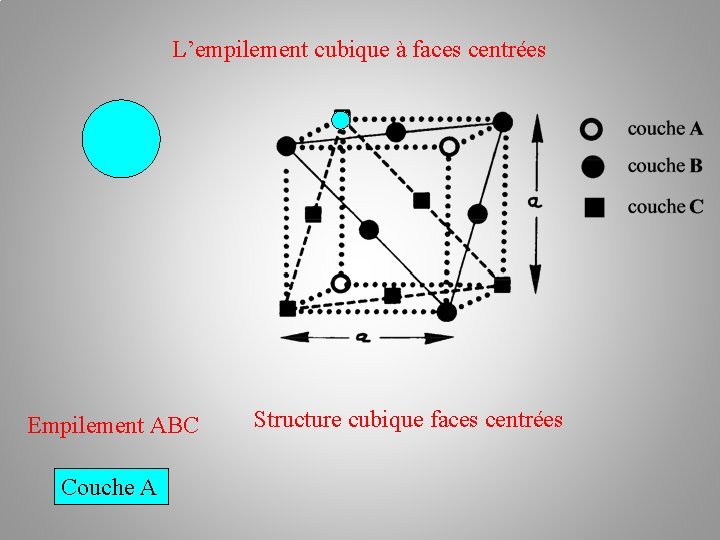
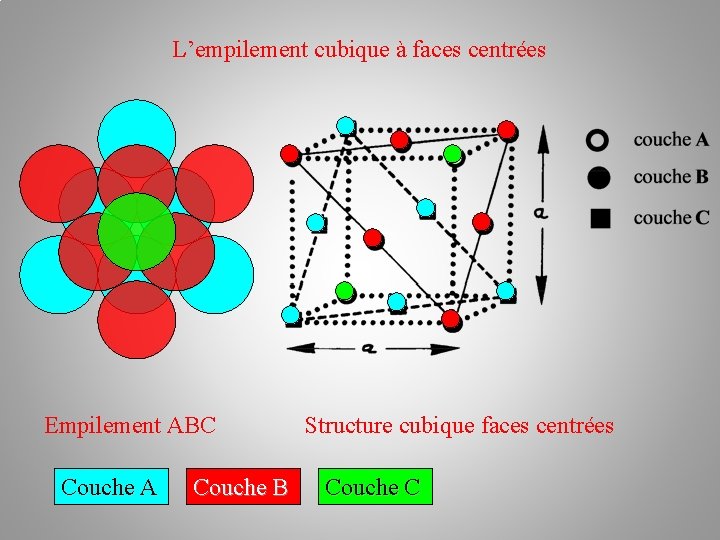
L’empilement cubique à faces centrées Empilement ABC Couche A Structure cubique faces centrées

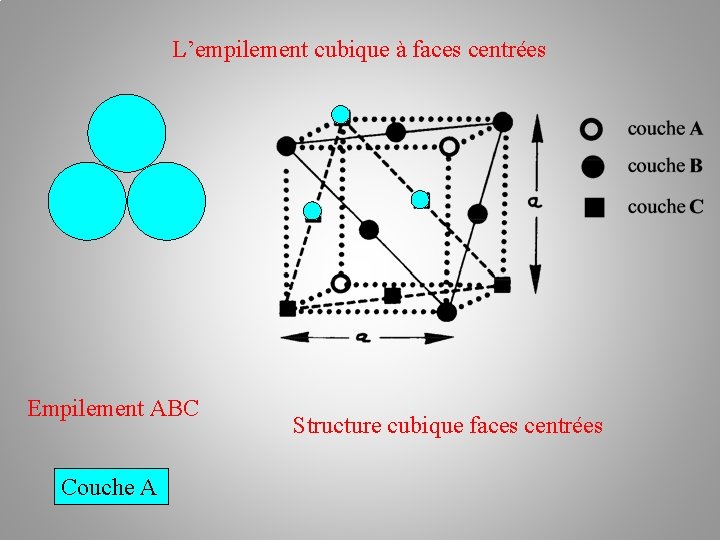
L’empilement cubique à faces centrées Empilement ABC Couche A Structure cubique faces centrées

L’empilement cubique à faces centrées Empilement ABC Couche A Structure cubique faces centrées

L’empilement cubique à faces centrées Empilement ABC Couche A Couche B Structure cubique faces centrées

L’empilement cubique à faces centrées Empilement ABC Couche A Couche B Structure cubique faces centrées

L’empilement cubique à faces centrées Empilement ABC Couche A Couche B Structure cubique faces centrées

L’empilement cubique à faces centrées Empilement ABC Couche A Couche B Structure cubique faces centrées Couche C

L’empilement cubique à faces centrées Empilement ABC Couche A Couche B Structure cubique faces centrées Couche C

L’empilement cubique à faces centrées

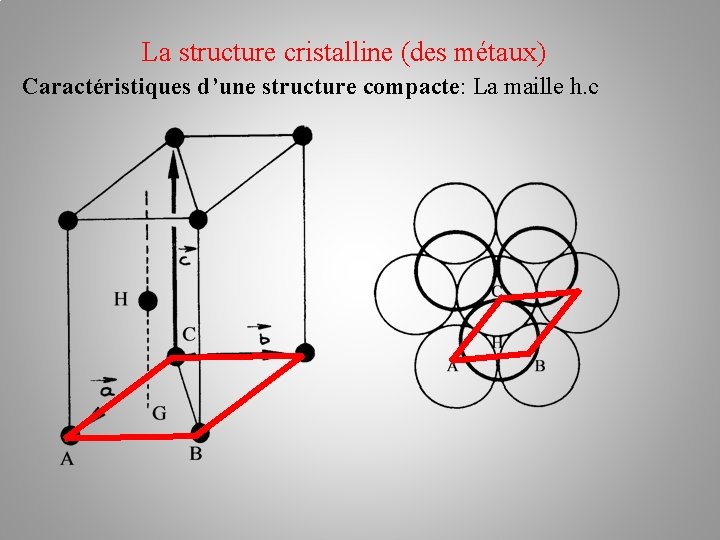
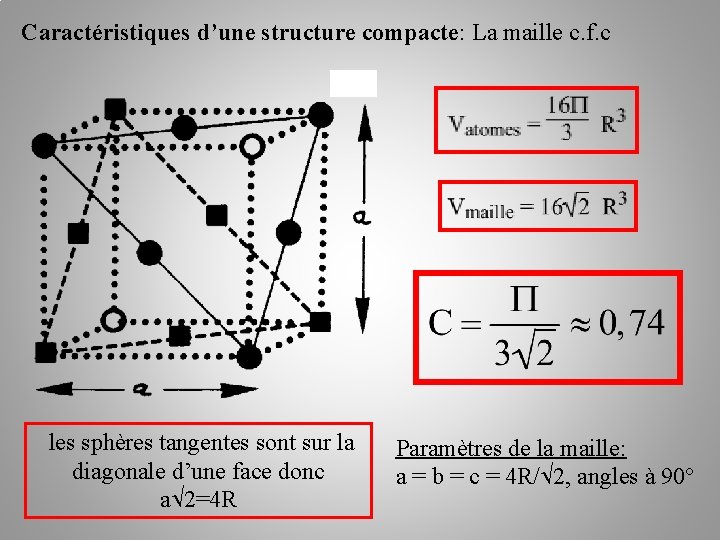
La structure cristalline (des métaux) Caractéristiques d’une structure compacte: - La coordinence: c’est le nombre de plus proches voisins d’une sphère quelconque. Les voisins étant les sphères tangentes. Dans une structure compacte elle est de 12 - La compacité: c’est le rapport du volume des atomes de la maille sur le volume de la maille.

La structure cristalline (des métaux) Caractéristiques d’une structure compacte: La maille h. c

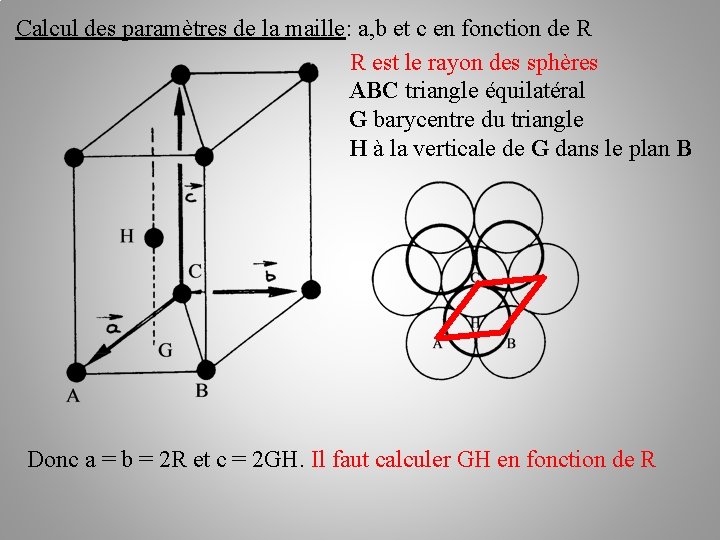
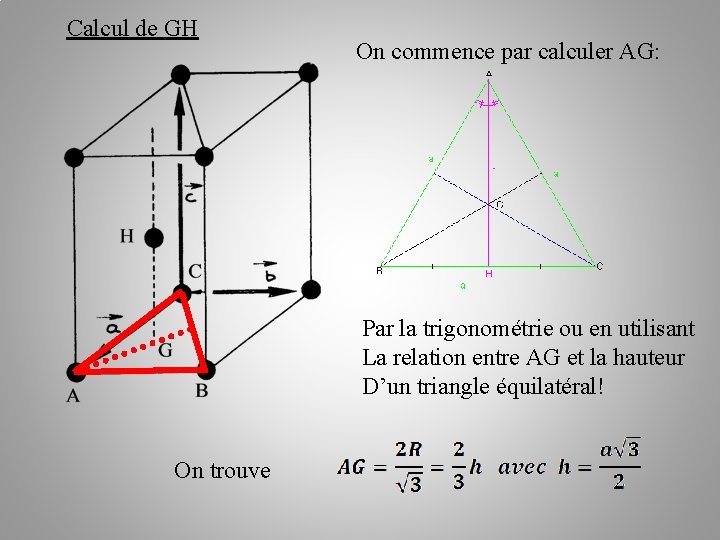
Calcul des paramètres de la maille: a, b et c en fonction de R R est le rayon des sphères ABC triangle équilatéral G barycentre du triangle H à la verticale de G dans le plan B Donc a = b = 2 R et c = 2 GH. Il faut calculer GH en fonction de R

Calcul de GH On commence par calculer AG: Par la trigonométrie ou en utilisant La relation entre AG et la hauteur D’un triangle équilatéral! On trouve

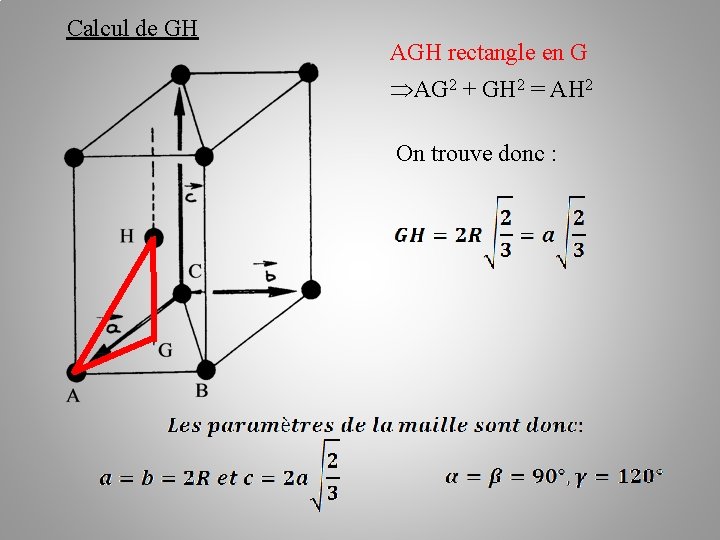
Calcul de GH AGH rectangle en G AG 2 + GH 2 = AH 2 On trouve donc :

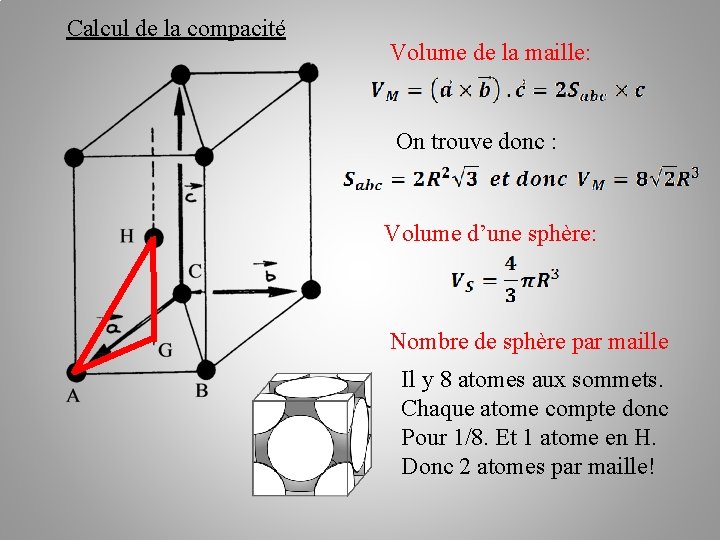
Calcul de la compacité Volume de la maille: On trouve donc : Volume d’une sphère: Nombre de sphère par maille Il y 8 atomes aux sommets. Chaque atome compte donc Pour 1/8. Et 1 atome en H. Donc 2 atomes par maille!

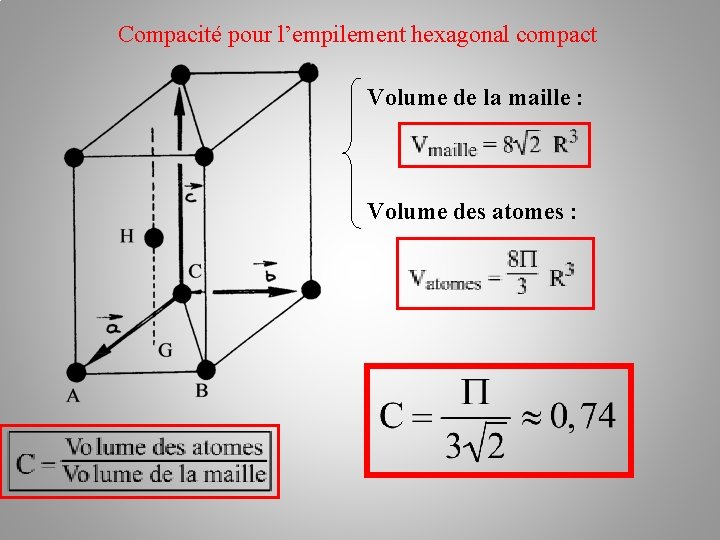
Compacité pour l’empilement hexagonal compact Volume de la maille : Volume des atomes :

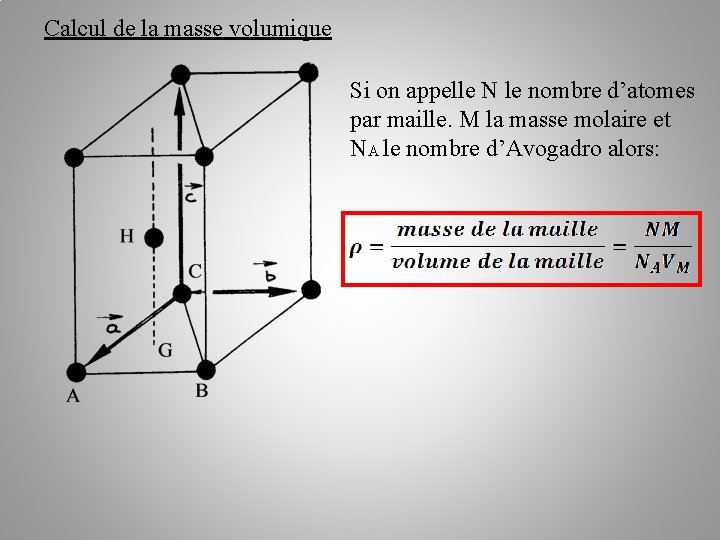
Calcul de la masse volumique Si on appelle N le nombre d’atomes par maille. M la masse molaire et NA le nombre d’Avogadro alors:

Caractéristiques d’une structure compacte: La maille c. f. c les sphères tangentes sont sur la diagonale d’une face donc a 2=4 R Paramètres de la maille: a = b = c = 4 R/ 2, angles à 90°

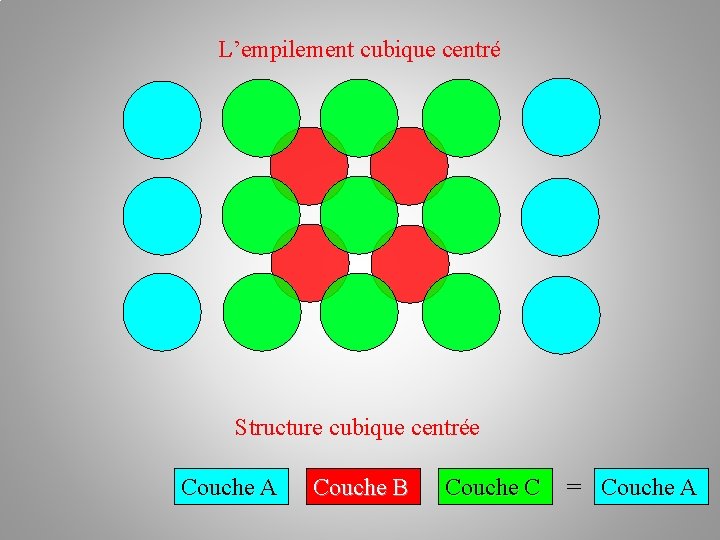
L’empilement cubique centré Structure cubique centrée Couche A Couche B Couche C = Couche A

Caractéristiques d’une structure pseudo-compacte: La maille cubique centrée c. c Attention cette fois les sphères tangentes sont sur la diagonale du cube donc a 3=4 R Paramètres de la maille: a = b = c = 4 R/ 3, angles à 90°

La coordinence des structures compactes est de 12. Celle de la maille cubique centrée est de 8! Existence de sites d’insertion: La compacité étant inférieure à 1, il reste de l’espace inoccupé. Des atomes plus petits peuvent venir s’insérer. On parle de solution solide d’insertion SSI. Il existe deux types de sites dans les structures compactes: -Le site tétraèdrique: cavité au centre d’un tétraèdre régulier de 4 atomes de la maille au contact. -Le site octaèdrique: cavité au centre d’un octaèdre régulier de 6 atomes au contact.

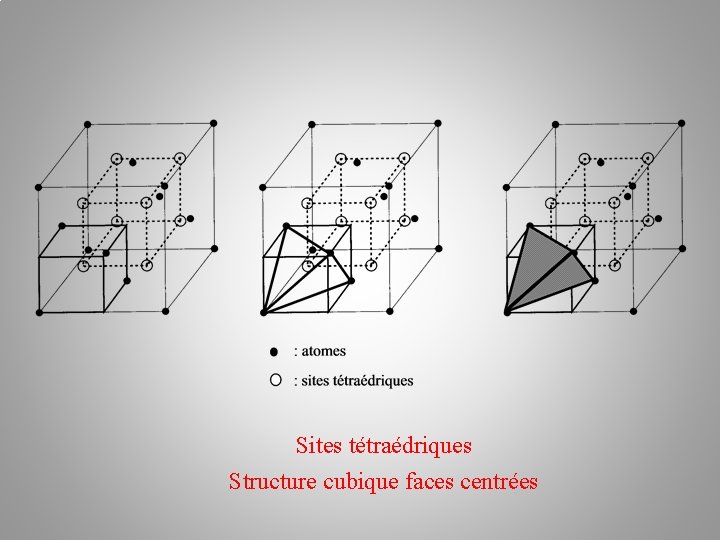
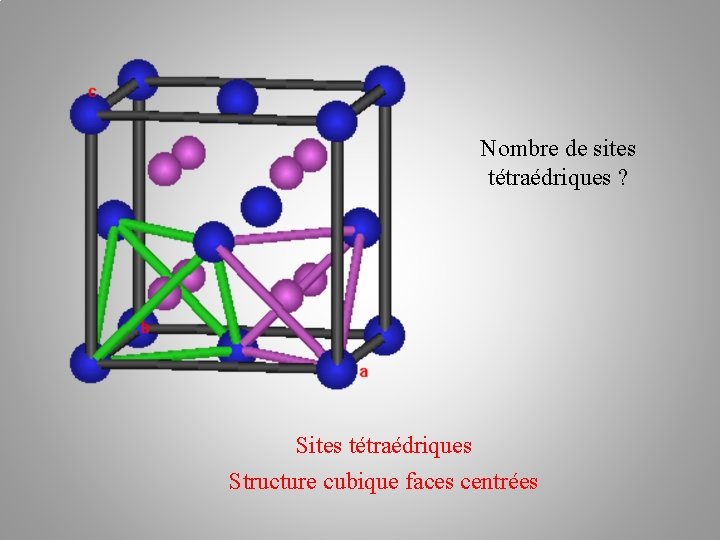
Sites tétraédriques Structure cubique faces centrées

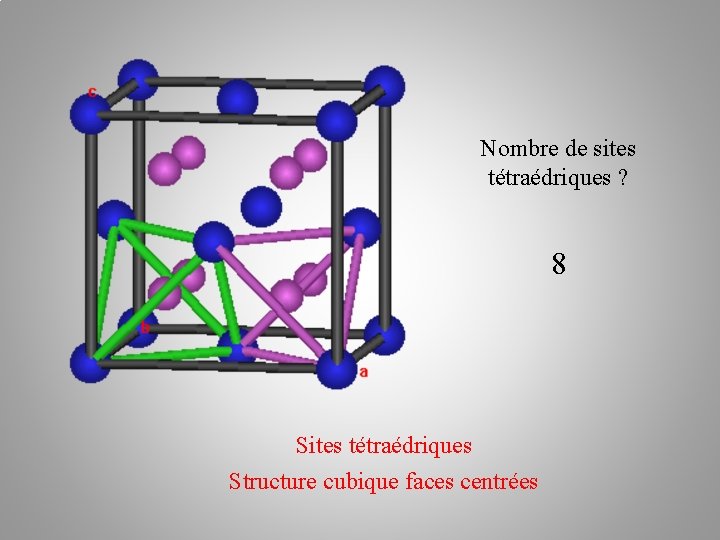
Nombre de sites tétraédriques ? Sites tétraédriques Structure cubique faces centrées

Nombre de sites tétraédriques ? 8 Sites tétraédriques Structure cubique faces centrées

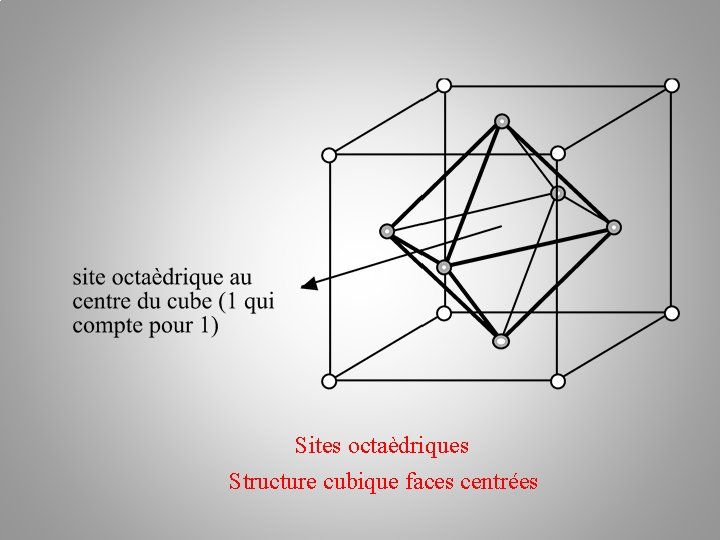
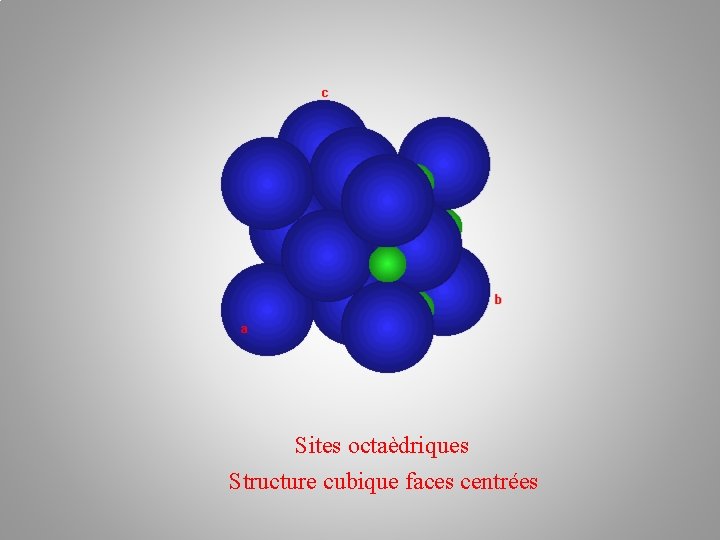
Sites octaèdriques Structure cubique faces centrées

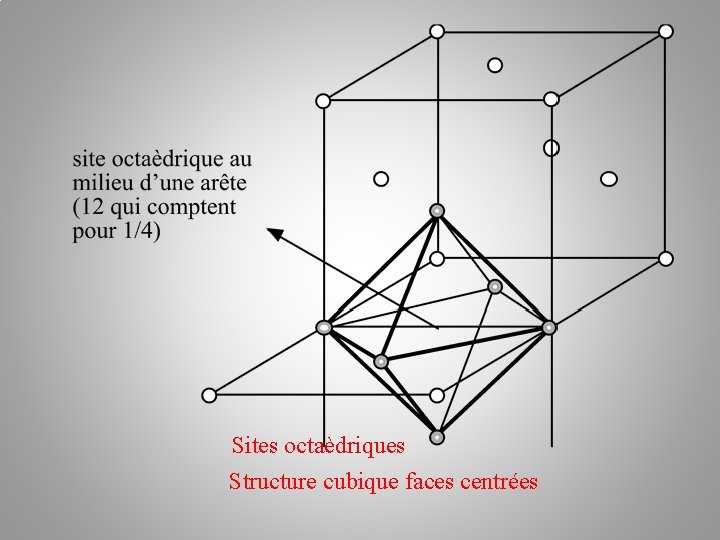
Sites octaèdriques Structure cubique faces centrées

Nombre de sites octaédriques ? 1 + 12*1/4 = 4 Sites octaèdriques Structure cubique faces centrées

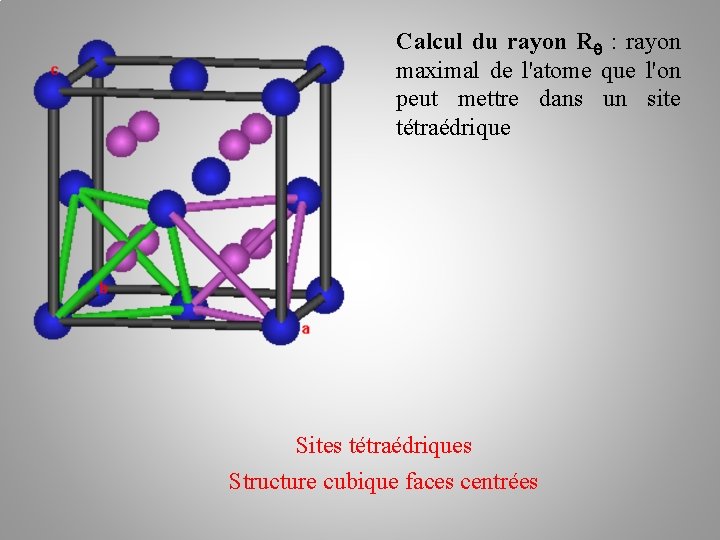
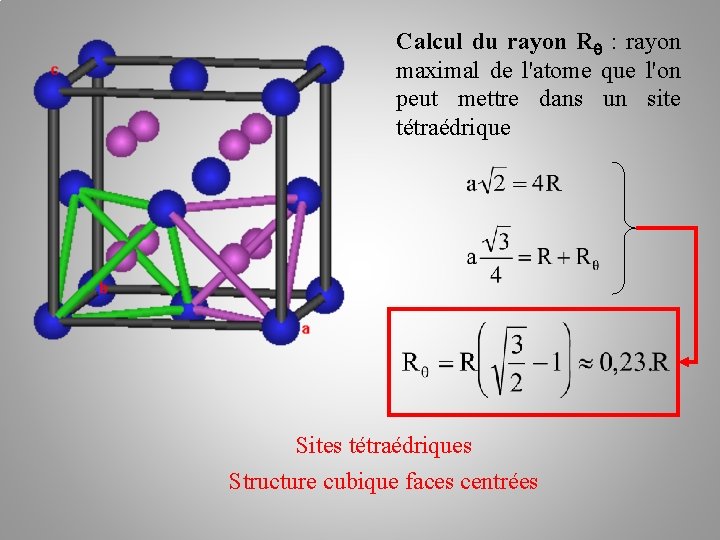
Calcul du rayon R : rayon maximal de l'atome que l'on peut mettre dans un site tétraédrique Sites tétraédriques Structure cubique faces centrées

Calcul du rayon R : rayon maximal de l'atome que l'on peut mettre dans un site tétraédrique Sites tétraédriques Structure cubique faces centrées

Sites tétraédriques Structure cubique faces centrées

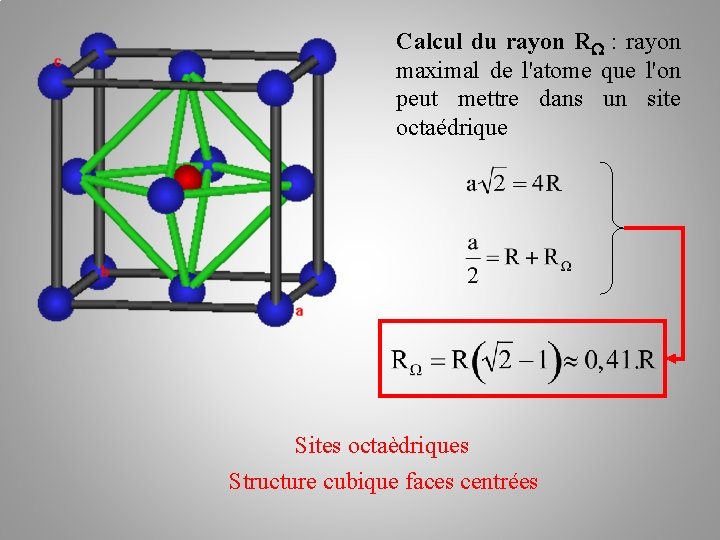
Calcul du rayon R : rayon maximal de l'atome que l'on peut mettre dans un site octaédrique Sites octaèdriques Structure cubique faces centrées

Sites octaèdriques Structure cubique faces centrées

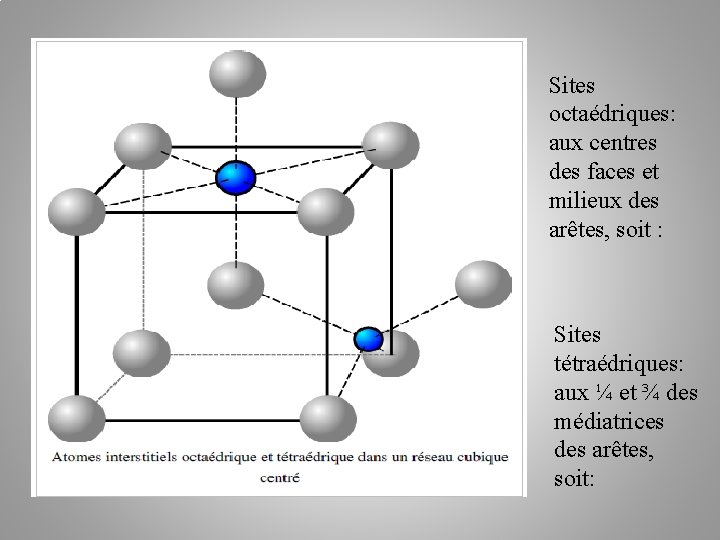
Sites octaédriques: aux centres des faces et milieux des arêtes, soit : Sites tétraédriques: aux ¼ et ¾ des médiatrices des arêtes, soit:

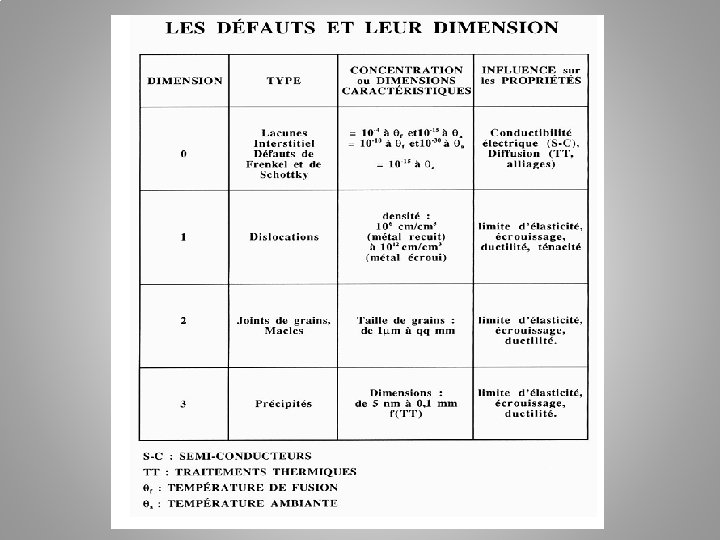
Les défauts cristallins Le cristal parfait est un empilement infini et régulier d'atomes. Mais les cristaux possèdent des défauts. Par rapport à la définition donnée ci-dessus : • le cristal n'est pas infini mais possède des limites, des faces ; • l'empilement n'est pas parfaitement régulier. Ces défauts vont expliquer un grand nombre de propriétés de la matière. Si les cristaux existent, c'est que cet état est ≪favorable ≫. L‘énergie est minimale si les atomes sont a une certaine distance les uns des autres. De même, cette énergie est minimale pour une organisation donnée. Donc, un cristal représente un état d‘énergie minimal. Créer un défaut, c'est aller vers une configuration différente donc avec une énergie plus grande.

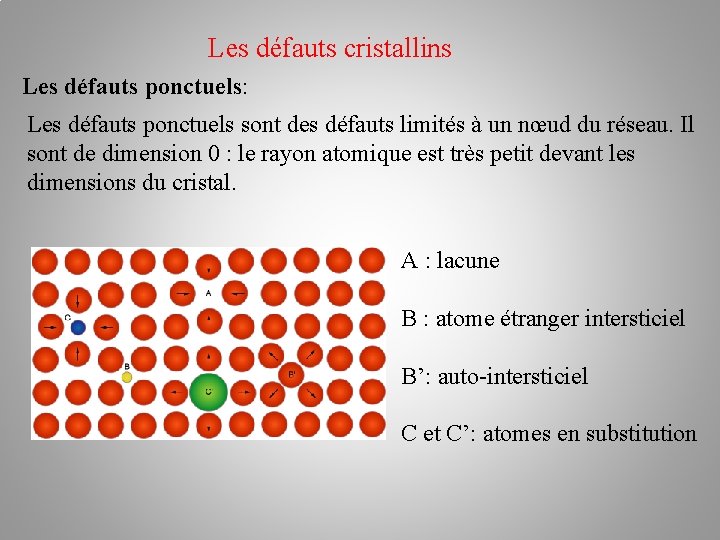
Les défauts cristallins Les défauts ponctuels: Les défauts ponctuels sont des défauts limités à un nœud du réseau. Il sont de dimension 0 : le rayon atomique est très petit devant les dimensions du cristal. A : lacune B : atome étranger intersticiel B’: auto-intersticiel C et C’: atomes en substitution

Les lacunes et les atomes interstitiels permettent d'expliquer la diffusion, c'est-a-dire le déplacement des atomes dans le cristal. Ce sont ces déplacements qui permettent les réactions chimiques en phase solide. Dans la chimie en solution ou en phase gazeuse, les espèces sont mobiles et peuvent donc facilement se rencontrer et réagir, alors qu'en phase solide, les atomes sont ≪figés≫ dans le cristal. Applications : croissance d’une couche d’oxyde, cémentation.


Effets des défauts ponctuels le rubis et le saphir sont tous deux des cristaux de corindon (alumine α, Al 2 O 3) ayant des impuretés différentes. Les traces de chrome donnent la couleur rouge au rubis. fer et titane pour le saphir (bleu) Diffusivité dans les cristaux. Conduction du courant électrique dans les semi-conducteurs et oxydes cristallins.

Les défauts cristallins Les défauts linéaires (dislocations): Les défauts linéaires sont appelés ≪ dislocations ≫. Ce sont des défauts de dimension 1, c'est-a-dire que la largeur des défauts est très petite devant les dimensions du cristal. Ces défauts permettent la déformation élastique et expliquent la déformation plastique. Sans ces dislocations on aurait une limite élastique bien supérieure a ce que l'on mesure. Les dislocations sont des défauts linéaires qui se déplacent le long des plans atomiques. Premières observations (1950) trait vertical = 200 nm

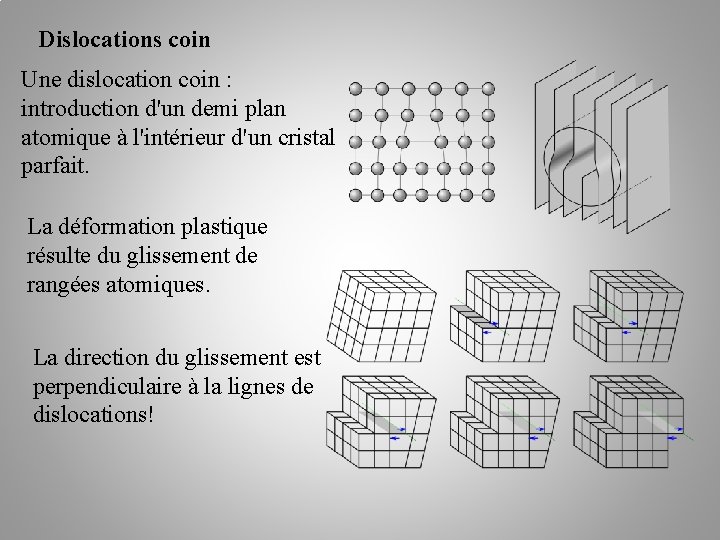
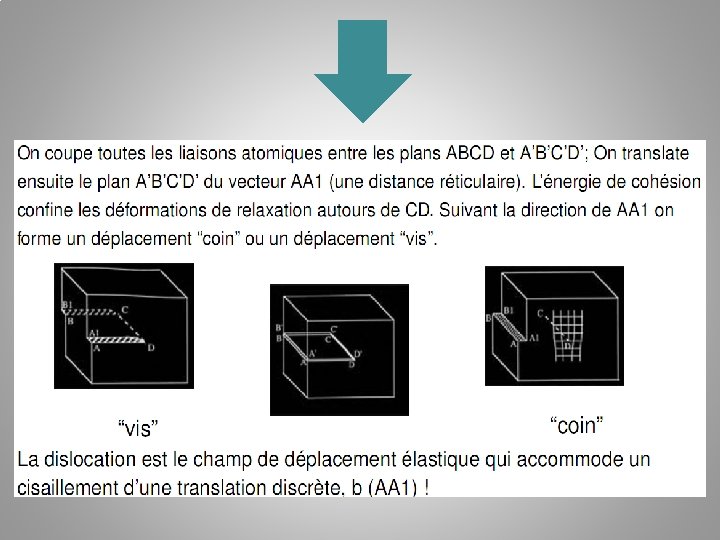
Dislocations coin Une dislocation coin : introduction d'un demi plan atomique à l'intérieur d'un cristal parfait. La déformation plastique résulte du glissement de rangées atomiques. La direction du glissement est perpendiculaire à la lignes de dislocations!

-les dislocations - coins Visualisation du mouvement réel des atomes Lors de la déformation pour une dislocation - coin

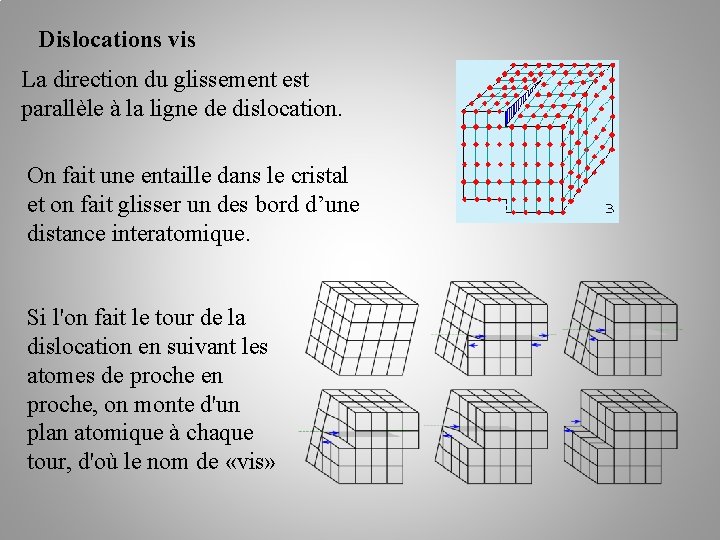
Dislocations vis La direction du glissement est parallèle à la ligne de dislocation. On fait une entaille dans le cristal et on fait glisser un des bord d’une distance interatomique. Si l'on fait le tour de la dislocation en suivant les atomes de proche en proche, on monte d'un plan atomique à chaque tour, d'où le nom de «vis»


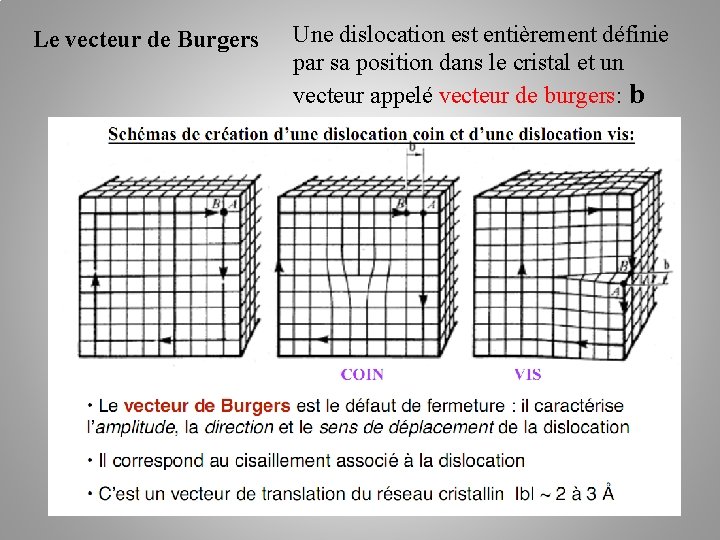
Le vecteur de Burgers Une dislocation est entièrement définie par sa position dans le cristal et un vecteur appelé vecteur de burgers: b


Liaison ionique Liaison métallique Les Métaux sont intrinsèquement ductiles Liaison covalente

Les défauts surfaciques Joints de grain La matière est en général composée de plusieurs cristaux ; on parle de polycristal ≠ monocristal. Sur une pièce d'acier galvanisée : les cristaux de zinc déposés sur l'acier diffusent la lumière différemment ce qui donne des différences de teintes (mm au cm). Les cristaux de l'acier, quant à eux, sont de l'ordre de la dizaine de micromètre (10 -100 μm). La frontière entre les cristaux est appelée « joint de grain » . C'est une surface, donc un défaut de dimension 2.

Joints de grain Deux cristaux voisins ont le même réseau cristallin mais orientés différemment. Le joint de grain est donc une frontière de désorientation. Les cristaux se raccordent aux joints de grain. Il y a donc « plus de place » au niveau d'un joint de grain, en raison des différences des réseaux, que dans le cristal. De fait, on a des propriétés communes avec les dislocations : • les atomes étrangers s'y logent préférentiellement (ségrégation) ; • le déplacement des atomes dans les joints de grain est plus rapide ; ce sont des courts-circuits de diffusion. De manière générale les joints de grain sont à la fois des sources et des pièges pour les défauts ponctuels et les dislocations.

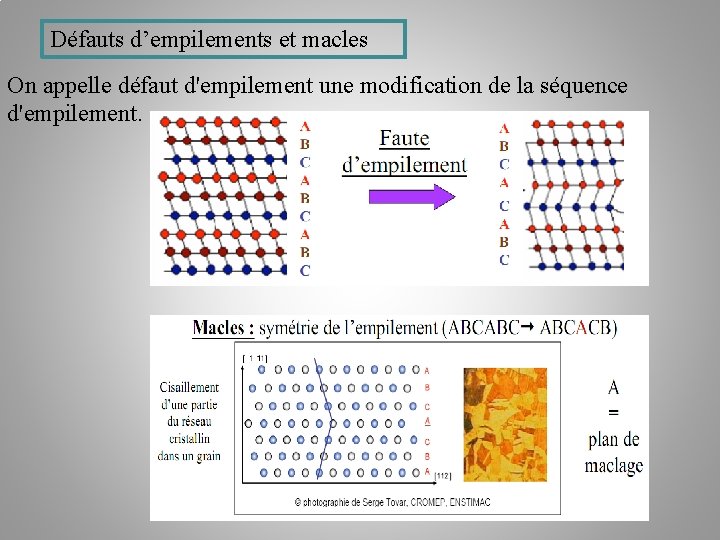
Défauts d’empilements et macles On appelle défaut d'empilement une modification de la séquence d'empilement.

Les défauts tridimensionnels Précipités Particules de 2 nd phase formées par combinaison entre atomes du métal et atomes des éléments d’alliages. Inclusions Impuretés provenant de l’élaboration depuis l’état liquide (généralement sulfures, oxydes ou silicates) Certaines roches ne sont faites que de précipités, dans le sens où il n'y a pas de « cristal majoritaire » . C'est le cas par exemple du granite, où l'on voit trois types de grains en proportion relativement égales : quartz, mica, feldspaths.

 Empilement cubique à faces centrées
Empilement cubique à faces centrées Mode f cristallographie
Mode f cristallographie Plan 111 cfc
Plan 111 cfc Hkl cristallographie
Hkl cristallographie Cours de cristallographie
Cours de cristallographie Des des des
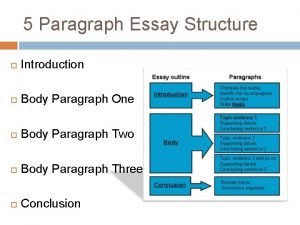
Des des des Intro paragraph outline
Intro paragraph outline La diffusion des idées des lumières
La diffusion des idées des lumières Il existe des personnes qui sont des lumières pour tous
Il existe des personnes qui sont des lumières pour tous Les valeurs du temps verbaux
Les valeurs du temps verbaux Affiche de propagande plan marshall
Affiche de propagande plan marshall Diversification des espaces et des acteurs de la production
Diversification des espaces et des acteurs de la production Volume d un corps
Volume d un corps Volume des liquides et des solides
Volume des liquides et des solides Cartographie des flux de valeur
Cartographie des flux de valeur Je t'offrirai des fleurs et des nappes en couleurs
Je t'offrirai des fleurs et des nappes en couleurs Robin des bois des alpes
Robin des bois des alpes Double des and triple des
Double des and triple des Budget des ventes méthode des moindres carrés
Budget des ventes méthode des moindres carrés Introduction sur la gestion des stocks
Introduction sur la gestion des stocks Structure des opportunités politiques
Structure des opportunités politiques Structure d'une fable de la fontaine
Structure d'une fable de la fontaine Lucifer cipher
Lucifer cipher Structure des ordinateur
Structure des ordinateur Data structures
Data structures Cat introduction structure
Cat introduction structure Capital structure introduction
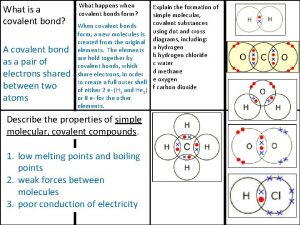
Capital structure introduction What is a covalent bond simple definition
What is a covalent bond simple definition Union myunion structure my structure
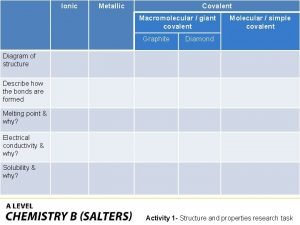
Union myunion structure my structure Ionic covalent metallic
Ionic covalent metallic Surface and deep structure
Surface and deep structure Surface and deep structure
Surface and deep structure S s' 's grammar
S s' 's grammar Zinc oxide + nitric acid → zinc nitrate + water
Zinc oxide + nitric acid → zinc nitrate + water Static data structure
Static data structure Yang merupakan pengertian dari rekaman data adalah
Yang merupakan pengertian dari rekaman data adalah Deep surface structure
Deep surface structure Modelo de besseyre des horts (1990)
Modelo de besseyre des horts (1990) Wurzel nenner rational machen
Wurzel nenner rational machen 2ter hauptsatz der thermodynamik
2ter hauptsatz der thermodynamik Musee des beaux arts analysis
Musee des beaux arts analysis Voyage au pays des maths
Voyage au pays des maths Ionenprodukt des wassers
Ionenprodukt des wassers Transcetolisation
Transcetolisation 24112007
24112007 Lieferverzug schreiben
Lieferverzug schreiben Rondeau du printemps
Rondeau du printemps Dickdarm anatomie
Dickdarm anatomie Cellule d'onodi aspect
Cellule d'onodi aspect Modèle de grille d'évaluation des compétences
Modèle de grille d'évaluation des compétences Violette toussaint
Violette toussaint Phasen des kaufvertrages
Phasen des kaufvertrages La tectonique des plaques - cours
La tectonique des plaques - cours Tableau des grandeurs
Tableau des grandeurs Faculté des sciences exactes constantine
Faculté des sciences exactes constantine Faculté des sciences el jadida
Faculté des sciences el jadida Peur des petit trou
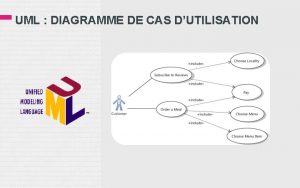
Peur des petit trou Diagramme de cas d utilisation
Diagramme de cas d utilisation Merkmale des jazz
Merkmale des jazz Méthode des stries
Méthode des stries Dar transmissions ciblées
Dar transmissions ciblées Réévaluation légale des immobilisations
Réévaluation légale des immobilisations Prinzip des trainingswirksamen reizes
Prinzip des trainingswirksamen reizes Formation d'un fruit
Formation d'un fruit Tinker vs des moines background
Tinker vs des moines background Tinker vs des moines facts
Tinker vs des moines facts Marbury v madison summary
Marbury v madison summary Comparaison de plusieurs pourcentages
Comparaison de plusieurs pourcentages Tegusõna käändeline vorm
Tegusõna käändeline vorm Plaque continentale et océanique
Plaque continentale et océanique La tectonique des plaques - cours
La tectonique des plaques - cours Methode cump
Methode cump Ecuries des morlots
Ecuries des morlots Unharmonis adalah
Unharmonis adalah Projection stéréographique des 32 groupes ponctuels
Projection stéréographique des 32 groupes ponctuels La trahison des images dictée
La trahison des images dictée Zusammenhang ks und kb wert
Zusammenhang ks und kb wert Metrorragie des vierges
Metrorragie des vierges Besoins non fonctionnels exemples
Besoins non fonctionnels exemples Dr frantz large haiti
Dr frantz large haiti Cpma citadelle
Cpma citadelle Sdes in cryptography
Sdes in cryptography Sélectivité ampèremétrique
Sélectivité ampèremétrique Cahier des charges recrutement
Cahier des charges recrutement Méthode des 5 pourquoi
Méthode des 5 pourquoi Vivre au temps des mammouths
Vivre au temps des mammouths Résumé route de chlifa
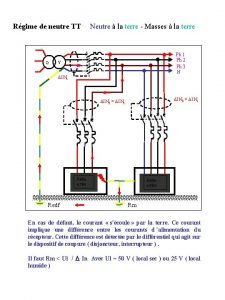
Résumé route de chlifa Regime du neutre
Regime du neutre Réseau des émetteurs français
Réseau des émetteurs français Composition des vitesses
Composition des vitesses