INTRODUCCIN El xido de silicio y los silicatos


























- Slides: 27


INTRODUCCIÓN • El óxido de silicio y los silicatos son extraordinariamente abundantes en la naturaleza, a tal punto de que sus combinaciones representan alrededor del 90% de la corteza terrestre.

• El silicio por si solo constituye un 28% de la corteza. No existe en estado libre, sino que se encuentra en forma de dióxido de silicio y de silicatos complejos. Los minerales que contienen silicio constituyen cerca del 40% de todos los minerales comunes, incluyendo más del 90% de los minerales que forman rocas volcánicas.

• Silicato de sodio es el nombre genérico dado a una serie de compuestos derivados del vidrio soluble de silicato de sodio. Son soluciones acuosas de óxido de sodio (Na 2 O) y dióxido de silicio (Si. O 2) combinados en diferentes proporciones. Variando las relaciones molares de Si. O 2 y Na 2 O se obtienen soluciones con múltiples aplicaciones

• El silicato de sodio tiene muchas propiedades útiles que no pueden ser obtenidas con ninguna otra sal alcalina. El silicato de sodio es ampliamente usado en industrias como: Detergentes y jabones, papel y cartón, ingeniería civil, tratamiento de agua, cementos, defloculantes, adhesivos, aislamiento de tuberías, excavación de suelos de pozos petroleros, fundición, limpieza de metales, aglomeración y pastillaje, flotación de minerales entre otros.

• Cuando una disolución de silicato de sodio se añade lentamente a un exceso de ácido clorhídrico diluido, se forma una disolución coloidal de óxido de silicio (IV) hidratado: Si. O 32 -+ 2 H+ → Si. O 2 + H 2 O

• Se produce así una disolución clara, que puede ser dializada para eliminar gran parte del electrolito. Un exceso de iones silicato provoca la coagulación. Con el tiempo, se forma una gelatina rígida o gel. Si se calienta con cuidado ese gel, se elimina la mayor parte del agua y se obtiene un sólido que absorbe bien el agua: el gel de sílice.

• La sílice coloidal es un sistema de dispersión estable en el cual el medio dispersante es un líquido en el que la fase dispersa o discontinua es dióxido de silicio en estado coloidal subdividido es decir una solución coloidal de alta hidratación molecular de partículas de sílice dispersas en agua.

• Es inodoro, insípido y no tóxico. Su fórmula química molecular es m. Si. O 2 · n. H 2 O. Este estado comprende partículas suficientemente chicas, de menos de 1 µm como para no verse afectados por las fuerzas gravitacionales, pero suficientemente grandes, mayores a 1 nm para mostrar marcadas desviaciones respecto a las propiedades de típicas soluciones.

• Gracias a la medida de sus partículas, el área específica de superficie es muy amplia. Al ser las partículas de sílice sol transparente no afectan al color de los objetos. También es conocido por hidrosol de sílice. La sílice precipitada, al igual que el sílice gel, son partículas sintéticas, finamente divididas, blancas y amorfas de dióxido de silicio.

• Las sílicas precipitadas han sido producidas comercialmente desde la década de 1940. Desde ese entonces, se han convertido en el grupo más importante entre los productos de sílice.

• Sus características están determinadas por su distribución de tamaño de partícula, porosidad, superficie específica y pureza. Es un material sintético de múltiples aplicaciones, imprescindible en ámbitos tan dispares como los productos farmacéuticos o los neumáticos ecológicos.

• Hoy en día es una industria en expansión, con numerosas aplicaciones de reciente descubrimiento. La principal forma de comercialización es en forma de polvo fino tal y como se prepara. Su principal ventaja es su pequeño tamaño, su facilidad de dispersión y su gran poder antiapelmazante.

• El silicato de sodio Na 2 Si. O 3, es un producto con una gran cantidad de aplicaciones en el mundo moderno. • Tienen muchas propiedades útiles que no comparten otras sales alcalinas.

Las sales son compuestos que resultan de la sustitución de iones hidrógeno de los ácidos por un metal o radical de carácter metálico; además, se puede considerar que las sales son el resultado de una neutralización al combinarse un ácido con una base, eliminándose el agua.

• Esto, junto con el hecho de que tienen bajo costo, da como resultado un amplio campo de uso en diferentes industrias. Son utilizados en la industria como adhesivos, detergentes, ingredientes en compuestos de limpieza, cementos, ligantes, capas protectoras y peculiares, ayuda coagulante, anticorrosivos, bases de catalizadores, defloculantes, insumos químicos, zeolitas, etc

OBJETIVOS: • Conocer los procesos de formación de precipitados y polímeros. • Reconocer la importancia del silicato de sodio en la industria moderna. • Comprender el término estado coloidal y su importancia biológica.

• Dominar términos químicos como: sol, coloide, defloculante, zeolita, sal, antiapelmazante, polaridad y otros. • Aplicar correctamente el método científico experimental. • Comprobar las enseñanzas teóricas a través de la experimentación. • Promover el reto de inventar productos químicos amigables con el medio ambiente.

MATERIALES Y REACTIVOS • • • • • Bata. Guantes. Lentes de protección. Cuaderno de laboratorio. Palangana. Recipiente plástico. Vaso de 400 ml. Varilla agitadora. Probetas graduadas. Beaker´s o vasos de precipitados. Mortero y pistilos. Vidrios de reloj. Cubre objetos. Silicato de sodio. Arena. Sulfato de cobre II. Alcohol etanol.

PROCEDIMIENTO • Mezclar en un recipiente 100 m. L de silicato de sodio y 200 m. L de agua. • Agregar arena al recipiente. • Decantar la solución acuosa de silicato de sodio con sumo cuidado.

• Esperar a que la solución acuosa de silicato de sodio esté cristalina. • Agregar con el cubre objetos los cristales de sulfato de cobre con cuidado (casi de uno en uno). • Se formarán sulfatos metálicos con formas curiosas que darán la apariencia de un enmarañado bosque.

• ¿qué pasó? • Los sulfatos metálicos reaccionan con el silicato de sodio para formar una membrana delgada de silicato insoluble. • El agua atraviesa la membrana por ósmosis, expandiéndola y rompiéndola luego y formando así nuevas membranas.

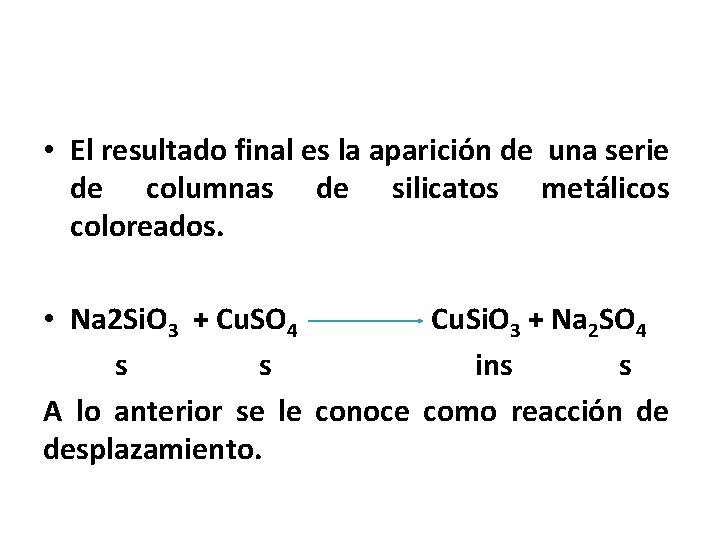
• El resultado final es la aparición de una serie de columnas de silicatos metálicos coloreados. • Na 2 Si. O 3 + Cu. SO 4 Cu. Si. O 3 + Na 2 SO 4 s s ins s A lo anterior se le conoce como reacción de desplazamiento.

• De manera similar a como se enlazan las cuentas de un rosario, moléculas idénticas se conectan entre sí para formar largas cadenas llamadas polímeros.

• Mezclaremos dos soluciones para prepara un compuesto sólido que tiene propiedades similares a las del caucho. • Colocar 20 m. L de solución de silicato de sodio en un vaso de cartón. Evitar el contacto con la piel • En otro vaso de cartón, adicionar 5 m. L de etanol • Mezclar la solución de etanol con la solución de silicato de sodio • Agitar con el palillo para chuzos, con movimientos circulares, hasta obtener un sólido blando • Tomar el sólido en la palma de la mano y darle la forma de una esfera

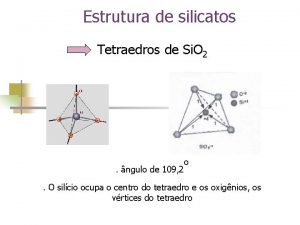
• ¿Qué pasó? • El silicio, un elemento del mismo grupo del carbono, puede formar cuatro enlaces en la dirección de los vértices de un tetraedro. En el silicato de sodio, cada átomo de silicio se encuentra enlazado a cuatro átomos de oxígeno: Cuando la solución de etanol, C 2 H 5 OH, reacciona con el silicato de sodio, dos moléculas de alcohol reemplazan un par de oxígenos del ion silicato y se obtiene un polímero.

CONCLUSIONES
 Que mineral es
Que mineral es Silicio electrones de valencia
Silicio electrones de valencia Pirosilicato
Pirosilicato Circuitos logicos
Circuitos logicos Introduccin
Introduccin Introduccin
Introduccin Que diferencia hay entre filosofia y ciencia
Que diferencia hay entre filosofia y ciencia Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin Ux
Ux Folklore ergológico wikipedia
Folklore ergológico wikipedia 10 deberes de los padres para con los hijos
10 deberes de los padres para con los hijos Cuáles son los tipos de texto expositivo
Cuáles son los tipos de texto expositivo 5 roles de la familia
5 roles de la familia Por que los sacerdotes pueden perdonar los pecados
Por que los sacerdotes pueden perdonar los pecados Rechaza el spam y los ficheros inesperados
Rechaza el spam y los ficheros inesperados Nombre de los profetas menores
Nombre de los profetas menores Los pensamientos del hombre no son los de dios
Los pensamientos del hombre no son los de dios Los hijos son como los buques
Los hijos son como los buques Los cuatro seres vivientes y los evangelios
Los cuatro seres vivientes y los evangelios Los amigos de colores
Los amigos de colores -facebook
-facebook Oracin
Oracin Historia de los derechos del niño
Historia de los derechos del niño Frutos de la pascua de resurreccion
Frutos de la pascua de resurreccion Escuchar a los muertos con los ojos
Escuchar a los muertos con los ojos Que color es la luz
Que color es la luz