Interprtation microscopique de la chaleur et du travail



- Slides: 21

Interprétation microscopique de la chaleur et du travail

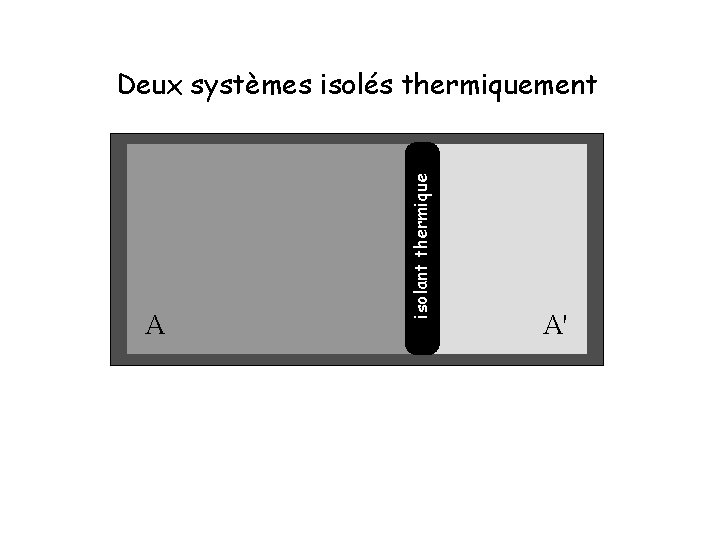
A isolant thermique Deux systèmes isolés thermiquement A'

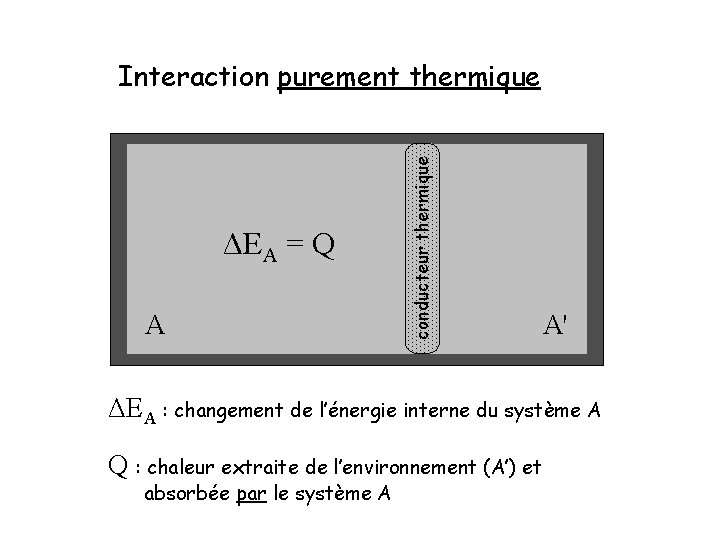
ΔEA = Q A conducteur thermique Interaction purement thermique A' ΔEA : changement de l’énergie interne du système A Q : chaleur extraite de l’environnement (A’) et absorbée par le système A

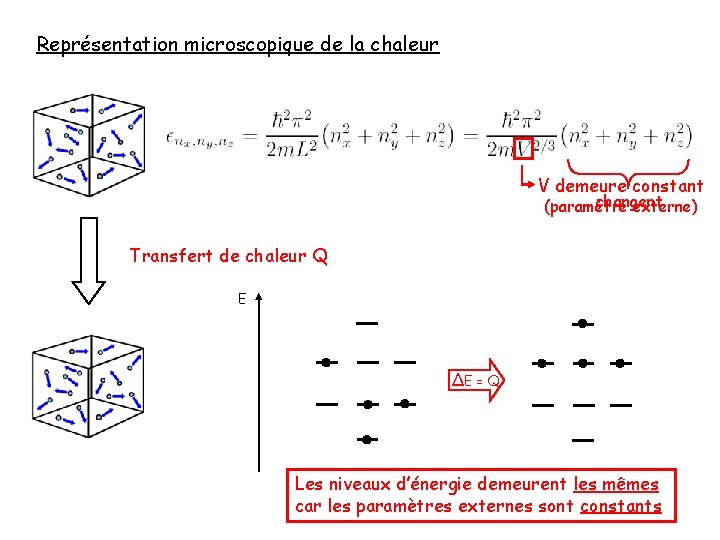
Représentation microscopique de la chaleur V demeure constant changent (paramètre externe) Transfert de chaleur Q Etot augmente E ∆E = Q Les niveaux d’énergie demeurent les mêmes car les paramètres externes sont constants

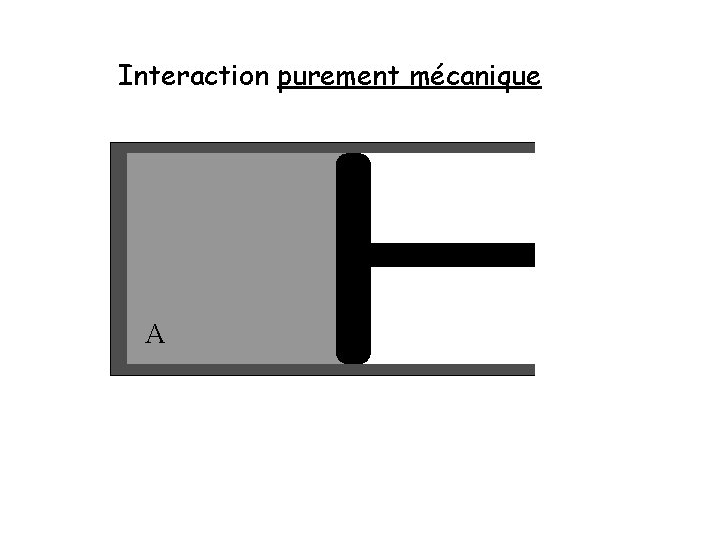
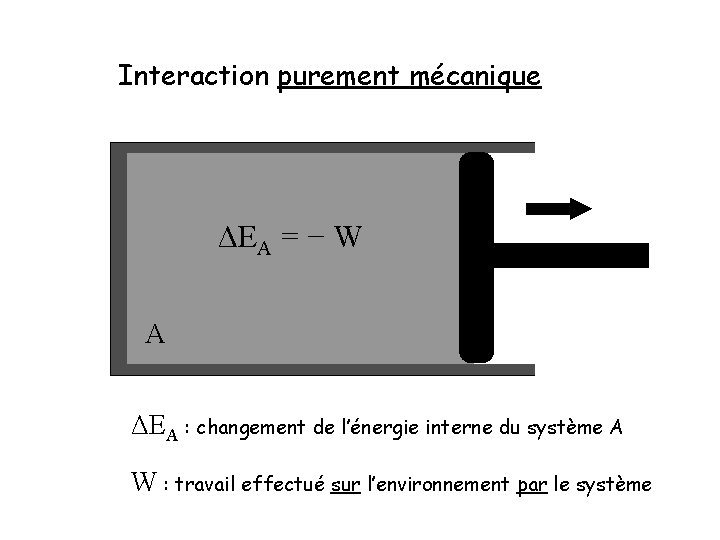
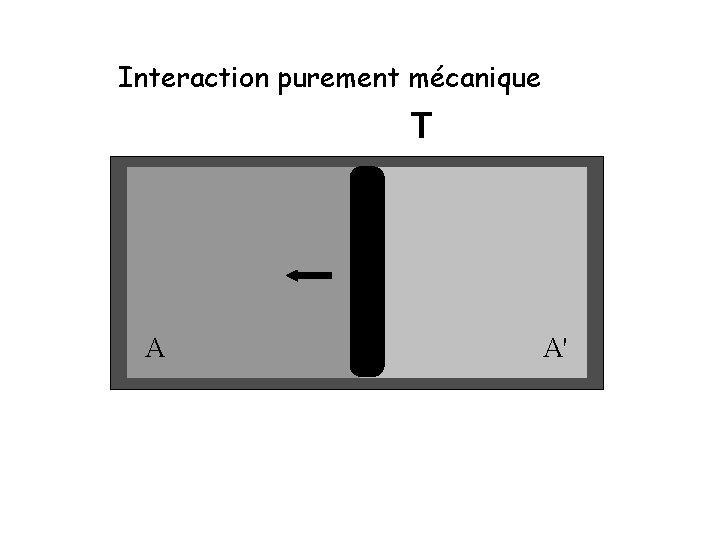
Interaction purement mécanique A

Interaction purement mécanique ΔEA = − W A ΔEA : changement de l’énergie interne du système A W : travail effectué sur l’environnement par le système

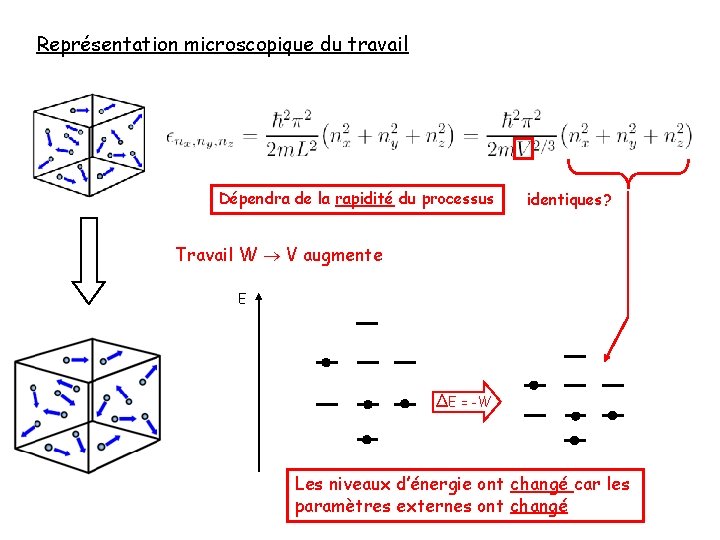
Représentation microscopique du travail Dépendra de la rapidité du processus identiques? Travail W V augmente les niveaux d’énergie changent! E ∆E = -W Les niveaux d’énergie ont changé car les paramètres externes ont changé

Deux systèmes isolés mécaniquement et thermiquement T A A' isolant thermique

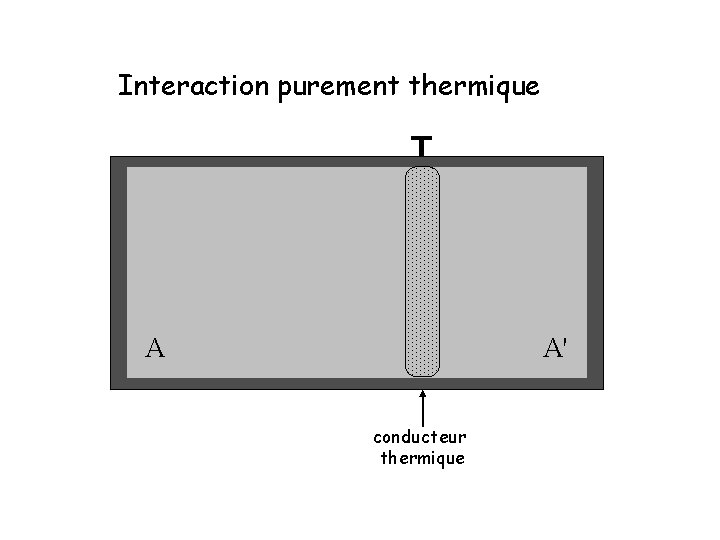
Interaction purement thermique T A A' conducteur thermique

Deux systèmes isolés mécaniquement et thermiquement T A A'

Interaction purement mécanique T A A'

Deux systèmes isolés mécaniquement et thermiquement T A A'

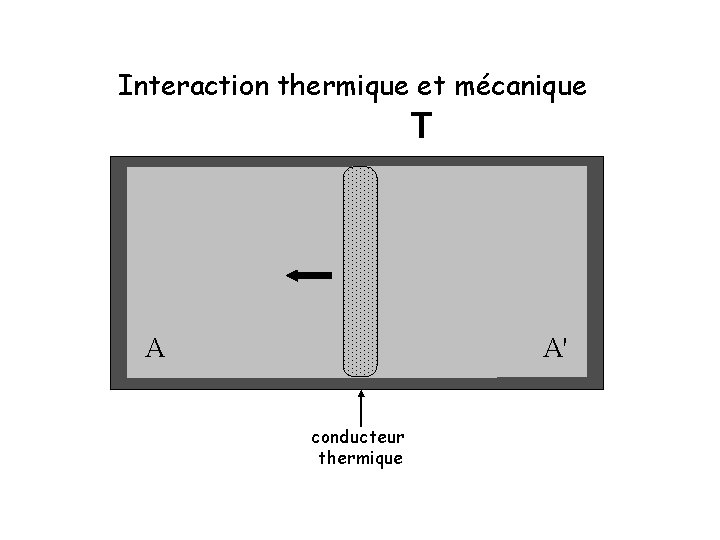
Interaction thermique et mécanique T A A' conducteur thermique

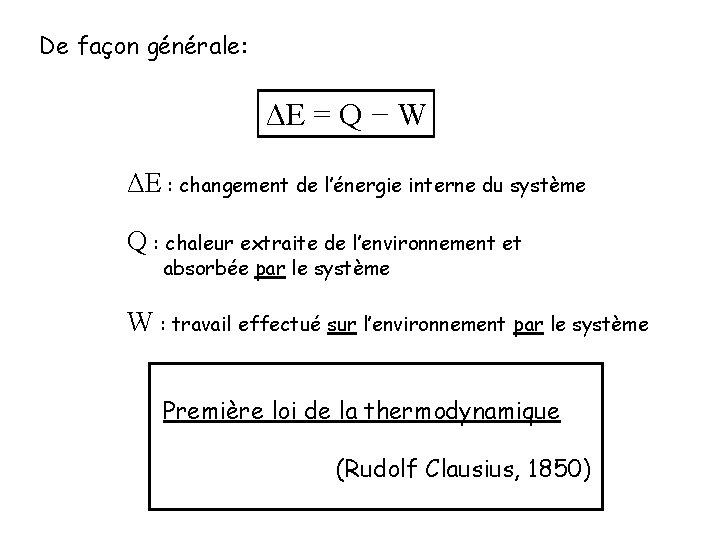
De façon générale: ΔE = Q − W ΔE : changement de l’énergie interne du système Q : chaleur extraite de l’environnement et absorbée par le système W : travail effectué sur l’environnement par le système Première loi de la thermodynamique (Rudolf Clausius, 1850)

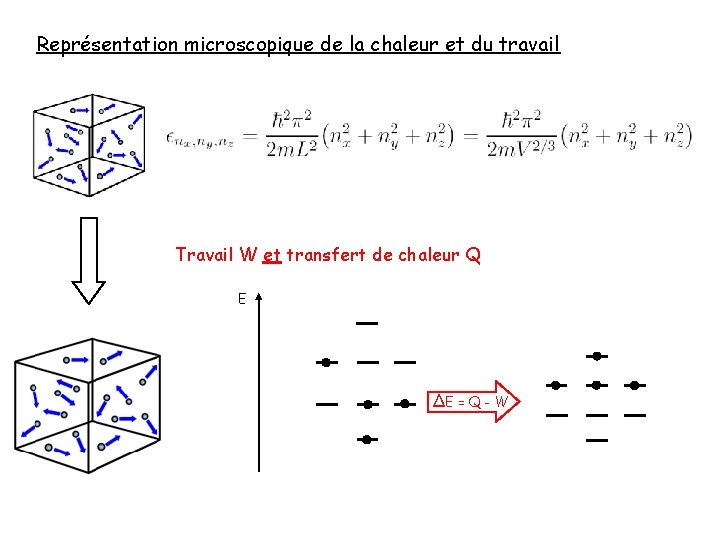
Représentation microscopique de la chaleur et du travail Travail W et transfert de chaleur Q E ∆E = Q - W

• Évidemment, du point de vue microscopique, le travail est un phénomène difficile à décrire… (ex: turbulence) • Plus facile à décrire du point de vue macroscopique: W=F·x F : force exercée par le système A x : le déplacement

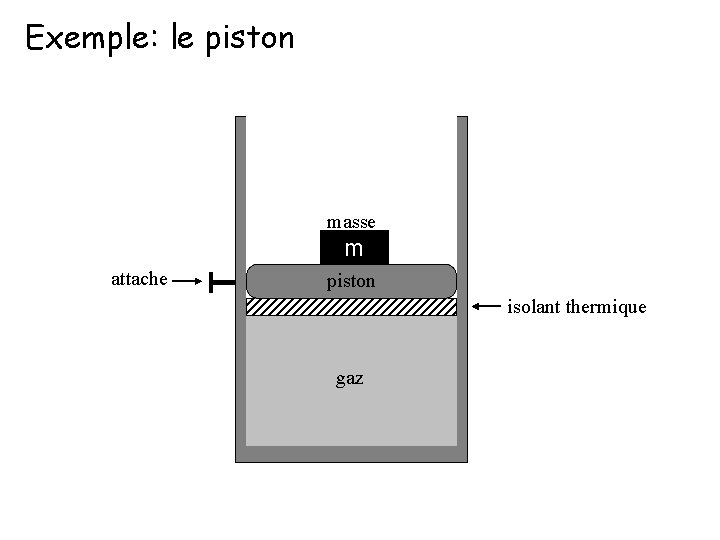
Exemple: le piston masse attache T m piston isolant thermique gaz

Exemple: le piston T m

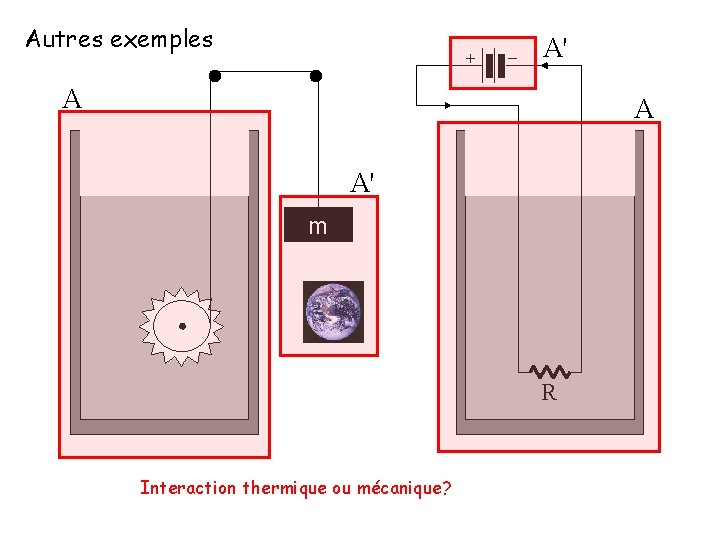
Autres exemples + − A' A A A' m R Interaction thermique ou mécanique?

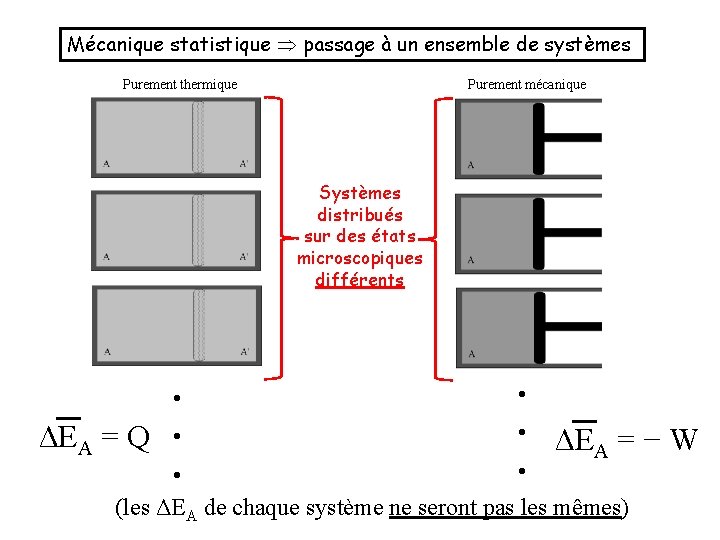
Mécanique statistique passage à un ensemble de systèmes Purement thermique Purement mécanique Systèmes distribués sur des états microscopiques différents • ΔEA = Q • • ΔEA = − W • (les ΔEA de chaque système ne seront pas les mêmes)

Cas général : échange de chaleur + travail mécanique Q ≡ ΔE + W ΔE : changement moyen de l’énergie interne Q : chaleur absorbée par le système W : travail effectué sur l’environnement par le système • C’est notre définition formelle de la chaleur (variation de l’énergie interne non associée au changement des paramètres externes) • E et W peuvent être mesurés expérimentalement, alors que Q est une quantité dérivée