Interaction ionique Entre 2 charges quelconques Loi de



- Slides: 6

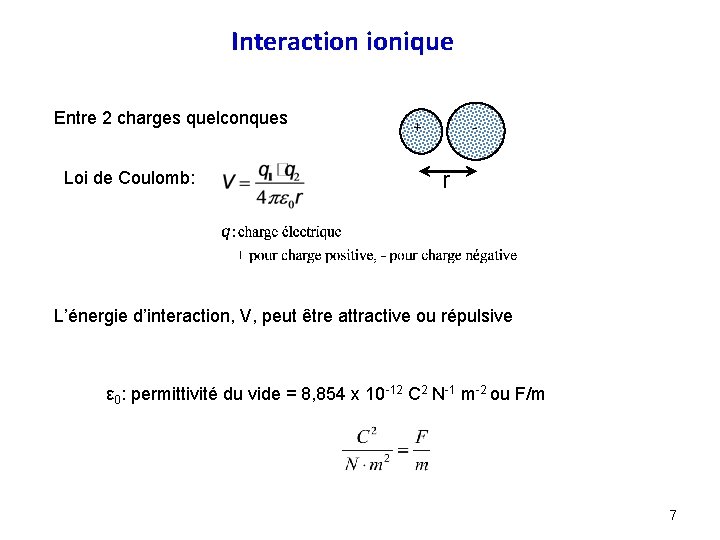
Interaction ionique Entre 2 charges quelconques Loi de Coulomb: + - r L’énergie d’interaction, V, peut être attractive ou répulsive ε 0: permittivité du vide = 8, 854 x 10 -12 C 2 N-1 m-2 ou F/m 7

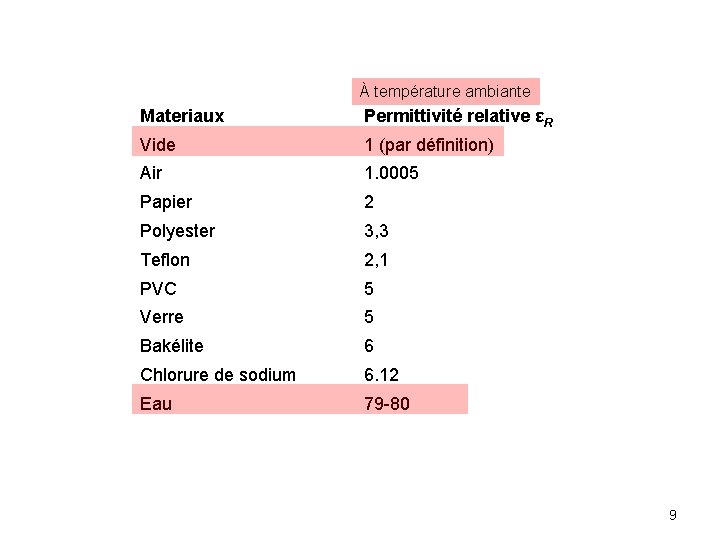
La permittivité est définie par : ε = D/E D : déplacement électrique (aussi appelé induction électrique ou excitation électrique) en coulombs par mètre carré E: intensité du champ électrique (en volts par mètre). La permittivité d’un milieu ε autre que le vide est généralement normalisée par celle du vide, ε 0: permittivité relative ou constante diélectrique Dans un milieu où la constante diélectrique (permittivité relative) est: Plus la permittivité du milieu est grande, plus faibles seront les interactions 8

À température ambiante Materiaux Permittivité relative εR Vide 1 (par définition) Air 1. 0005 Papier 2 Polyester 3, 3 Teflon 2, 1 PVC 5 Verre 5 Bakélite 6 Chlorure de sodium 6. 12 Eau 79 -80 9

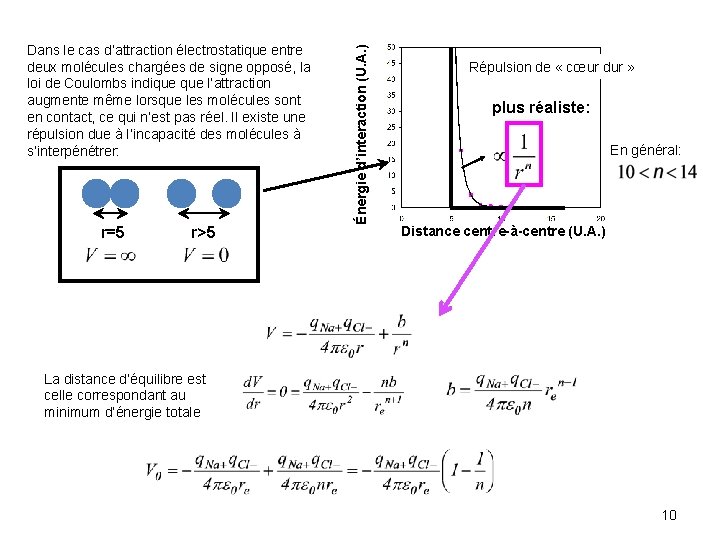
r=5 r>5 Énergie d’interaction (U. A. ) Dans le cas d’attraction électrostatique entre deux molécules chargées de signe opposé, la loi de Coulombs indique l’attraction augmente même lorsque les molécules sont en contact, ce qui n’est pas réel. Il existe une répulsion due à l’incapacité des molécules à s’interpénétrer: Répulsion de « cœur dur » plus réaliste: En général: Distance centre-à-centre (U. A. ) La distance d’équilibre est celle correspondant au minimum d’énergie totale 10

Exemple Quelle est l’énergie potentielle associée à la paire d’ions Na. Cl séparés par leur distance d’équilibre re ? longueur de liaison entre Na et Cl de Na. Cl à l’état gazeux de 2, 36 Å, 1, 602 x 10 -19 C pour la charge unitaire et n=10 pour le terme de répulsion, on peut écrire pour 1 mole de paires d’ions Na+ et Cl- : 11

Quelle est l’énergie potentielle associée à la paire d’ions Na. Cl séparés par leur distance d’équilibre re dans un milieu dont la constante diélectrique est supérieure à 1. Par exemple, dans l’eau : Les ions sont moins retenus “ensemble”que dans l’air 12