Instituto Tecnolgico do Sudoeste Paulista Faculdade de Engenharia














- Slides: 23

Instituto Tecnológico do Sudoeste Paulista Faculdade de Engenharia Elétrica – FEE Bacharelado em Engenharia Elétrica Aula 9 Temperatura, Calor, Lei Zero da Termodinâmica, Dilatação Térmica, Termometria Física Geral e Experimental II Prof. Ms. Alysson Cristiano Beneti IPAUSSU-SP 2012

Termologia É o estudo dos fenômenos térmicos que envolvem calor e temperatura. São exemplos:

Calor e Temperatura: é uma medida proporcional à energia cinética média das moléculas de um material. Está relacionada à sensação térmica provocada no contato com este material. Calor: é a energia térmica que flui de um corpo para outro enquanto há diferença de temperatura entre eles.

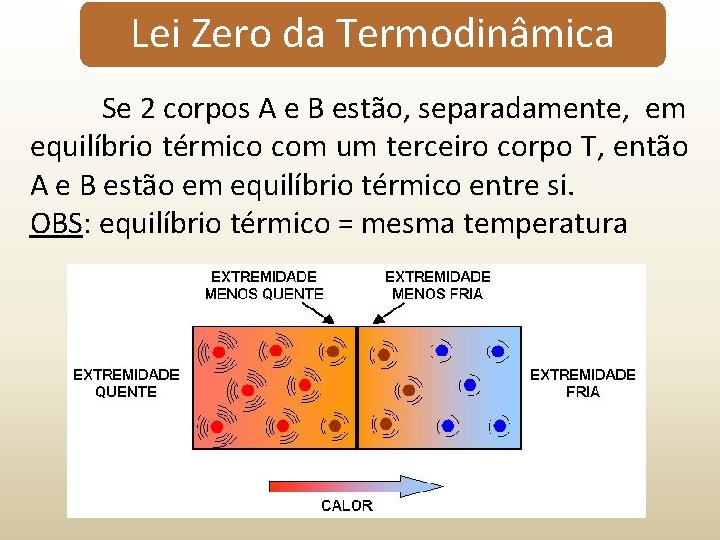
Lei Zero da Termodinâmica Se 2 corpos A e B estão, separadamente, em equilíbrio térmico com um terceiro corpo T, então A e B estão em equilíbrio térmico entre si. OBS: equilíbrio térmico = mesma temperatura

Escalas Termométricas Existem 5 escalas termométricas, 3 mais conhecidas e empregadas na atualidade: Celsius( C), Fahrenheit ( F), Kelvin (K), Rankine ( Ra) e Reamur ( R).

Exemplos 1) Converta as temperaturas: a) 300 K em F c) 52 F em C e) 70 R em F 80, 6°F 11, 11°C 189, 5°F b) 20 C em K 293 K d) 303 K em C 30°C f) 550 Ra em C 32, 2°C

Exemplos 2) (a) Em 1964, a temperatura da aldeia de Oymyakon, na Sibéria, chegou a -71 C. Qual é o valor desta temperatura na escala Fahrenheit? (b) A maior temperatura registrada oficialmente nos EUA foi 134 F, no Vale da Morte, Califórnia. Qual é o valor desta temperatura na escala Celsius? 3) Em que temperatura a leitura na escala Fahrenheit é igual (a) a duas vezes a leitura na escala Celsius e (b) a metade da leitura na escala Celsius?

Comportamento Anômalo da Água Em países onde os invernos são rigorosos, muitas pessoas deixam suas torneiras gotejando para não permitir que a água contida no encanamento se congele, devido ao pequeno fluxo, e os canos arrebentem. Do mesmo modo, nas encostas rochosas desses países, com a chegada do inverno, as águas que se infiltraram nas rachaduras congelam-se e aumentam de volume, provocando um desmoronamento.

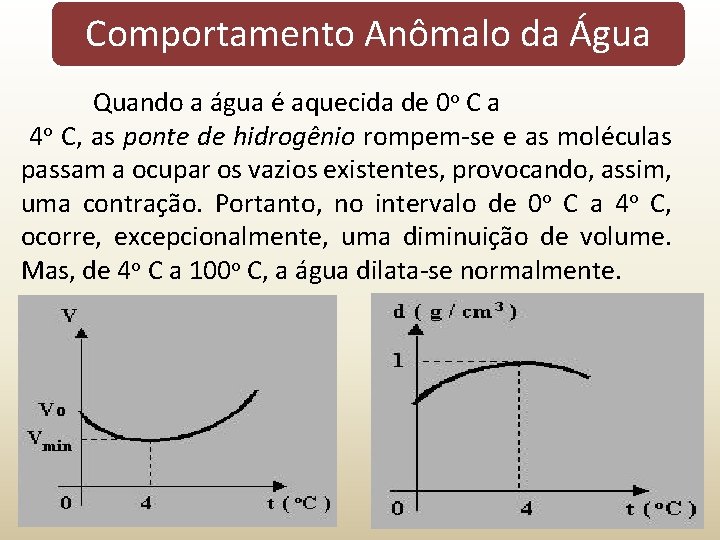
Comportamento Anômalo da Água Ao se elevar a temperatura de uma substância, verifica-se uma dilatação térmica. Entretanto, a água, ao ser aquecida de 00 C a 40 C, contrai-se, constituindo-se uma exceção ao caso geral. Esse fenômeno pode ser aplicado da seguinte maneira: no estado sólido, os átomos de oxigênio, que são muito eletronegativos, unem-se aos átomos de hidrogênio através da ligação denominada ponte de hidrogênio. Em consequência disso, entre as moléculas, formam-se grandes vazios, aumentando o volume externo (aspecto macroscópico).

Comportamento Anômalo da Água Quando a água é aquecida de 0 o C a 4 o C, as ponte de hidrogênio rompem-se e as moléculas passam a ocupar os vazios existentes, provocando, assim, uma contração. Portanto, no intervalo de 0 o C a 4 o C, ocorre, excepcionalmente, uma diminuição de volume. Mas, de 4 o C a 100 o C, a água dilata-se normalmente.

Termômetros São dispositivos construídos para medir a temperatura. Podem ser: de mercúrio, a álcool, clínico, Six e Bellani, de resistência elétrica, bimetálico, de pressão de gás, laser e infravermelho.

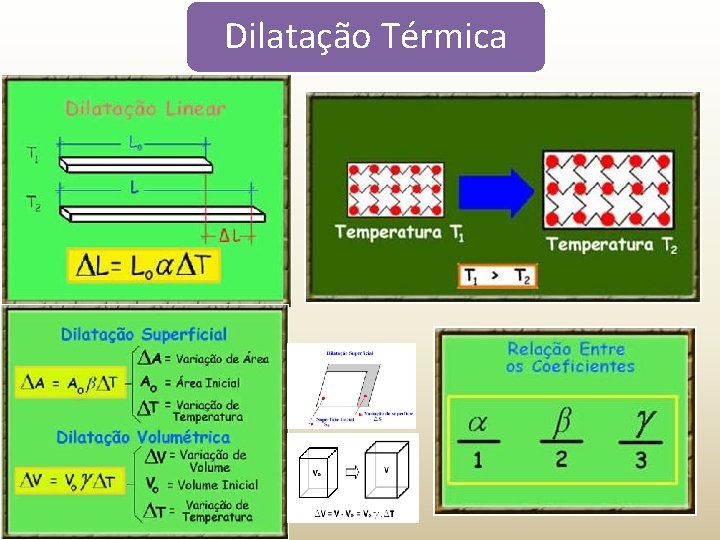
Dilatação Térmica A matéria quando aquecida, dilata-se, aumentando suas dimensões físicas.

Dilatação Térmica

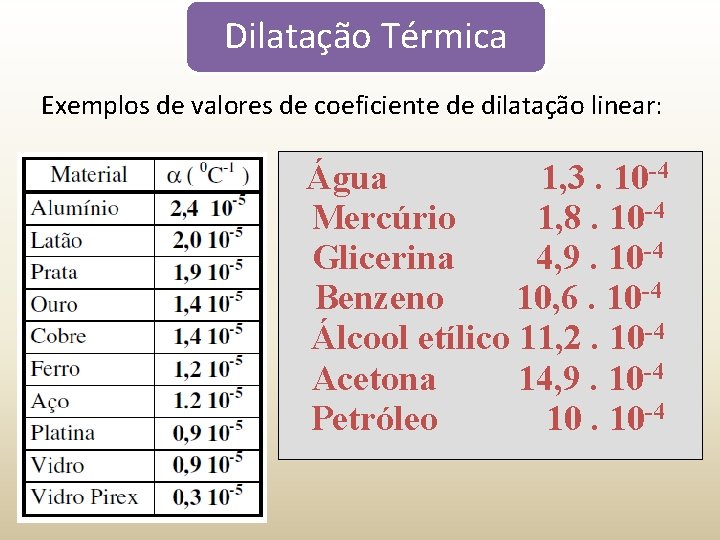
Dilatação Térmica Exemplos de valores de coeficiente de dilatação linear: Água 1, 3. 10 -4 Mercúrio 1, 8. 10 -4 Glicerina 4, 9. 10 -4 Benzeno 10, 6. 10 -4 Álcool etílico 11, 2. 10 -4 Acetona 14, 9. 10 -4 Petróleo 10. 10 -4

Exemplo 1) (Halliday, p. 190) Em um dia quente em Las Vegas um caminhão tanque foi carregado com 37000 L de óleo diesel. Ele encontrou tempo frio ao chegar a Payson, Utah, onde a temperatura estava 23 K abaixo da temperatura de Las Vegas, e onde ele entregou a carga. Quantos litros foram descarregados? O coeficiente de dilatação volumétrica do óleo diesel é , e o coeficiente de dilatação linear do aço de que é feito o tanque do caminhão é.

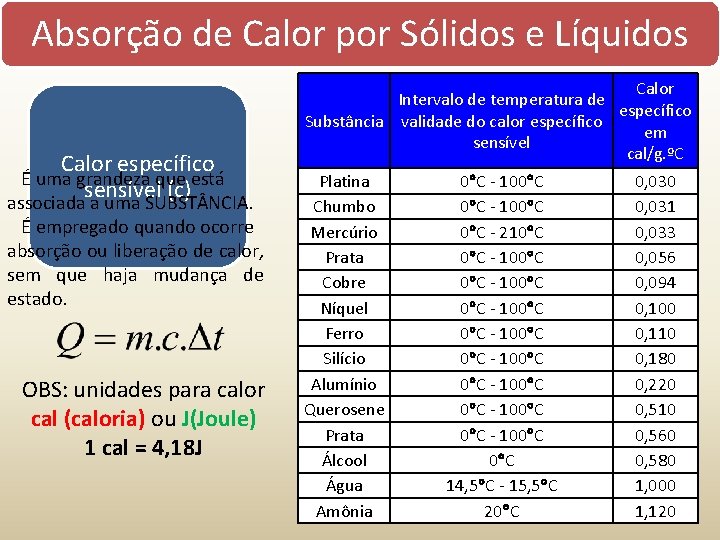
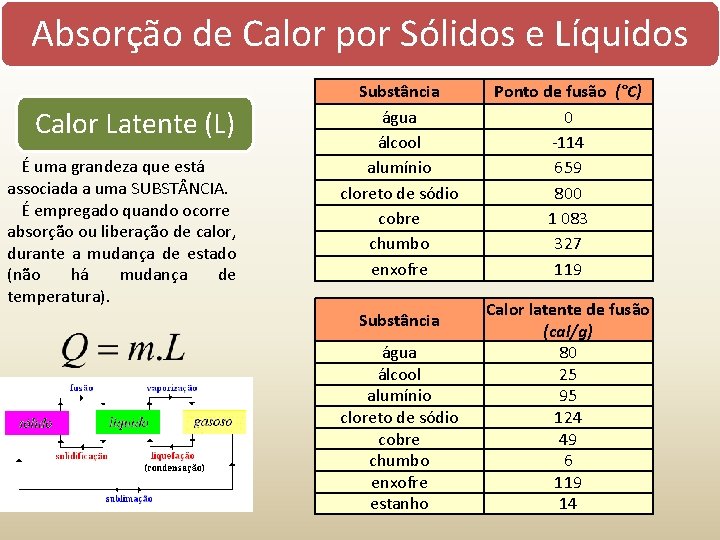
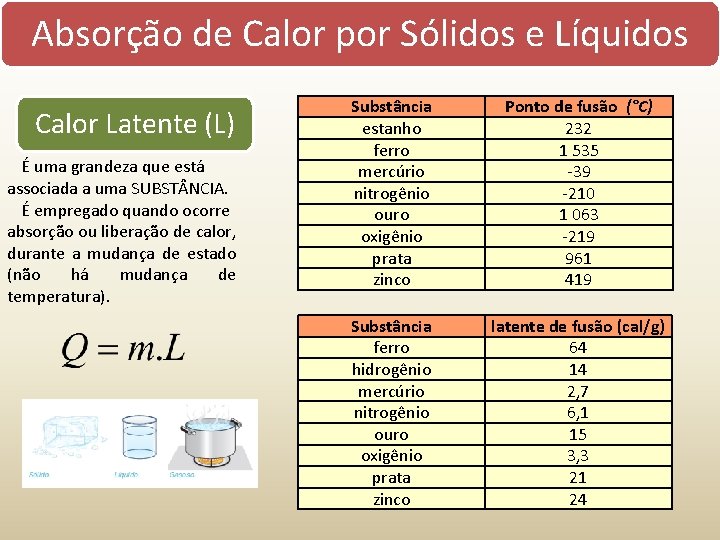
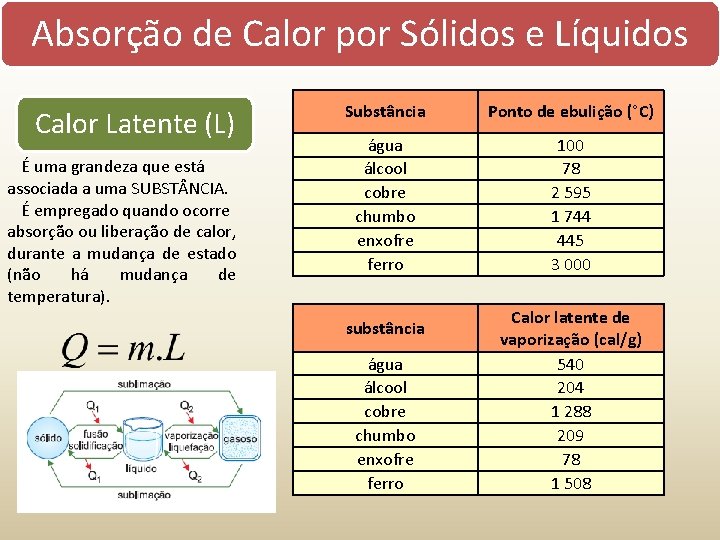
Absorção de Calor por Sólidos e Líquidos Calor absorvido = Temperatura aumenta = Quente Calor perdido = Temperatura diminui = Frio Calor específico É uma grandeza que está associada sensível a uma SUBST NCIA. (c) É empregado quando ocorre absorção ou liberação de calor, sem que haja mudança de estado. Q calor m massa c calor específico T variação da temperatura Capacidade Térmica (C) É uma grandeza que está associada a um CORPO. Calor Latente (L) É uma grandeza que está associada a uma SUBST NCIA. É empregado quando ocorre absorção ou liberação de calor, durante a mudança de estado (não há mudança de temperatura). Q calor m massa c calor específico C capacidade térmica T variação da temperatura Q calor m massa L calor latente

Absorção de Calor por Sólidos e Líquidos Calor específico É uma grandeza que está sensível (c) associada a uma SUBST NCIA. É empregado quando ocorre absorção ou liberação de calor, sem que haja mudança de estado. OBS: unidades para calor cal (caloria) ou J(Joule) 1 cal = 4, 18 J Calor Intervalo de temperatura de específico Substância validade do calor específico em sensível cal/g. ºC Platina Chumbo Mercúrio Prata Cobre Níquel Ferro Silício Alumínio Querosene Prata Álcool Água Amônia 0 C - 100 C 0 C - 210 C 0 C - 100 C 0 C - 100 C 14, 5 C - 15, 5 C 20 C 0, 030 0, 031 0, 033 0, 056 0, 094 0, 100 0, 110 0, 180 0, 220 0, 510 0, 560 0, 580 1, 000 1, 120

Absorção de Calor por Sólidos e Líquidos Calor Latente (L) É uma grandeza que está associada a uma SUBST NCIA. É empregado quando ocorre absorção ou liberação de calor, durante a mudança de estado (não há mudança de temperatura). Substância água álcool alumínio cloreto de sódio cobre chumbo enxofre estanho Ponto de fusão (°C) 0 -114 659 800 1 083 327 119 Calor latente de fusão (cal/g) 80 25 95 124 49 6 119 14

Absorção de Calor por Sólidos e Líquidos Calor Latente (L) É uma grandeza que está associada a uma SUBST NCIA. É empregado quando ocorre absorção ou liberação de calor, durante a mudança de estado (não há mudança de temperatura). Substância estanho ferro mercúrio nitrogênio ouro oxigênio prata zinco Ponto de fusão (°C) 232 1 535 -39 -210 1 063 -219 961 419 Substância ferro hidrogênio mercúrio nitrogênio ouro oxigênio prata zinco latente de fusão (cal/g) 64 14 2, 7 6, 1 15 3, 3 21 24

Absorção de Calor por Sólidos e Líquidos Calor Latente (L) É uma grandeza que está associada a uma SUBST NCIA. É empregado quando ocorre absorção ou liberação de calor, durante a mudança de estado (não há mudança de temperatura). Substância Ponto de ebulição (°C) água álcool cobre chumbo enxofre ferro 100 78 2 595 1 744 445 3 000 substância água álcool cobre chumbo enxofre ferro Calor latente de vaporização (cal/g) 540 204 1 288 209 78 1 508

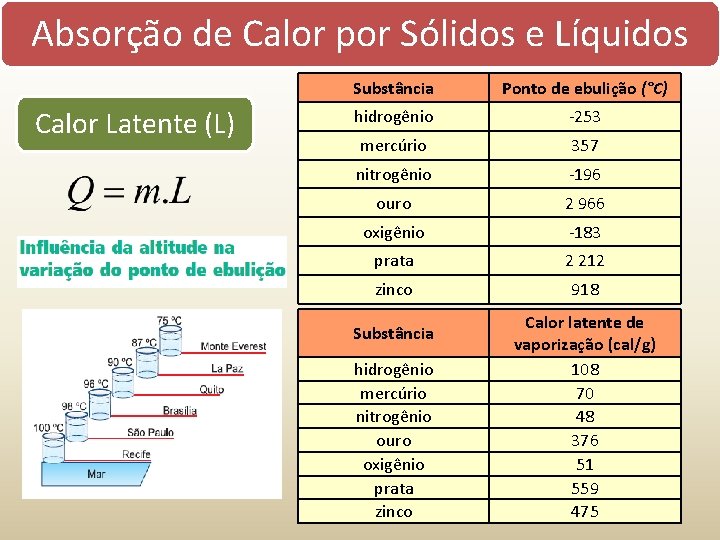
Absorção de Calor por Sólidos e Líquidos Calor Latente (L) Substância Ponto de ebulição (°C) hidrogênio -253 mercúrio 357 nitrogênio -196 ouro 2 966 oxigênio -183 prata 2 212 zinco 918 Substância hidrogênio mercúrio nitrogênio ouro oxigênio prata zinco Calor latente de vaporização (cal/g) 108 70 48 376 51 559 475

Exemplos 1) Qual é a quantidade de calor necessária para aquecer 250 g de chumbo que está a uma temperatura de 20 C até 85 C? Resposta: O chumbo de 20 C a 85 C é sólido e não muda de estado. Portanto utilizamos a expressão do calor específico: 2) Qual é a quantidade de calor necessária para fundir 250 g de chumbo que está a 327 C? Resposta: O chumbo a 327 C está mudando do estado sólido para o líquido. Portanto é fusão. Utilizamos a expressão do calor latente:

Exemplos 3) Um bloco de 100 g de gelo a – 20°C será aquecido até 120°C. Indique em um gráfico a sequência das transformações e calcule a quantidade total de calor necessária para ocorrer tal processo. Dados: considere o calor específico da água 1 cal/g C, mesmo sabendo que ele varia com a temperatura. Considere Lf=80 cal/g e Lv=540 cal/g e sistema ao nível do mar.