InfrarotSpektroskopie IR Die folgende Prsentation entspricht den Infrarotes











- Slides: 22

Infrarot-Spektroskopie (IR) Die folgende Präsentation entspricht den Infrarotes Licht regt Moleküle zur Schwingung (und Rotation) Teilkapiteln 12. 2. 5 bis 12. 4. aus dem Buch an. Die Bindungen absorbieren Licht bei bestimmten, für sie „Chemie erleben“ (Wawra/Dolznig/Müllner). charakteristischen Frequenzen. Am Beispiel von Kohlendioxid sieht das etwa so aus: Man kann das mit einem Da die Texte teilweise übereinander gelegt Musikinstrument sind, muss man im Power-Point auf vergleichen Bildschirm-Präsentationen schalten, um alle Texte und Animationen. Jesehen zu können. nach Länge und Spannung gibt jede Saite Viel Vergnügen. einen bestimmten Ton = bestimmte Frequenz Im infraroten Bereich hat daher eine jeder Stoff ein anderes Spektrum. Edgar Wawra Man verwendet diese Methode, um einen Stoff zu charakterisieren oder um Verunreinigungen eines fremden Stoffes festzustellen.

Man kann aus den Schwingungen auf die Art der Bindungen und weiter auf die Struktur des betreffenden Moleküls schließen. Das ist etwa die Situation von jemanden, der aus den Tönen eines Musikinstrumentes dessen Konstruktion errechnet, ohne das Instrument selbst gesehen zu haben.

Ein Infrarot-Spektrometer sieht zum Beispiel so aus:

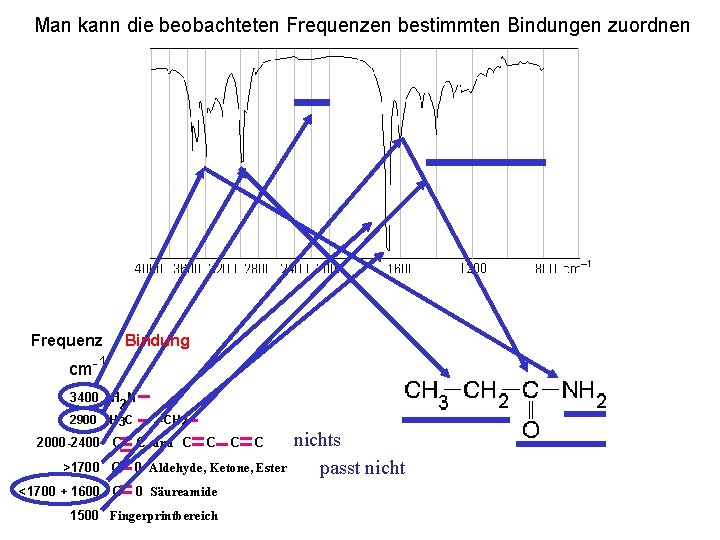
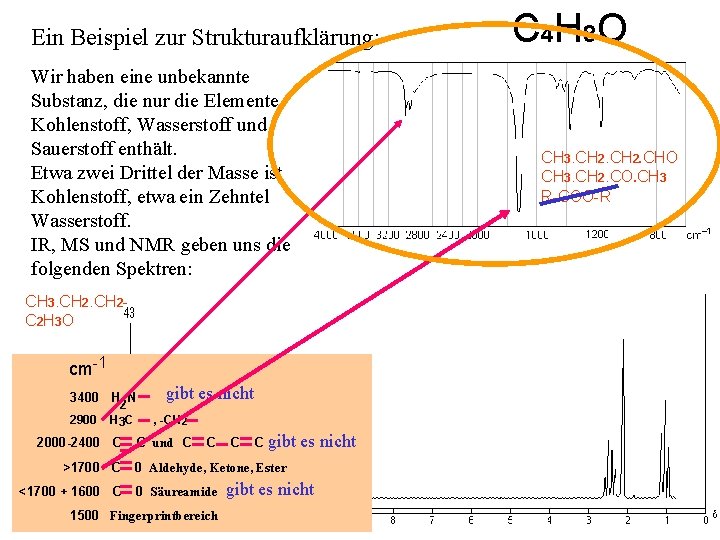
Man kann die beobachteten Frequenzen bestimmten Bindungen zuordnen Frequenz cm-1 Bindung 3400 H N 2 2900 H 3 C 2000 -2400 C >1700 C <1700 + 1600 C , -CH 2 C und C C 0 Aldehyde, Ketone, Ester 0 Säureamide 1500 Fingerprintbereich nichts passt nicht

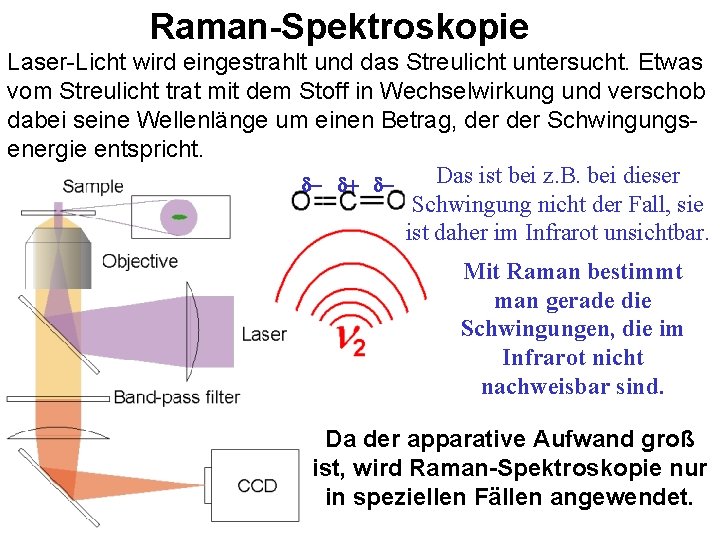
Infrarot-Spektroskopie Raman-Spektroskopie (IR) Laser-Licht wird eingestrahlt und das Streulicht untersucht. Etwas Infrarotes Licht regt Moleküle zur Schwingung (und Rotation) vom Streulicht trat mit dem Stoff in Wechselwirkung und verschob an. Die Bindungen absorbieren Licht bei bestimmten, für sie dabei seine Wellenlänge um einen Betrag, der Schwingungscharakteristischen Frequenzen. energie entspricht. Das ist bei z. B. bei dieser d- d+ d. Schwingung nicht der Fall, sie ist daher im Infrarot unsichtbar. Mit Raman bestimmt man gerade die Schwingungen, die im Infrarot nicht nachweisbar sind. Damit eine Schwingung im Infrarot absorbiert, muss sich bei dieser Schwingung die Ladungsverteilung im Molekül ändern. Da der apparative Aufwand groß ist, wird Raman-Spektroskopie nur in speziellen Fällen angewendet.

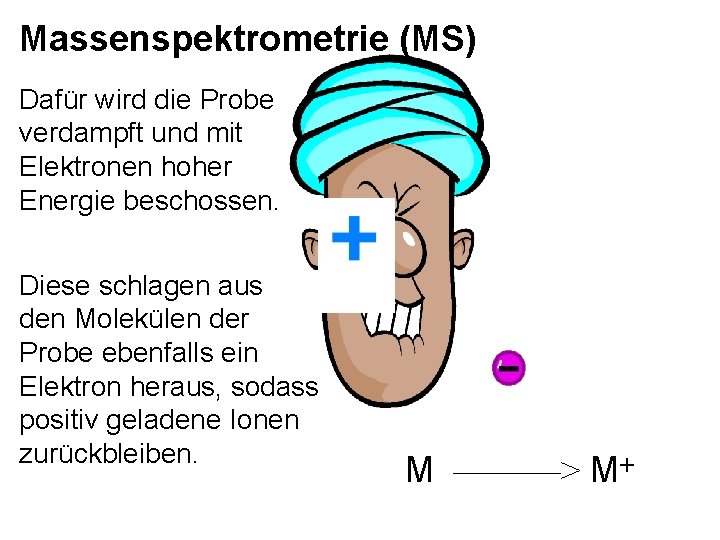
Massenspektrometrie (MS) Dafür wird die Probe verdampft und mit Elektronen hoher Energie beschossen. Diese schlagen aus den Molekülen der Probe ebenfalls ein Elektron heraus, sodass positiv geladene Ionen zurückbleiben. M ———> M+

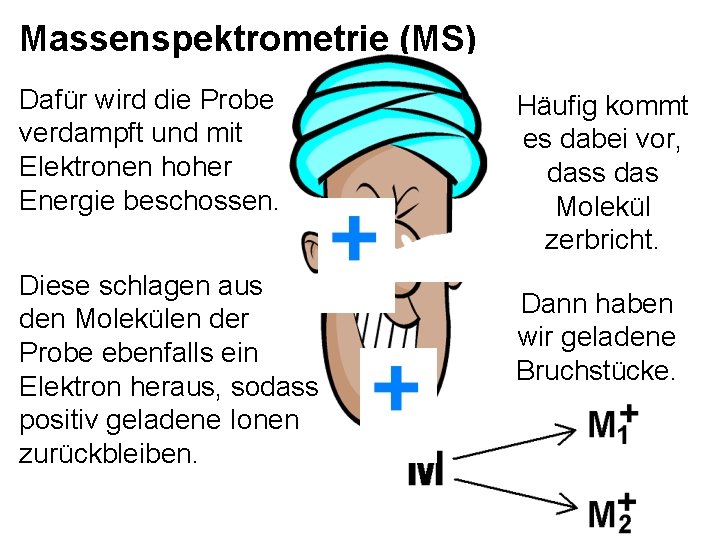
Massenspektrometrie (MS) Dafür wird die Probe verdampft und mit Elektronen hoher Energie beschossen. Diese schlagen aus den Molekülen der Probe ebenfalls ein Elektron heraus, sodass positiv geladene Ionen zurückbleiben. Häufig kommt es dabei vor, dass das Molekül zerbricht. Dann haben wir geladene Bruchstücke.

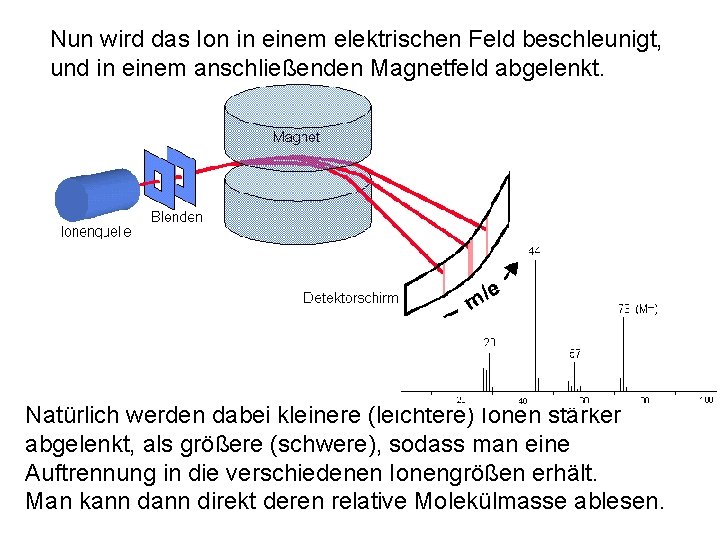
Nun wird das Ion in einem elektrischen Feld beschleunigt, und in einem anschließenden Magnetfeld abgelenkt. Natürlich werden dabei kleinere (leichtere) Ionen stärker abgelenkt, als größere (schwere), sodass man eine Auftrennung in die verschiedenen Ionengrößen erhält. Man kann direkt deren relative Molekülmasse ablesen.

So ein Massenspektrometer kann recht handlich sein … oder ein riesiges Ding.

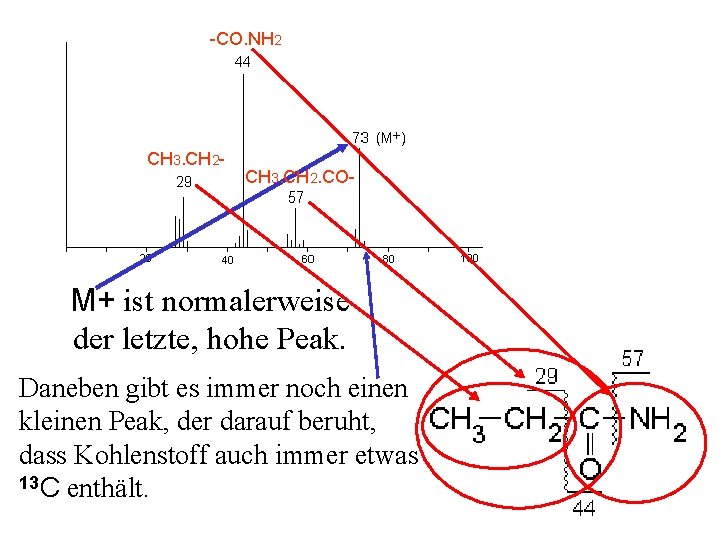
-CO. NH 2 CH 3. CH 2 - CH 3. CH 2. CO- M+ ist normalerweise der letzte, hohe Peak. Daneben gibt es immer noch einen kleinen Peak, der darauf beruht, dass Kohlenstoff auch immer etwas 13 C enthält.

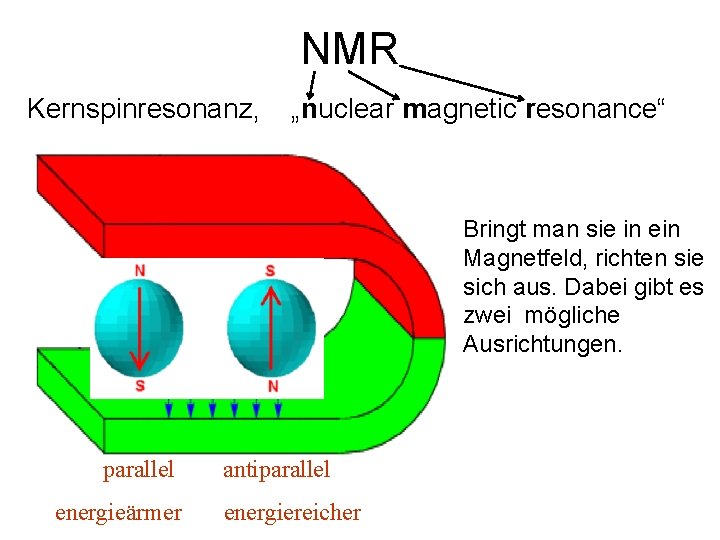
NMR Kernspinresonanz, „nuclear magnetic resonance“ Bringt man sie in ein Magnetfeld, richten sie Protonen haben Ladung sich aus. Dabei gibt es und Spin (~ Drehrichtung). zwei mögliche Sie verhalten sich daher Ausrichtungen. wie winzige Magnete. parallel energieärmer antiparallel energiereicher

Der Übergang von einer Ausrichtung zur anderen kann durch Energiezufuhr bewirkt werden, d. h. dass die Protonen Strahlung einer bestimmten Energie (bestimmten Frequenz) absorbieren. Diese Frequenz ist nicht völlig gleich, sie ändert sich mit der chemischen Umgebung des Protons. In Atomkernen mit gerader Protonenanzahl hebt sich das aber auf, weil sich die Protonen mit ihren Spins gegenseitig neutralisieren. Nur bei ungerader Anzahl von Protonen im Kern kann der Effekt beobachtet werden. Solche Kerne sind 19 F und 31 P, vor allem aber Wasserstoff 1 H.

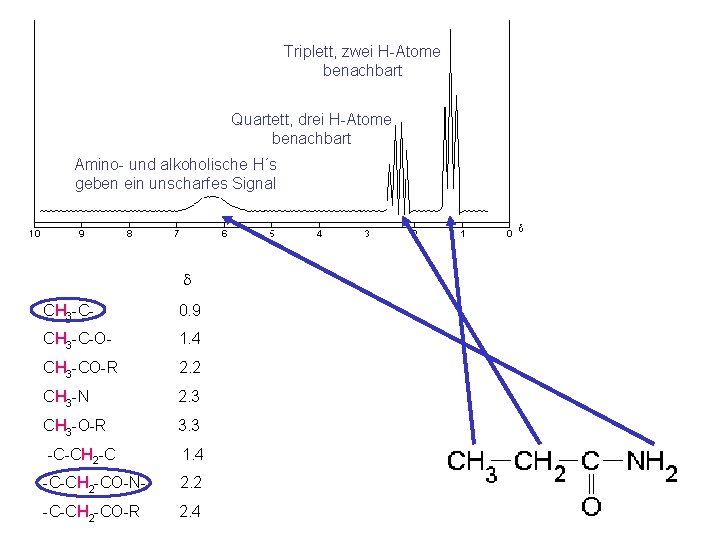
Das hätte wenig Sinn, wenn man damit Wasserstoff nur nachweisen könnte. d CH 3 -C- 0. 9 Doch da das Signal von der chemischen Umgebung abhängt, kann man feststellen, WIE diese Wasserstoffe gebunden sind. CH 3 -C-O- 1. 4 CH 3 -CO-R 2. 2 CH 3 -N 2. 3 CH 3 -O-R 3. 3 -C-CH 2 -C 1. 4 -C-CH 2 -CO-N- 2. 2 -C-CH 2 -CO-R 2. 4

Und dann gibt es noch eine ganz besondere Spezialität: Wasserstoffe lassen sich nämlich auch von anderen Wasserstoffen beeinflussen, die in unmittelbarer Umgebung stehen. Da der Energieunterschied gering ist, sind Wasserstoffe etwa zu 50% parallel, zu 50% antiparallel. Ein anderer Wasserstoff daneben spaltet das eigene Signal daher im Verhältnis 1: 1 auf und zeigt so ein doppeltes Signal.

Bei zwei Wasserstoffen, gibt es drei Möglichkeiten: beide parallel einer parallel, der andere antiparallel, bzw. einer antiparallel, der andere parallel beide antiparallel Benachbarte Wasserstoffe spalten daher ihre Signale in ein Triplett im Verhältnis 1: 2 : 1 auf.

Und das geht so weiter, bei drei Wasserstoffen haben wir vier Möglichkeiten, die acht möglichen Kombinationen entsprechen: 1 x alle parallel 3 x zwei parallel, eins antiparallel 3 x eins parallel, zwei antiparallel 1 x alle antiparallel Benachbarte Wasserstoffe spalten daher ihre Signale in ein Quartett im Verhältnis 1: 3: 3 : 1 auf.

So etwa sieht ein NMR-Labor aus.

Triplett, zwei H-Atome benachbart Quartett, drei H-Atome benachbart Amino- und alkoholische H´s geben ein unscharfes Signal d CH 3 -C- 0. 9 CH 3 -C-O- 1. 4 CH 3 -CO-R 2. 2 CH 3 -N 2. 3 CH 3 -O-R 3. 3 -C-CH 2 -C 1. 4 -C-CH 2 -CO-N- 2. 2 -C-CH 2 -CO-R 2. 4

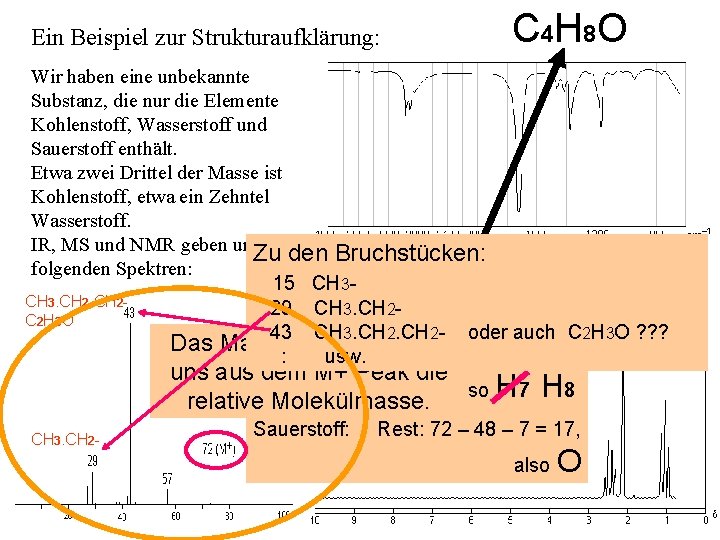
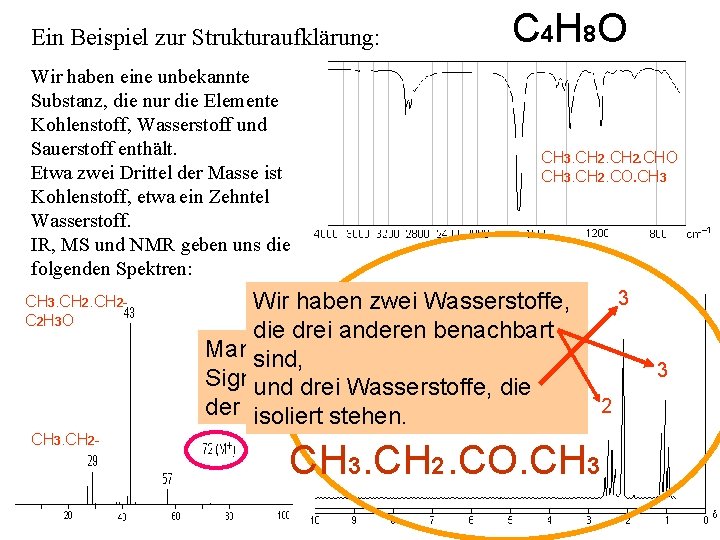
Ein Beispiel zur Strukturaufklärung: C 4 H 8 O Wir haben eine unbekannte Substanz, die nur die Elemente Kohlenstoff, Wasserstoff und Sauerstoff enthält. Etwa zwei Drittel der Masse ist Kohlenstoff, etwa ein Zehntel Wasserstoff. IR, MS und NMR geben uns die Zu den Bruchstücken: folgenden Spektren: Kohlenstoff: zwei Drittel von 72 = 48, 15 CH 3. CH 2 - 29 CH 3. CH 2 also 4 C 2 H 3 O 43 CH 3. CH 2 - oder auch C 2 H 3 O ? ? ? Das Massenspektrum gibt Wasserstoff: ein Zehntel von 72 = 7, : usw. C uns aus dem M+ Peak die also also H 7 H H 87 relative Molekülmasse. CH 3. CH 2 - Sauerstoff: Rest: 72 – 48 – 7 = 17, also O

Ein Beispiel zur Strukturaufklärung: Wir haben eine unbekannte Substanz, die nur die Elemente Kohlenstoff, Wasserstoff und Sauerstoff enthält. Etwa zwei Drittel der Masse ist Kohlenstoff, etwa ein Zehntel Wasserstoff. IR, MS und NMR geben uns die folgenden Spektren: CH 3. CH 2 - C 2 H 3 O cm-1 3400 H N 2 2900 H 3 C gibt es nicht , -CH 2 CH 3. CH 2 - C C und C C gibt es nicht 2000 -2400 >1700 C <1700 + 1600 C 0 Aldehyde, Ketone, Ester 0 Säureamide 1500 Fingerprintbereich gibt es nicht C 4 H 8 O CH 3. CH 2. CHO CH 3. CH 2. CO. CH 3 R-COO-R

Ein Beispiel zur Strukturaufklärung: Wir haben eine unbekannte Substanz, die nur die Elemente Kohlenstoff, Wasserstoff und Sauerstoff enthält. Etwa zwei Drittel der Masse ist Kohlenstoff, etwa ein Zehntel Wasserstoff. IR, MS und NMR geben uns die folgenden Spektren: CH 3. CH 2 - C 2 H 3 O CH 3. CH 2 - C 4 H 8 O CH 3. CH 2. CHO CH 3. CH 2. CO. CH 3 Wir haben zwei Wasserstoffe, die drei anderen benachbart Man kann aus der Fläche der sind, Signale das Mengenverhältnis und drei Wasserstoffe, die der Wasserstoffe bestimmen isoliert stehen. C . CO. C H 3 H 2 H 3 3 3 2

Ein Beispiel zur Strukturaufklärung: Wir haben eine unbekannte Substanz, die nur die Elemente Kohlenstoff, Wasserstoff und Sauerstoff enthält. Etwa zwei Drittel der Masse ist Kohlenstoff, etwa ein Zehntel Wasserstoff. IR, MS und NMR geben uns die folgenden Spektren: C 4 H 8 O CH 3. CH 2. CHO CH 3. CH 2. CO. CH 3 Ende der Präsentation d 3 CH 3. CH 2 - CH 3 -C- 0. 9 C 2 H 3 O CH 3 -C-O- 1. 4 CH 3. CH 2 - CH 3 -CO-R 2. 2 3 CH 3 -N 2. 3 2 CH 3 -O-R 3. 3 -C-CH 2 -C 1. 4 -C-CH 2 -CO-N- 2. 2 -C-CH 2 -CO-R 2. 4 C . CO. C H 3 H 2 H 3
 Musik
Musik Den gode den onde og den grusomme
Den gode den onde og den grusomme Den gode den onde den grusomme
Den gode den onde den grusomme Prsentation
Prsentation Prsentation powerpoint
Prsentation powerpoint Prsentation
Prsentation Baumnetz sternnetz
Baumnetz sternnetz Die mier en die sprinkaan fabel
Die mier en die sprinkaan fabel Man kann den menschen nur vor den kopf schauen
Man kann den menschen nur vor den kopf schauen Vsade tam kde su ludia zideni
Vsade tam kde su ludia zideni Ny karakterskala
Ny karakterskala Die vier kerzen geschichte pdf
Die vier kerzen geschichte pdf Wie kommt eine giraffe in den kühlschrank
Wie kommt eine giraffe in den kühlschrank Wenn die seele durch den körper spricht
Wenn die seele durch den körper spricht Coca cola mit aroma bringt den opa auf die oma
Coca cola mit aroma bringt den opa auf die oma Medium termyn doelwitte
Medium termyn doelwitte Die pad van waarheid
Die pad van waarheid Pad van waarheid tot die lewe
Pad van waarheid tot die lewe Du machst mich immer noch verrückt nach all jahren
Du machst mich immer noch verrückt nach all jahren Die hippies die
Die hippies die Die pad van waarheid tot die lewe
Die pad van waarheid tot die lewe Lydende vorm sinne
Lydende vorm sinne Die kinder verbringen die ferien
Die kinder verbringen die ferien