INFECCIN ASOCIADA A CATTER Clnica Mdica Htal Pirovano





































- Slides: 46

INFECCIÓN ASOCIADA A CATÉTER Clínica Médica. Htal. Pirovano. 2015

INTRODUCCIÓN Primera causa de bacteriemia nosocomial. 90% asociada a catéteres venosos centrales. IAC 3° causa de infecciones nosocomiales asociadas a dispositivos biomédicos, luego de ITU asociada a sonda vesical y neumonía asociada a respirador. 50% en UTI. Las bacteriemias nosocomiales aumentan los costos de atención, prolongan la internación y aumentan la morbi-mortalidad.

FACTORES DE RIESGO DEL PACIENTE: DEL CATÉTER: Enfermedades crónicas. Duración. Trasplante de M. O. Material. Inmunodeficiencias, en especial neutropenia. Femoral y yugular interna vs. Subclavia. Malnutrición. Habilidad de quien realiza el procedimiento. Nutrición parenteral total. Condiciones de la colocación. Antecedente de infección asociada a catéter. Cuidado del sitio. Extremos de la vida. Hiperalimentación y hemodiálisis. Pérdida de integridad cutánea, quemados. No tunelizados> completamente implantables. Catéteres no impregnados con ATB.

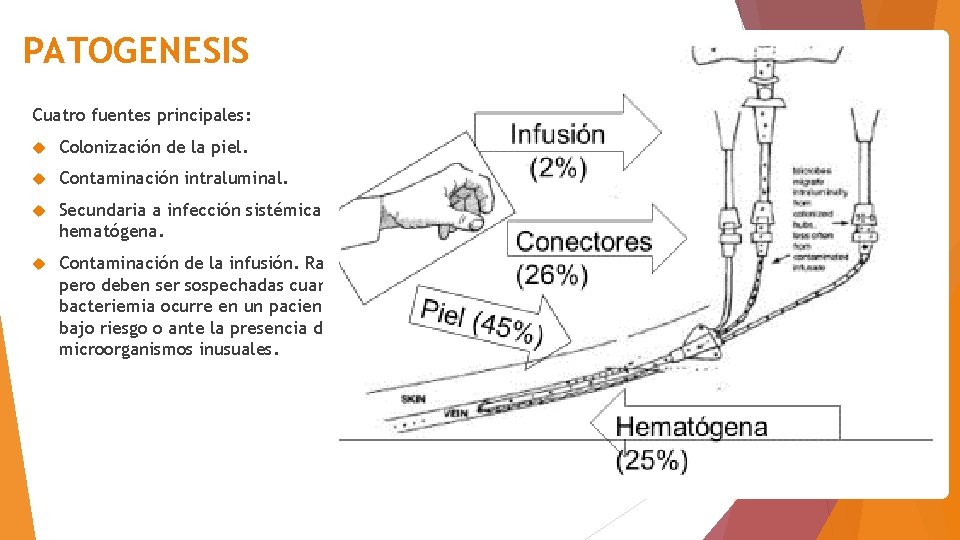
PATOGENESIS Cuatro fuentes principales: Colonización de la piel. Contaminación intraluminal. Secundaria a infección sistémica por vía hematógena. Contaminación de la infusión. Raras pero deben ser sospechadas cuando la bacteriemia ocurre en un paciente de bajo riesgo o ante la presencia de microorganismos inusuales.

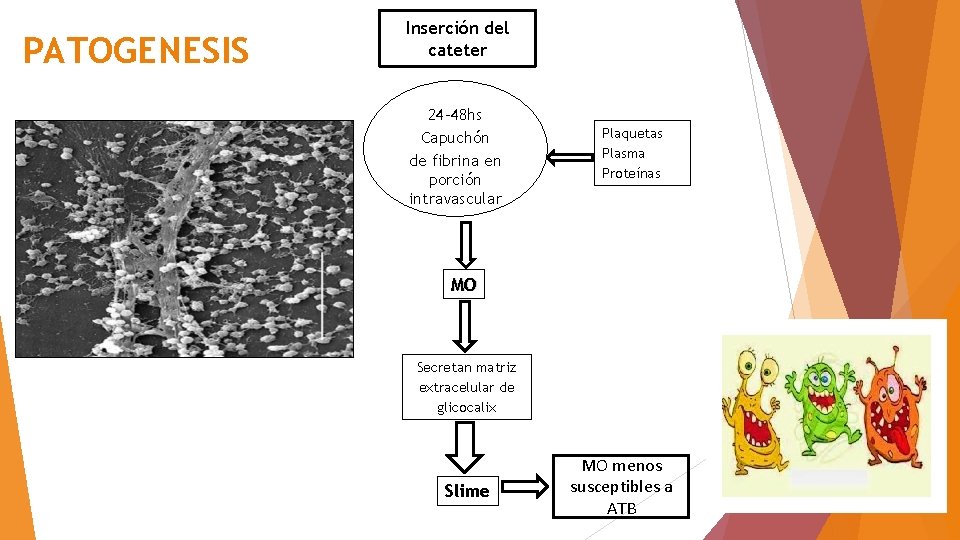
PATOGENESIS Inserción del cateter 24 -48 hs Capuchón de fibrina en porción intravascular Plaquetas Plasma Proteínas MO Secretan matriz extracelular de glicocalix Slime MO menos susceptibles a ATB

ETIOLOGÍA Estudio prospectivo SCOPE 49 hospitales en los Estados Unidos (1995 -2002) Proyecto Validar 107 hospitales en Argentina (juliodiciembre 2004) Staphylococco Coagulasa-negativo – 31% S. Aureus 30% Staphylococcus aureus – 20% SCN 17% Enterococco – 9% Candida species – 9% P. Aeruginosa 9% Escherichia coli – 6% Acinetobacter 9% Klebsiella species – 5% Enterecoco fecalis 5% Pseudomonas species – 4% Klebsiella 5% Enterobacter species – 4% Serratia species – 2% Acinetobacter baumannii – 1% E. coli 2% Candida 2%

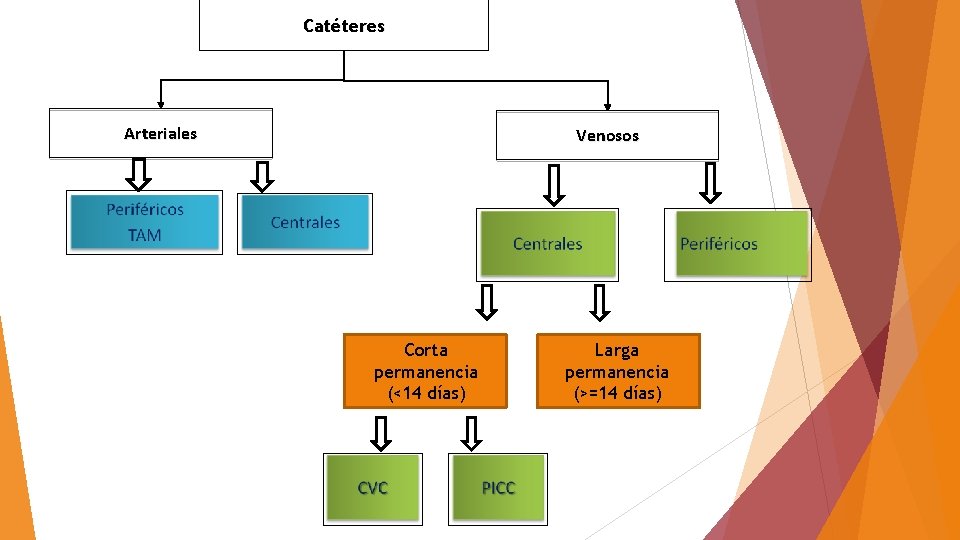
Catéteres Arteriales Venosos Corta permanencia (<14 días) Larga permanencia (>=14 días)

DISPOSITIVOS UTILIZADOS FRECUENTEMENTE CATÉTER VENOSO PERIFÉRICO Generalmente insertado en venas de antebrazo o mano Es el dispositivo intravascular de corto plazo más utilizado

DISPOSITIVOS UTILIZADOS FRECUENTEMENTE CATÉTER ARTERIAL PERIFÉRICO: Generalmente de corto uso: monitoreo de estado hemodinámico, gasometría arterial, etc. El riesgo de infección parece ser similar a la de los catéteres venosos centrales.

DISPOSITIVOS UTILIZADOS FRECUENTEMENTE VÍA CENTRAL DE CORTA DURACIÓN: La forma de catéter central más utilizada Causa de la mayor parte de infecciones asociada a catéteres

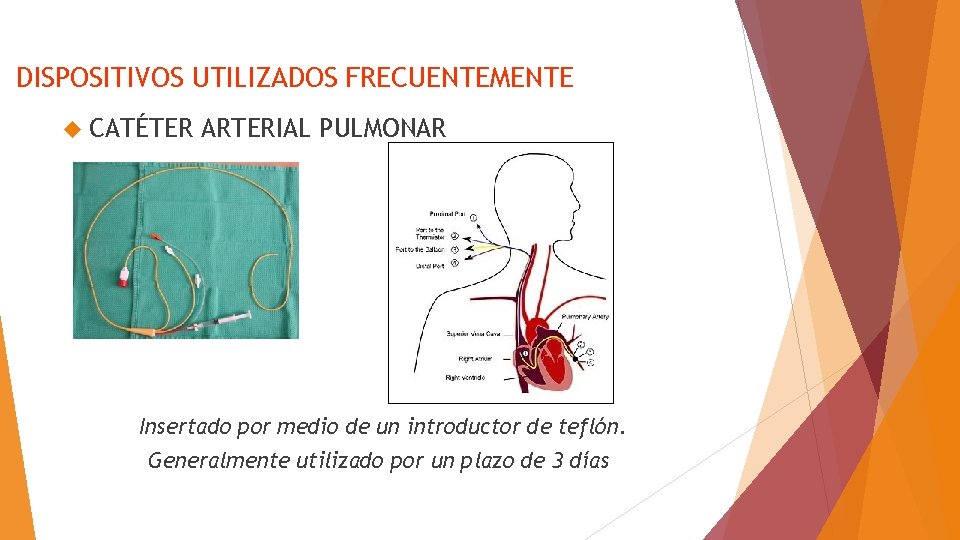
DISPOSITIVOS UTILIZADOS FRECUENTEMENTE CATÉTER ARTERIAL PULMONAR Insertado por medio de un introductor de teflón. Generalmente utilizado por un plazo de 3 días

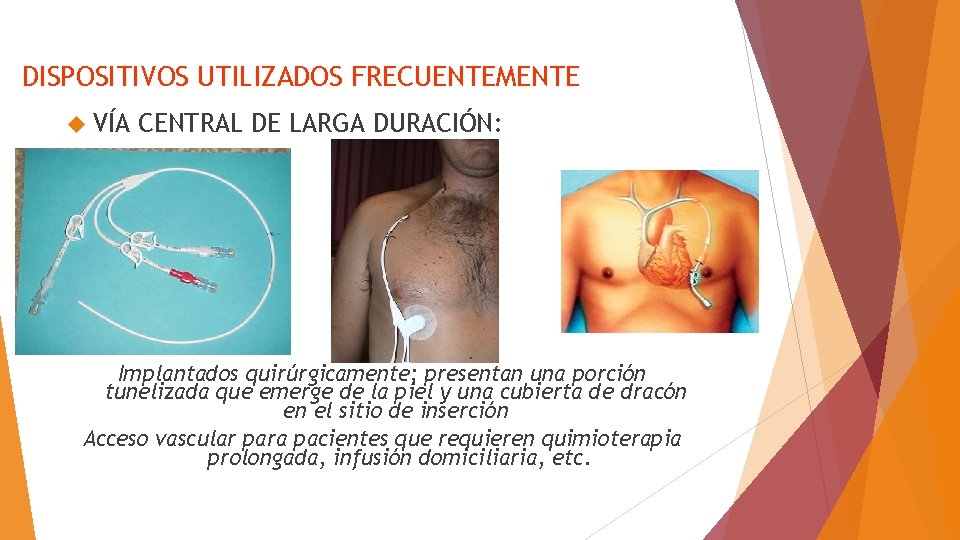
DISPOSITIVOS UTILIZADOS FRECUENTEMENTE VÍA CENTRAL DE LARGA DURACIÓN: Implantados quirúrgicamente; presentan una porción tunelizada que emerge de la piel y una cubierta de dracón en el sitio de inserción Acceso vascular para pacientes que requieren quimioterapia prolongada, infusión domiciliaria, etc.

DISPOSITIVOS UTILIZADOS FRECUENTEMENTE DISPOSITIVO TOTALMENTE IMPLANTABLE: (port-a-cath) Contiene un reservorio subcutáneo (port) con un tabique auto-sellante al cual se accede con una aguja a través de la piel intacta. Asociado a baja tasa de infección.

DIAGNÓSTICO Sospecha Clínica Cultivos

SOSPECHA DIAGNÓSTICA Fiebre sin foco infeccioso evidente en un paciente cateterizado por un mínimo de 3 días (alta sensibilidad). Inflamación y/o supuración en el sitio de inserción del catéter (alta especificidad). Hemocultivos positivos (SA, SCN, Cándida spp. ) sin otro foco probable. Mejoría clínica luego de 24 hs de removido el catéter. Signos de sepsis que comienzan súbitamente luego de iniciada la infusión (sepsis asociada a infusión). Inestabilidad hemodinámica, alteración estado de conciencia, disfunción de catéter (como ocurre con el coágulo intraluminal). Complicaciones: tromboflebitis supurada, endocarditis, osteomielitis, infección metastásica.

RECOLECCIÓN DE LA MUESTRA TIPOS DE MUESTRA: 1. CULTIVO DE CATÉTER 2. EXUDADO DEL SITIO DE INSERCIÓN 3. RETROCULTIVO (CULTIVO TRANSCATETER) 4. CULTIVO DE SANGRE VENOSA PERIFÉRICA

CULTIVO DEL CATÉTER SIEMPRE que exista indicación de remoción del catéter en el contexto de sospecha de infección. NUNCA en forma rutinaria. En el caso de las vías centrales, se debe cultivar la punta del catéter (5 cm proximales) y no el segmento subcutáneo. COLONIZACIÓN: con recuentos > 15 UFC para cultivos semi-cuantitativos (roll-plate) > 10 2 UFC para cultivos cuantitativos (sonication) CATÉTERES DE CORTA DURACIÓN (<14 días) Se recomienda el método roll-plate Catéter arterial pulmonar: cultivar la punta del introductor CATÉTERES DE LARGA DURACIÓN (> 14 días) El crecimiento < 15 UFC en cultivos semicuantiativos del sitio de inserción y retrocultivo del mismo MO, sugiere fuente distinta al catéter En caso de remover el reservorio subcutáneo (port) por sospecha de infección cultivar el mismo además de la punta.

PROCESAMIENTO DE LA MUESTRA CULTIVO SEMICUANTITATIVO: (superficie externa del dispositivo) Método de Maki / Roll-Plate: (1977): consiste en rodar la superficie externa de la punta del catéter en una placa de agar y contar las unidades formadoras de colonias luego de la incubación. Indicado en catéteres de corta duración (< 14 días) � CULTIVO CUANTITATIVO: (superficie interna del dispositivo) Métodos de dilución: Método de Cleri (1980) Modificación de Linares (1985) Método de Bruñí-Buisson (1987) Sonication: aplica ondas sonoras para desprender las bacterias de la superficie interna del catéter. Indicado en catéteres de larga duración (>14 días)

EXUDADO DEL SITIO DE INSERCIÓN En caso de sospechar infección asociada a catéter, de existir secreción purulenta del sitio de infección, SIEMPRE recolectar muestra para realizar tinción de Gram y cultivo

RETROCULTIVO Tomar SIEMPRE una muestra trans-catéter en el caso de sospechar infección asociada a catéter en aquellos casos que no vaya a ser removido y cultivado el dispositivo. OBJETIVO: demostrar la colonización del dispositivo. PROCEDIMIENTO: Siempre tomar la muestra antes de iniciar el tratamiento antibiótico. Limpiar el conector con tintura de yodo, alcohol o clorhexidina alchólica (> 0, 5%) y dejar secar (previene la contaminación). El retocultivo debe parearse con una muestra de sangre periférica: El volumen del retrocultivo y sangre periférica debe ser el mismo. Rotular las botellas adecuadamente. En caso de no poder obtenerse una muestra de vena periférica, se pueden obtener 2 o más muestras de diferentes lúmenes.

CULTIVO DE SANGRE VENOSA SIEMPRE deberá tomarse al menos una muestra de vena periférica parear con el cultivo del catéter o el retrocultivo. OBJETIVO: demostrar la diseminación hematógena del germen que coloniza el dispositivo. PROCEDIMIENTO: Tomar la muestra antes de iniciar el tratamiento antibiótico. Limpiar la piel con alcohol o tintura de yodo o clorhexidina alchólica (> 0, 5%) y dejar secar.

INTERPRETACIÓN DE LOS CULTIVOS PUNTA DE CATÉTER + CULTIVO DE SANGRE PERIFÉRICA: Recuento significativo del mismo microorganismo en el cultivo de la punta de catéter y sangre periférica. RETROCULTIVO + CULTIVO DE SANGRE PERIFÉRICA: Recuento en el retrocultivo 3 veces superior del mismo microorganismo con respecto al cultivo de sangre periférica. Tiempo diferencial hasta positividad (DTP): detección del crecimiento dos horas antes en el retrocultivo con respecto a la muestra periférica. RETROCULTIVO + RETROCULTIVO: (distinto lumen) Recuento de colonias al menos 3 veces mayor en la muestra de un lumen con respecto a la del otro. DTP: no se estableció criterio.

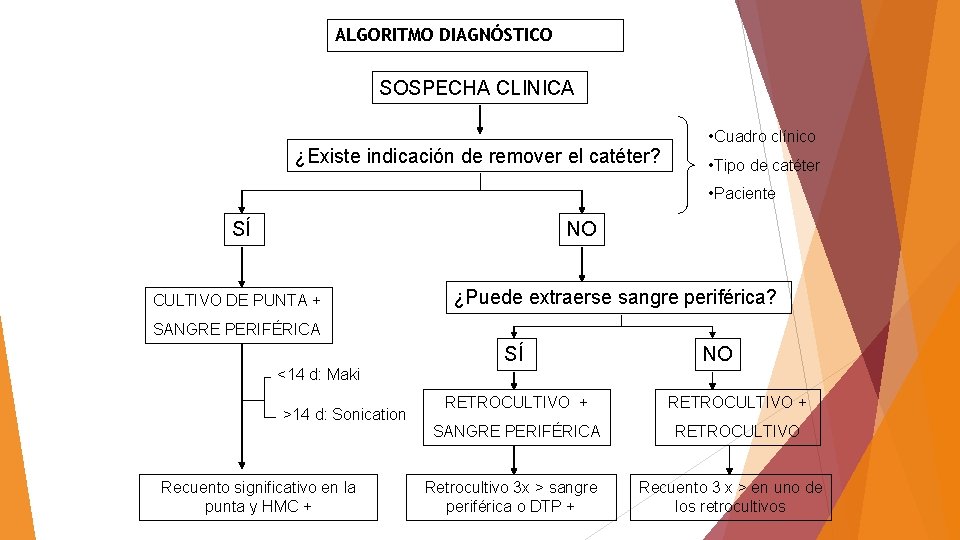
ALGORITMO DIAGNÓSTICO SOSPECHA CLINICA ¿Existe indicación de remover el catéter? • Cuadro clínico • Tipo de catéter • Paciente SÍ NO CULTIVO DE PUNTA + ¿Puede extraerse sangre periférica? SANGRE PERIFÉRICA SÍ NO <14 d: Maki >14 d: Sonication Recuento significativo en la punta y HMC + RETROCULTIVO + SANGRE PERIFÉRICA RETROCULTIVO Retrocultivo 3 x > sangre periférica o DTP + Recuento 3 x > en uno de los retrocultivos

CRITERIOS DIAGNÓSTICOS Establecer la presencia de infección del torrente sanguíneo, demostrando que la infección está relacionada con el catéter (por ejemplo, hay no hay fuentes alternativas para el bacteriemia). Confirmación microbiológica basada en cultivos de sangre obtenidos antes del inicio de la terapia antibiótica. 1 de los siguientes: Cultivo + para el mismo organismo en la punta del catéter y al menos un hemocultivo periférico. Cultivo del mismo microorganismo de por lo menos 2 muestras de sangre (del lumen y la otro de una muestra periférica o de un segundo lumen) cumpliendo los criterios de cuantitividad o el tiempo diferencial a la positividad.

TRATAMIENTO 1°-QUÉ HACER CON EL CATETER?

REMOCIÓN— Tras el diagnóstico de infección relacionada con el catéter, retirar el catéter SIEMPRE: Sepsis severa. Inestabilidad hemodinámica. Endocarditis o evidencia de infección metastásica. Eritema o exudado por tromboflebitis supurativa. Bacteriemia persistente tras 72 horas de terapia antimicrobiana ajustada a sensibilidad. Bacteriemia persistente después de 72 horas de tratamiento ATB adecuado.

REMOCIÓN— Naturaleza del patógeno. Catéteres de corto plazo (< 14 días) removerse si infección asociada al catéter es debido a Staphylococcus aureus, enterococos, bacilos gramnegativos, hongos y micobacterias. Catéteres a largo plazo (≥ 14 días) deben eliminarse si es debido a S. aureus, Pseudomonas aeruginosa, hongos o micobacterias. No hay ninguna evidencia para apoyar el cambio rutinario del catéter. No es necesario para pacientes hemodinámicamente estables con fiebre inexplicada en ausencia de infección del torrente sanguíneo y sin material protésico endovascular.

RESCATE — Tras el diagnóstico de infección asociada a catéter, el rescate del catéter se puede intentar en IAC no complicada con catéteres a largo plazo debido a patógenos NO S. aureus, p. aeruginosa, hongos o micobacterias Si se intenta salvar, puede administrarse terapia de bloqueo sistémico y antimicrobiana a través del catéter colonizado por la duración del tratamiento, dependiendo del microorganismo. La eficacia de la terapia de bloqueo antibiótico sigue siendo incierta y se han planteado preocupaciones acerca de la aparición de resistencia a los antimicrobianos y sobreinfección micótica. Realizar dos juegos de hemocultivos después de 72 horas de terapia antimicrobiana apropiada; los cultivos positivos deben incitar la retirada del catéter.

CAMBIO GUIADO POR CUERDA DE PIANO — Circunstancias en que retirar el catéter es necesario por la sospecha de infección asociada al catéter y el riesgo de complicaciones mecánicas o sangrado durante la reinserción es alta (excepto en el contexto de sepsis). La punta del catéter retirado debe enviarse para cultivo. Si los resultados son positivos o si hay evidencia de flebitis, trombosis o purulencia, debe ser reubicado en un sitio diferente.

TRATAMIENTO 2°-TERAPIA EMPÍRICA

TERAPIA EMPÍRICA — La elección inicial de antibióticos depende de las circunstancias clínicas, incluyendo la severidad de la enfermedad, los factores de riesgo para la infección y los patógenos probablemente asociados con el dispositivo intravascular específico. SCN: causa más común de infección relacionada con catéter; la mayoría de aislamientos son resistentes a la meticilina. Vancomicina. En instituciones con tasas elevadas de infección debido a SAMR concentración mínima inhibitoria (CMI) ≥ 2 mcg/Ml a vancomicina, se recomienda un agente alternativo como daptomicina. Sobre todo en el marco del fracaso clínico de vancomicina en la ausencia de infección metastásica. Linezolid no es un agente apropiado para el tratamiento empírico de IAC.

TERAPIA EMPÍRICA — La cobertura empírica para organismos gram-negativos depende de circunstancias individuales y la severidad de la enfermedad. Neutropenia. Sepsis. Antecedente de colonización por BGN. ATB: cefalosporinas de cuarta generación, carbepenemos, β-lactámico/inhibidor de β-lactamasa con o sin aminoglucósido.

TERAPIA EMPÍRICA —CANDIDEMIA. Pacientes sépticos con los siguientes factores de riesgo: Nutrición parenteral total. Uso prolongado de antibióticos de amplio espectro. Enfermedad onco-hematológica. Trasplante de M. O. u órganos sólidos. Catéter femoral. Colonización por Candida species. Agentes: equinocandina o azoles. Fluconazol: sin exposición a azoles en los tres meses anteriores y en entornos donde el riesgo de Candida krusei o Candida glabrata es muy bajo.

TERAPIA EMPÍRICA — Tras inicio de terapia antibiótica empírica, ajustar a los resultados de cultivo y susceptibilidad según sea necesario cuando los datos estén disponibles.

TERAPIA EMPÍRICA — Duración— Depende de las circunstancias clínicas. Si no hay complicaciones con hemocultivos negativos después de retirar el catéter y con la terapia antibiótica apropiada, 10 a 14 días (día 1 es el primer día en el que se obtienen hemocultivos negativos). La duración del tratamiento puede ampliarse 4 a 6 semanas en pacientes con colocación reciente de válvula protésica, aunque la investigación no logra demostrar la evidencia de la IE. Pacientes con bacteriemia persistente > 72 horas después de retirar el catéter generalmente deben recibir tratamiento durante al menos cuatro a seis semanas. Para los pacientes con complicaciones relacionadas con la bacteriemia (como la tromboflebitis supurada, endocarditis, osteomielitis, infección metastásica), la duración de la terapia se debe adaptar en consecuencia.



SEGUIMIENTO— Vigilancia estrecha. Recaídas o signos de infección metastásica. Realizar hemocultivos después de iniciado el tratamiento para demostrar clearence de la bacteriemia. Bacteriemia persistente — Hemocultivos persistentemente positivos o síntomas 72 horas después de la extracción del catéter + tratamiento antibiótico adecuado: Sospechar complicaciones incluyendo tromboflebitis supurada, endocarditis y focos metastáticos de infección.

PREVENCIÓN

PREVENCIÓN Adherencia estricta a las recomendaciones de higiene de manos y el uso de técnicas asépticas durante la colocación y cambio de apósitos. Otras medidas: Elegir el sitio adecuado. Utilizar un catéter de material adecuado. Usar las barreras de precaución durante la colocación. Cambio del catéter a intervalos apropiados. Asegurar el cuidado apropiado del sitio de inserción. Retirar el catéter cuando este ya no sea necesario.

Medidas de prevenciòn Higiene de manos: ü Al entrar y salir de UTI ü Antes y después de tocar al paciente ü Antes y después de tocar sitio de inserción del catéter ü Antes y después de insertar, cambiar, reacomodar o cubrir un CVC EL USO DE GUANTES NO EXCLUYE EL LAVADO DE MANOS (IA)

Medidas de prevención Higiene de manos: Jabón antiséptico • Mojar las manos • Aplicar solución antiséptica. • Friccionar toda la superficie de las manos y entre los dedos, por lo menos entre 10 y 15 segundos, poniendo especial atención al lavado de las uñas. • Enjuagar vigorosamente. • Secar las manos con toallas descartables o de primer uso. Las mismas deben ser de buena calidad. • Con canillas accionadas a mano o usar toallas para cerrarlas. • El tiempo recomendado para la duración del procedimiento es de 60 segundos

Medidas de prevención Higiene de manos: Alcohol en gel • Solo debe utilizarse esta técnica con manos visiblemente limpias • Aplicar suficiente cantidad de solución alcohólica. • Extender cubriendo toda la superficie de la mano incluyendo los dedos y entre los dedos • Friccionar vigorosamente las manos hasta que la solución se seque (30 segundos) • La piel de las manos no debe quedar mojada con alcohol; si es así, la asepsia no fue efectiva. • El alcohol se debe evaporar con la fricción, nunca agitando las manos

Medidas de prevención Inserción de catéter centrales Uso de gorro, barbijos, camisolines, guantes estériles Uso de campo estéril grande. Antisepsia cutánea. - Desinfectar la piel limpia con un antiséptico apropiado antes de la inserción del catéter y durante el cambio de apósitos. Puede utilizarse tintura de yodo, un yodóforo o alcohol al 70%. Si se dispone utilizar clorhexidina al 2% (IA) - Permitir que el antiséptico quede en el sitio de inserción y se seque antes de la inserción del catéter. Permitir que la yodopovidona quede en la piel durante 2 minutos o más si es que no está seco antes de la inserción (IB) - No aplicar solventes orgánicos (p. e: acetona y éter) a la piel antes de la inserción del catéter o durante el cambio de apósitos (IA)

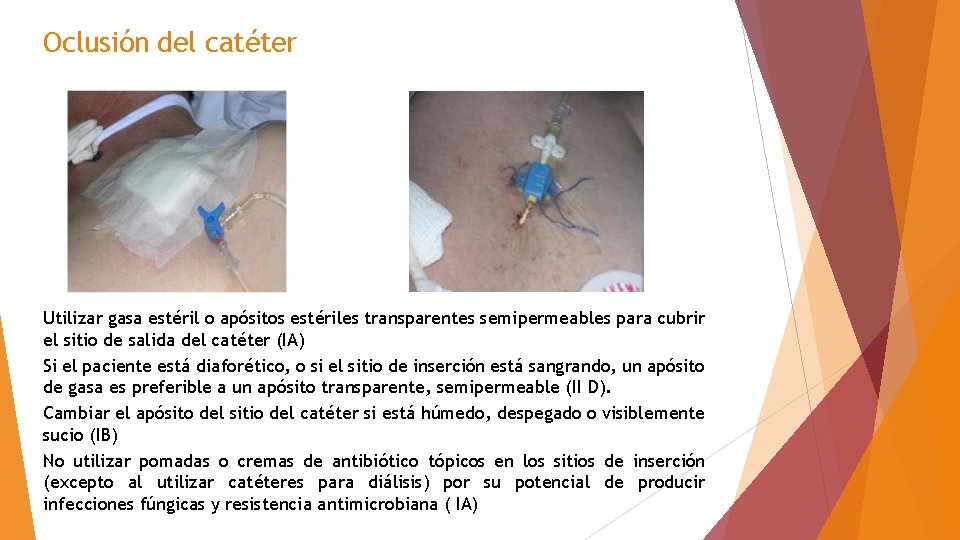
Oclusión del catéter Utilizar gasa estéril o apósitos estériles transparentes semipermeables para cubrir el sitio de salida del catéter (IA) Si el paciente está diaforético, o si el sitio de inserción está sangrando, un apósito de gasa es preferible a un apósito transparente, semipermeable (II D). Cambiar el apósito del sitio del catéter si está húmedo, despegado o visiblemente sucio (IB) No utilizar pomadas o cremas de antibiótico tópicos en los sitios de inserción (excepto al utilizar catéteres para diálisis) por su potencial de producir infecciones fúngicas y resistencia antimicrobiana ( IA)

MUCHAS GRACIAS!!!!