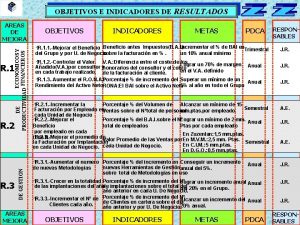
Indicadores Indicadores de neutralizacin En una reaccin volumtrica






















- Slides: 24

Indicadores

Indicadores de neutralización • En una reacción volumétrica de neutralización, la cuestión fundamental esta en conocer con exactitud el punto en el cual la cantidad del acido ha neutralizado a la cantidad equivalente de la base; ese punto llamado neutro o de equivalencia, no corresponde siempre a un p. H = 7, sino que puede ser también mayor o menor según que la sal formada tienda a hidrolizarse; ese valor del p. H dependerá de la concentración de la solución y de la naturaleza de los iones del acido y de la base.

Neutralización (métodos) • El punto de equivalencia en una neutralización puede ser conocido por dos métodos distintos; uno de ellos consiste en medir el p. H de la solución por el sistema electrométrico; el otro se basa en el uso de ciertas sustancias llamadas indicadores, las cuales, al cambiar de coloración hacen posible el conocer el p. H de la solución.

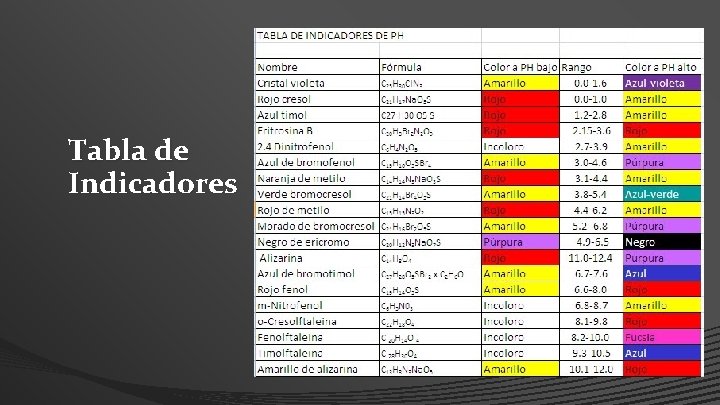
Indicadores • Los indicadores usados en alcalimetría y acidimetría son sustancias orgánicas de carácter ácido o básico muy débil, y que tienen la propiedad de cambiar de coloración cuando el medio pasa de un p. H determinado a otro.

• Un indicador cambia de coloración cuando pasa del estado no disociado al estado iónico, estando supeditado este cambio a la concentración de los iones hidrogeno de la solución. (Ostwald - 1891). • El cambio de coloración de los indicadores es debido a una modificación de su constitución; según Hantzsch, los indicadores son sustancias que pueden existir en dos formas tautómeras, a cada una de las cuales corresponde un color diferente (hay casos en que una de las formas tautómeras es incolora).

• Siendo los indicadores ácidos o bases cuya constante de disociaciones muy pequeña, el equilibrio de sus iones será similar al de los ácidos y las bases débiles comunes, y estarán sujetos, como estos, a los efectos del ion común y de la neutralización, fenómenos que son la causa directa del cambio de coloración.


• De los dos tipos de iones de este indicador ácido, los iones H+ no poseen color, en cambio los iones In- son coloridos; si la concentración de estos últimos es muy pequeña, su color no es perceptible al ojo humano; pero si disminuimos [H+], por unión con OH- para dar H 2 O, y como K no puede alterarse, deberá aumentar [In-], siendo entonces cuando se pone de manifiesto su color.

Tabla de Indicadores

Zona de Viraje • Ese espacio dentro del cual varia la coloración se denomina intervalo o zona de viraje, y aunque su magnitud corresponde, como se dijo antes a dos unidades de p. H mas o menos, este limite depende en parte del observador y del tipo de indicador.

Zona de Viraje • Cuando los indicadores son coloridos en un medio e incoloros en otro, dentro de la zona de viraje no se presentan mezclas de coloraciones, sino solo diferentes tonalidades; pero si el indicador tiene un color en medio acido y otro en medio alcalino, en el intervalo se percibe, en la mayoría de los casos, un tintermedio, producto de la mezcla de aquellos, que se denomina tinte o color de transición.

Cambios de estructura de los indicadores FENOLFTALEÍNA Y ANARANJADO DE METILO

Fenolftaleína • Esta substancia orgánica tiene carácter acido muy débil; al estado no disociado es incolora y su formula de constitución es la siguiente:

Fenolftaleína • Cuando sobre la solución de este compuesto se hace actuar un hidróxido alcalino, se forma una sal constituida por un acido débil (fenolftaleína), y una base fuerte (hidróxido alcalino); esa sal se ioniza fuertemente, encontrándose en la solución suficiente concentración de los iones coloridos para que pueda ser percibida la coloración roja.

Fenolftaleína • Ahora bien, al formarse la sal, el compuesto sufrió un cambio en la estructura molecular, en la siguiente forma:

En General • La fenolftaleína es un indicador propio para la titulación de ácidos orgánicos e inorgánicos, así como de bases fuertes, pero no de bases débiles; su zona de viraje esta entre p. H 8. 3 y 10.

Anaranjado de Metilo • Esta sustancia es muy empleada como indicador en el análisis volumétrico por neutralización; se la conoce también bajo otros nombres, como Heliantina, Tropeolina D, etc. , y se encuentra en el comercio tanto en la forma del acido libre como de su sal de sodio. La formula del acido es la siguiente:

Anaranjado de Metilo • En soluciones diluidas o en presencia de iones OH- este compuesto tiene color amarillo, o sea el color que corresponde a la molécula disociada. • Si por la adición de un acido se aumenta la concentración de iones (hidrogeno), la molécula restringe su ionización y adquiere el color rojo.

Anaranjado de Metilo • En la zona de viraje del color amarillo (solución alcalina) al color, rojo (solución acida), se obtiene un tintermedio de un tono naranja rosado; esa zona queda comprendida entre p. H 3. 1 y 4. 4. • Este indicador es empleado en la titulación de bases fuertes y de bases débiles, como KOH, Na. OH, Ba(OH)2 y NH 4 OH, así como de ácidos fuertes, pero no en la valoración de ácidos débiles como el acético o el oxálico.

• Empleando este indicador en titulaciones con soluciones 0. 2 N o mas concentradas, se obtienen virajes precisos, pero titulando con soluciones 0. 1 N, el cambio de coloración es menos definido y es necesario acostumbrarse al tintermedio naranja-rosado. Es por eso que se aconseja el uso de testigos y realizar el viraje en un orden.

Curvas de Neutralización

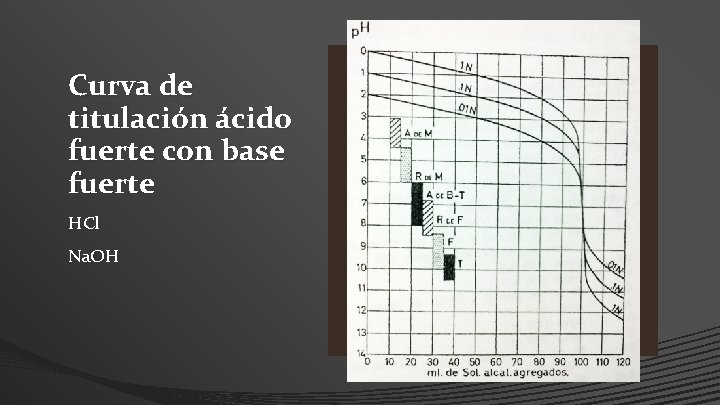
Cuervas de Neutralización • Al efectuar una titulación de un ácido con una base o viceversa, es de gran importancia tener en cuenta los cambios de concentración de H+ cerca del punto de viraje, para así elegir el indicador mas apropiado, de acuerdo con los valores de p. H entre los que tenga lugar su cambio de coloración.

Neutralización de un acido fuerte con una base fuerte • Encontrándose tanto el acido como la base fuertemente ionizados, no se presentaran fenómenos hidrolíticos, por lo que es fácil relacionar el p. H de la solución con el p. H de viraje de los indicadores.

Curva de titulación ácido fuerte con base fuerte HCl Na. OH
 Reaccin
Reaccin Reaccin
Reaccin Reaccin
Reaccin Conocimiento anticipado de algún suceso
Conocimiento anticipado de algún suceso Ejemplo de metas de una empresa
Ejemplo de metas de una empresa Los elementos de las ondas
Los elementos de las ondas Contenidos procedimentales y actitudinales
Contenidos procedimentales y actitudinales Exemplos de indicadores sociais
Exemplos de indicadores sociais La pca
La pca Cual es la estructura del pei
Cual es la estructura del pei Indicadores y metas ejemplos
Indicadores y metas ejemplos Indicador de resultado ejemplo
Indicador de resultado ejemplo Indicadores del capital intelectual
Indicadores del capital intelectual Indicadores hospitalarios
Indicadores hospitalarios Gestin mvm
Gestin mvm Matriz marco logico ejemplo proyecto social
Matriz marco logico ejemplo proyecto social Supuesto fatal
Supuesto fatal Indicadores unesco de cultura para el desarrollo
Indicadores unesco de cultura para el desarrollo Indicadores sociales en venezuela
Indicadores sociales en venezuela Indicador de vacunacion
Indicador de vacunacion Indicadores operacionales de tuberculosis
Indicadores operacionales de tuberculosis Indicadores de indicios
Indicadores de indicios Nif a 3 apendice c
Nif a 3 apendice c Indicadores evolutivos
Indicadores evolutivos Es un indicador de salud
Es un indicador de salud