In una reazione chimica come faccio a contare




























- Slides: 30

In una reazione chimica come faccio a contare gli atomi che reagiscono? C + O 2 CO 2 Non li posso contare e quindi posso ricorrrere a misurare la loro massa. Ciò vuol dire che occorre trovare una correlazione tra massa misurata di un elemento o composto ed un certo numero di particelle noto. Questo mi permette anche di avere masse misurabili su una bilancia.

La mole Le grandezze fondamentali e le unita' di misura nel Sistema Internazionale (SI) Grandezza fondamentale lunghezza Unita’ Simbolo metro m massa kilogrammo Kg tempo secondo s corrente elettrica ampere A temperatura kelvin K intensita’ luminosa candela cd quantita’ di sostanza mole mol

La mole descrive una quantità di sostanza correlandola ad un numero di particelle La mole è la quantità di sostanza che contiene un numero N di particelle quanti atomi sono contenuti in esattamente 12 g di 12 C. Il numero di particelle contenute in una mole si chiama numero o costante di Avogadro (NAo N)

La mole N = 6, 0221367(36) × 1023 Poiché N è un numero per mole, esso ha unità di misura mol-1 ed è chiamata costante di Avogadro. NA = 6, 0221367(36) × 1023 mol-1

La mole Una mole di 23 Na è la quantità di sostanza che contiene NA atomi di 23 Na

Esempi Una mole di CO 2 contiene NA molecole di CO 2 Una mole di Na. Cl contiene NA ioni Na+ e NA ioni di Cl. Una mole di Na 2 SO 4 contiene 2 NA ioni Na+ ed NA ioni di SO 42 - Una mole di Si. O 2 contiene NA atomi di Si ed 2 NA atomi di O


Massa Molare: massa in grammi di una mole di materia di una qualsiasi sostanza elementare o composta • la massa molare (M) di una qualsiasi sostanza elementare o composta è la quantità di materia in grammi che contiene un numero di atomi pari a quelli contenuti in 12 grammi di 12 C. Questo numero di atomi è un numero naturale, intero, chiamato numero di Avogadro (NA), e vale circa 6, 022 x 1023. La massa in g di una mole di 12 C è per definizione della mole uguale a 12 g.

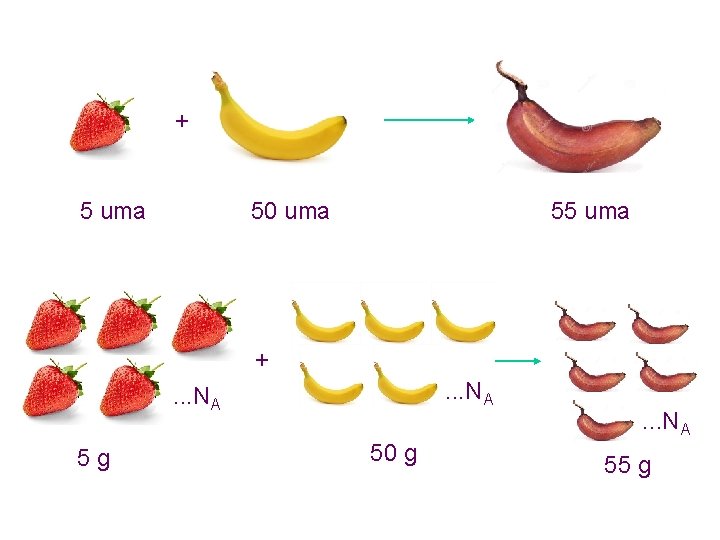
Mole e massa molare Una mole di sostanze diverse ha massa diversa !

Mole e massa molare Moli di sostanze diverse hanno massa diversa ! NA= 6, 0221367(36) × 1023 =12 C Massa di una mole =12 g NA= 6, 0221367(36) × 1023 =16 O Massa di una mole =15, 9949 g In una reazione o in una formula chimica contano le moli, non i grammi! C + O 2 CO 2 12 g di C = 1 mole di C 12 g di O 2 è meno di una mole di O 2

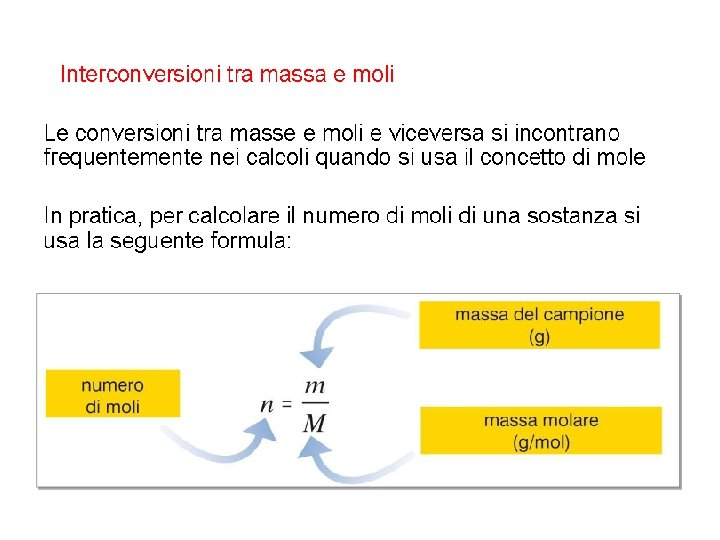
Massa molare = massa di una mole di atomi Rapporto fra massa (in grammi) e quantità di sostanza (in moli), quindi ha come unità di misura g mol-1.

Definendo la mole come la quantità di sostanza che contiene un numero di unità elementari uguale al numero di atomi contenuti in 12 g di 12 C, risulta che la massa molare ha lo stesso valore numerico del peso atomico di un singolo atomo di 12 C, esattamente 12 u. m. a. o Da Il risultato è che per tutti gli elementi il valore numerico della massa in grammi di una mole di atomi (massa molare) e il peso atomico espresso in unità di massa atomica (o Da) sono UGUALI!!!


uma


PA

Reazioni chimiche e mole In una reazione o in una formula chimica contano le moli, non i grammi! Es: C + O 2 CO 2 12 g di C reagiscono con 32 g di O 2 per dare 44 g di CO 2 Ma che corrispondono 1 mole di C, 1 mole di O 2 e una mole di CO 2 quindi allo stesso numero di particelle.

+ 5 uma 50 uma 55 uma +. . . NA 5 g 50 g . . . NA 55 g


Stechiometria: quella parte della chimica che riguarda le quantità delle specie che partecipano a reazioni n. moli= grammi/ massa molare mol =g/g*mol-1 grammi di sostanza= massa molare x n. moli Massa molare= grammi/ n. moli Per i gas: volume molare= volume/ n. moli= volume/ volume molare g=g*mol-1*mol g *mol-1 =g/mol mol =dm 3/dm 3 mol-1


Esercizi Ho un campione di zolfo che pesa 4. 07 g. (a) Quante moli di zolfo sono presenti? (b) Qual è il numero totale di atomi di zolfo nel campione? (a) n. moli= grammi/ massa molare mol =g/g*mol-1 n. moli= 4. 07 g/ 32. 07 g mol-1 = 0. 127 mol (b) n. atomi= moli x NA atomi =mol x mol-1 n. atomi= 0. 127 mol x 6. 022 x 1023 mol-1 = 7. 64 x 1022 atomi

Esercizi Ho questo composto C 2 HBr. Cl. F 3. (a) Quanti atomi di C sono presenti per mole del composto? 1 mole di C 2 HBr. Cl. F 3 contiene 2 moli C Quindi: n. atomi di C = 1 mol x 2 x 6. 022 x 1023 mol-1 = 1. 202 x 1024

Esercizi Determinare le moli di Cu. SO 4 5 H 2 O che sono contenute in 15 g? n. moli= grammi del composto/ massa molare del composto = massa atomica di Cu (63, 55) + massa atomica di S (32, 07) + 4 x massa atomica di O (15, 9994) + 10 x massa atomica di H (1, 008) + 5 x massa atomica di O (15, 9994) = 249, 7 g mol-1 n. moli= 15 g/ 249, 7 g mol-1 = 6, 008 x 10 -2 mol

Esercizi Calcolare quanti grammi dell’elemento idrogeno e dell’elemento ossigeno sono contenuti in 1, 00 g di H 2 O? n. moli= grammi del composto/ massa molare del composto = massa atomica di O (15, 9994) + 2 x massa atomica di H (1, 008) = 18, 02 g mol-1 n. moli di H 2 O= 1 g/ 18, 02 g mol-1 = 0, 0555 mol n. moli di ossigeno = n. moli di H 2 O n. moli di idrogeno = 2 x n. moli di H 2 O grammi di sostanza= massa molare x n. moli grammi di ossigeno = 0, 0555 mol x 15, 9994 g mol-1 = 0, 888 g grammi di idrogeno = 0, 0555 mol x 2 x 1, 008 g mol-1 = 0, 112 g

Esercizi Calcolare la massa di ciascun elemento e di H 2 O che è contenuta in 1, 00 g di Ni. SO 4 7 H 2 O. n. moli= grammi del composto/ massa molare del composto = massa atomica di Ni (58, 69) + massa atomica di S (32, 07) + 4 x massa atomica di O (15, 9994) + 7 x massa molecolare di H 2 O (18) = 280, 9 g mol-1 n. moli di composto = 1 g / 280. 9 g mol-1 = 0, 00356 mol grammi di sostanza= massa molare x n. moli La massa di ciascun elemento e dell’acqua è: 0, 00356 mol x 58, 7 g mol-1 = 0, 209 g di Ni 0, 00356 mol x 32, 1 g mol-1 = 0, 114 g di S 0, 00356 mol x 11 x 15, 9994 g mol-1 = 0, 627 g di O 0, 00356 mol x 14 x 1, 008 g mol-1 = 0, 0503 g di H 0, 00356 mol x 7 x 18, 0 g mol-1 = 0, 449 g di H 2 O

L'analisi elementare • La formula che arriviamo a scrivere per un composto è detta formula minima (stechiometrica o elementare), ossia le proporzioni minime tra gli elementi di un composto: si ricava dall’analisi elementare della sostanza. Per tutte le sostanze è possibile scrivere una formula minima. • L’ analisi elementare di un composto è la determinazione delle percentuali in massa degli elementi presenti nel composto. Da queste percentuali è possibile risalire alla formula minima; per trovare la vera formula molecolare occorre altro dato sperimentale (spesso si deve determinare la massa molare della sostanza).

Esercizi: Composizione % dei composti chimici La percentuale in peso è data dal rapporto fra la massa di ciascun elemento e la massa della sostanza dove l’elemento è contenuto, moltiplicato x 100. % peso dell’elemento contenuto nella sostanza = (massa in g dell’elemento /massa in g della sostanza ) x 100 Es. : Calcolare la % in peso degli elementi del composto C 5 H 5 N. Peso molecolare del composto = 5 x 12, 01 (C) + 5 x 1, 008 (H) + 14, 01 (N) = 79, 10 g mol-1 1 mole di composto contiene 5 moli di C, 5 moli di H e 1 mole di H, quindi: % C = ((5 x 12, 01 g mol-1) / 79, 10 g mol-1 ) x 100 = 75, 9 % % H = ((5 x 1, 008 g mol-1) / 79, 10 g mol-1 ) x 100 = 6, 38 % % N = 14, 01 g mol-1 / 79, 10 g mol-1 ) x 100 = 17, 7 %

Esercizi: Calcolo delle formule minime e molecolari di un composto Se si conosce la % in peso di tutti gli elementi in un composto si può trovare la formula minima del composto. Se si conosce il peso molecolare del composto si può ricavare a anche la formula molecolare. Es. : un composto è costituito da C, H e Cl con percentuali in peso uguali a 49, 0%, 2, 74%, 48, 1%, rispettivamente. Calcolare la formula minima. Consideriamo di avere 100 g del composto: Moli di C = 49, 0 g / 12, 01 g mol-1 = 4, 08 mol Moli di H = 2, 74 g / 1, 008 g mol-1) = 2, 72 mol Moli di Cl = 48, 1 g / 35, 45 g mol-1 ) = 1, 36 mol Dividendo questi numeri per il numero più piccolo (1, 36 mol) si calcola il rapporto tra le moli di C, H e Cl è uguale a 3: 2: 1. quindi la fomula minima è C 3 H 2 Cl. Quella molecolare sarà un multiplo alla n di quella minima (C 3 H 2 Cl)n.

Esercizi: Calcolo delle formule minime e molecolari di un composto Un composto puro è è costituito da 5, 9% di H, 94, 0% di O. Il peso molecolare determinato sperimentalmente è 34, 1. Calcolare la formula molecolare del composto. Consideriamo di avere 100 g del composto: Moli di H = 5, 9 g / 1, 008 g mol-1 = 5, 90 mol Moli di O = 94, 0 g / 15, 994 g mol-1 = 5, 87 mol Il numero di atomi di H rispetto all’O è 5, 9/5, 87 = 1 Quindi la formula minima è HO. Quella molecolare sarà un multiplo alla n di quella minima (HO)n. n = 34, 1 g mol-1 /17, 0 g mol-1 = 2, 0 Quindi la formula molecolare è H 2 O 2
 Dieresi
Dieresi Rapporto stechiometrico
Rapporto stechiometrico Ti faccio una domanda
Ti faccio una domanda Reazioni chimiche esempi
Reazioni chimiche esempi Contare lleva tilde
Contare lleva tilde Hola nios
Hola nios Descuido de la potra zaina
Descuido de la potra zaina Contare ordinare
Contare ordinare Contare con le mani bortolato
Contare con le mani bortolato Come rico come sano
Come rico come sano Federico faccio
Federico faccio Se ascolto dimentico se vedo ricordo se faccio capisco
Se ascolto dimentico se vedo ricordo se faccio capisco Ossidazione perde elettroni
Ossidazione perde elettroni Reazione omogenea
Reazione omogenea Ad ogni azione corrisponde una reazione
Ad ogni azione corrisponde una reazione Ogni azione ha una reazione
Ogni azione ha una reazione K equilibrio
K equilibrio Calcolo molarità
Calcolo molarità Reazione spontanea
Reazione spontanea Reazione vincolare guida circolare
Reazione vincolare guida circolare Reazione ossidoriduzione
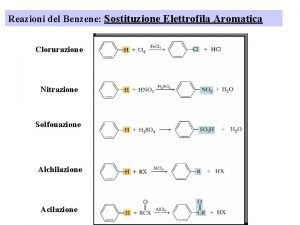
Reazione ossidoriduzione Reazione benzene
Reazione benzene Combustione alcano
Combustione alcano Cos'è un nucleofilo
Cos'è un nucleofilo Reazione del terreno
Reazione del terreno Legge azione reazione
Legge azione reazione Reazione spontanea
Reazione spontanea Spontaneità reazione
Spontaneità reazione 2 metilpentano
2 metilpentano Reazione di presa del gesso
Reazione di presa del gesso Keq=e^-g/rt
Keq=e^-g/rt