Immunit antiinfectieuse Cdric Mnard Pierre Tattevin Prsentation de







































- Slides: 63

Immunité anti-infectieuse Cédric Ménard & Pierre Tattevin

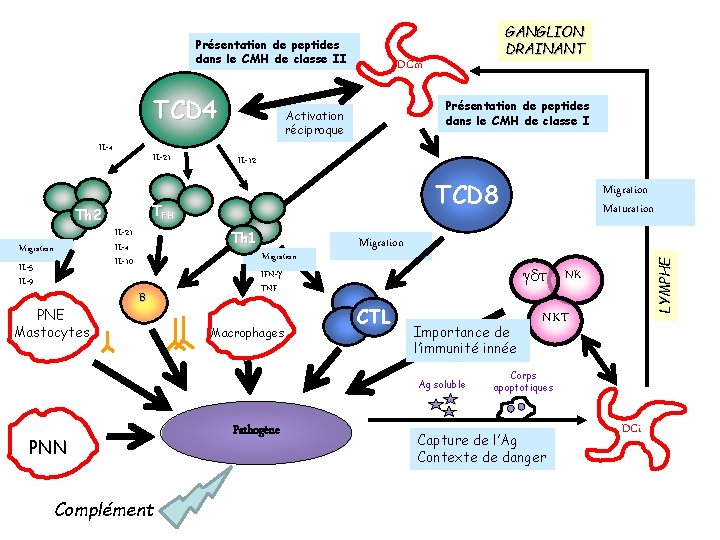
Présentation de peptides dans le CMH de classe II TCD 4 IL-21 IL-4 IL-10 IL-5 IL-9 PNE Mastocytes Présentation de peptides dans le CMH de classe I Activation réciproque IL-12 TCD 8 TFH Th 2 Migration DCm Th 1 B Migration IFN-g TNF Macrophages Migration gd. T CTL Importance de l’immunité innée Ag soluble PNN Complément Pathogène Migration Maturation LYMPHE IL-4 GANGLION DRAINANT NK NKT Corps apoptotiques Capture de l’Ag Contexte de danger DCi

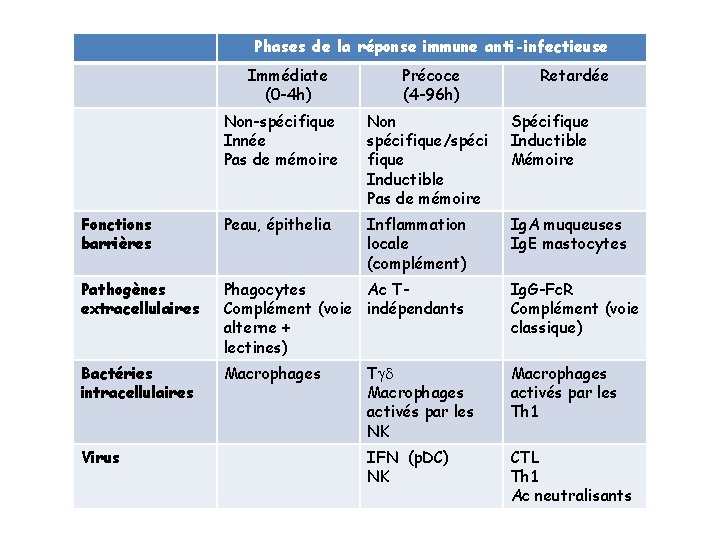
Phases de la réponse immune anti-infectieuse Immédiate (0 -4 h) Précoce (4 -96 h) Retardée Non-spécifique Innée Pas de mémoire Non spécifique/spéci fique Inductible Pas de mémoire Spécifique Inductible Mémoire Fonctions barrières Peau, épithelia Inflammation locale (complément) Ig. A muqueuses Ig. E mastocytes Pathogènes extracellulaires Phagocytes Ac TComplément (voie indépendants alterne + lectines) Ig. G-Fc. R Complément (voie classique) Bactéries intracellulaires Macrophages Tgd Macrophages activés par les NK Macrophages activés par les Th 1 IFN (p. DC) NK CTL Th 1 Ac neutralisants Virus

Immunité anti-parasitaire • Plasmodium (dans GR): Ac+++ (neutralisation, opsonisation) + activation macrophages • Leishmania (intra-macrophagique): rôle des macrophages et des CTL • Helminthes: réponse Th 2 (rôle des éosinophiles, des mastocytes/Ig. E) + compartiments régulateurs dont Treg (diminution réponses antiparasitaires et de l’allergie)

Immunité anti-fongique • Surtout immunité innée – Barrières physiques et chimiques – Phagocytose (PNN) – Complément (voie alterne et mannose) • Rôle de l’immunité acquise – Survenue d’infections fongiques chez le patient HIV

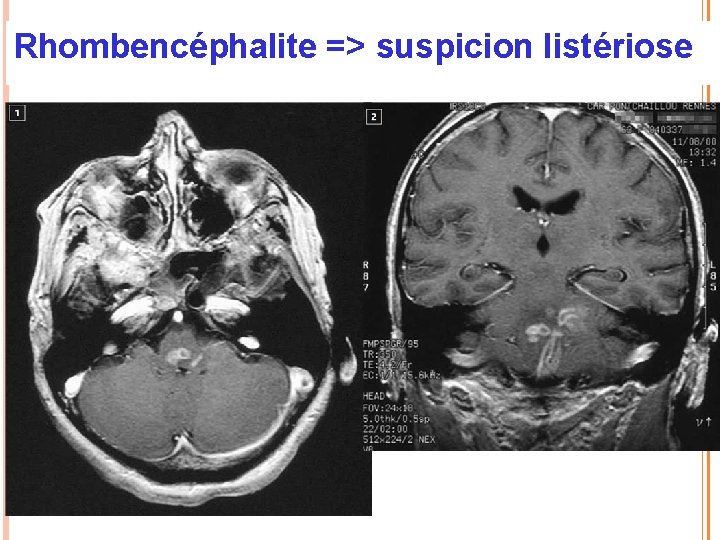
Cas clinique 1. Femme, 76 ans Motif d’hospitalisation Fièvre, confusion, céphalées, paralysie des nerfs crâniens Mode de vie, antécédents 3 enfants, en bonne santé Ancienne institutrice, jamais voyagé Hypothyroidie substituée Examen clinique Syndrome méningé Paralysie faciale Diplopie Troubles déglutition Méningo-encéphalite Aciclovir + amoxicilline Imagerie cérébrale avant PL

Rhombencéphalite => suspicion listériose

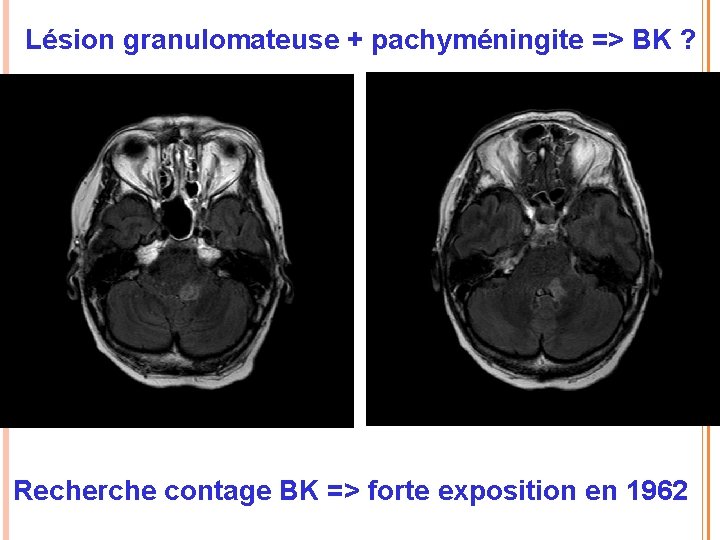
Lésion granulomateuse + pachyméningite => BK ? Recherche contage BK => forte exposition en 1962

Infection tuberculeuse latente (ITL) et tuberculose maladie TB maladie 5 -10 %

Exposition de sujets (contacts) à un patient source contagieux (TB respiratoire) Inoculum (charge bacillaire) Immunité locale Pas d’infection Infection tuberculeuse Réponse immune robuste Croissance BK contenue Réponse immune durable Croissance bactérienne stoppée Réponse immune faible insuffisante Croissance BK poursuivie TB ‘primaire’ Eradication du BK (10%) Croissance bactérienne contrôlée Quelques bacilles viables persistent Immunité stérilisante Infection tuberculeuse latente (90%) Total Monde = 2, 2 milliards patients Immunité efficace (90%) Jamais symptomatique Jamais contagieux Immunité défaillante (10%) Réactivation d’une TB latente Ahmad S, Respir Res 2010

Infection tuberculeuse latente (ITL) Définition ‘Persistance de bacilles tuberculeux (BK) viables dont le métabolisme est ralenti’ => aucun symptôme, pas de risque de transmission Mécanisme = stress hypoxique / efficacité de l’immunité Modèles expérimentaux (cultures / animaux) Diagnostic Tests 2017 = réponse immune (IDR, IGRA) Pas de test pour ‘persistance de BK viables’ En pratique, 3 critères exigés pour ITL Exposition BK avérée (test immuno et/ou contage) 2. Eliminer une TB guérie (critère = 6 mois INH/RMP) 3. Eliminer une TB-maladie 1. Pas de symptômes RP strictement normale (sinon, recherche BK)

Réponse immunitaire: de l’infection latente à la maladie Réponse immunitaire Immunité à médiation cellulaire Infection latente Maladie Charge bactérienne Antibody Temps Infection Maladie

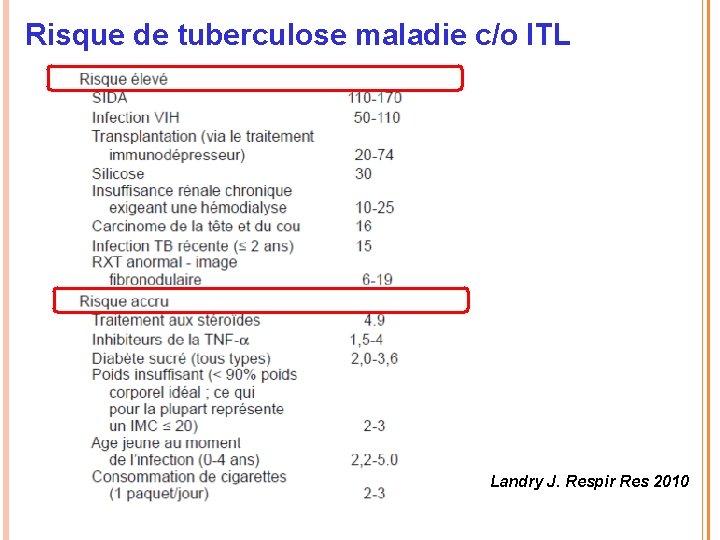
Risque de tuberculose maladie c/o ITL Landry J. Respir Res 2010

Tuberculose et immunologie • Longue coévolution M tuberculosis/homme • SI = rôle ambivalent – Défense contre la tuberculose (si SI déficient = maladie) – Si SI efficace: controle de la maladie (latence) mais utilisation du SI comme niche par le pathogène • Puissants systèmes d’échappement au SI

1. 2. 3. 4.

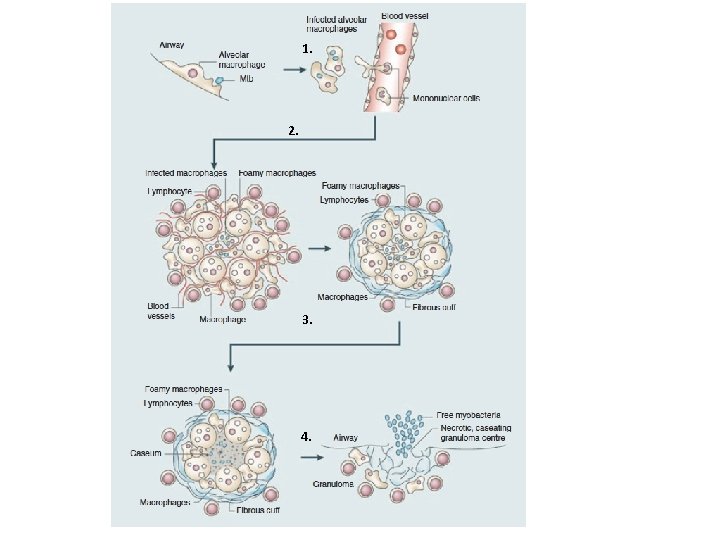
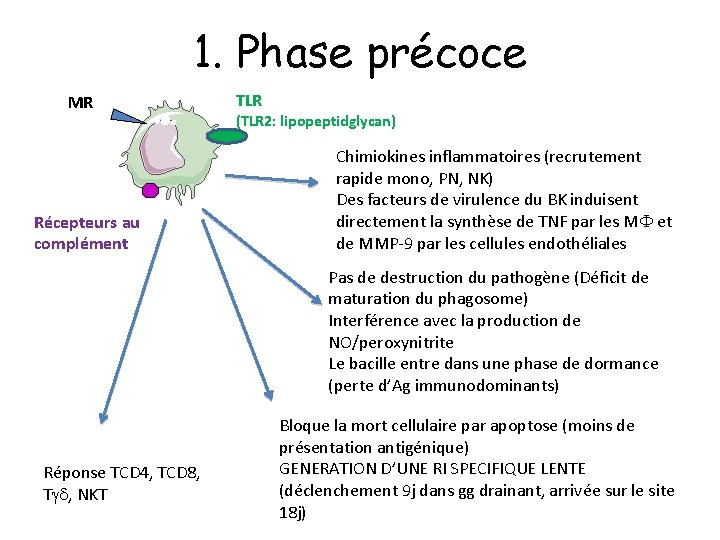
1. Phase précoce MR Récepteurs au complément TLR (TLR 2: lipopeptidglycan) Chimiokines inflammatoires (recrutement rapide mono, PN, NK) Des facteurs de virulence du BK induisent directement la synthèse de TNF par les MF et de MMP-9 par les cellules endothéliales Pas de destruction du pathogène (Déficit de maturation du phagosome) Interférence avec la production de NO/peroxynitrite Le bacille entre dans une phase de dormance (perte d’Ag immunodominants) Réponse TCD 4, TCD 8, Tgd, NKT Bloque la mort cellulaire par apoptose (moins de présentation antigénique) GENERATION D’UNE RI SPECIFIQUE LENTE (déclenchement 9 j dans gg drainant, arrivée sur le site 18 j)

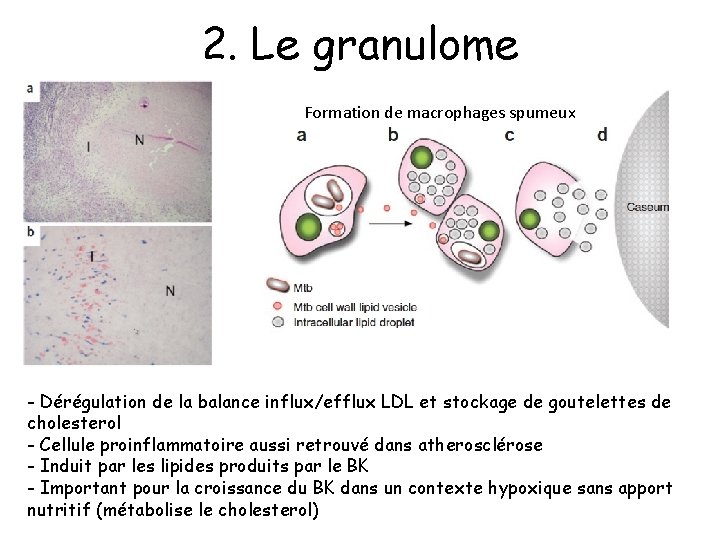
2. Le granulome Formation de macrophages spumeux - Dérégulation de la balance influx/efflux LDL et stockage de goutelettes de cholesterol - Cellule proinflammatoire aussi retrouvé dans atherosclérose - Induit par les lipides produits par le BK - Important pour la croissance du BK dans un contexte hypoxique sans apport nutritif (métabolise le cholesterol)

3. La réactivation • Deux mécanismes bien identifiés – Altération CD 4 chez HIV (TCD 4 BKspécifiques hypersensibles/TCD 4 CMVspécifiques) – Anticorps anti-TNF (induction Treg, inactivation MF et TCD 8) • Glucocorticoides, malnutrition, âge…

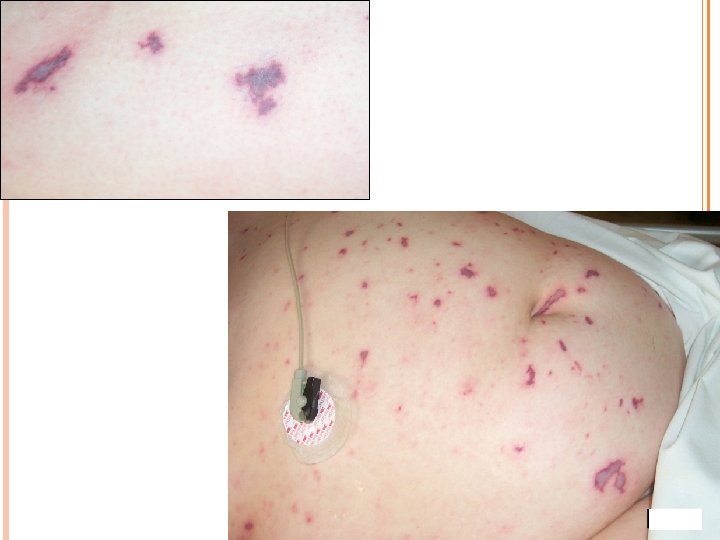
Cas clinique 2. Homme, 36 ans Motif d’hospitalisation Fièvre (T = 39°C) depuis 12 h Mode de vie, antécédents 2 enfants, en bonne santé, voyage beaucoup Maladie de Hodgkin (1996) => chimio + radiothérapie (thorax, abdo) Examen clinique TA = 90/60 mm. Hg, FC = 130/min, Sa. O 2 (AA) = 88% Purpura rapidement extensif


Infections et asplénie Conséquence de l’asplénie: Sepsis fulminant • Prodromes aspécifiques – Fièvre, frissons, myalgies, pharyngite, diarrhée – Durée < 24 h • Septicémie ‘fulgurante’ – Installation brutale – Charge bactérienne très élevée dans le sang – Pas de foyer infectieux évident • Complications dramatiques – – Choc, coma CIVD, MAT, Syndrome Waterhouse Friderichsen Nécrose extrémités Mortalité > 50%, < 48 h

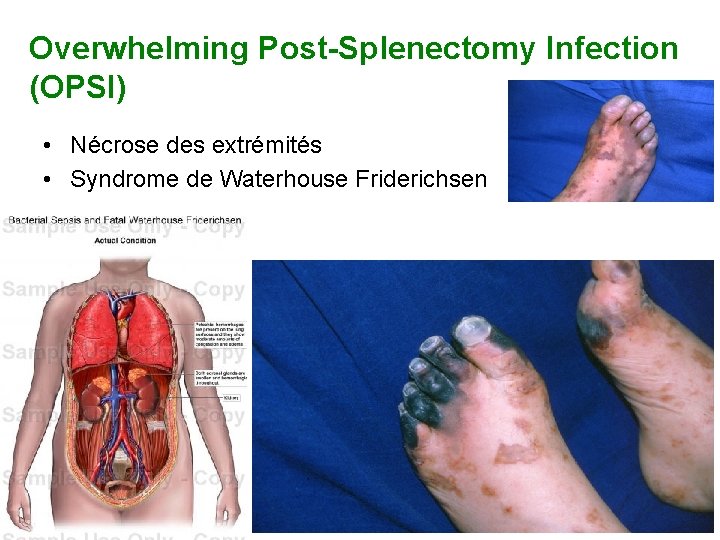
Overwhelming Post-Splenectomy Infection (OPSI) • Nécrose des extrémités • Syndrome de Waterhouse Friderichsen

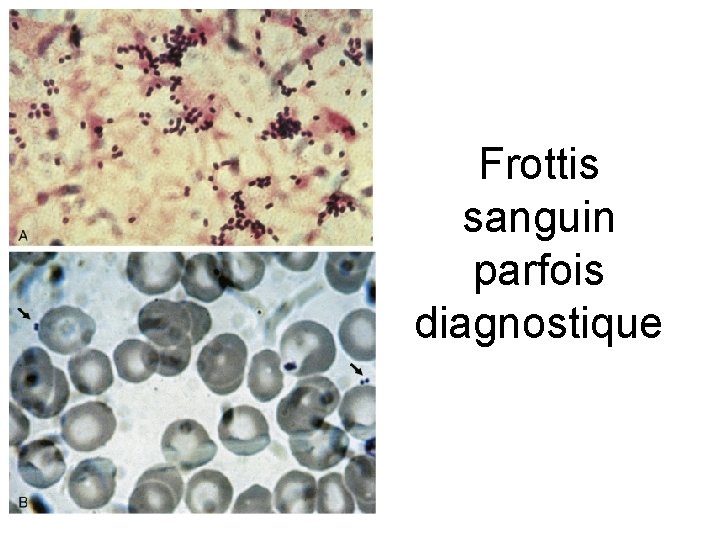
Frottis sanguin parfois diagnostique

Infections et asplénie Microbiologie (1) Bactéries encapsulées 1. Pneumocoque (50 -90% OPSI) • Plus fréquent chez l’adulte 2. Haemophilus influenzae type B (5 -15% OPSI) • • Plus fréquent chez l’enfant < 15 ans En voie de disparition (vaccins) 3. Méningocoques (< 5% OPSI) • OPSI pas plus sévère que c/o ‘eusplénique’ ?

Infections et asplénie Microbiologie (2) Plus rares, mais caractéristiques 1. Babésiose • • • Rare en Europe (40 observations en 40 ans) Rarement pathogène hors ‘asplénie’ Hémolyse aiguë gravissime si asplénie 2. Capnocytophaga canimorsus • • Morsure de chien 80% formes graves rapportées = asplénisme 3. Divers • • Paludisme (données humaines contradictoires) Salmonellose ‘mineure’ sévère (si hémoglobinopathie) Ehrlichiose (Anaplasma phagocytophilum) Fièvre d’Oroyo (Bartonella bacilliformis) Pas les opportunistes ‘classiques’ (BK, mycoses, etc…)

Bactériologie des ‘OPSI’ (n=298)

Etiologie des asplénies l l Congénitales (isolées, ou polymalf° -> sd d’Ivemark) Chirurgicales – l Hémostase (35%), curatives (50%) ou diagnostiques (15%) Fonctionnelles – – – – Hémoglobinopathies Pathologies gastro-intestinales (MICI, maladie coeliaque) Pathologies autoimmunes (lupus, polyarthrite, vascularites) Hépatopathies chroniques avec HTP Pathologies hématologiques (lymphome, leucémie, irradiation) Pathologies vasculaires (thrombose veine ou artère splénique) Pathologies infectieuses (paludisme, leishmaniose viscérale)

Infections et asplénie Epidémiologie des asplénies en France (~0, 8% pop. ) 1. Splénectomisés – – Prévalence = 250 000 Incidence = 6 à 9000/an (50% adultes) 2. Asplénies ‘autres’ – – Prévalence = 250 000 Principales • • • Drépanocytose (5 000 patients) Hypertension portale Hémopathies (Hodgkin) Irradiations Causes vasculaires Maladies systémiques 1 Kyaw, Am J Med, 2006; 2 Holdsworth, Br J Surg, 1991 Coignard-Biehler et al, Rev Prat, 2008

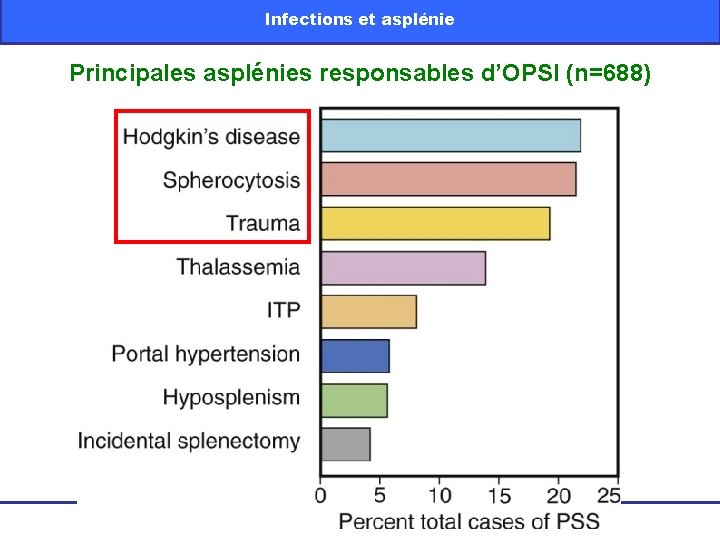
Infections et asplénie Principales asplénies responsables d’OPSI (n=688) Interface SRLF/SFAR, 19/1/2011

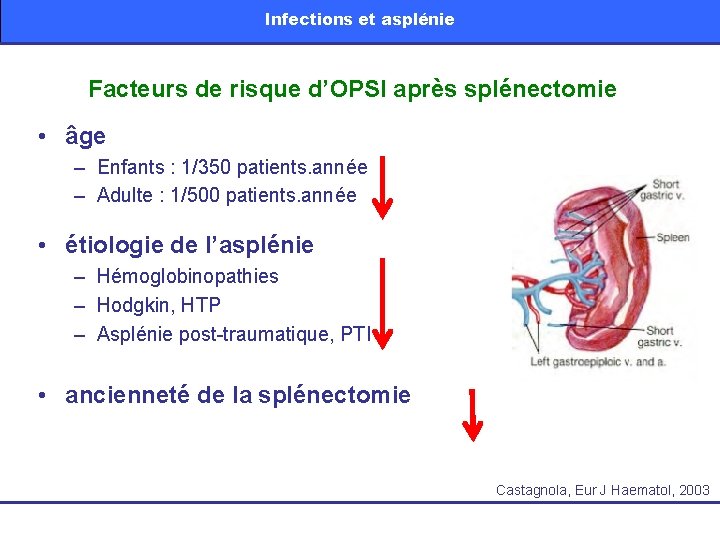
Infections et asplénie Facteurs de risque d’OPSI après splénectomie • âge – Enfants : 1/350 patients. année – Adulte : 1/500 patients. année • étiologie de l’asplénie – Hémoglobinopathies – Hodgkin, HTP – Asplénie post-traumatique, PTI • ancienneté de la splénectomie Castagnola, Eur J Haematol, 2003

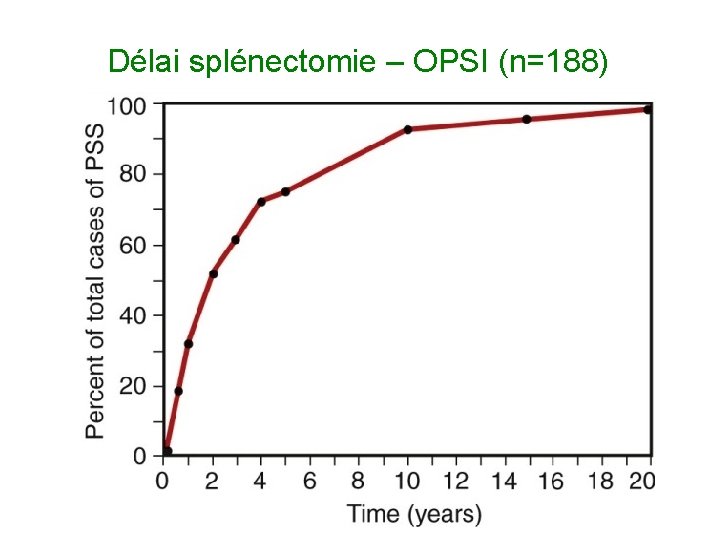
Délai splénectomie – OPSI (n=188)

Infections et asplénie Traitement des infections chez le patient asplénique fébrile • Règles d’or – Rapide +++ – Actif sur PCQ, H. influenzae, méningocoque C 3 G injectable • Importance de l’éducation – patients: consultation précoce si fièvre – médecins: administration rapide de C 3 G IV • Intérêt d’une carte ‘je suis asplénique’ • Registre

Prévention – 1: diagnostic de l’asplénie • Corps de Howell-Jolly – Spécificité bonne – Sensibilité médiocre • ‘Pitted’ ou ‘pocked’ erythrocytes – Bonne sensibilité, mais: – Microscope contraste de phase – Peu répandu en France • Thrombocytose • Hypogammaglobulinémie (Ig. M) • Imagerie fonctionnelle

Infections et asplénie Prévention – 2: antibioprophylaxie • Recommandations – 1 seule étude randomisée concluant à une efficacité: chez l’enfant drépanocytaire de moins de 3 ans (Gaston, NEJM, 1988) • Péni V vs placebo • Diminution du portage du pneumocoque • Diminuation de 84% de l’incidence des infections à pneumocoque Indiquée chez l’enfant pendant 5 ans – Chez l’adulte • Rien de démonté • SFAR 2005: pendant 2 ans après splénectomie Péni V (oracilline), 1 MU x 2/j (50 000 UI/Kg/j chez enfant) Alternative (allergie) = érythromycine, 500 mg x 1/j

Prévention – 3: Vaccinations

‘Chez les patients aspléniques, les vaccins conjugués doivent être privilégiés pour la primo-vacccination’

Infections et asplénie Conclusions - Principaux messages (1) • Asplénie – situation fréquente (~0, 8% population Française) – peu étudiée (1ère publication 1952 – études observationnelles) • Traitement curatif – simple (C 3 G injectable précoce) – ‘course contre la montre’ (enjeu majeur) – 30 -50% mortalité, quelque soit le terrain • Prévention: Règles bien établies (SFAR 2005)… – Education patient, médecin traitant, urgentistes – Antibioprophylaxie initiale – Vaccins conjugués …mais toujours mal suivies !

Infections et asplénie Conclusions - Principaux messages (2) • Antibioprophylaxie – Pénicilline V orale (Oracilline), 1 M UI x 2/j, pendant 2 ans – Alternative, érythromycine, 500 mg/j (bof !) • Vaccins (conjugués au départ) – Pneumocoques – Haemophilus influenzae b – Méningocoques

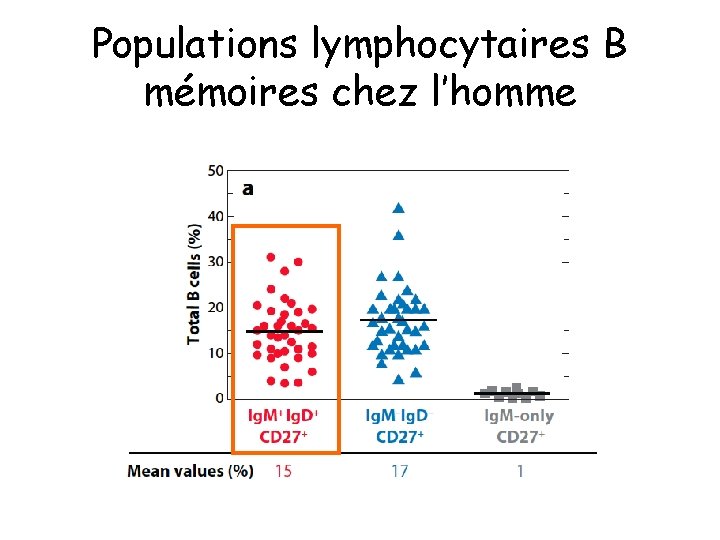
Populations lymphocytaires B mémoires chez l’homme

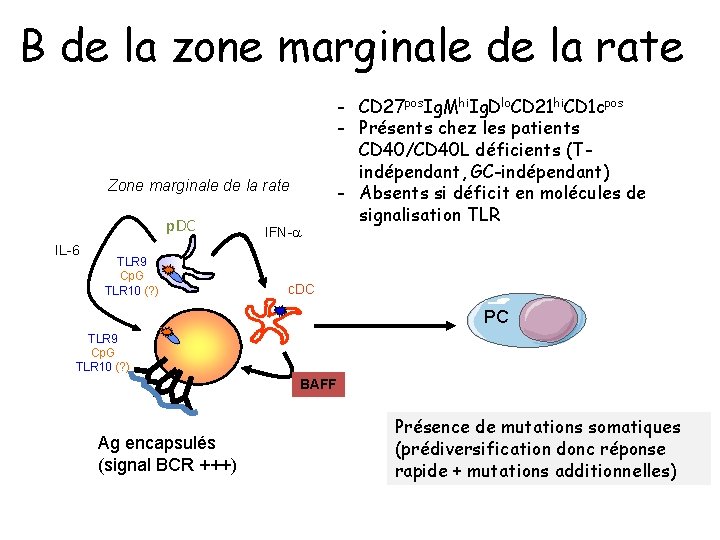
B de la zone marginale de la rate Zone marginale de la rate p. DC IL-6 TLR 9 Cp. G TLR 10 (? ) IFN-a - CD 27 pos. Ig. Mhi. Ig. Dlo. CD 21 hi. CD 1 cpos - Présents chez les patients CD 40/CD 40 L déficients (Tindépendant, GC-indépendant) - Absents si déficit en molécules de signalisation TLR c. DC PC TLR 9 Cp. G TLR 10 (? ) BAFF Ag encapsulés (signal BCR +++) Présence de mutations somatiques (prédiversification donc réponse rapide + mutations additionnelles)

B de la zone marginale de la rate • Cellules majoritaires de la réponse au vaccin polysaccharidique (Pneumovax) • Explique l’absence de réponse chez enfants <2 ans (immaturité ZM rate) et splenectomisés (décroissance de leur nombre après splenectomie). Us polysaccharides conjugués • Aucune anomalie immunitaire massive chez splenectomisés (RI T-dépendante majoritaire)

Autres effets • Diminution de l’élimination des bactéries/macrophages • La rate est aussi un réservoir de B mémoires Ig. G pos


Primo-infection EBV y 2 pics (6 -7 ans et 14 -15 ans) yde + en + tardive dans l’hémisphère Nord xincidence corrélée à • taille des familles, promiscuité • hygiène, conditions socio-économiques MNI ylymphoprolifération bénigne EBV-induite yintensité des symptômes liée à l ’âge x< 10% des primo-infections EBV avant 5 ans symptomatiques x 30 -75% symptomatiques si âge > 15 ans

Méthodes z. Etude rétrospective monocentrique y. Patients hospitalisés entre 1990 et avril 2004 y. Maladies Infectieuses ou Réanimation Médicale y ge > 16 ans y. Diagnostic de MNI d ’après x. Syndrome mononucléosique fébrile et x. Primo-infection EBV documentée • MNI test ou Paul Bunnel Davidsohn positif et/ou • Présence d ’Ig. M anti VCA en l ’absence d ’anti EBNA, et/ou • PCR EBV positive (sérum)

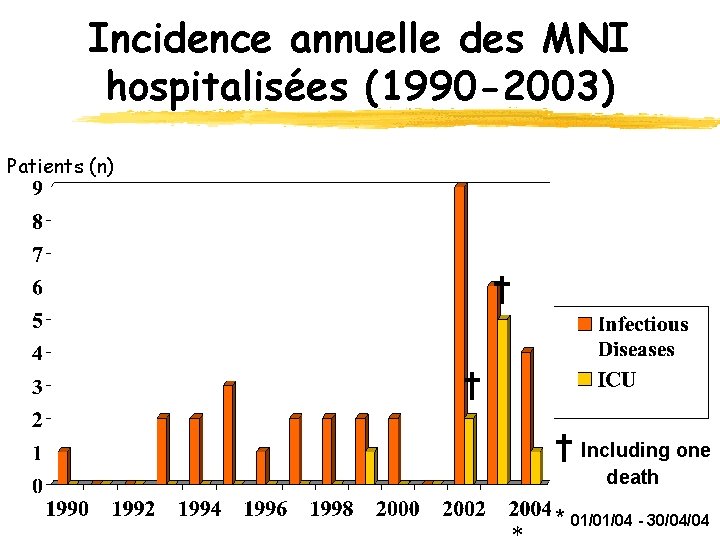
Résultats z 36 patients y 15 hommes/21 femmes y ge moyen = 22, 8 ans (extrêmes 16 -53) y. Hospitalisation moyenne 11 jours (médiane 6 j) y. Durée moyenne T° = 17, 2 jours (médiane 17, 5 j) y. Incidence x 1990 -2001 : 1, 4 patient/an (1 seul patient en réa) x 2002 - avril 2004 : 19 patients (8 patient réa, 2 décès)

Incidence annuelle des MNI hospitalisées (1990 -2003) Patients (n) † † † Including one death * 01/01/04 - 30/04/04

Discussion (1) z. Augmentation significative de l’incidence des MNI hospitalisées à Rennes ycoef. corrélation Spearman : r=0. 543 ; p<0, 05 z. Constatation similaire en Grande Bretagne yincidence annuelle = 2, 6/100 000 en 1989 yincidence annuelle = 4, 8/100 000 en 1998 yaugmentation régulière moyenne 5% par an

Discussion (2) z. Effet « boule de neige » +/- biais de recrutement ? ymais gravité objective pour la plupart z. Si gravité MNI en augmentation yplutôt liée à l ’hôte x. Symptômes corrélés • à l ’âge (et primo-infection de + en + tardive) • à des marqueurs de l ’hôte (récepteur IL-10; Purtilio) • mais pas aux souches EBV (études moléculaires) xlymphoprolifération le + souvent au 1 er plan

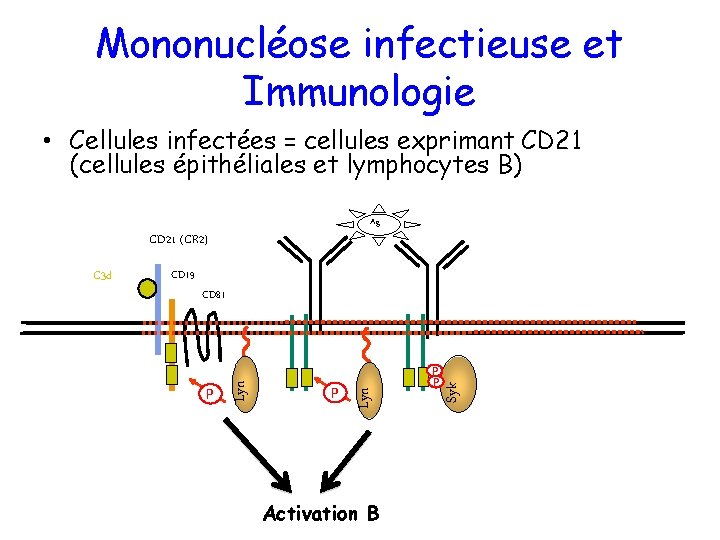
Mononucléose infectieuse et Immunologie • Cellules infectées = cellules exprimant CD 21 (cellules épithéliales et lymphocytes B) Ag CD 21 (CR 2) CD 19 P Activation B P P Syk P Lyn CD 81 Lyn C 3 d

Mononucléose infectieuse et Immunologie • Cellule B = CPA professionnelle • Réponse T+++ et NK • Formation TCD 4 et TCD 8 mémoires – TCD 8 anti-Ag de phase lytique sont responsables des symptomes cliniques (et du syndrome mononucléosique) • Persistance dans les B mémoires sous une forme de latence peu immunogène

XLP • Purtilio (X-linked lymphoproliferative disease): mutations inactivatrices sur SAP • Protéine adaptatrice (signalisation récepteurs SLAM) • Infection EBV létale + autres anomalies immunitaires (hypogammaglobulinémie, lymphoproliférations) – Déficit spécifique de la cytotoxicité TCD 8 et NK/B – Anomalies du contact TFH/B – Défaut de mort des TCD 8 (hyperactivation)

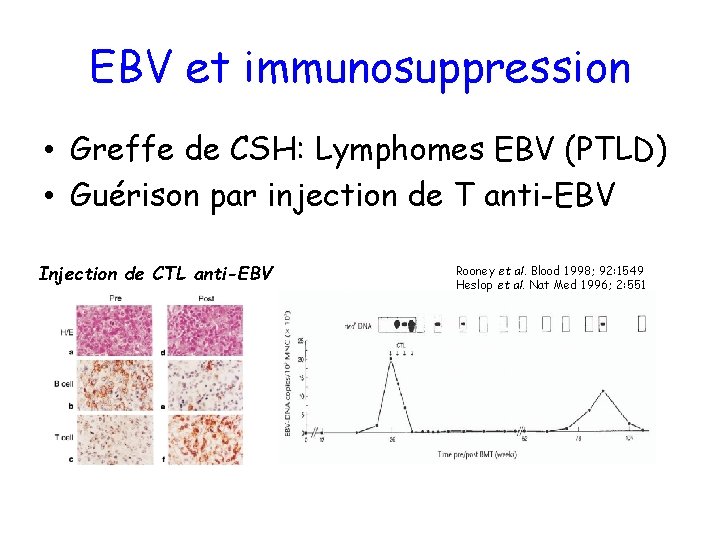
EBV et immunosuppression • Greffe de CSH: Lymphomes EBV (PTLD) • Guérison par injection de T anti-EBV Injection de CTL anti-EBV Rooney et al. Blood 1998; 92: 1549 Heslop et al. Nat Med 1996; 2: 551

Pourquoi le VIH a t’il eu tant de succès ?

LE VIH INFECTE LES CELLULES DU SYSTEME IMMUNITAIRE T T INFECTION PRODUCTION 55

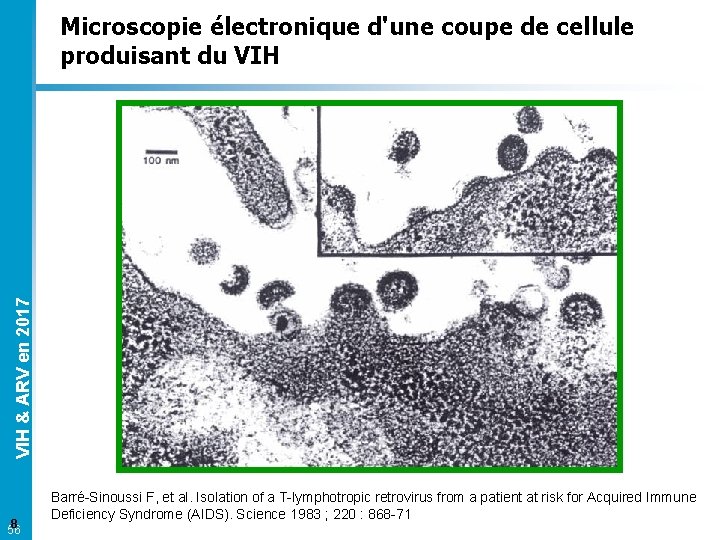
VIH & ARV en 2017 Microscopie électronique d'une coupe de cellule produisant du VIH 8 56 Barré-Sinoussi F, et al. Isolation of a T-lymphotropic retrovirus from a patient at risk for Acquired Immune Deficiency Syndrome (AIDS). Science 1983 ; 220 : 868 -71

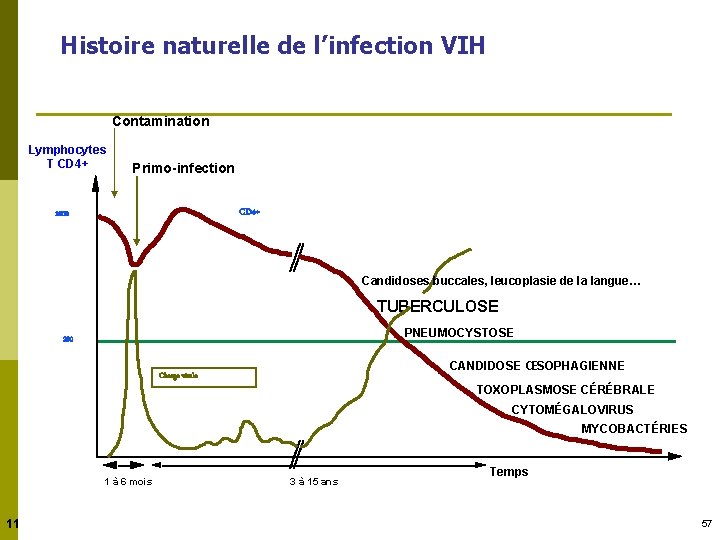
Histoire naturelle de l’infection VIH Contamination Lymphocytes T CD 4+ Primo-infection CD 4+ 1000 Candidoses buccales, leucoplasie de la langue… TUBERCULOSE PNEUMOCYSTOSE 200 CANDIDOSE ŒSOPHAGIENNE Charge virale TOXOPLASMOSE CÉRÉBRALE CYTOMÉGALOVIRUS MYCOBACTÉRIES 1 à 6 mois 11 3 à 15 ans Temps 57

Marqueurs biologiques évolutifs – CD 4 VIH & ARV en 2017 • Reflètent l’état des défenses immunitaires • Prédisent le risque de manifestations opportuniste 58 – Infections – Cancers – Charge virale (ARN-VIH) • Reflet de la contagiosité (risque de transmission) • Prédisent la vitesse de diminution des CD 4

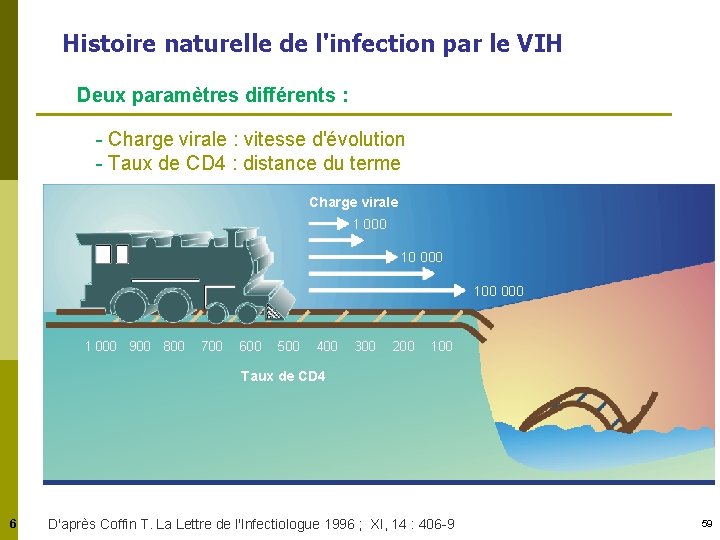
Histoire naturelle de l'infection par le VIH Deux paramètres différents : - Charge virale : vitesse d'évolution - Taux de CD 4 : distance du terme Charge virale 1 000 100 000 1 000 900 800 700 600 500 400 300 200 100 Taux de CD 4 6 D'après Coffin T. La Lettre de l'Infectiologue 1996 ; XI, 14 : 406 -9 59

Interprétation de la mesure des CD 4 • Valeurs normales : 500 à 1000/mm 3 VIH & ARV en 2017 • Infections opportunistes mineures : 60 CD 4 entre 350 et 200/mm 3 • Infections opportunistes majeures (SIDA) – CD 4 < 200/mm 3

Principes du traitement antirétroviral (ARV) • Supprime la réplication virale VIH & ARV en 2017 – Ne tue pas le virus (‘latent’) – Absence de réplication 61 • On récupère des CD 4 • On ne sélectionne pas de résistance • On ne transmet plus Efficacité permanente du traitement si bien pris

Chronologie du succès des ARV 1. Supprime la réplication virale (critère virologique) - > 95% des patients, en 3 à 6 mois => Risque de transmission ‘presque nul’ VIH & ARV en 2017 2. Remontée des CD 4 (critère immunologique) 62 - environ 100/an 3. Disparition des symptômes (critère clinique) - Reprise pondérale - Pas de nouvelle IO après 6 mois d’ARV

Conclusions • Les manifestations de nombreuses maladies infectieuses reflètent plus la nature et l’efficacité de la réponse immunitaire que la virulence du pathogène • • Tuberculose maladie latente Sepsis fulminant à pneumocoque c/o aspléniques Gravité variable de la primo-infection EBV Histoire naturelle de l’infection VIH Merci de votre attention !
 Pierre tattevin cv
Pierre tattevin cv D
D Ppt on apple company
Ppt on apple company Prsentation
Prsentation Guido richter
Guido richter Observe les membres de la famille de pierre
Observe les membres de la famille de pierre Neurochirurgien clinique du bois lille
Neurochirurgien clinique du bois lille Pierre simon laplace
Pierre simon laplace Pierre louis toutain
Pierre louis toutain Dr daste pierre
Dr daste pierre Pierre labrecque
Pierre labrecque Pierre bertieaux
Pierre bertieaux Pierre sikivie
Pierre sikivie Pierre desproges
Pierre desproges Biografia de pierre ronsard
Biografia de pierre ronsard Lycée pierre et marie curie versailles
Lycée pierre et marie curie versailles Formation pierre vermersch
Formation pierre vermersch Jean pierre landau
Jean pierre landau Scolarité insuffisante sram
Scolarité insuffisante sram Pierre lermusiaux
Pierre lermusiaux Pierre robin
Pierre robin Pierre bourdieu
Pierre bourdieu Verwendung salz
Verwendung salz 1 pierre 1 13
1 pierre 1 13 Lineas reguladoras arquitectura
Lineas reguladoras arquitectura Pierre ferruit esa
Pierre ferruit esa Pierre de fermat family
Pierre de fermat family Pierre latrille
Pierre latrille Jean pierre bely
Jean pierre bely Pierre herm
Pierre herm Pierre de gioia carabellese
Pierre de gioia carabellese Pierre fraigniaud
Pierre fraigniaud Pierre de blanchefort, french nobleman, diary entry, 1576
Pierre de blanchefort, french nobleman, diary entry, 1576 Pierre bottero bibliographie
Pierre bottero bibliographie Pierre brousseau
Pierre brousseau Pierre girier
Pierre girier Pierre ammann
Pierre ammann La pierre du tombeau a été roulée alléluia
La pierre du tombeau a été roulée alléluia Musee picasso
Musee picasso Rsultat
Rsultat Un tat
Un tat Autor de ollantay
Autor de ollantay Pierre daimant
Pierre daimant Pierre thuillier la trastienda del sabio resumen
Pierre thuillier la trastienda del sabio resumen Gerrit hoogenboom
Gerrit hoogenboom Pierre bachelet décès
Pierre bachelet décès Julie d hondt
Julie d hondt Dr pierre combes
Dr pierre combes Pierre henri bertoye
Pierre henri bertoye Thanks pierre
Thanks pierre Protocole antagoniste avec minidril
Protocole antagoniste avec minidril Groupe pierre et vacances
Groupe pierre et vacances Slonia noha černobyl
Slonia noha černobyl Leverton pierre
Leverton pierre Pierre couzy
Pierre couzy Pr innocent pierre guissou
Pr innocent pierre guissou Les enfants vont ____ école.
Les enfants vont ____ école. Dominique jaccard
Dominique jaccard Audrey pierre
Audrey pierre Pierre sikivie
Pierre sikivie Pierre bjurhager
Pierre bjurhager Pierre d'almeida telles filho
Pierre d'almeida telles filho Ideas principales de pierre bourdieu
Ideas principales de pierre bourdieu Construction pyramide
Construction pyramide