Il sistema immunitario cutaneo SALTSkinAssociated Lymphoid Tissue Le


- Slides: 11

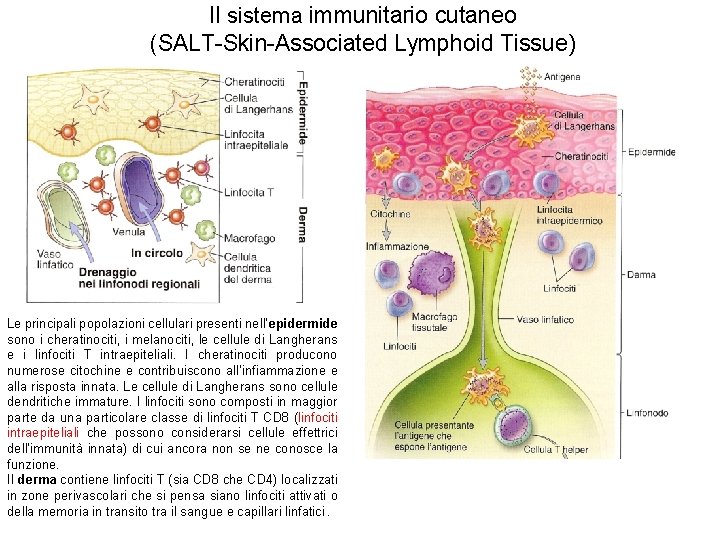
Il sistema immunitario cutaneo (SALT-Skin-Associated Lymphoid Tissue) Le principali popolazioni cellulari presenti nell’epidermide sono i cheratinociti, i melanociti, le cellule di Langherans e i linfociti T intraepiteliali. I cheratinociti producono numerose citochine e contribuiscono all’infiammazione e alla risposta innata. Le cellule di Langherans sono cellule dendritiche immature. I linfociti sono composti in maggior parte da una particolare classe di linfociti T CD 8 (linfociti intraepiteliali che possono considerarsi cellule effettrici dell’immunità innata) di cui ancora non se ne conosce la funzione. Il derma contiene linfociti T (sia CD 8 che CD 4) localizzati in zone perivascolari che si pensa siano linfociti attivati o della memoria in transito tra il sangue e capillari linfatici.

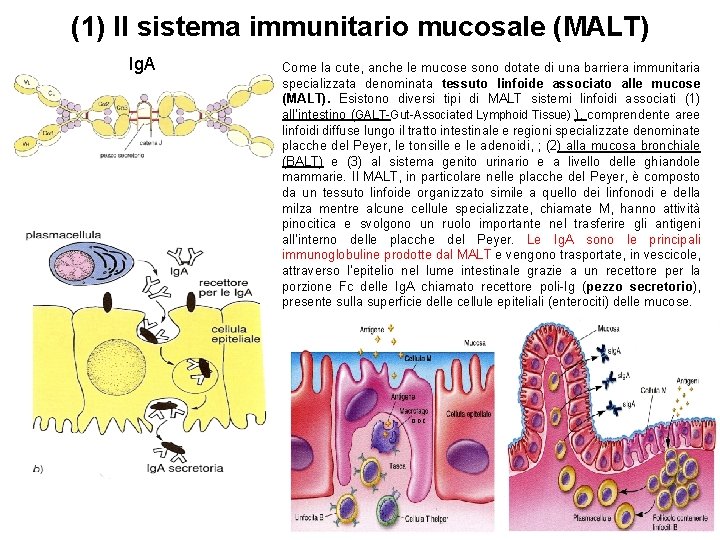
(1) Il sistema immunitario mucosale (MALT) Ig. A Come la cute, anche le mucose sono dotate di una barriera immunitaria specializzata denominata tessuto linfoide associato alle mucose (MALT). Esistono diversi tipi di MALT sistemi linfoidi associati (1) all’intestino (GALT-Gut-Associated Lymphoid Tissue) ), comprendente aree linfoidi diffuse lungo il tratto intestinale e regioni specializzate denominate placche del Peyer, le tonsille e le adenoidi, ; (2) alla mucosa bronchiale (BALT) e (3) al sistema genito urinario e a livello delle ghiandole mammarie. Il MALT, in particolare nelle placche del Peyer, è composto da un tessuto linfoide organizzato simile a quello dei linfonodi e della milza mentre alcune cellule specializzate, chiamate M, hanno attività pinocitica e svolgono un ruolo importante nel trasferire gli antigeni all’interno delle placche del Peyer. Le Ig. A sono le principali immunoglobuline prodotte dal MALT e vengono trasportate, in vescicole, attraverso l’epitelio nel lume intestinale grazie a un recettore per la porzione Fc delle Ig. A chiamato recettore poli-Ig (pezzo secretorio), presente sulla superficie delle cellule epiteliali (enterociti) delle mucose. o DC

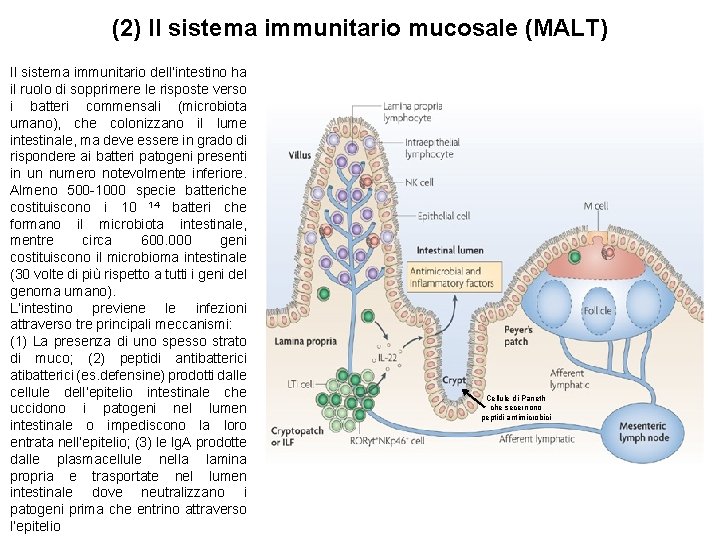
(2) Il sistema immunitario mucosale (MALT) Il sistema immunitario dell’intestino ha il ruolo di sopprimere le risposte verso i batteri commensali (microbiota umano), che colonizzano il lume intestinale, ma deve essere in grado di rispondere ai batteri patogeni presenti in un numero notevolmente inferiore. Almeno 500 -1000 specie batteriche costituiscono i 10 14 batteri che formano il microbiota intestinale, mentre circa 600. 000 geni costituiscono il microbioma intestinale (30 volte di più rispetto a tutti i geni del genoma umano). L’intestino previene le infezioni attraverso tre principali meccanismi: (1) La presenza di uno spesso strato di muco; (2) peptidi antibatterici atibatterici (es. defensine) prodotti dalle cellule dell’epitelio intestinale che uccidono i patogeni nel lumen intestinale o impediscono la loro entrata nell’epitelio; (3) le Ig. A prodotte dalle plasmacellule nella lamina propria e trasportate nel lumen intestinale dove neutralizzano i patogeni prima che entrino attraverso l’epitelio Cellule di Paneth che secernono peptidi antimicrobici

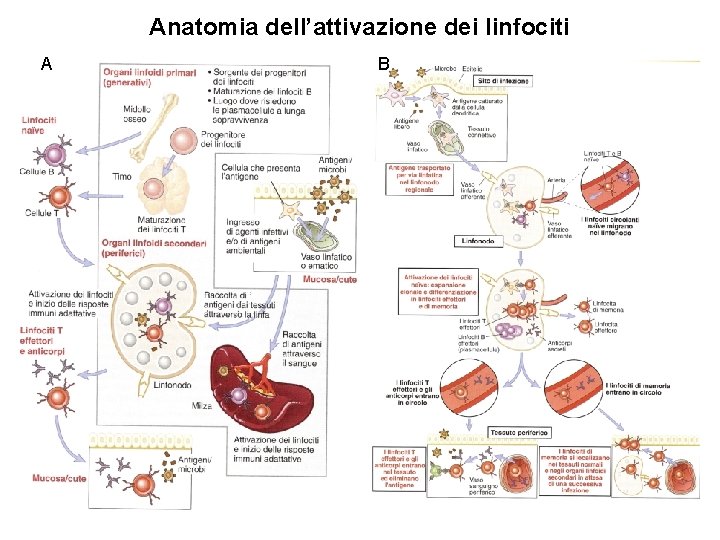
A. VIE E MECCANISMI DELLA RICIRCOLAZIONE E DELL’HOMING LINFOCITARIO I linfociti migrano in continuazione tra il torrente ematico, i vasi linfatici, i tessuti linfoidi secondari e i tessuti non linfoidi periferici. I linfociti naive passano in continuazione dal sangue ai linfonodi per poi ritornare in circolo attraverso i vasi linfatici, fino all’incontro dell’antigene specifico a livello di un linfonodo. Questo modo di circolare dei linfociti naive, chiamato ricircolazione linfocitaria, fa si che i pochi linfociti naive specifici per un particolare antigene pattuglino l’intero organismo alla ricerca di quel dato antigene. A. I meccanismi di migrazione dei linfociti naive (“vergini”) agli organi linfodi secondari e la loro localizzazione nelle varie aree T e B (homing o accasamento linfocitario) è dovuto all’espressione di molecole di adesione (selectine ed integrine) ed a chemochine e recettori delle chemochine presenti in particolare su venule postcapillari specializzate presenti nei linfonodi, chiamate venule ad alto endotelio (High Endothelial Venules, HEV). La migrazione dei linfociti T naive dal sangue al parenchima dei linfonodi è un processo a stadi successivi. Questi stadi consistono (1) nel rotolamento (rolling) delle cellule, mediato dalle selectine, (2) nell’adesione ferma (stop) all’endotelio vascolare, mediato dalle integrine, e (3) nella trasmigrazione (diapedesi) attraverso la parete del vaso. B. I linfociti che hanno reagito con l’antigene specifico e che si sono differenziati in cellule effettrici e di memoria a livello dei tessuti linfoidi secondari possono poi ritornare nel torrente ematico e così migrare nei tessuti periferici (non linfoidi) sede dei processi flogistici e/o infettivi con un meccanismo di homing simile a quello descritto. Le chemochine coinvolte nel traffico leucocitario sono prodotte in modo costitutivo negli organi linfoidi secondari, mentre sono indotte nei siti dell’ infezione e dell’infiammazione. FIGURA. I linfociti T naive si localizzano nei linfonodi in seguito al legame della L-selectina ai suoi ligandi espressi sulle HEV (High Endothelial Venules), presenti selettivamente nei linfonodi, ed in seguito al legame alle chemochine CCL 19 e CCL 21 anch’esse espresse sulle HEV. I linfociti T attivati e le cellule T effettrici si localizzano nei tessuti periferici sede dell’infiammazione e dell’infezione e questa migrazione è mediata dalle E- e P-selectine, dalle integrine e dalle chemochine prodotte dall’immunità innata nei siti dell’infezione.

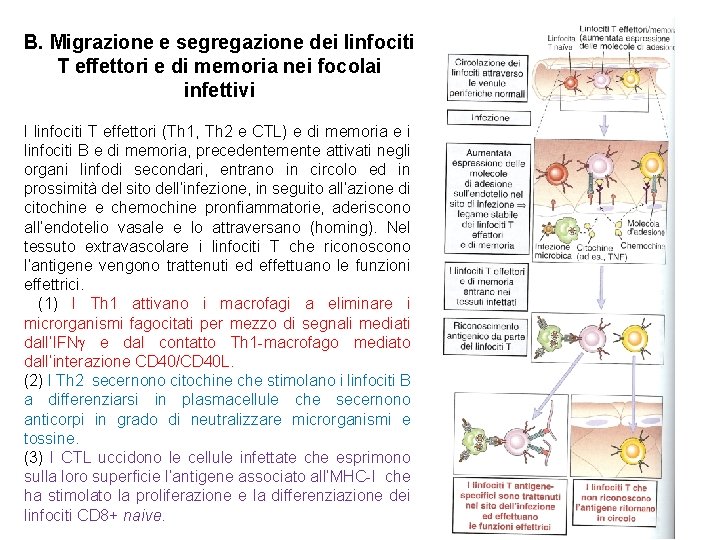
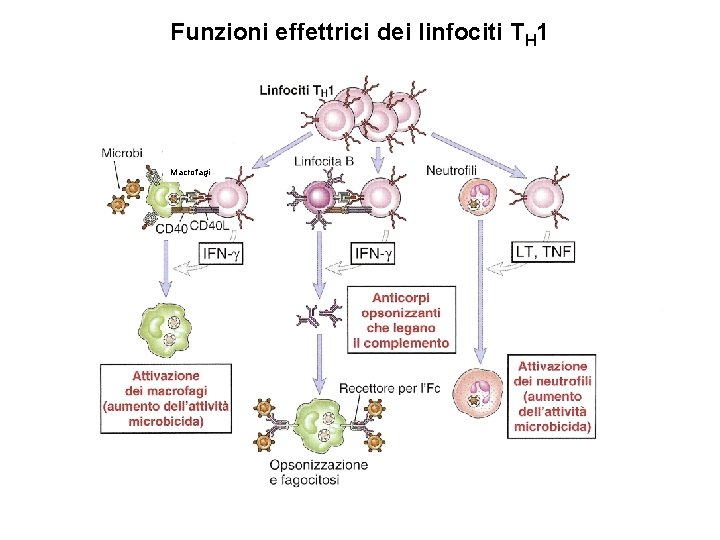
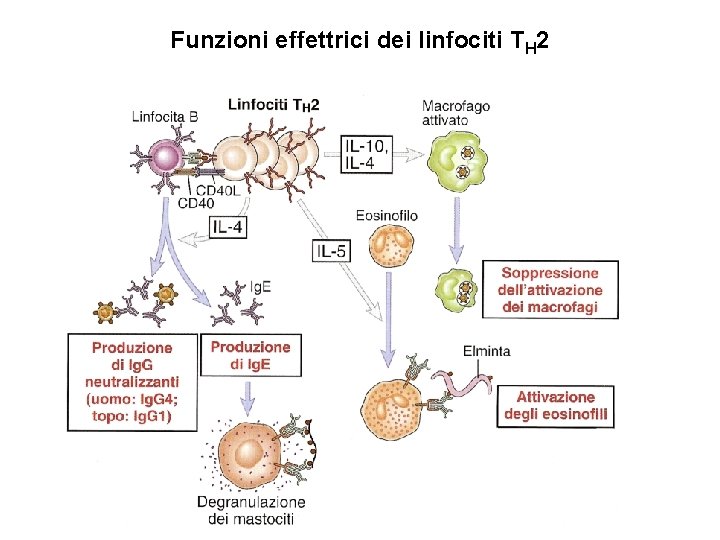
B. Migrazione e segregazione dei linfociti T effettori e di memoria nei focolai infettivi I linfociti T effettori (Th 1, Th 2 e CTL) e di memoria e i linfociti B e di memoria, precedentemente attivati negli organi linfodi secondari, entrano in circolo ed in prossimità del sito dell’infezione, in seguito all’azione di citochine e chemochine pronfiammatorie, aderiscono all’endotelio vasale e lo attraversano (homing). Nel tessuto extravascolare i linfociti T che riconoscono l’antigene vengono trattenuti ed effettuano le funzioni effettrici. (1) I Th 1 attivano i macrofagi a eliminare i microrganismi fagocitati per mezzo di segnali mediati dall’IFN e dal contatto Th 1 -macrofago mediato dall’interazione CD 40/CD 40 L. (2) I Th 2 secernono citochine che stimolano i linfociti B a differenziarsi in plasmacellule che secernono anticorpi in grado di neutralizzare microrganismi e tossine. (3) I CTL uccidono le cellule infettate che esprimono sulla loro superficie l’antigene associato all’MHC-I che ha stimolato la proliferazione e la differenziazione dei linfociti CD 8+ naive.

Fasi dell’immunità adattativa L’immunità adattativa si sviluppa in 3 fasi successive: (1) il riconoscimento e processazione degli antigeni che compongono un microrganismo; (2) l’attivazione e differenziazione cellulare; (3) la risposta effettrice con l’eliminazione dell’antigene e/o microrganismo. 1. Riconoscimento del microrganismo. La sorveglianza del sistema immunitario è basata sulla ricerca e sull’individuazione di molecole (antigeni) estranee al nostro organismo (non self) discriminandole da molecole che fanno parte del nostro organismo (self). Il riconoscimento di un antigene può avvenire con due meccanismi diversi che coinvolgono rispettivamente, o i linfociti B o i linfociti T. I linfociti B riconoscono gli antigeni attraverso un recettore specifico (BCR-B Cell Receptor), che è rappresentato da due molecole anticorpali di membrana (Ig. D e Ig. M). I linfociti T attraverso i Tcr che sono in grado di riconoscere sequenze peptidiche associate a MHC-I o MHC-II, presente sulle cellule APC professionali (DC, macrofagi e linfociti B). Le DC e i macrofagi si trovano sotto gli epiteli e nell’interstizio di tutti i tessuti e possiedono recettori che catturano e reagiscono ai microbi (es. TLR) per poi migrare agli organi linfoidi per presentare l’antigene ai linfociti T. 2. Attivazione e differenziazione cellulare. I linfociti e le APC sono cellule itineranti che migrano negli organi linfoidi ed in altri tessuti, con un meccanismo definito di homing. I linfociti immaturi che non hanno ancora incontrato i rispettivi antigeni sono detti “naive” o vergini. In particolari aree degli organi linfoidi secondari avviene l’incontro fra cellule APC e linfociti T helper CD 4+ o linfociti T CD 8+. Quando i i linfociti TCD 4+ vergini riconoscono il complesso peptide-MHC di classe II, sulle cellule APC, queste secernono opportune citochine che promuovono (1) la proliferazione ed espansione clonale dei Th (IL 2 che si lega al suo recettore-IL 2 R), (2) la differenziazione dei Th in diverse sottoclassi (es IL 12 per la differenziazione in Th 1 e IL 4 per i Th 2). Quando i linfociti CD 8+ vergini riconoscono il complesso peptide-MHC di classe I sulle cellule APC vengono espresse specifiche citochine che promuovono l’espansione clonale dei CD 8+ e la loro differenziazione in linfociti T citotossici (CTL). L’attivazione dei TCD 4+ e dei TCD 8+ portano alla generazione di linfociti della memoria che possono persistere nell’ospite per tutta la vita. I linfociti T della memoria si dividono in due sottoclassi: linfociti T di memoria centrali che risiedono nei linfonodi e linfociti T di memoria effettori che migrano ai tessuti periferici (es. mucose) L’attivazione dei linfociti B può essere o timo indipendente (TI) o timo dipendente (TD). I linfociti B attivati vanno incontro ad amplificazione clonale e successiva trasformazione in plasmacellule secernenti anticorpi e in linfociti B della memoria. 3. Risposta effettrice. Le cellule B e T attivate si vanno a localizzare nei tessuti dove è avvenuto il processo di infezione e infiammazione, con un meccanismo definito di “homing”, E’ questa la fase finale in cui i linfociti attivati espletano le funzioni che portano all’eliminazione del patogeno di cui l’antigene è parte. Le cellule e le molecole effettrici sono (1) gli anticorpi, (2) diverse classi di linfociti T CD 4+, che esprimono particolari citochine, e (3) i linfociti citotossici o CTL.

Anatomia dell’attivazione dei linfociti A B

Funzioni effettrici dei linfociti TH 1 Macrofagi

Funzioni effettrici dei linfociti TH 2

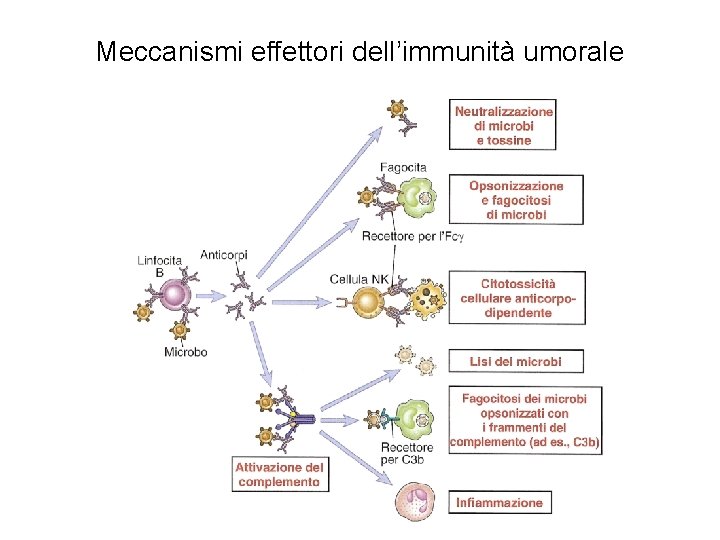
Meccanismi effettori dell’immunità umorale

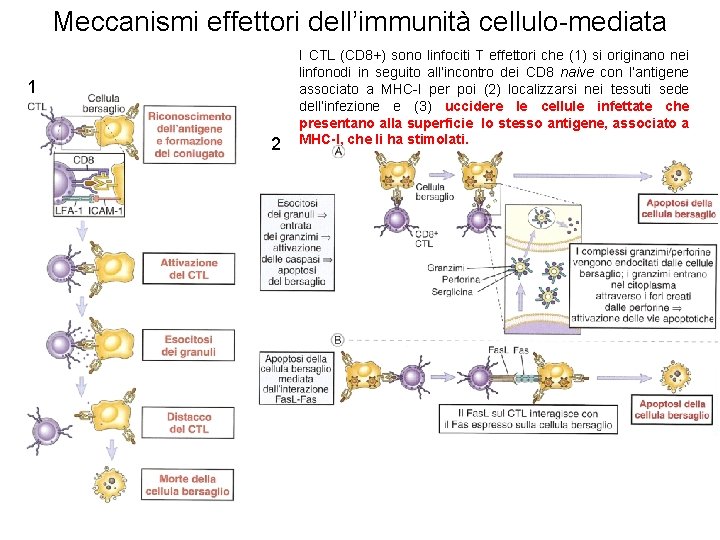
Meccanismi effettori dell’immunità cellulo-mediata 1 2 I CTL (CD 8+) sono linfociti T effettori che (1) si originano nei linfonodi in seguito all’incontro dei CD 8 naive con l’antigene associato a MHC-I per poi (2) localizzarsi nei tessuti sede dell’infezione e (3) uccidere le cellule infettate che presentano alla superficie lo stesso antigene, associato a MHC-I, che li ha stimolati.