Il numero di ossidazione una carica positiva o



















- Slides: 31

Il numero di ossidazione è una carica positiva o negativa che viene attribuita formalmente a ciascun elemento in un composto. Esso viene determinato dal numero di elettroni in più o in meno rispetto all’atomo neutro quando gli elettroni di legame sono attribuiti all’elemento più elettronegativo n. o. +1 H n. o. -1 Cl Per definizione il numero di ossidazione di un elemento nelle sostanze elementari è zero. Ca 2+ ha n. o. +2 perche’ ha perso due elettroni rispetto all’atomo neutro

Il numero di ossidazione non dipende dal formalismo con cui la formula di struttura è scritta (cioè non dipende dal numero di legami ). -2 -2 -2 O S +6 -2 O ] O 2 - ] O -2 O +6 -2 S O -2 O ] 2 - ] Il numero di ossidazione di ioni monoatomici corrisponde alla carica dello ione. La somma dei numeri di tutti i numeri di ossidazione degli atomi che compongono una specie chimica deve essere pari a zero per molecole neutre o pari alla carica dello ione.

Numero di ossidazione Molecole: NH 3, CO, Si. H 4, HNO 3 Formula di struttura Sali: Na 2 CO 3, K 2 Cr. O 4, NH 4 Cl, Na. Cl Il n. o. dello ione mononegativo o monopositivo corrisponde alla sua carica, mentre i n. o. degli elementi dello ione poliatomico si calcola come la formula di struttura. Come per la carica formale la somma algebrica dei numeri di ox degli elementi in un composto fa zero se il composto è neutro ed è uguale alla carica dello ione negli ioni poliatomici Ma…. non dipende dalla formula di risonanza…

n. o. -3 N n. o. +1 H HH O n. o. -2 H HH n. o. -1 CH 4 => n. o. H è +1 Sb. H 3 => n. o. Sb è +3 O n. o. +5 N O n. o. -1 Si n. o. +4 PH 3 => n. o. P è -3 As. H 3 => n. o. As è +3 n. o. -2 H n. o. +1 n. o. -2 O H n. o. +1 n. o. +2 C n. o. -2 O n. o. +1 H n. o. +5 N O n. o. -2 n. o. +1 O n. o. +5 H O n. o. -2 N O n. o. -2


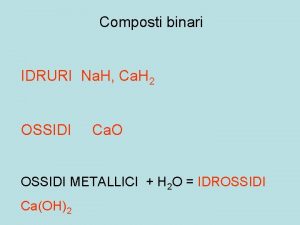
I numeri di ox si ricavano dalle formule minime Ossigeno e idrogeno hanno quasi sempre, con poche eccezioni, numeri di ossidazione fissi uguali a -2 e +1, rispettivamente. Quindi HCl. O, Cl 2 O, CO 32 -, Cr 2 O 72 ma attenzione non sempre!!!! Es. OF 2, perossidi (H 2 O 2), superossidi (Na. O 2) idruri (es. Na. H, Na. BH 4)

• Il numero di ossidazione dell’idrogeno quando è legato ad ossigeno è +1. • Il numero di ossidazione dell’ossigeno più comune è – 2. +1 -2 H 2 SO 4 +1 -2 HSO 4 - -2 x 4 + 1 x 2 + X = 0 X=6 -2 x 4 + 1+ X = -1 X=6

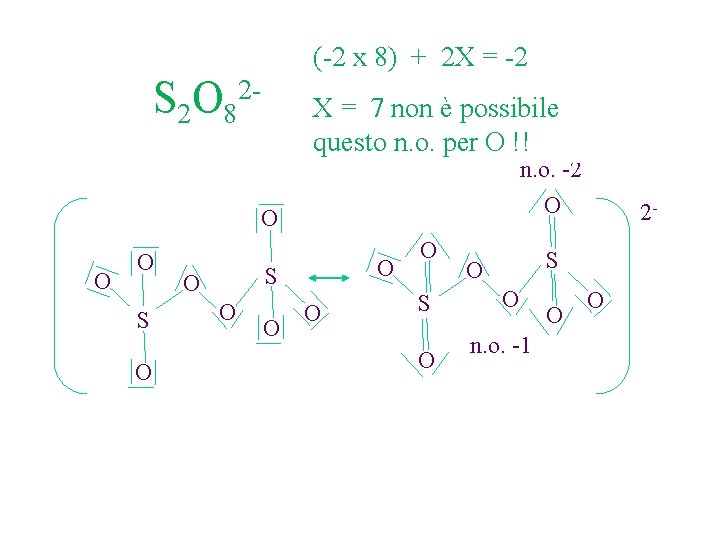
(-2 x 8) + 2 X = -2 2 S 2 O 8 X = 7 non è possibile questo n. o. per O !! n. o. -2 O O S O O O O O S O 2 - S O O n. o. -1 O O

-1 -1

Metalli di transizione e composto di coordinazione • Gli elementi di transizione sono caratterizzati dal parziale riempimento degli orbitali d di uno strato n e dal riempimento, spesso completo, dell’orbitale s dello strato successivo caratterizzato dal numero quantico n+1. • Quando formano ioni Mn+, gli elettroni che vengono persi per primi da questi elementi sono gli (n+1)s • Nella formazione di legami covalenti questi composti hanno a disposizione sia gli orbitali dello strato n+1 (s, p, d), che gli orbitali nd. Questi orbitali n+1 sono tutti VUOTI!! • Come conseguenza essi potrebbero dare luogo ad un numero molto elevato di legami s • In realtà tale numero di legami s è limitato dalla repulsione sterica fra gli atomi legati al metallo di transizione, che è l’atomo centrale, più che dal numero di orbitali a disposizione.

Composto di coordinazione • Il metallo mette a disposizione orbitali vuoti • Il legante mette a disposizione una coppia elettronica e un orbitale • Sono legami molto polari, e la polarizzazione è diretta verso l’atomo che mette in compartecipazione la coppia elettronica = atomo donatore • Il numero di atomi donatori a cui è legato l’atomo centrale si chiama numero di coordinazione

Complessi o composti di coordinazione Es. M(NH 3)62+ M = Cr 2+, Mn 2+, Fe 2+, Co 2+, Ni 2+, Cu 2+, Zn 2+ N è l’atomo donatore NH 3 è il legante Il numero di leganti è sempre 6 pur avendo orbitali d che via si riempiono da Cr allo Zn Quindi il numero di legami è determinato dalla repulsione sterica tra i leganti e non dal numero di orbitali disponibili perche’ sono tanti!

I composti di coordinazione • Si è definito composto di coordinazione un composto in cui l'atomo centrale forma un numero di legami maggiore del suo numero di ossidazione quando esso sia maggiore o uguale a 0. Nei cationi metallici complessati con leganti neutri il n. o. è uguale alla carica del complesso, es. M(NH 3)62+ , perchè atomo donatore è sempre più elettronegativo del metallo centrale. Anche composti non contenenti metalli di transizione possono essere considerati complessi, Es. BF 4 -, PCl 6 -, Si. F 6 -

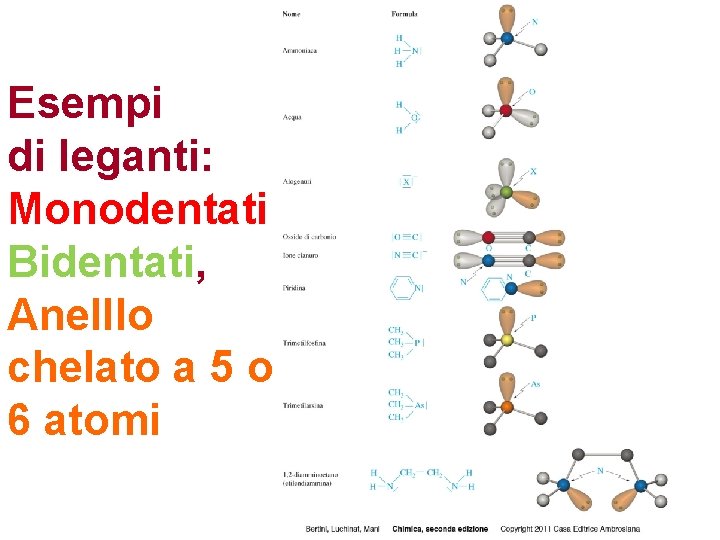
Esempi di leganti: Monodentati Bidentati, Anelllo chelato a 5 o 6 atomi

Uno ione complesso è costituito da un atomo metallico centrale, con carica positiva, che coordina attorno a sé, secondo definite geometrie, un numero definito di molecole polari o di anioni (leganti). Il numero di leganti coordinati va di solito da 2 a 6, ma può arrivare a 12.

Un CATIONE METALLICO con ORBITALI “d” vuoti è capace di accettare coppie di elettroni e in genere ha alta carica (+2, +3, +4) e piccola dimensione (alta densità di carica). I LIGANDI possono essere anioni e molecole neutre La carica di un certo complesso è data dalla somma algebrica delle cariche del metallo e delle specie chimiche leganti: • se i gruppi leganti sono neutri si ha un CATIONE COMPLESSO (Es. Zn(H 2 O)62+) • se i gruppi leganti sono anionici si ha un ANIONE COMPLESSO (Es. Zn. Cl 42 -) • i leganti possono anche essere in parte anioni ed in parte neutri (Es. Zn(H 2 O)Cl 3 -)

Esempi di composti di coordinazione di metalli

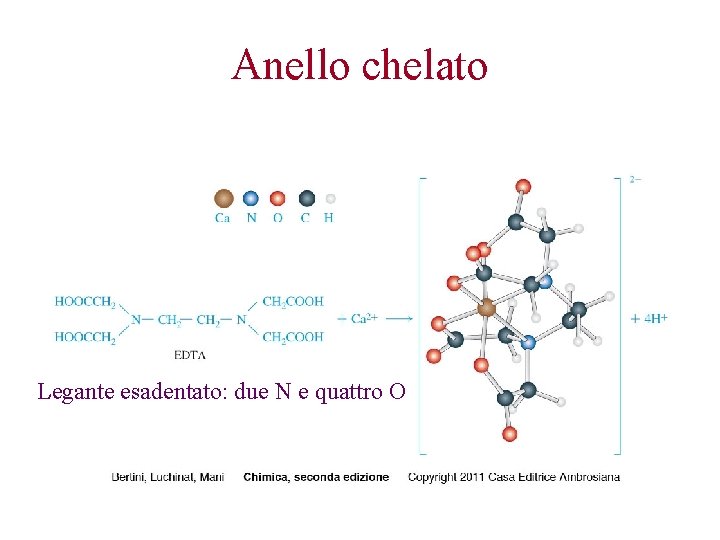
Anello chelato Legante esadentato: due N e quattro O

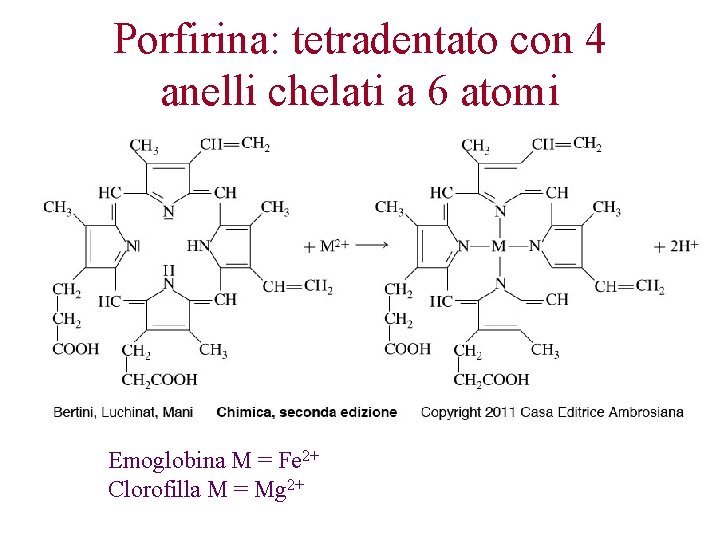
Porfirina: tetradentato con 4 anelli chelati a 6 atomi Emoglobina M = Fe 2+ Clorofilla M = Mg 2+

Numero di coordinazione: da cosa dipende? • Non dalla configurazione elettronica esterna • Dalla carica, ossia numero di ossidazione, (es. Pt. Cl 62 - e Pt. Cl 42 -) e dimensioni dell’atomo centrale • Dalle dimensioni dei leganti • Dalla carica dei leganti molecole neutre e piccole es NH 3 e H 2 O danno numero di coordinazione 6, gli ioni Cl-, Br-, Ipiu’ grandi e carichi danno numero di coordinazione +4

Numero di coordinazione: Nella I serie di transizione il numero di coordinazione 6 è frequente per ioni metallici +2 e +3, e il numero di coordinazione 4 è presente per gli ioni metallici +2 Numero di coordinazione 2 è presente negli ioni metallici +1

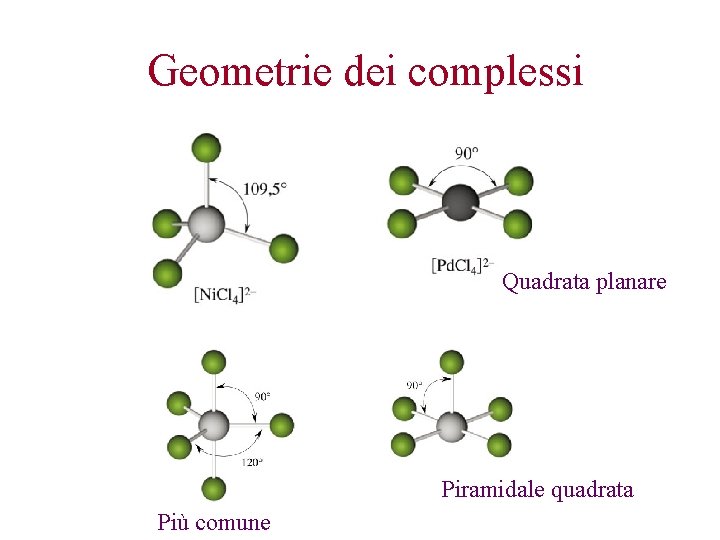
Geometrie dei complessi Per i metalli di transizione ci si riferisce sempre a composti del tipo AX 2, AX 3, AX 4, AX 5, AX 6. Gli elettroni di non legame che occupano gli orbitali d esterni non si contano nel meccanismo delle repulsioni elettroniche della VSEPR, ma si considerano solo i doppietti di non legame derivanti dagli atomi donatori dei leganti. La disposizione spaziale degli atomi donatori intorno al metallo è tale da rendere minima l’energia di repulsione tra le coppie di legame, quindi: Ag(NH 3)2+, Ag(CN)2 - Cu. Br 32 - M(NH 3)6 n+ M(H 2 O)6 n+ n = +2 e +3 M = metalli I serie di transizione

Geometrie dei complessi Quadrata planare Piramidale quadrata Più comune

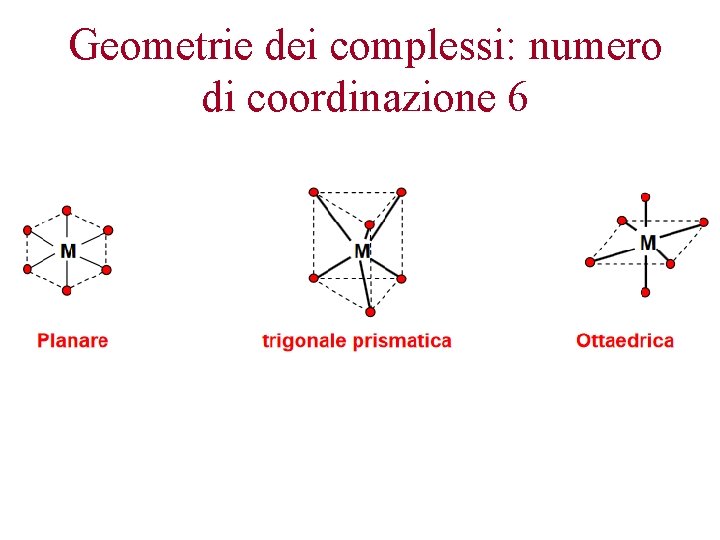
Geometrie dei complessi: numero di coordinazione 6

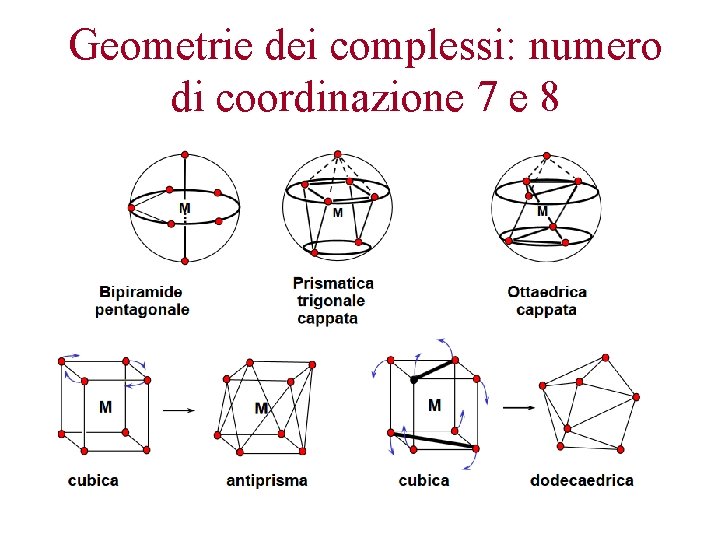
Geometrie dei complessi: numero di coordinazione 7 e 8

Geometrie dei complessi: numero di coordinazione 9, coordinazione inusuale

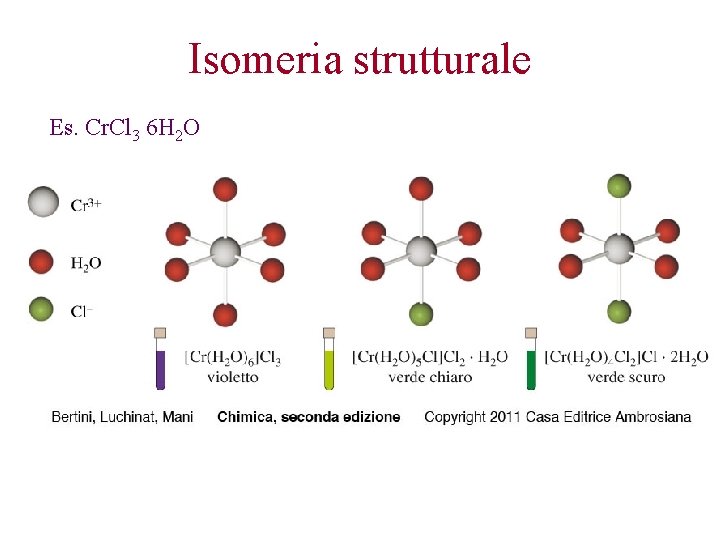
Isomeria Si parla isomeria quando ho composti con stessa composizione o formula molecolare ma diversa formula di struttura. Dato che le proprietà chimiche e fisiche delle sostanze dipendono dalla loro struttura, gli isomeri sono individui chimici diversi fra loro • Isomeria strutturale • Isomeria geometrica (diastereoisomeria) • Isomeria ottica

Isomeria strutturale Es. Cr. Cl 3 6 H 2 O

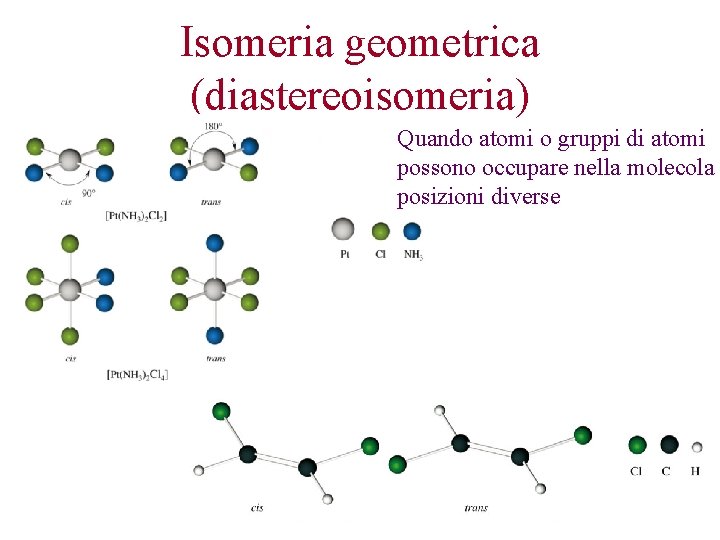
Isomeria geometrica (diastereoisomeria) Quando atomi o gruppi di atomi possono occupare nella molecola posizioni diverse

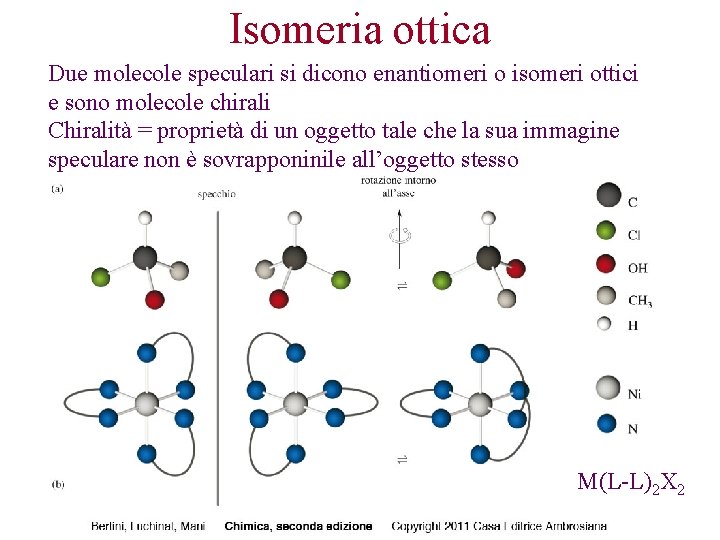
Isomeria ottica Due molecole speculari si dicono enantiomeri o isomeri ottici e sono molecole chirali Chiralità = proprietà di un oggetto tale che la sua immagine speculare non è sovrapponinile all’oggetto stesso M(L-L)2 X 2

Isomeria ottica: diasteroisomeri Molecole che contengono due o più centri asimmetrici che differiscono per uno o più (ma non tutti) i centri asimmetrici sono diasteroisomeri. I diasteroisomeri, a differenza degli enantiomeri, hanno proprietà chimiche e fisiche diverse
 Numero di ossidazione definizione
Numero di ossidazione definizione Idruri
Idruri Ammonizzazione dell'azoto
Ammonizzazione dell'azoto Energia campo elettrico
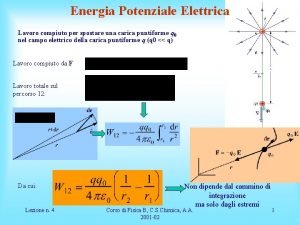
Energia campo elettrico Una particella carica negativamente di massa
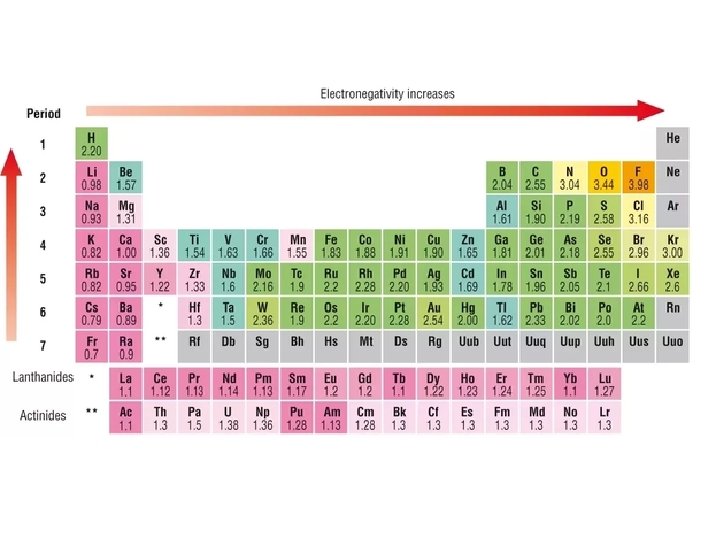
Una particella carica negativamente di massa Tavola periodica numeri di ossidazione
Tavola periodica numeri di ossidazione Epossidazione di sharpless
Epossidazione di sharpless Idroborazione ossidazione
Idroborazione ossidazione Idroborazione ossidazione
Idroborazione ossidazione Soluzioni capitolo 18 chimica più
Soluzioni capitolo 18 chimica più Reazioni ossido riduzione
Reazioni ossido riduzione Ossiacido
Ossiacido Ditetraossoclorato di magnesio
Ditetraossoclorato di magnesio Reazioni ossido riduzione
Reazioni ossido riduzione Beta ossidazione
Beta ossidazione Ossidazione e riduzione
Ossidazione e riduzione Concepto de trabajo
Concepto de trabajo Aplica la fuerza
Aplica la fuerza Trabajo y potencia de una fuerza positiva
Trabajo y potencia de una fuerza positiva Factorizacion de crout
Factorizacion de crout Derivada de tangente
Derivada de tangente Que es una imagen positiva
Que es una imagen positiva Cuando una matriz es definida positiva
Cuando una matriz es definida positiva Foda concepto
Foda concepto Campo elettrico sfera carica
Campo elettrico sfera carica Coniugazione di carica
Coniugazione di carica Valenza chimica
Valenza chimica Severini ballerina blu
Severini ballerina blu Teorema di gauss campo elettrico
Teorema di gauss campo elettrico Carica formale
Carica formale Massa protone
Massa protone Carica protone
Carica protone