Il gruppo COOH molto polare e pu formare











- Slides: 17

• Il gruppo COOH è molto polare e può formare legami a idrogeno • Gli acidi carbossilici hanno temperature di ebollizione e fusione superiori a tutti i composti organici con la medesima lunghezza della catena idrocarburica • Fino a 4 C gli acidi carbossilici sono solubili in acqua, poi sempre meno solubili

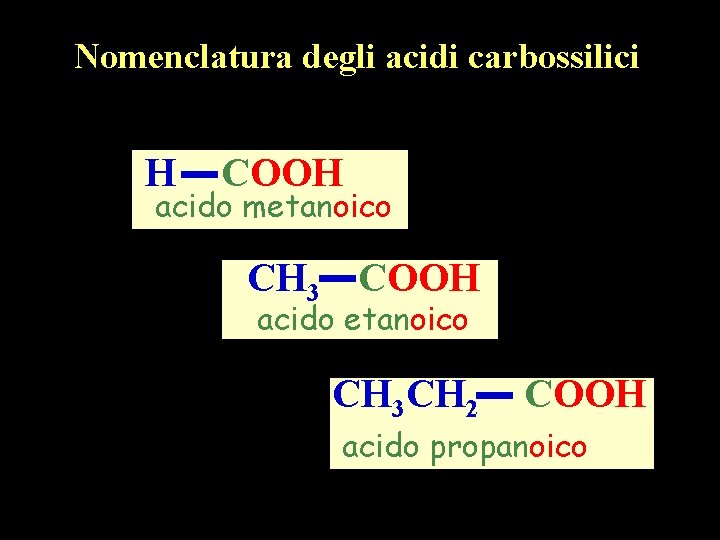
Nomenclatura degli acidi carbossilici H COOH acido metanoico CH 3 COOH acido etanoico CH 3 CH 2 COOH acido propanoico

Gli acidi carbossilici sono acidi più forti degli alcoli corrispondenti Ka = 1. 8 x 10 -5 CH 3 COOH + H 2 O CH 3 COO- + H 3 O+ Ka = 1 x 10 -16 CH 3 CH 2 OH + H 2 O CH 3 CH 2 O- + H 3 O+ risonanza

• Gli acidi insolubili e componenti di di grassi e oli animali e vegetali sono chiamati acidi grassi • Il Nome IUPAC è acido R–oico ma sono molto diffusi i nomi tradizionali • Esistono anche acidi bicarbossilici e tricarbossilici

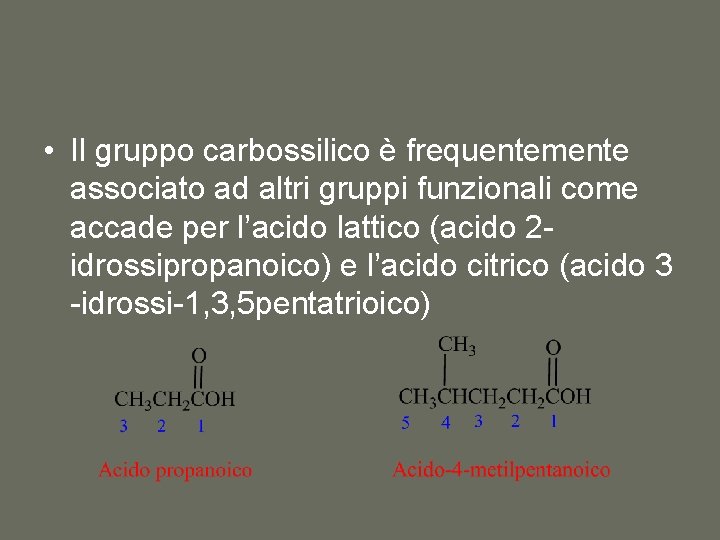
• Il gruppo carbossilico è frequentemente associato ad altri gruppi funzionali come accade per l’acido lattico (acido 2 idrossipropanoico) e l’acido citrico (acido 3 -idrossi-1, 3, 5 pentatrioico)

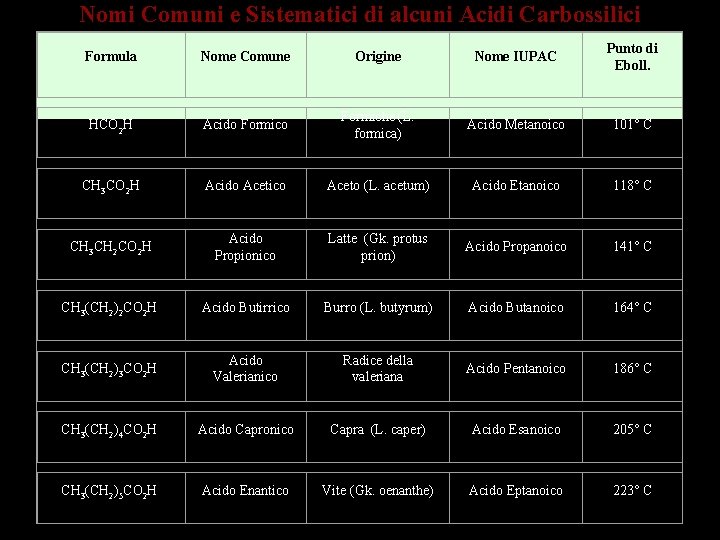
Nomi Comuni e Sistematici di alcuni Acidi Carbossilici Formula Nome Comune Origine Nome IUPAC Punto di Eboll. HCO 2 H Acido Formiche (L. formica) Acido Metanoico 101° C CH 3 CO 2 H Acido Acetico Aceto (L. acetum) Acido Etanoico 118° C CH 3 CH 2 CO 2 H Acido Propionico Latte (Gk. protus prion) Acido Propanoico 141° C CH 3(CH 2)2 CO 2 H Acido Butirrico Burro (L. butyrum) Acido Butanoico 164° C CH 3(CH 2)3 CO 2 H Acido Valerianico Radice della valeriana Acido Pentanoico 186° C CH 3(CH 2)4 CO 2 H Acido Capronico Capra (L. caper) Acido Esanoico 205° C CH 3(CH 2)5 CO 2 H Acido Enantico Vite (Gk. oenanthe) Acido Eptanoico 223° C

Proprietà chimiche • A causa dell’attrazione tra il gruppo carbonilico e quello ossidrilico, il gruppo carbossilico presenta proprietà acide più spiccate degli alcoli. • Tutti gli acidi carbossilici possono perdere uno ione H+ trasformandosi in ioni carbossilato COO-. La reazione è reversibile e lo ione carbossilato si comporta da base coniugata forte e stabile

Neutralizzazione • Con basi forti gli acidi carbossilici danno luogo a Sali e acqua • R-COOH + Na. OH R-COO-Na+ • I Sali degli acidi carbossilici sono solubili in acqua • Il nome del sale si ottiene mettendo la desinenza –ato • I Sali degli acidi grassi prendono il nome di saponi.

Gli acidi carbossilici reagiscono con gli idrossidi degli elementi metallici dando luogo alla formazione di sali CH 3 COO Na+ etanoato di sodio (CH 3 CH 2 COO- )2 Ca 2+ propanoato di calcio

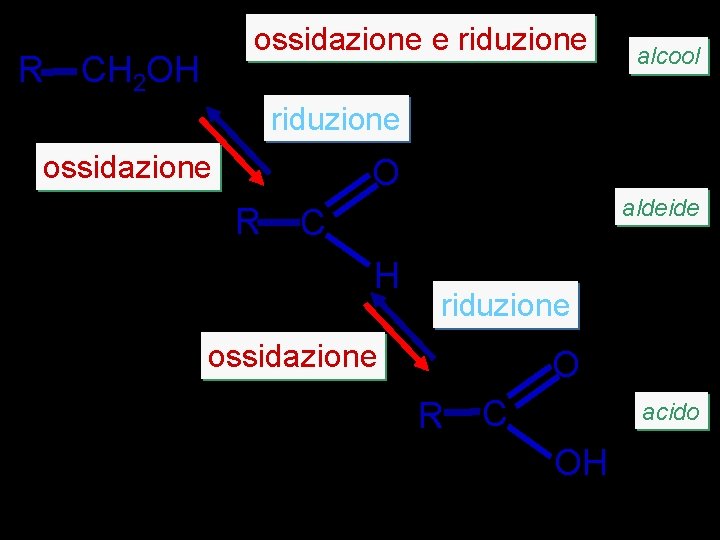
R ossidazione e riduzione CH 2 OH alcool riduzione ossidazione O R aldeide C H riduzione ossidazione O R C acido OH

Riduzione e trasformazione ad alcoli • In presenza di un riducente forte, si riducono, trasformandosi in alcoli: • R-COOH R-CH 2 OH (con Li. Al. H 4 e H 2 O)

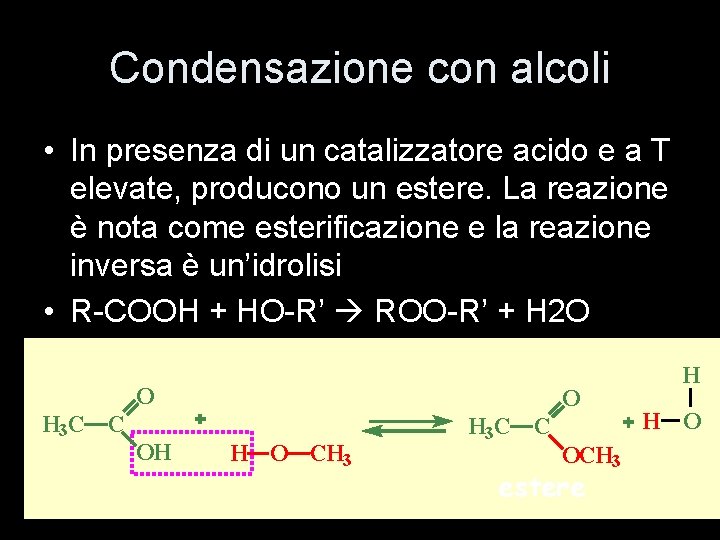
Condensazione con alcoli • In presenza di un catalizzatore acido e a T elevate, producono un estere. La reazione è nota come esterificazione e la reazione inversa è un’idrolisi • R-COOH + HO-R’ ROO-R’ + H 2 O O H 3 C C OH O CH 3 H 3 C C OCH 3 estere H H O

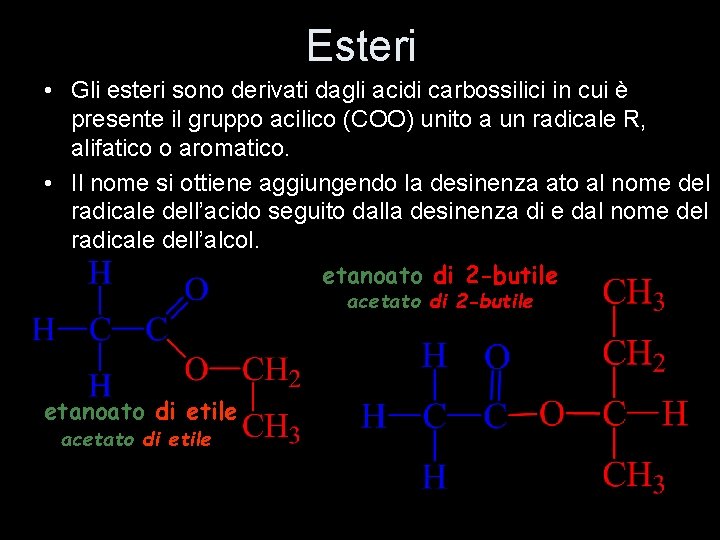
Esteri • Gli esteri sono derivati dagli acidi carbossilici in cui è presente il gruppo acilico (COO) unito a un radicale R, alifatico o aromatico. • Il nome si ottiene aggiungendo la desinenza ato al nome del radicale dell’acido seguito dalla desinenza di e dal nome del radicale dell’alcol. etanoato di 2 -butile acetato di 2 -butile etanoato di etile acetato di etile

• Gli esteri vengono considerati Sali organici dove al posto del metallo c’è un gruppo derivato da un composto organico. • Sono solitamente insolubili in acqua • In generale sono dotati di un aroma caratteristico e gradevole

• Importanti gli esteri che deviano dal glicerolo (1, 2, 3 -propantriolo) che può unirsi a tre acidi grassi formando i trigliceridi, principali componenti dei grassi e degli oli

• Addizionando una molecola d’acqua gli esteri vanno incontro a reazioni di idrolisi riformando l’alcol e l’acido di provenienza (reazione inversa dell’esterificazione) • Quando un estere reagisce con idrossido di sodio o di potassio si produce il sale dell’acido e l’alcol in una reazione di idrolisi • Benzoato di metile+Idrossido di sodio Benzoato di sodio + alcol metilico

• I trigliceridi reagiscono con idrossido di sodio o di potassio producendo tre molecole di sapone e glicerolo • I poliesteri hanno struttura filamentosa e vengono dall’unione di alcoli e acidi carbossilici