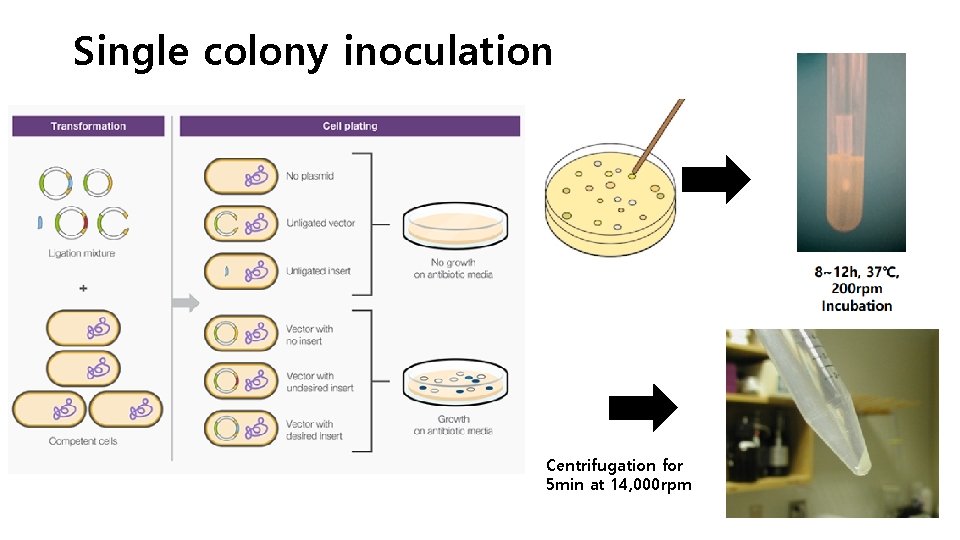
II Plasmid DNA Extraction Single colony inoculation Centrifugation








- Slides: 10

기초생명과학 및 실험 II Plasmid DNA Extraction

Single colony inoculation Centrifugation for 5 min at 14, 000 rpm


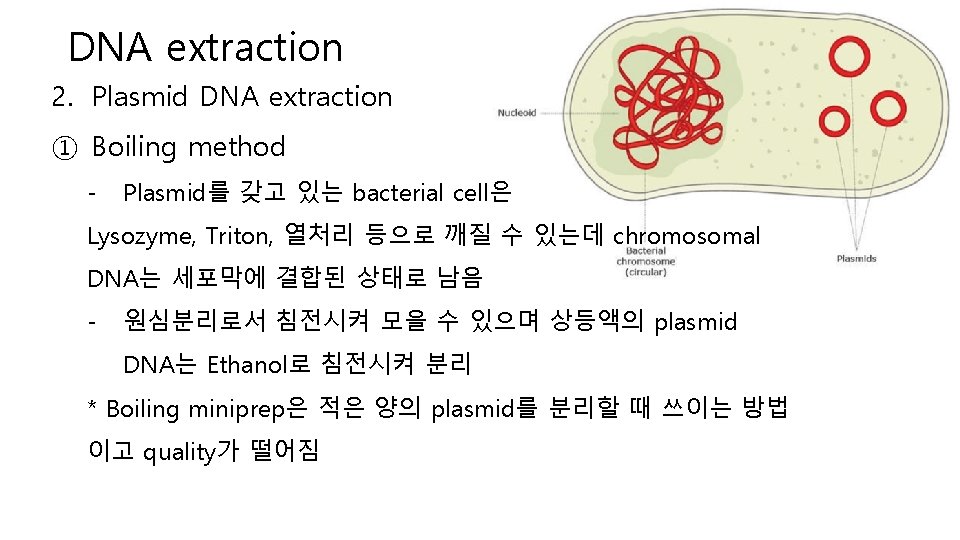
DNA extraction 2. Plasmid DNA extraction ① Boiling method - Plasmid를 갖고 있는 bacterial cell은 Lysozyme, Triton, 열처리 등으로 깨질 수 있는데 chromosomal DNA는 세포막에 결합된 상태로 남음 - 원심분리로서 침전시켜 모을 수 있으며 상등액의 plasmid DNA는 Ethanol로 침전시켜 분리 * Boiling miniprep은 적은 양의 plasmid를 분리할 때 쓰이는 방법 이고 quality가 떨어짐

DNA extraction 2. Plasmid DNA extraction ② Alkaline lysis method - 가장 일반적으로 쓰이는 분리 방법 - Bacterial cell에 EDTA, SDS를 처리하여 lysis - Na. OH를 처리하여 Denaturation - Potassium acetate를 처리하여 Neutralization - Chromosomal DNA & bacterial protein 원심분리로 제거 - plasmid DNA는 상등액에 남아있게 되고 ethanol precipitation으로 침전

Plasmid DNA extraction (Alkaline lysis method) • Mini-prep ① Sol-I : Resuspension buffer Glucose + Tris-Cl (p. H 8. 0)+ EDTA + RNase ② Sol-II : Lysis buffer & Denaturation SDS (sodium dodecyl sulfate) + Na. OH ③ Sol-III : Neutralization buffer & Renaturation Potassium acetate + glacial acetic acid

DNA concentration & Purity • DNA extraction하여 얻은 DNA의 양(Yield)과 순도(purity)를 확인하기 위해 흡광도(OD)를 측정(spectrophotometer) • Yield : ng/ul • DNA : 260 nm에서 최대 흡광도 • Protein : 280 nm에서 최대 흡광도 • Phenol, EDTA : 230 nm에서 최대 흡광도 ØPurity ratios : - A 260/280 : 1. 8~2. 0 - A 260/230 > 2. 0

Silica resin matrix • DNA separation by silica adsorption • Silica resin matrix : (-) charge • DNA : (-) charge • Salt : (+) charge cation bridge formation

Method 1. 액체배지에서 18 h 키운 bacterial cell 5 ml 을 14, 000 rpm 5 min centrifuge 2. Pellet을 제외한 supernatant를 제거한다. 3. Pellet을 Sol-I buffer 250 ul를 넣어 resuspension한 후 새로운 tube에 옮긴다. 4. Sol-II buffer 250 ul를 3번 tube에 넣고 4 -6번의 inverting으로 섞는다. (Don’t vortexing) 5. Sol-III buffer 350 ul를 넣고 바로 4 -6번의 inverting으로 섞는다. 6. Centrifuge at 14, 000 rpm for 10 min (room temperature) 7. Supernatant를 column으로 옮긴 후 Centrifuge at 14, 000 rpm for 1 min (아래에 떨어진 용액은 버린다. )

Method 8. Wash buffer 700 ul를 넣은 후 centrifuge at 14, 000 rpm for 1 min 후 아래의 용액을 버린다. 9. 추가로 centrifugation을 1 min 더 한다. (남아있을 wash buffer를 제거하기 위해) 10. Column에 새로운 1. 5 ml tube를 낀다. 11. Elution buffer 50 ul을 column의 가운데에 넣어준 후 1 min incubation 12. Centrifuge at 14, 000 rpm for 1 min 13. Nano-drop (spectrophotometer의 종류 중 하나)