Ideln plyn n n velikost a hmota stic











- Slides: 13

Ideální plyn n n velikost a hmota částic je vůči jeho objemu zanedbatelná, mezi částicemi nejsou žádné interakce, žádná atrakce ani repulse. Částice ideálního plynu mají pouze kinetickou energii a jsou dokonale pružné). Objem který zaujímá jeden molekul je za standardních podmínek (teplota 273 K a tlak 101 k. Pa) 22, 4 dm 3 a počet částic je 6*1023. Pro srovnání je v kapalném stavu molární objem dusíku (teplota 77 K, tlak 101 k. Pa) 0, 0346 litru a v pevném stavu (teplota 63 K, tlak 101 k. Pa) dokonce 0, 0272 litru.

Plynné skupenství n Plyny se svými vlastnostmi liší od pevných látek a kapalin: § nemají stálý tvar ani stálý objem, § usilují o vyplnění celého prostoru, který mají k dispozici, § jsou stlačitelné a pružné (chovají se jako pružina) § a nemají vlastní povrch, povrchovou energii. § Pro úplnost heterogenní soustav (kapilární chemie) zahrnují povrchové napětí (energii) rovinných a zakřivených povrchů. Typické projevy (utajený var, neochota látek krystalovat, fázové přechody s kritickými hodnotami teplot, koncentrací a tlaků, adsorpce, heterogenní reakce a katalýza, a další.

Kinetická teorie (ideálního) plynu n n U ideálních plynů zanedbáváme jejich objem vzhledem k objemu ve kterém se nacházejí. Zvýšením počtu molekul v objemu se zvýší i počet možných nárazů na jednotku plochy nádoby a vzroste tlak. Ten je přímo úměrný množství plynu a nepřímo úměrný objemu

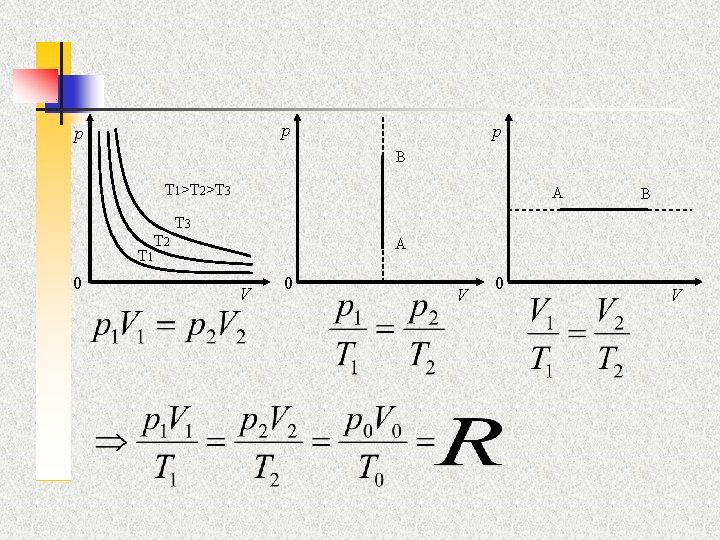
R. Boyle (1662) a P. Mariotte (1679) n n Formulovali jednoduchý výraz pro vztah mezi tlakem a objemem za konstantní teploty (d. T=0) p 1 V 1 = p 2 V 2 = konst. Pro závislost tlaku plynu na teplotě (při izochorickém ději, d. V=0) platí (I. A. Charles 1787): p = p 0(1 + t/273, 16) = p 0 (T/T 0). A pro analogický izobarický děj (dp=0) (I. L. Gay Lussac (1862): V = V 0(1 + t/273, 16) = V 0 (T/T 0).

Shrnutí n n Při konstantní teplotě se zachovává součin p. V =konst 1. Při konstantním objemu podíl p/T = konst 2 Při konstantní tlaku podíl V/T = konst 3 Jednou větou zachovává se výraz: p. V/T = konst. Tato konstanta se označuje R, nazývá se plynovou konstantou a je rovna 8, 314 J. mol-1 K-1.

p p p B T 1>T 2>T 3 T 2 A T 3 A T 1 0 B V 0 V

n … počet molů Vm … molární objem c …molární koncentrace (1/Vm) …osmotický tlak

Stavová rovnice ideálního plynu Pro 1 g p. V = r. T r-plynová konstanta [J. g -1. K-1] Pro 1 mol p. Vm = Rm. T Rm- univerzální plynová konstanta 8314, 3 J. mol-1. K-1 Pro m g p. V = m. r. T Pro n mol p. V = n. Rm. T

Daltonův zákon n Pro ideálně se chovající plyny platí Daltonův zákon, podle kterého se součet parciálních tlaků všech složek se rovná celkovému tlaku směsi plynu.

Reálné plyny se nechovají ideálně n n Van der Waalsova rovnice: vrcholným projevem neideálního chování je je kondenzace par § čím je větší tlak a nižší teplota, tím víc se plyny chovají neideálně a naopak. Čím nižší tlak a vyšší teplota, tím blíže je chování plynu shodné s ideálním plynem

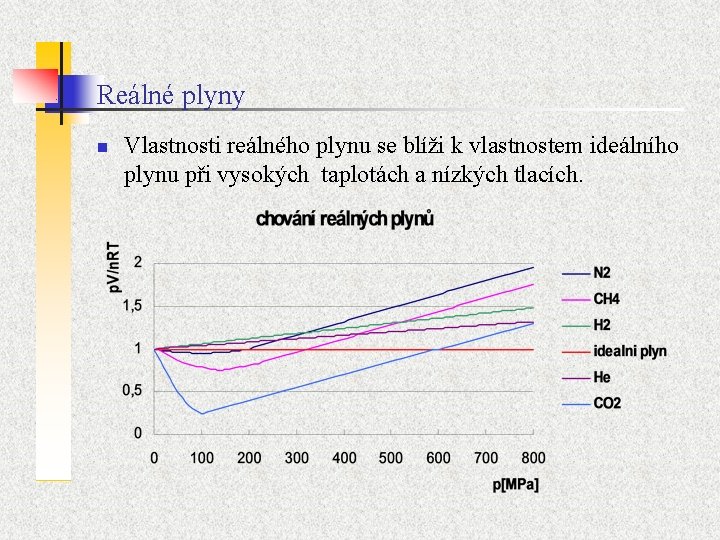
Reálné plyny n Vlastnosti reálného plynu se blíži k vlastnostem ideálního plynu při vysokých taplotách a nízkých tlacích.

Reálné plyny - pokračování n n Ideální plyn má pouze kinetickou energii, reálny plyn má navíc energii potenciální, které odpovídá interakci molekul. Tato interakce se projevuje vnitřním tlakem, který je ve Van der Waalsově rovnici aproximován výrazem a/V 2. Interakce molekul vedou až ke zkapalnění plynu.

Význam stavové rovnice n n n Je jedna univerzální pravda. Chceme-li vytvořit teorii, je nutné si představit ideální (neexistující) situaci. Ač formulovaná pro ideální plyn, objevují se její důsledky i v kondensovaných soustavách (roztocích). To čemu říkáme ideální roztok jsou zředěné roztoky molekul rozpuštěné látky, které se chovají jako ideální plyn. Nereagují mezi sebou, jinými slovy mají jen kinetickou energii a nemají potenciální a jejich objem je vymezen objemem roztoku.
























