I nuovi Registri AIFA Entela Xoxi Unit Registri




































- Slides: 48

I nuovi Registri AIFA Entela Xoxi Unità Registri protocolli dei farmaci – gestione esperti AIFA I Registri AIFA di Monitoraggio ed i Flussi informativi Napoli, 08 novembre 2013

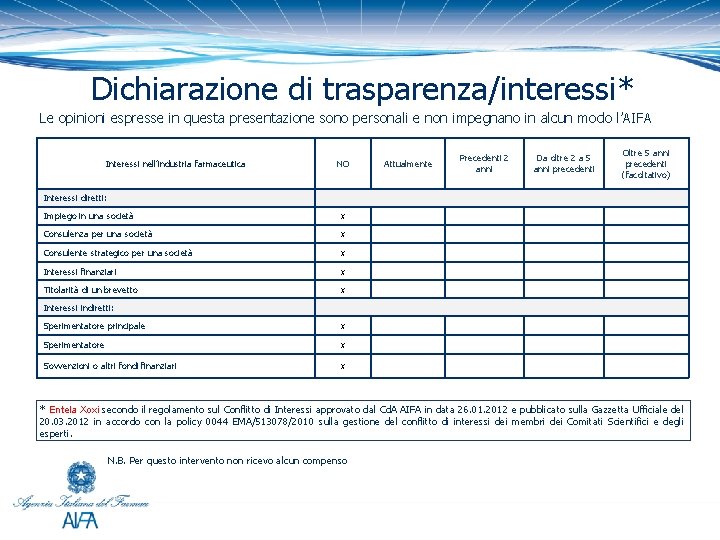
Dichiarazione di trasparenza/interessi* Le opinioni espresse in questa presentazione sono personali e non impegnano in alcun modo l’AIFA Interessi nell’industria farmaceutica NO Attualmente Precedenti 2 anni Da oltre 2 a 5 anni precedenti Oltre 5 anni precedenti (facoltativo) Interessi diretti: Impiego in una società x Consulenza per una società x Consulente strategico per una società x Interessi finanziari x Titolarità di un brevetto x Interessi indiretti: Sperimentatore principale x Sperimentatore x Sovvenzioni o altri fondi finanziari x * Entela Xoxi secondo il regolamento sul Conflitto di Interessi approvato dal Cd. A AIFA in data 26. 01. 2012 e pubblicato sulla Gazzetta Ufficiale del 20. 03. 2012 in accordo con la policy 0044 EMA/513078/2010 sulla gestione del conflitto di interessi dei membri dei Comitati Scientifici e degli esperti. N. B. Per questo intervento non ricevo alcun compenso

Regulatory process ① Scientific Advice (EMA, AIFA) ② Clinical trials authorization (AIFA) ③ CHMP – MA Centralized procedure (EMA) ④ Post-marketing: PASS, PAES (EMA) ⑤ Governance at national level (AIFA) 3

What is a clinical trial? A prospective study of the effect of a drug in humans conducted under conditions pre-specified A controlled trial is a prospective study that compares the effect of a drug compared to a control treatment (including no treatment)

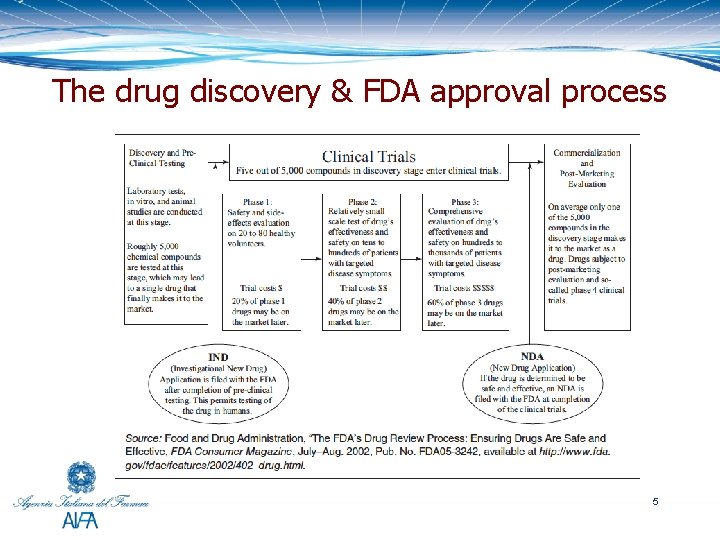
The drug discovery & FDA approval process 5

6

What is meant by “Required under Accelerated Approval” On December 11, 1992, FDA published the final rule to accelerate the approval of new drugs for serious and life-threatening diseases when the drug provides meaningful therapeutic benefit over existing products. Under 21 CFR 314. 510 and 21 CFR 601. 41, FDA may approve drugs based on surrogate endpoints that reasonably predict that a drug provides clinical benefit. This clinical benefit is then confirmed through additional human studies or clinical trials that will be completed after marketing approval. 7

FDA Takes Slow Road Toward Withdrawal of Drug Approved With Fast-Track Process JAMA, March 9, 2011 – Vol. 305, N. 10 The accelerated approval process for prescription drugs remains a problem for the US FDA. For such approval, the FDA expects the drug maker to conduct post-market studies to evaluate the drug’s clinical benefits and adverse events, but companies often do not do such studies in a timely manner. 8

9

Strategy based on simple principles An innovative drug should be reimbursed only if effective; the welfare systems cannot take anymore responsibility for the failures in front of such high costs. Identification of responders patients in order to ensure an effective therapy against the poor prediction of clinical response at the time of recruitment. 10

Why the Italian Registers exist? a) To support the regulatory, administrative and clinical activities of the National Health Service b) To improve the public health governance, the analysis of real clinical practice after the conclusion of the clinical trials and the marketing authorization processes, the effective governance of public costs 11

What the Italian Registers are not: ü Phase IV Clinical Trials (Post Marketing Studies) ü Observational Studies (PASS studies) ü Mechanisms of Restricted Drug Prescription 12

Which therapeutic areas are involved ü Highly Innovative ü Biological/ Biotechnological ü High priced 13

Why are they considered positive at regulatory level ü Placed in the early phases after MA ü Partiality of information related to efficacy, safety and place in therapy coming from CT ü Drugs and treatments are highly innovative but high priced 14

The role of Registry ü To increase the patient’s protection by promoting drugs’ appropriate use; ü To verify effectiveness & tolerability; ü To apply the Managed Entry Agreements procedure by the Italian regulatory position. 15

16

The Italian National Health Service (NHS) ü Provides healthcare to all citizens in equal way ü Primary care and hospital care free of charge to all patients ü Pharmaceutical care is free of charge for all the most important medicines Among European countries, in Italy there is: ü A central legislative power which defines licensing, reimbursement and price of medicines for the Italian NHS (AIFA) ü A region’s responsibility for organizing the supply of medicines for healthcare. Regions could influence the market and patient access to medicines. 17

Balancing innovation and outcomes To ensure ü Rapid access to new potentially beneficial health technologies ü Obtain best value for money ü Ensure affordability Healthcare payers are adopting a range of innovative reimbursement approaches called Managed Entry Agreements (MEAs) Some of these agreements link coverage of medical products to: ü The collection of additional evidence ü And/or to measures of health outcomes in the “real world” that is, outside the context of highly controlled clinical trials.

Instruments Managing budget impact ① Price-volume agreements ② Cost sharing (CS) ③ Budget cap Managing uncertainty about clinical and/or cost effectiveness ④ Payment by result (Pb. R) Managing utilization to optimize performance ⑦ Therapeutic plan ⑤ Risk sharing (RS) ⑥ Success fee (SF) ⑧ ‘AIFA notes’ *According to the HTAi Forum Policy 19

20

MEA’s impact § Can lead to a refusal to reimburse or cover the drug § More often it leads to restrictions to access to drugs (eg 2 nd o 3 rd line use, only for some patient groups, etc. ) § Some restrictions are harder to enforce than others, and the implementations of the decisions is automatic 21

How Registry works: Patients’ Case Report Forms must be filled in, in a specific web based platform. The Registry tracks the eligibility of the registered patients and the complete flow of the treatments. 22

Collecting data: more information from the real world A necessity for: Required for: ü Academy; ü Health economic data; ü Regulatory; ü Experiences data; ü Pharma industry. ü Patient-reported outcomes; ü Reimbursement data; ü Safety surveillance data. 23

ü Drug & Pathology analysis ü National context ü Appropriateness & Managed Entry Agreements 24

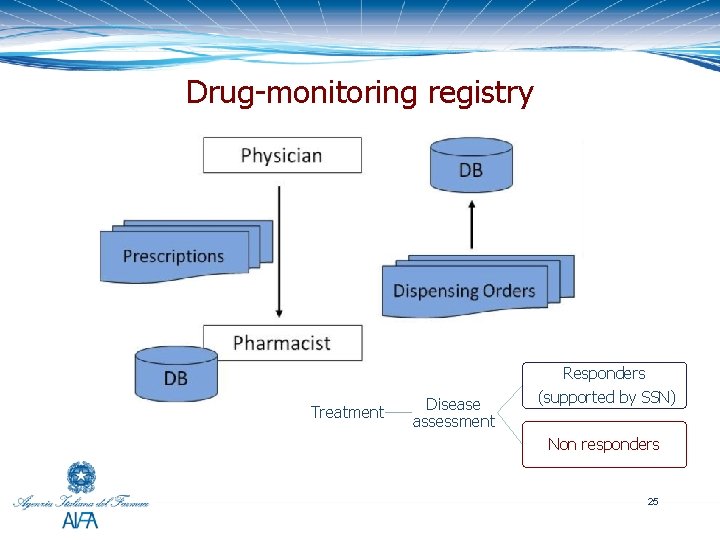
Drug-monitoring registry Treatment Disease assessment Responders (supported by SSN) Non responders 25

About regulatory politic & money ü Cost of new drugs is prohibitive, and (sometimes) unrelated to benefit size ü At the level of EU member states, no or limited actions are possible • Registration is mandatory; • Reimbursement is the only field for actions. 26

Health Technology Assessment Is a multidisciplinary process that summarizes information about the medical, social, economic and ethical issues related to the use of a HT in a systematic, transparent, unbiased, robust manner. Its aim is to inform the formulation of safe effective, health policies that are patient focused and seek to achieve best value. EUnet. HTA , European network for HTA 27

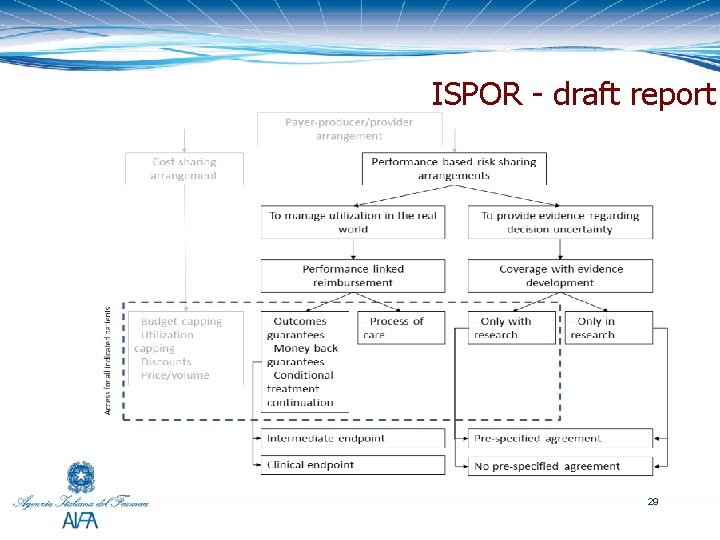
MEAs: Performance - based risk-sharing arrangements PBRSAs are payment schemes – they involve a plan by which the performance of the product is tracked in a defined patient population over a specified period of time and the level of reimbursement is based on the health and costs outcomes achieved. ISPOR performance based Risk sharing arrangements TF Report 28

ISPOR - draft report 29

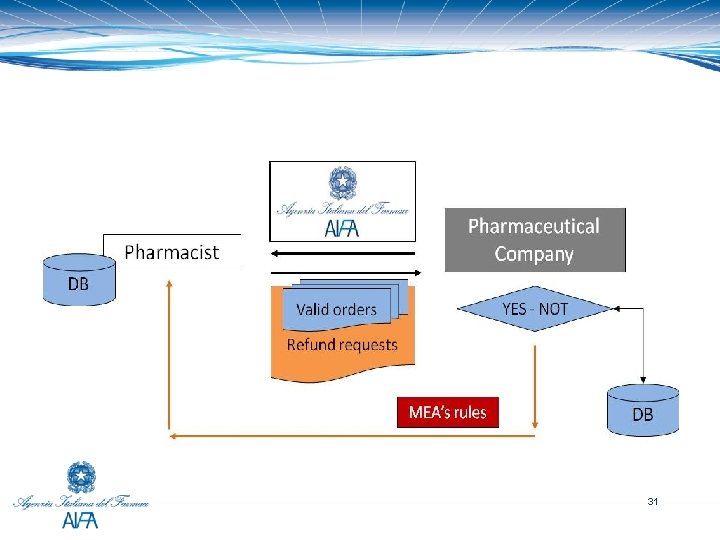
AIFA’s MEAs rules Eligible: • Cost sharing (CR, special discount) Non responder: • Payment by results (Pb. R, total refund) • Risk sharing (discount) • Success fee (SF) 30

31

32

Registri AIFA Abilitazione: Utenze e Registri • Nuove funzionalità • Verso i registri di patologia • Regioni e Direttori sanitari (DS) • Limitazione dei centri prescrittori 33

Funzionalità rilasciate – 1 st release Profilo Regionale Abilitazione/ disabilitazione dei centri alla prescrizione dei farmaci Autorizzazione delle utenze dei DS • Punto di contatto preferenziale dedicato alle Regioni • Supporto da parte di AIFA nell’abilitazione dei centri alla prescrizione dei farmaci Farmacisti Visualizzazione di tutte le informazioni relative al trattamento Funzionalità evolute di ricerca DS Rilasciate le funzionalità di autorizzazione delle utenze dei Medici e Farmacisti 34

Funzionalità rilasciate – 2 nd release Profilo Regionale Evoluzione delle funzionalità di abilitazione dei centri attraverso l’introduzione di funzionalità di ricerca e di selezione multipla (es. seleziona/deseleziona tutto) Razionalizzazione delle anagrafiche dei centri ospedalieri disponibili Farmacisti Possibilità di registrarsi in corrispondenza di più farmacie DS Possibilità di registrarsi in corrispondenza di più strutture Introduzione del profilo del Direttore Sanitario di ASL/A. O.

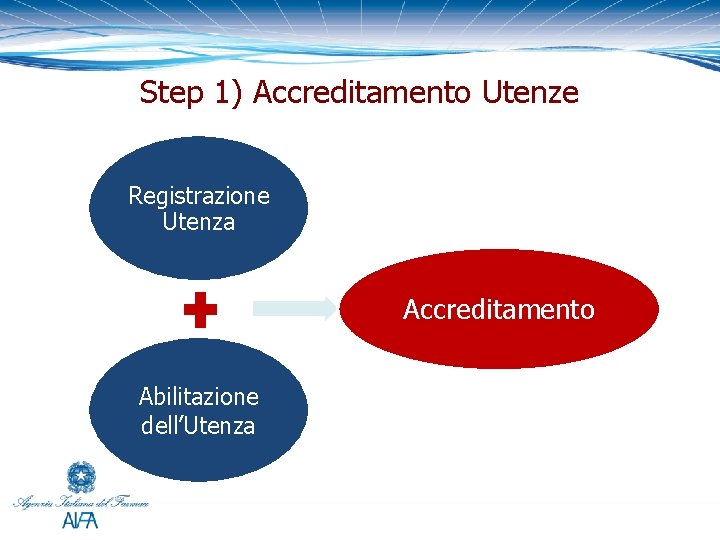
Step 1) Accreditamento Utenze Registrazione Utenza Accreditamento Abilitazione dell’Utenza

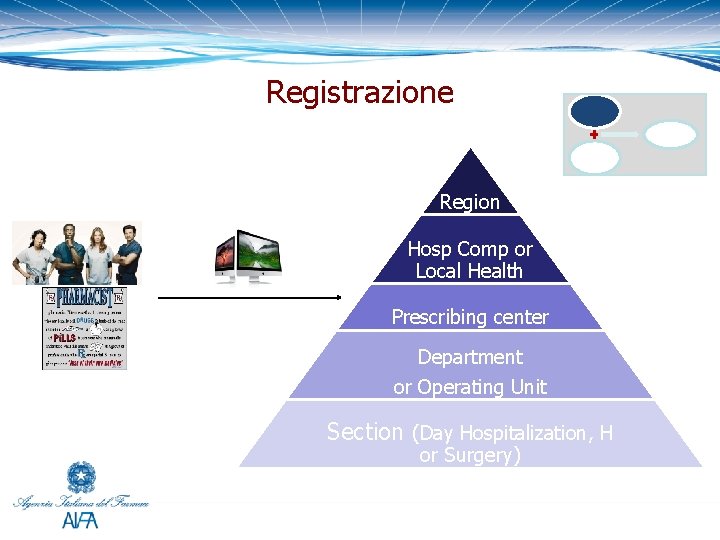
Registrazione Region Hosp Comp or Local Health Prescribing center Department or Operating Unit Section (Day Hospitalization, H or Surgery)

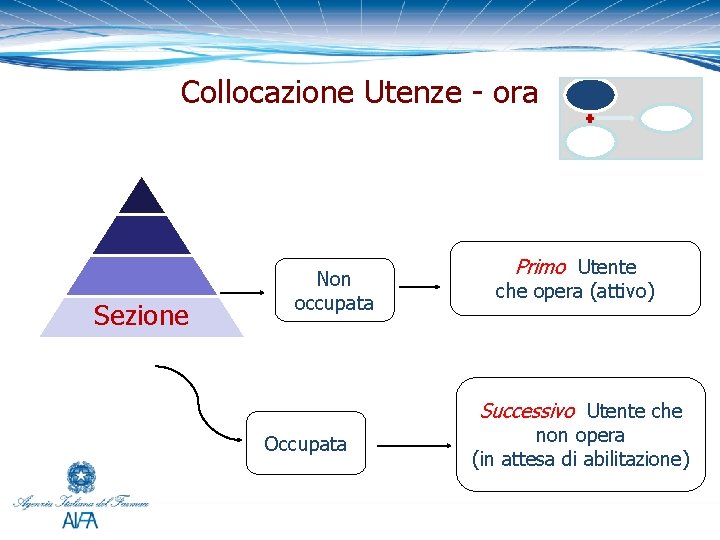
Collocazione Utenze - ora Sezione Non occupata Primo Utente che opera (attivo) Successivo Utente che Occupata non opera (in attesa di abilitazione)

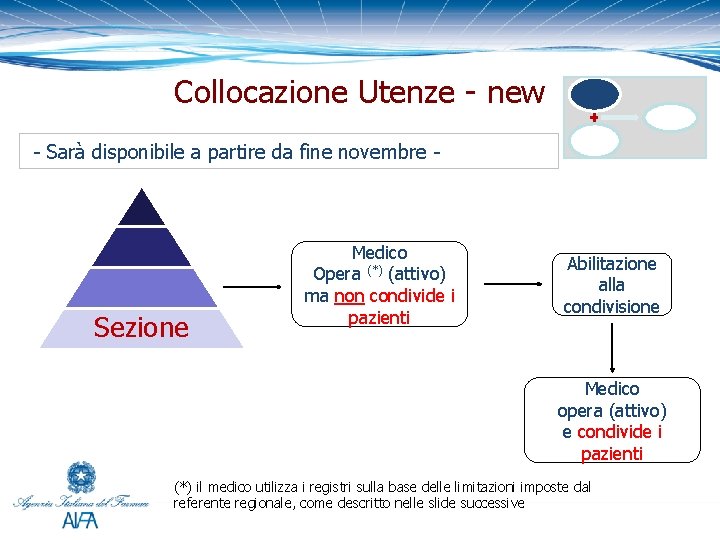
Collocazione Utenze - new - Sarà disponibile a partire da fine novembre - Sezione Medico Opera (*) (attivo) ma non condivide i pazienti Abilitazione alla condivisione Medico opera (attivo) e condivide i pazienti (*) il medico utilizza i registri sulla base delle limitazioni imposte dal referente regionale, come descritto nelle slide successive

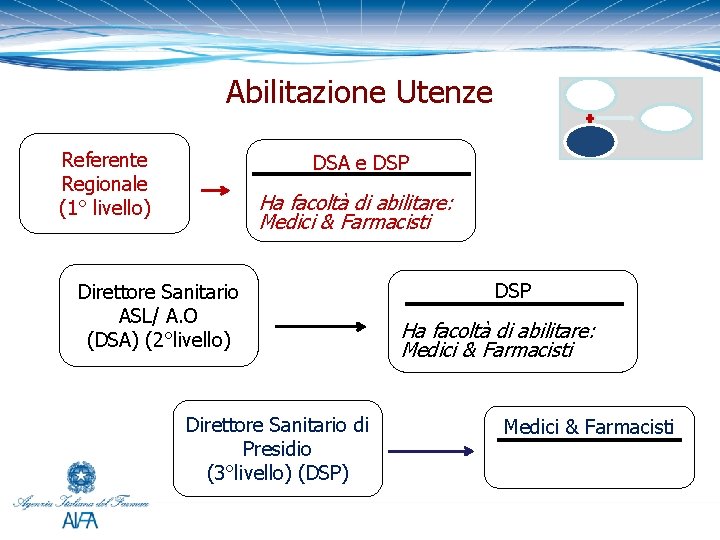
Abilitazione Utenze Referente Regionale (1° livello) DSA e DSP Ha facoltà di abilitare: Medici & Farmacisti Direttore Sanitario ASL/ A. O (DSA) (2°livello) Direttore Sanitario di Presidio (3°livello) (DSP) DSP Ha facoltà di abilitare: Medici & Farmacisti

Step 2) Abilitazione dei Registri Referente Regionale (1° livello) Su base STRUTTURA/REPARTO Il sistema consente di effettuare operazioni di selezione multipla per operare contemporaneamente su più strutture. Esempio: • Reparto di Oncologia abilitato per la Struttura A Regione X • Reparto di Oncologia abilitato su tutte le strutture ospedaliere della Regione X

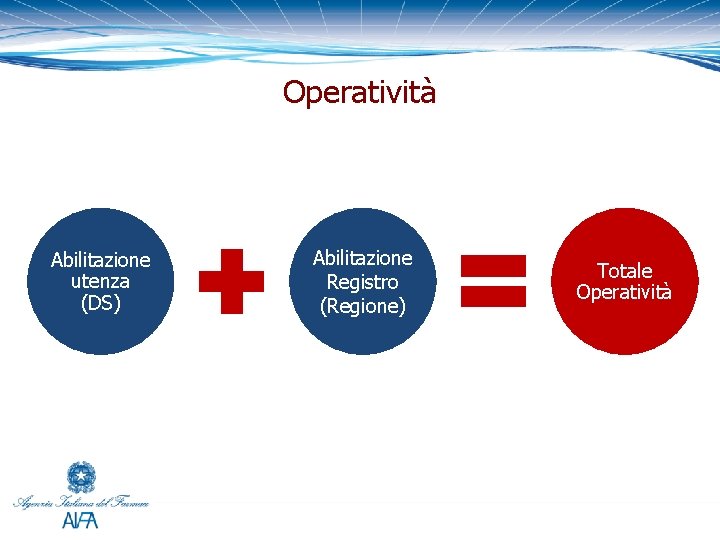
Operatività Abilitazione utenza (DS) Abilitazione Registro (Regione) Totale Operatività

Ricollocazione Utenze (medici) e Trattamenti La condivisione dei pazienti all’interno del reparto/sezione di appartenenza presuppone la corretta allocazione dei medici sulle strutture ospedaliere e la successiva validazione da parte del referente responsabile (Direttore Sanitario o Referente Regionale)

Di seguito la descrizione del processo che consentirà ai medici, registrati su strutture obsolete, di riallocarsi sulle strutture corrette 1. Al primo accesso a sistema si obbliga il medico a scegliere la struttura di appartenenza all’interno della nuova anagrafica 2. Ciascun medico continua a lavorare sui propri pazienti ma in linea con le abilitazioni dei singoli Registri effettuate per la nuova struttura scelta. 3. Il Direttore Sanitario di competenza valida la richiesta del medico al fine di consentire la condivisione dei pazienti con gli altri medici presenti nella struttura target (stesso reparto e sezione) Il Direttore Sanitario effettua le operazioni di cui al punto 3, con le stesse funzionalità con cui abilita/disabilita i nuovi medici registrati alla condivisione dei pazienti.

I primi 4 mesi di lavoro … 119 schede di monitoraggio (web, Excel, cartacee) 79 medicinali 94 indicazioni terapeutiche 108, 000 trattamenti

Modalità di rilascio dei nuovi registri ü ü Tutti i prossimi Registri verranno rilasciati da AIFA disabilitando tutte le strutture del territorio nazionale Le Regioni potranno agire sul sistema per abilitare le strutture in anticipo rispetto alla data di avvio delle prescrizioni indicato in determina.

Prossime releases 1. 2. 3. 4. 5. 6. 7. Attivazione delle procedure di Pb. R, SF CS, RS Profilo globale AIFA Profili per le Aziende Farmaceutiche Reportistica Registri e Cruscotto regioni Possibilità di modifica del nome cognome del paziente da parte del M Possibilità di modificare ASL di riferimento da parte del M Possibilità di modifica delle date RF (dell’ultimo ciclo inserito) e delle posologie da parte del M (in base ai controlli esistenti di congruenza) 8. Possibilità di modifica delle date DF (ultimo ciclo inserito) e delle dosi erogate da parte del F (in base ai controlli esistenti di congruenza) 9. Possibilità di modifica delle date RV e FT da parte del M (in base ai controlli esistenti di congruenza) 47

Thank you! Entela Xoxi e. xoxi@aifa. gov. it http: //www. agenziafarmaco. gov. it/it/content/registri-farmaci-sottoposti-monitoraggio 48