I legami presenti nella molecola del metano CH



- Slides: 13

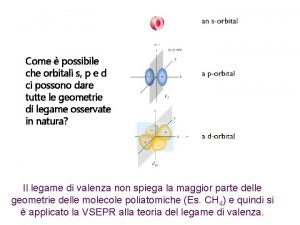
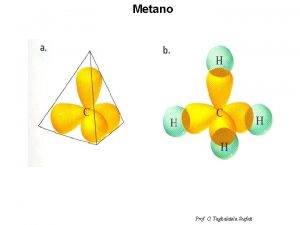
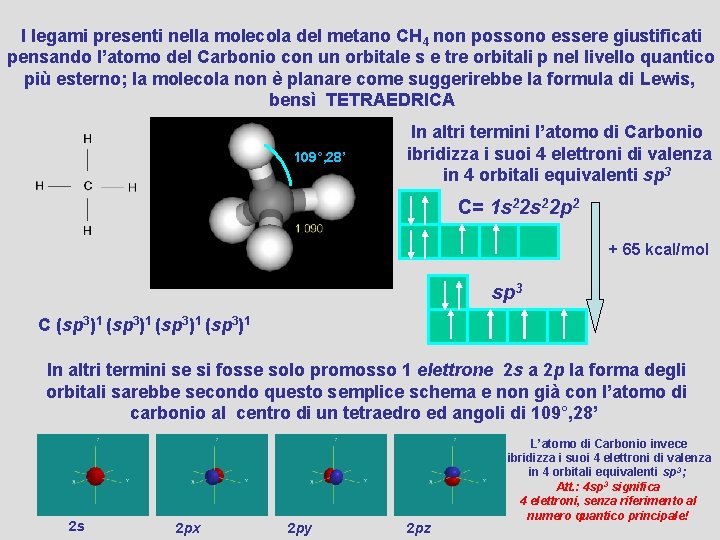
I legami presenti nella molecola del metano CH 4 non possono essere giustificati pensando l’atomo del Carbonio con un orbitale s e tre orbitali p nel livello quantico più esterno; la molecola non è planare come suggerirebbe la formula di Lewis, bensì TETRAEDRICA 109°, 28’ In altri termini l’atomo di Carbonio ibridizza i suoi 4 elettroni di valenza in 4 orbitali equivalenti sp 3 C= 1 s 22 p 2 + 65 kcal/mol sp 3 C (sp 3)1 In altri termini se si fosse solo promosso 1 elettrone 2 s a 2 p la forma degli orbitali sarebbe secondo questo semplice schema e non già con l’atomo di carbonio al centro di un tetraedro ed angoli di 109°, 28’ 2 s 2 px 2 py 2 pz L’atomo di Carbonio invece ibridizza i suoi 4 elettroni di valenza in 4 orbitali equivalenti sp 3 ; Att. : 4 sp 3 significa 4 elettroni, senza riferimento al numero quantico principale!

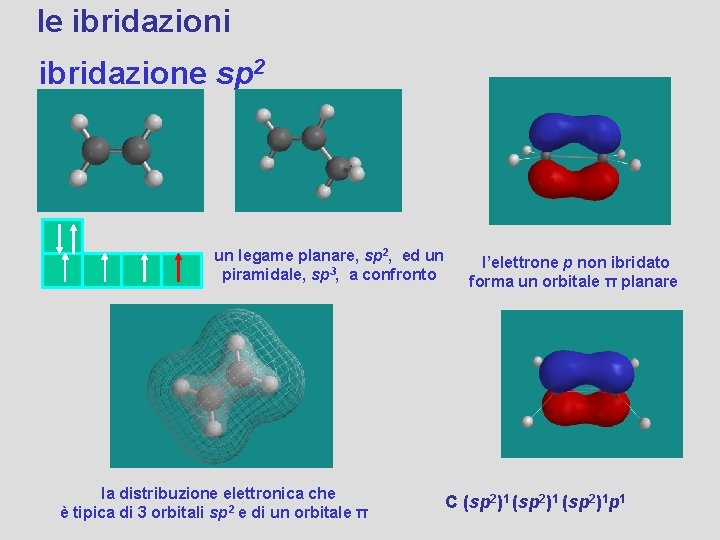
le ibridazioni ibridazione sp 2 un legame planare, sp 2, ed un piramidale, sp 3, a confronto la distribuzione elettronica che è tipica di 3 orbitali sp 2 e di un orbitale π l’elettrone p non ibridato forma un orbitale π planare C (sp 2)1 p 1

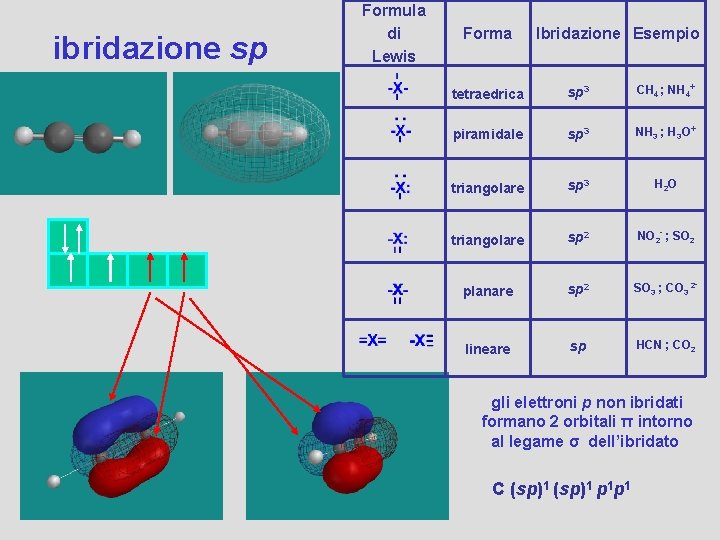
ibridazione sp Formula di Lewis Forma Ibridazione Esempio tetraedrica sp 3 CH 4 ; NH 4+ piramidale sp 3 NH 3 ; H 3 O+ triangolare sp 3 H 2 O triangolare sp 2 NO 2 - ; SO 2 planare sp 2 SO 3 ; CO 3 2 - lineare sp HCN ; CO 2 gli elettroni p non ibridati formano 2 orbitali π intorno al legame σ dell’ibridato C (sp)1 p 1 p 1

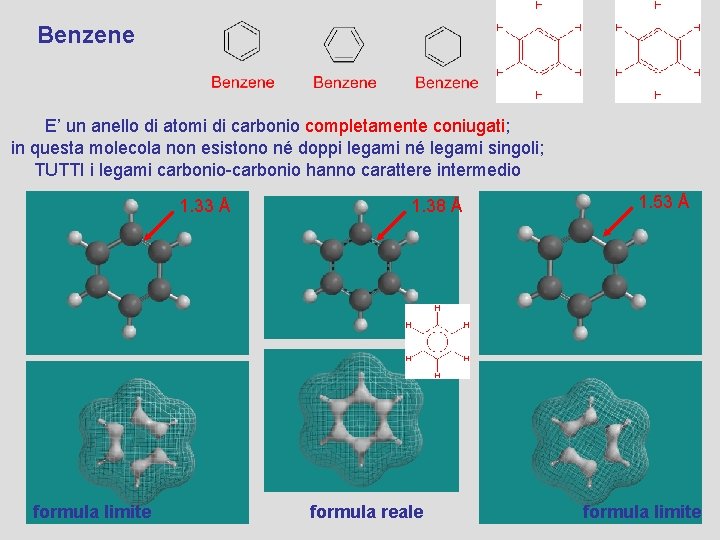
Benzene E’ un anello di atomi di carbonio completamente coniugati; in questa molecola non esistono né doppi legami né legami singoli; TUTTI i legami carbonio-carbonio hanno carattere intermedio 1. 33 Å formula limite 1. 38 Å formula reale 1. 53 Å formula limite

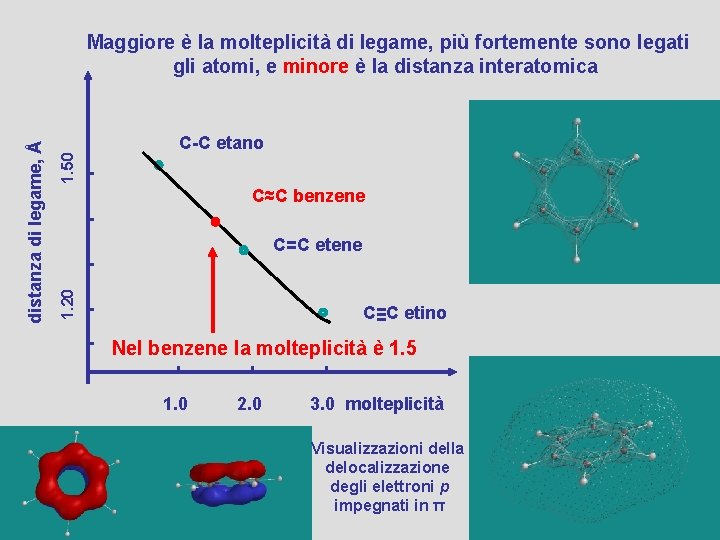
1. 50 C-C etano C≈C benzene C=C etene 1. 20 distanza di legame, Å Maggiore è la molteplicità di legame, più fortemente sono legati gli atomi, e minore è la distanza interatomica C≡C etino Nel benzene la molteplicità è 1. 5 1. 0 2. 0 3. 0 molteplicità Visualizzazioni della delocalizzazione degli elettroni p impegnati in π

Le proprietà allotropiche dell’atomo di Carbonio Il Carbonio appartiene al gruppo IVA, 2 s 22 p 2, insieme al Silicio, al Germanio lo Stagno ed il Piombo. Questi elementi hanno la tendenza a dare legami covalenti (1/2 gas nobile) specialmente Carbonio e Silicio Il Carbonio forma un numero enorme di idruri (centinaia di migliaia); il Silicio NON va oltre Si 6 H 14; gli idruri del Carbonio hanno catena lineare e ramificata Il Carbonio forma legami multipli sovrapponendo orbitali p, con altri Carboni ed altri elementi, formando legami π; il Silicio NON forma legami π. CO 2 fonde a -56°C a 5. 11 Atm; Si. O 2 fonde a 1710 °C Legami Si-Si= 50 kcal/mol Si-O= 100 kcal/mol; C-C= 80 kcal/mol C-O= 80 kcal/mol La CO 2 è una molecola lineare; Si. O 2 è un cristallo tetraedrico macromolecolare insolubile e di tipo rigidamente ordinato (Si. O 2)n

Il Carbonio può dare molti legami : 1 legame triplo ed un singolo sp (H-C≡N) 2 doppi sp (CO 2), 1 doppio e 2 singoli sp 2 (H 2 C=CH 2), 4 singoli sp 3 (CH 4); in aggiunta uno o più degli elettroni può partecipare in legami covalenti delocalizzati Allotropia del Carbonio Proprietà Diamante Grafite Aspetto Frammenti ottaedrici regolari Cristalli piccoli e grandi, fioccosi Colore Trasparente, giallo, bruno Nera Trasmissione luce Sì; elevata rifrazione Opaca Densità 3. 5 2. 2 Durezza Elevatissima Tenerissima Conducibilità NO 1000 volte < Cu

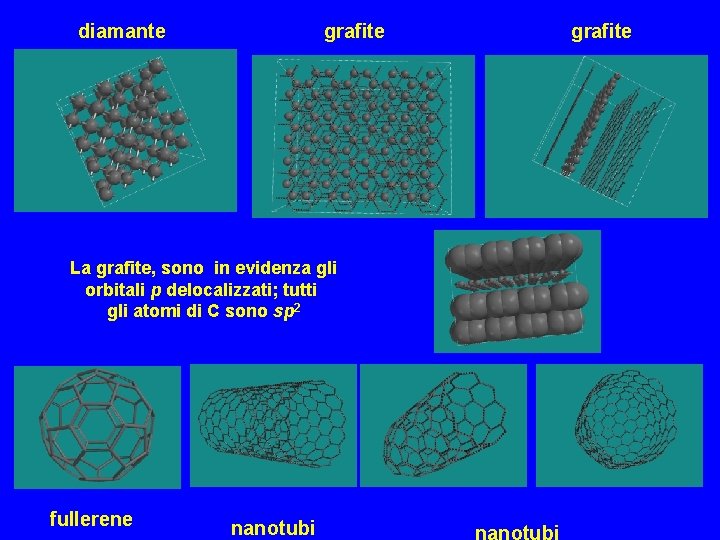
diamante grafite La grafite, sono in evidenza gli orbitali p delocalizzati; tutti gli atomi di C sono sp 2 fullerene nanotubi grafite

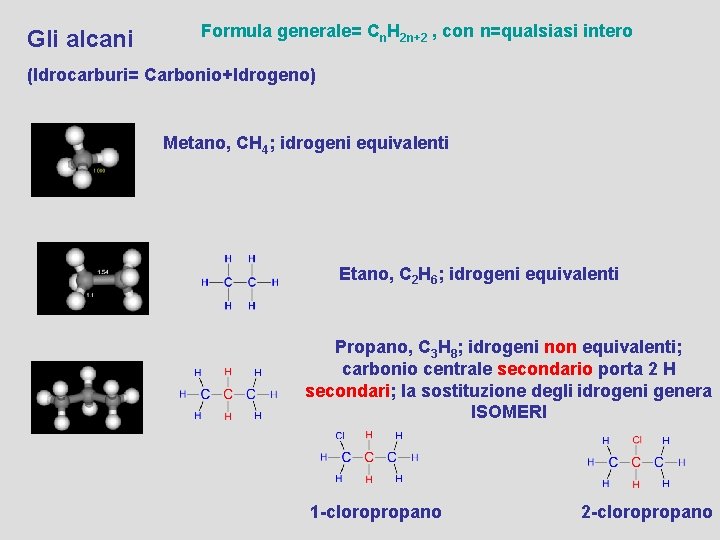
Gli alcani Formula generale= Cn. H 2 n+2 , con n=qualsiasi intero (Idrocarburi= Carbonio+Idrogeno) Metano, CH 4; idrogeni equivalenti Etano, C 2 H 6; idrogeni equivalenti Propano, C 3 H 8; idrogeni non equivalenti; carbonio centrale secondario porta 2 H secondari; la sostituzione degli idrogeni genera ISOMERI 1 -cloropropano 2 -cloropropano

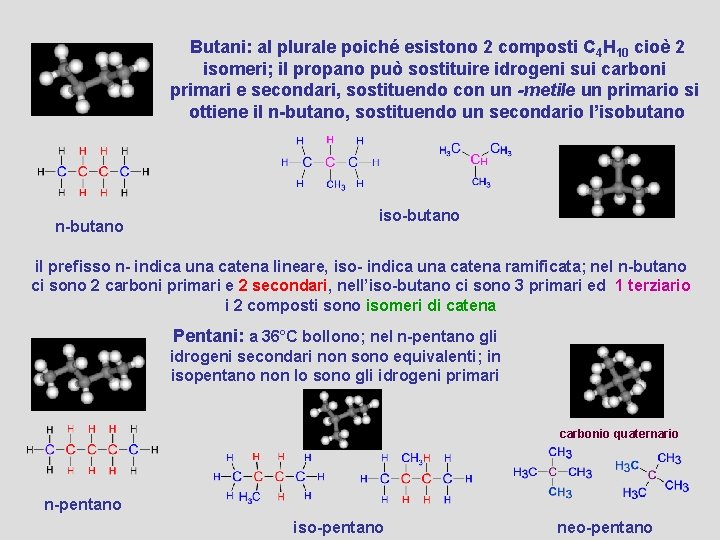
Butani: al plurale poiché esistono 2 composti C 4 H 10 cioè 2 isomeri; il propano può sostituire idrogeni sui carboni primari e secondari, sostituendo con un -metile un primario si ottiene il n-butano, sostituendo un secondario l’isobutano n-butano iso-butano il prefisso n- indica una catena lineare, iso- indica una catena ramificata; nel n-butano ci sono 2 carboni primari e 2 secondari, nell’iso-butano ci sono 3 primari ed 1 terziario i 2 composti sono isomeri di catena Pentani: a 36°C bollono; nel n-pentano gli idrogeni secondari non sono equivalenti; in isopentano non lo sono gli idrogeni primari carbonio quaternario n-pentano iso-pentano neo-pentano

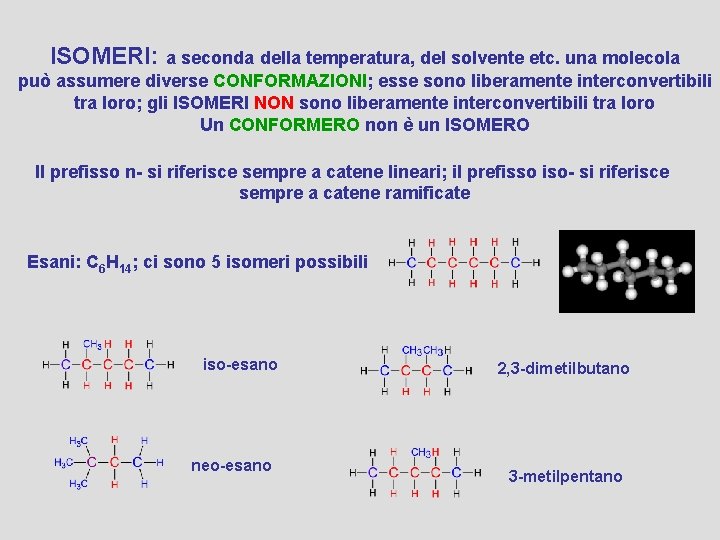
ISOMERI: a seconda della temperatura, del solvente etc. una molecola può assumere diverse CONFORMAZIONI; esse sono liberamente interconvertibili tra loro; gli ISOMERI NON sono liberamente interconvertibili tra loro Un CONFORMERO non è un ISOMERO Il prefisso n- si riferisce sempre a catene lineari; il prefisso iso- si riferisce sempre a catene ramificate Esani: C 6 H 14; ci sono 5 isomeri possibili iso-esano neo-esano 2, 3 -dimetilbutano 3 -metilpentano

Numero di isomeri di catena: per osservarlo ci vogliono 4 atomi di Carbonio; il numero possibile aumenta all’aumentare del numero di atomi di Carbonio Formula molecolare CH 4 C 2 H 6 C 3 H 8 n° di isomeri 1 1 1 C 4 H 10 C 5 H 12 C 6 H 14 C 7 H 16 C 8 H 18 C 14 H 20 C 30 H 62 2 3 5 9 35 1858 4, 111, 846, 763

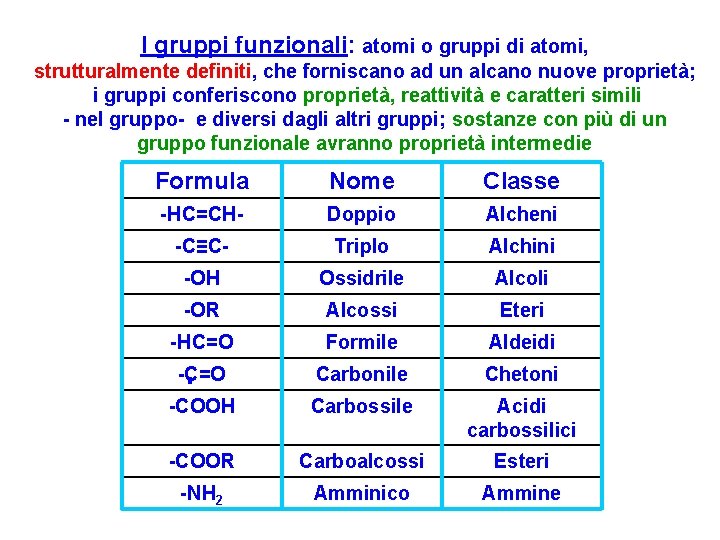
I gruppi funzionali: atomi o gruppi di atomi, strutturalmente definiti, che forniscano ad un alcano nuove proprietà; i gruppi conferiscono proprietà, reattività e caratteri simili - nel gruppo- e diversi dagli altri gruppi; sostanze con più di un gruppo funzionale avranno proprietà intermedie Formula Nome Classe -HC=CH- Doppio Alcheni -C≡C- Triplo Alchini -OH Ossidrile Alcoli -OR Alcossi Eteri -HC=O Formile Aldeidi -C=O Carbonile Chetoni -COOH Carbossile Acidi carbossilici -COOR Carboalcossi Esteri -NH 2 Amminico Ammine
 Insieme delle acque presenti sulla terra
Insieme delle acque presenti sulla terra Molecole discrete significato
Molecole discrete significato Struttura primaria del dna
Struttura primaria del dna Orbitali sp2
Orbitali sp2 Ciclo del metano
Ciclo del metano Problemas de volumen molar
Problemas de volumen molar Homolisis y heterolisis
Homolisis y heterolisis Bromometilciclohexano
Bromometilciclohexano Reazione formazione metano
Reazione formazione metano Energia mappa concettuale
Energia mappa concettuale Homologine eile
Homologine eile Ramificaciones
Ramificaciones Formula di struttura alcani
Formula di struttura alcani Hibridização do carbono
Hibridização do carbono