I Hp cht st II Gm mui hidroxit










- Slides: 11


I. Hợp chất sắt (II) Gồm muối, hidroxit, oxit của Fe 2+ Vd: Fe. O, Fe(OH)2, Fe. Cl 2 - Hợp chất sắt (II) tác dụng với chất oxi hoá sẽ bị oxi hoá thành hợp chất sắt (III). Trong pư hoá học ion Fe 2+ có khả năng cho 1 electron.

1. Sắt(II) Oxit: Fe. O = 72 - Sắt(II) oxit là chất rắn màu đen, không có trong tự nhiên Fe 2+ Fe 3+ + 1 e Tính chất hoá học chung của hợp chất sắt (II) là tính khử. Ví dụ 3: Cho Fe. O vào dung dịch HNO 3 loãng: 3 Fe. O + 10 HNO 3 3 Fe(NO 3)3 + NO + 5 H 2 O - Điều chế: Fe 2 O 3 + CO 2 Fe. O + CO 2

2. Sắt(II) hiđroxit: Fe(OH)2=90 - Sắt(II) hiđroxit là chất rắn, màu trắng hơi xanh, không tan trong nước - Ở nhiêt độ thường, trong không khí ( có O 2, H 2 O) Fe(OH)2 bị oxi hoá thành Fe(OH)3. Pư: 4 Fe(OH)2 + O 2 + 2 H 2 O 4 Fe(OH)3 khử oxh Ion Fe 2+ + 2 OH- → Fe(OH)2

3. Muối sắt(II) + Đa số sắt(II) tan trong nước, khi kết tinh thường ở dạng ngậm nước Vd: Fe. SO 4. 7 H 2 O, Fe. Cl 2. 4 H 2 O + Muối Fe(II) dể bị oxi hoá thành Fe(III) + Sục khí clo vào dung dịch muối Fe. Cl 2 Pư: 2 Fe. Cl 2 + Cl 2 2 Fe. Cl 3 Fe(NO 3)2 + HNO 3 NO +. . . + Điều chế: Fe + HCl Fe. Cl 2 + H 2 Fe. O + H 2 SO 4 Fe. SO 4 + H 2 O

II. Hợp chất sắt (III) + Hợp chất sắt (III) có tính oxi hoá: + Khi tác dụng với chất khử, hợp chất sắt (III) bị khử thành hợp chất sắt (II) hoặc kim loại sắt tự do. + Trong pư hoá học : Fe 3+ + 1 e Fe 2+ Fe 3+ + 3 e Fe Tính chất chung của hợp chất sắt (III) là tính oxi hoá.

1. Sắt (III) oxit: Fe 2 O 3=160 + Sắt(III) oxit là chất rắn màu đỏ nâu, không tan trong nước + Tan trong axit mạnh Fe 2 O 3 + 6 HCl 2 Fe. Cl 3 + 3 H 2 O + Nung hỗn hợp gồm Al và Fe 2 O 3 ở nhiệt độ cao: Fe 2 O 3 + 2 Al Al 2 O 3 + 2 Fe Fe 2 O 3 + CO ? + Điều chế Sắt (III) oxit: Fe 2 O 3 phân huỷ Fe(OH)3 ở nhiệt độ cao 2 Fe(OH)3 Fe 2 O 3 + 3 H 2 O + Trong tự nhiên Fe(III) tồn tại dạng quặng hematit

2. Sắt(III) hiđroxit: Fe(OH)3=107 + Fe(OH)3: Chất rắn, màu nâu đỏ, không tan trong nước. + Tan trong dung dịch axit 2 Fe(OH)3 + 3 H 2 SO 4 Fe 2(SO 4)3 + 6 H 2 O + Điều chế bằng pư trao đổi ion giữa dung dịch muối sắt (III) với dung dịch kiềm. Ví dụ : Fe(NO 3)3 +3 Na. OH Fe(OH)3+3 Na. NO 3 Pt ion: Fe 3+ + 3 OH- Fe(OH)3

3. Muối sắt(III) + Các muối Fe(III) tan trong nước. Khi kết tinh thường ở dạng ngậm nước: Vd: Fe. Cl 3. 6 H 2 O, Fe 2(SO 4)3. 9 H 2 O + Các muối Fe(III) có tính oxi hoá Vd Fe + 2 Fe. Cl 3 3 Fe. Cl 2 Cu + 2 Fe. Cl 3 Cu. Cl 2 + 2 Fe. Cl 2 Fe. Cl 3 + Al ? + Muối Fe(III) làm chất xúc tác trong tổng hợp hữu cơ.

III. Áp dụng o Hoàn thành chuyển hoá sau: 1 2 4 3 5 Fe Fe. Cl 2 Fe(OH)3 Fe 2 O 3 Fe 8 9 Fe. Cl 3 6 7 Fe(NO 3)3 Cu(NO 3)2

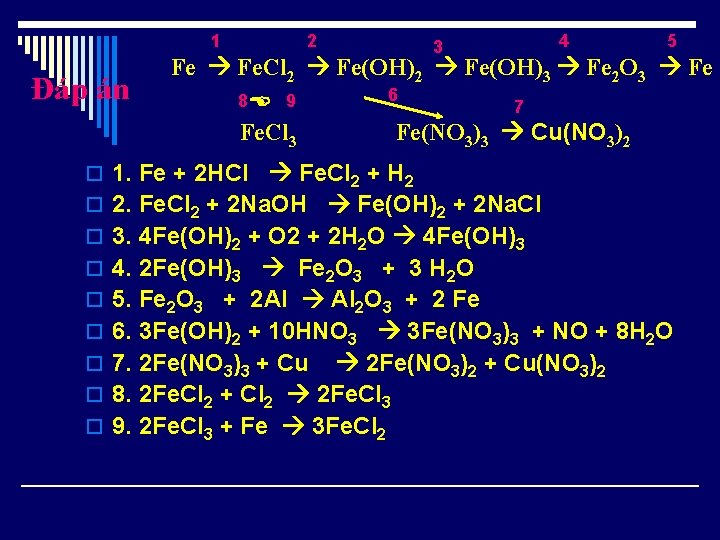
1 Đáp án 2 4 3 5 Fe Fe. Cl 2 Fe(OH)3 Fe 2 O 3 Fe 8 9 Fe. Cl 3 6 7 Fe(NO 3)3 Cu(NO 3)2 o 1. Fe + 2 HCl Fe. Cl 2 + H 2 o 2. Fe. Cl 2 + 2 Na. OH Fe(OH)2 + 2 Na. Cl o 3. 4 Fe(OH)2 + O 2 + 2 H 2 O 4 Fe(OH)3 o 4. 2 Fe(OH)3 Fe 2 O 3 + 3 H 2 O o 5. Fe 2 O 3 + 2 Al Al 2 O 3 + 2 Fe o 6. 3 Fe(OH)2 + 10 HNO 3 3 Fe(NO 3)3 + NO + 8 H 2 O o 7. 2 Fe(NO 3)3 + Cu 2 Fe(NO 3)2 + Cu(NO 3)2 o 8. 2 Fe. Cl 2 + Cl 2 2 Fe. Cl 3 o 9. 2 Fe. Cl 3 + Fe 3 Fe. Cl 2





















