Hukum Ke dua Oleh Termodinamika dan entropi Pandu












































- Slides: 52

Hukum Ke dua Oleh : Termodinamika dan entropi Pandu Jati Laksono Prodi Pend. Kimia Fakultas Ilmu Tarbiyah dan Keguruan Universitas Islam Negeri Raden Fatah Jl. KH. Zainal Abidin Fikri KM 3, 5 HP. 089695979599, Email: pandualong@gmail. com

INTRODUCTION Hukum pertama termodinamika energi bersifat kekal Hukum kedua termodinamika entropi. “ Entropi dapat diciptakan tetapi tidak dapat dimusnahkan” Secara filosofis pada kehidupan sehari-hari, dalam sistem tertutup tanpa campur tangan dari luar ketidakteraturan akan selalu bertambah. Secara alamiah proses cenderung kearah tidak teratur “Total entropi dr suatu sistem termodinamika terisolasi meningkat selama ada perub spontan seiring dg meningkatnya waktu, mendekati nilai maksimumnya “. Stotal = Ssis + Ssurr > 0 Proses irreversibel S > menghasilkan S Proses reversibel tdk menghasilkan S, hanya memindahkan S dari sistem terisolasi kebagian lain

Sistem alami cenderung kearah tidak teratur, random, distribusi partikel kurang teratur Beberapa sistem cenderung lebih tidak teratur (es meleleh) tetapi ada juga yang lebih teratur (air membeku) secara spontan Dengan meninjau sistem dan lingkungan terlihat semua proses yang berlangsung dlm arah spontan akan meningkatkan entropi total alam semesta (sistem dan lingkungan). hukum kedua termodinamika Hukum ini tidak memberikan batasan perub entropi sistem atau lingkungan, tetapi u perub spontan entropi total sistem dan lingk harus positif Suniv = Ssis + Ssurr > 0

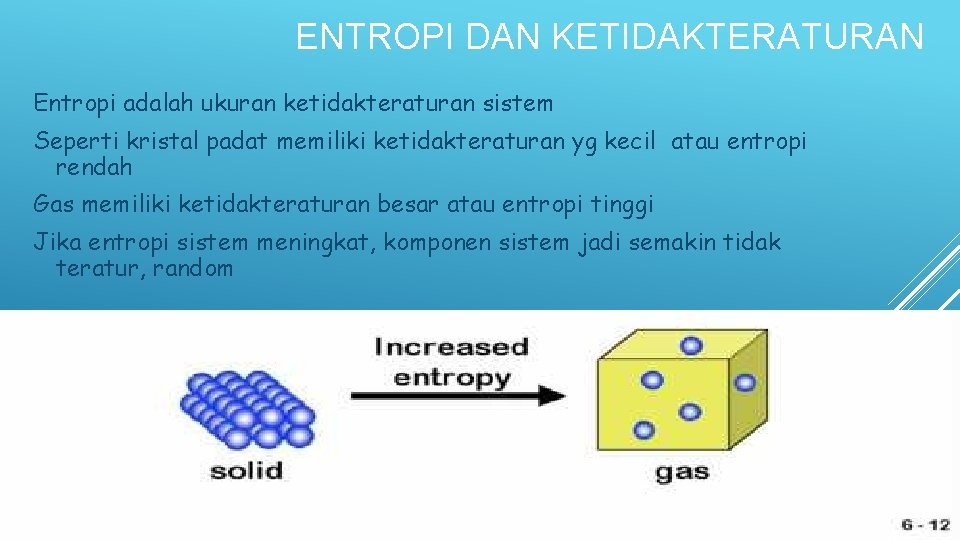
ENTROPI DAN KETIDAKTERATURAN Entropi adalah ukuran ketidakteraturan sistem Seperti kristal padat memiliki ketidakteraturan yg kecil atau entropi rendah Gas memiliki ketidakteraturan besar atau entropi tinggi Jika entropi sistem meningkat, komponen sistem jadi semakin tidak teratur, random

MEMPERKIRAKAN NILAI SO SISTEM Berdasarkan pengamatan kita bisa dpt entropi zat akibat pengaruh 1. Perubahan temperatur 2. Keadaan fisik dan perubahan fasa 3. Pelarutan solid atau liquid 4. Pelarutan gas 5. Ukuran atom atau kompleksitas molekul

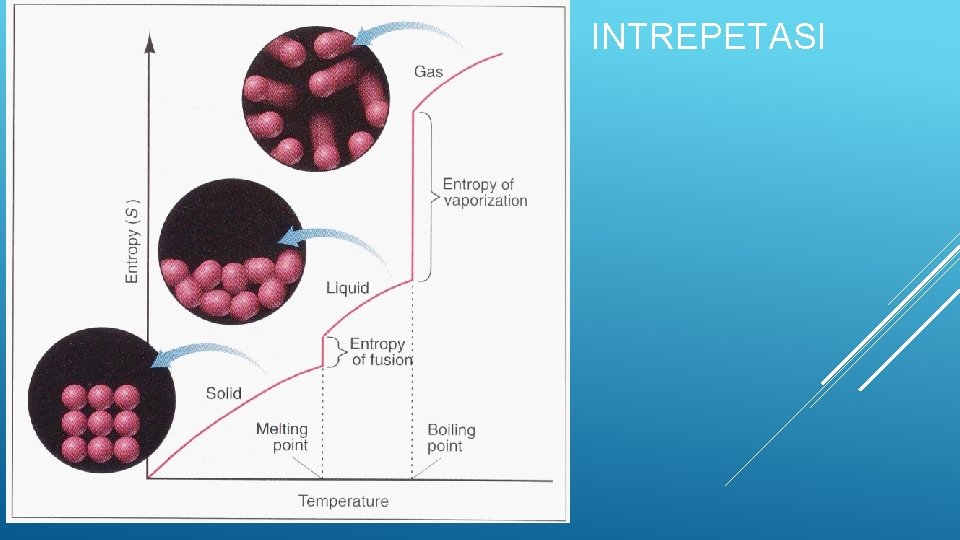
1. PERUBAHAN TEMPERATUR So meningkat seiring dengan kenaikan temperatur T(K) 273 So 31, 0 295 298 32, 9 33, 1 Kenaikan temperatur menunjukkan kenaikan energi kinetik rata-rata partikel

ENTROPI DAN TEMPERATUR Entropi dari gas ideal pada tekanan tetap meningkat dengan meningkatnya temperatur Hal ini karena volumenya bertambah

ENTROPI DAN TEMPERATUR Untuk molekul-molekul, berarti akan dapat berotasi dan vibrasi ikatan-ikatanya Shg dpt meningkatkan entropi

INTREPETASI

2. KEADAAN FISIK DAN PERUBAHAN FASA Ketika fasa yg lebih teratur berubah ke kurang teratur, perubahan entropi positif Untuk zat tertentu So meningkat jk perubahan zat dari solid ke liquid ke gas Na H 2 O C(grafit) So (s / l) 51, 4(s) 69, 9 (l) 5, 7(s) So (g) 153, 6 188, 7 158, 0

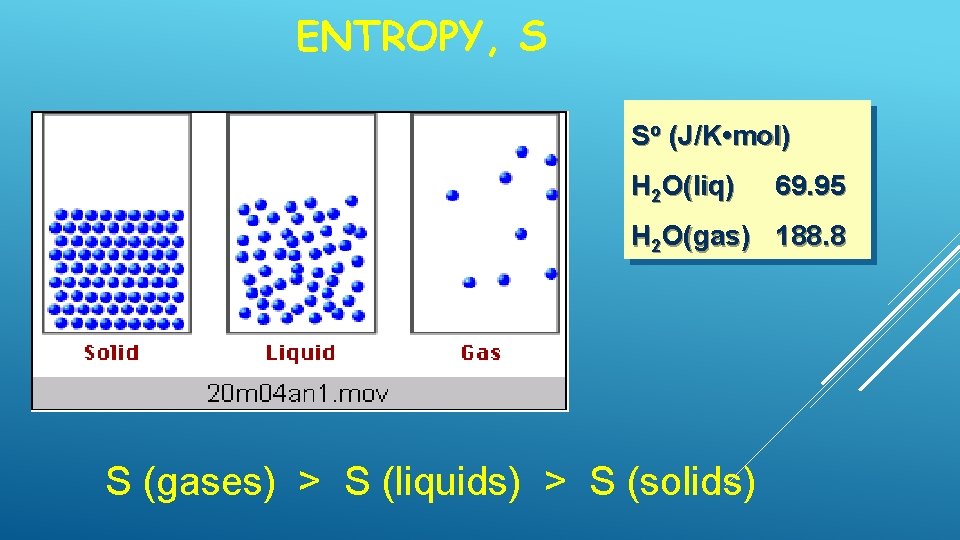
ENTROPY, S So (J/K • mol) H 2 O(liq) 69. 95 H 2 O(gas) 188. 8 S (gases) > S (liquids) > S (solids)

3. PELARUTAN SOLID ATAU LIQUID Entropi solid/liquid terlarut > solut murni, jenis solut dan solven dan bagaimana proses pelarutannya mempengaruhi entropi overall Na. Cl CH 3 OH So s/l 72. 1(s) Soaq 115, 1 127(l) 132

4. PELARUTAN GAS Gas begitu tidak teratur dan akan jadi lebih teratur saat dilarutkan dlm liquid atau solid Entropi larutan gas dlm liquid atau solid selalu lebih kecil dibanding gas murni Saat O 2 (So g = 205, 0 J/mol K) dilarutkan dalam air, entropi turun drastis (So aq = 110, 9 J/mol K)

5. UKURAN ATOM KOMPLEKSITAS MOLEKUL Perbedaan entropi zat dg fasa sama tergantung ukuran atom dan komplesitas molekul Li Na K Rb Cs Jari 2 152 186 227 248 265 M molar 6. 941 22. 99 39. 10 85. 47 132. 9 So(s) 29. 1 51. 4 64. 7 69. 5 85. 2

Untuk senyawa, entropi meningkat seiring dg kompleksitas kimia dg semakin banyaknya jml atom dalam molekul Hal ini berlaku u senyawa ionik dan kovalen So(g) NO 2 211 240 N 2 O 4 304 Kecenderungan ini didasarkan atas variasi gerakan yang dapat dilakukan molekul

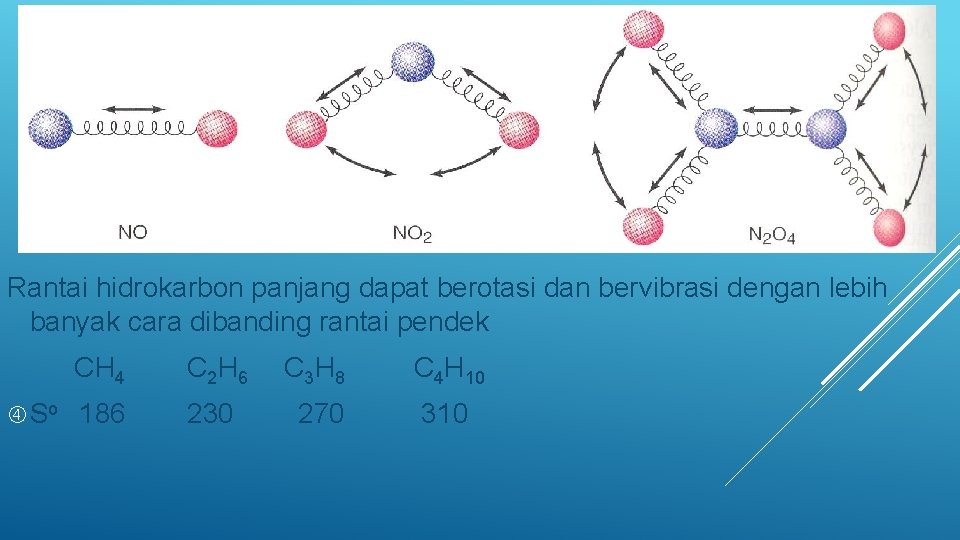
Rantai hidrokarbon panjang dapat berotasi dan bervibrasi dengan lebih banyak cara dibanding rantai pendek CH 4 So 186 C 2 H 6 C 3 H 8 C 4 H 10 230 270 310

LATIHAN Mana entropi yang lebih tinggi 1 mol SO 2(g) atau 1 mol SO 3(g) 1 mol CO 2(s) atau 1 mol CO 2(g) 1 mol KBr(s) atau 1 mol KBr (aq)

ENTROPI? Entropi berbeda dengan energi, walaupun dengan sekilas namanya hampir sama, namun keduanya mempunyai konsep yang jauh berbeda. Temperatur(T) dan energi dalam(U) dapat dihubungkan dengan hukum kedua termodinamika. Perhitungan perubahan entropi untuk sistem memerlukan informasi tentang lintasan reversibel yang menghubungkan keadaan ekuilibrium awal dan akhir. Entropi adalah variabel keadaan, dan perubahan entropi hanya bergantung pada keadaan awal dan akhir. (Atkins. 1994)

BAGAIMANA PERUBAHAN ENTROPI TIAP-TIAP PROSES DI BAWAH INI? (a) Kondensasi uap air Keacakan menurun entropi menurun ( S < 0) (b) Pembentukan kristal sukrosa dari larutan superjenuh Keacakan menurun entropi menurun ( S < 0) (c) Pemanasan gas hidrogen dari 600 C sampai 800 C Keacakan meningkat entropi meningkat ( S > 0) (d) Penyubliman es kering Keacakan meningkat entropi meningkat ( S > 0)

PERUBAHAN ENTROPI DAN KESETIMBANGAN Hk kedua penurunan entropi sistem hanya dapat terjadi jika entropi lingkungan meningkat melebihinya Peran penting lingkungan mengambilnya dari sistem memberi panas ke sistem atau Pada perubahan eksotermik, panas yang dilepas sistem, diserap oleh lingkungan menyebabkan gerak random partikel dilingkungan meningkat entropi meningkat qsis < 0, qling > 0, Sling > 0 Pada perubahan endotermik, sistem menyerap panas dan lingkungan melepas panas, sehingga entropi lingkungan menurun, qsis > 0, qling < 0, Sling < 0

EKSOTERMIK DAN ENDOTERMIK Reaksi Eksotermik C 6 H 12 O 6(s) + 6 O 2(g) 6 CO 2(g) + 6 H 2 O(g) + kalor Ca. O(s) + CO 2(g) Ca. CO 3(s) + kalor Reaksi Endotermik Kalor + Ba(OH)2· 8 H 2 O(s) + 2 NH 4 NO 3(s) Ba 2+(aq) + 2 NO 3 -(aq) + 2 NH 3(aq) + 10 H 2 O(l)

TANDA DARI ∆H DAN KESPONTANAN Semua reaksi pembakaran adalah spontan dan eksotermik: CH 4 (g) + 2 O 2 (g) CO 2 (g) + 2 H 2 O(g) Horxn = -802 k. J Besi berkarat secara spontan and eksotermik: 2 Fe(s) + 3/2 O 2 (g) Fe 2 O 3 (s) Horxn = -826 k. J Senyawa ion sca spontan membentuk unsurnya dgn melepas kalor: Na(s) + 1/2 Cl 2 (g) Na. Cl(s) Horxn = -411 k. J Pd tekanan normal, air membeku di bawah 0°C dan mencair di atas 0°C. keduanya adalah proses spontan, namun yang pertama termasuk eksotermik sedangkan yang kedua termasuk endotermik. H 2 O(l) H 2 O(s) H 2 O(l) Horxn = -6, 02 k. J (eksotermik; spontan pada T < 0 o. C) Horxn = +6, 02 k. J (endotermik; spontan pada T > 0 o. C)

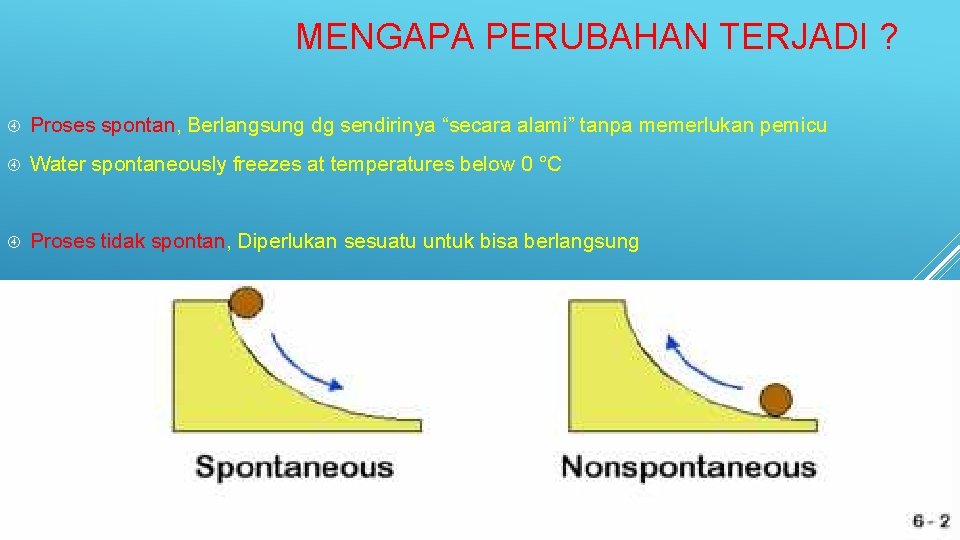
MENGAPA PERUBAHAN TERJADI ? Proses spontan, Berlangsung dg sendirinya “secara alami” tanpa memerlukan pemicu Water spontaneously freezes at temperatures below 0 °C Proses tidak spontan, Diperlukan sesuatu untuk bisa berlangsung

KAPAN REAKSI BERLANGSUNG SPONTAN ? Kespontanan suatu reaksi dapat ditentukan dg mempelajari termodinamika Termodinamika dapat digunakan untuk menghitung kerja yang dihasilkan dari beberapa reaksi kimia Dua faktor yang dapat menetukan kespontanan reaksi yaitu entalphi dan entropi Perubahan mengarah kekesetimbangan scr spontan, Suniv > 0 Ketika kesetimbangan tercapai shg Suniv = 0. Pada titik ini perubahan entropi sistem diikuti perubahan entropi lingkungan ( Ssurr ) dlm jumlah yang sama tetapi berbeda tanda

ENTROPI, KESPONTANAN, KESETIMBANGAN Hukum termodinamika kedua - entropi semesta (sistem + lingkungan) selalu naik pada proses spontan dan tidak berubah pada proses kesetimbangan. Ssemesta = Ssis + Sling > 0 proses spontan Ssemesta = Ssis + Sling = 0 Suniverse = Ssistem + Slingkungan Kesetimbangan Suniverse Ssis = - Sling proses kesetimbangan = Ssistem + Slingkungan = 0

NH 4 NO 3 in water—an entropy driven process. ∆Suniverse =∆Ssystem + ∆Ssurroundings

Suniv = Ssis + Ssurr Pada Tekanan konstan Ssurr = - Hsis/T Suniv = Ssis - Hsis/T Jika kedua sisi dikalikan –T maka -T Suniv = Hsis - T Ssis atau -T Suniv = Gsis Suniv > 0 spontan G < 0 Suniv < 0 non spontan G > 0 Suniv = 0 setimbang G = 0

ENTROPY S = q/T where q = heat transferred in phase change For H 2 O (liq) ---> H 2 O(g) ∆H = q = + 40, 700 J/mol

KESETIMBANGAN UAP AIR Penguapan 1 mol air pada 100 o. C (373 K) H 2 O(l: 373 K) H 2 O(g: 373 K) Sosis = So H 2 O(g) – So H 2 O(l) = 195, 9 – 86, 8 = 109, 1 J/K Sistem menjadi lebih tidak teratur Ssurr = - Hosis/T = - Hovap/T = -40, 7 x 103 J/373 K = -109 J/K Suniv = 109 J/K + (-109 J/K) = 0 Saat kesetimbangan tercapai, proses reaksi berlangsung spontan baik arah maju maupun balik

2 H 2(g) + O 2(g) ---> 2 H 2 O(liq) ∆Sosystem = -326. 9 J/K ∆Horxn = ∆Hosystem = -571. 7 k. J ∆Sosurroundings = +1917 J/K

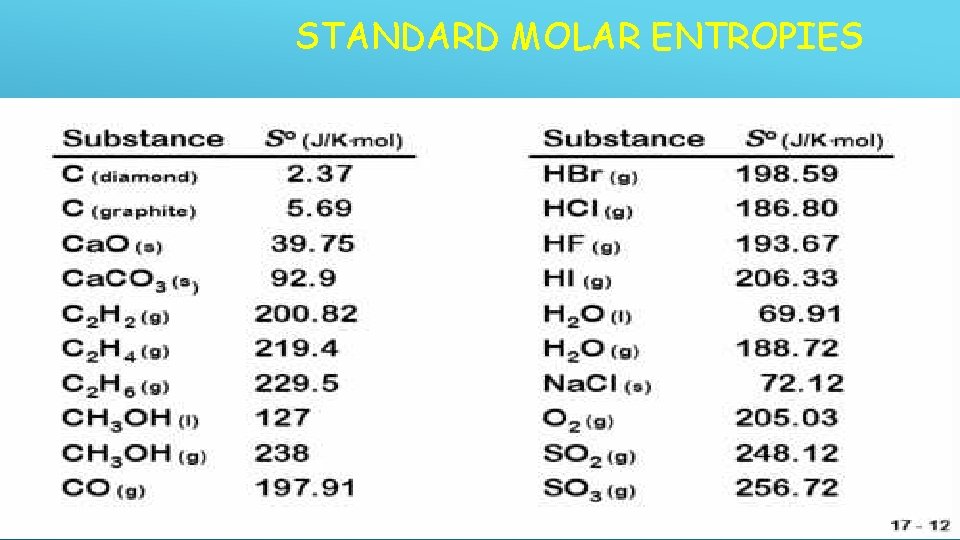
ENTROPI STANDAR / O S So Entropi dari suatu zat pd keadaan standar Perbedaan antara nilai entropi kristal sempurna zat pada 0 K dan keadaan standarnya pd temperatur yg lebih tinggi - Tekanan 1 atmosfer - temperatur yang diketahui pada 25 o. C - Satuan untuk So adalah J/K mol

STANDARD MOLAR ENTROPIES

ENTROPI SEBAGAI FUNGSI VARIABLE SISTEM 1. entropi sebagai fungsi suhu 2. entropi sebagai fungsi suhu dan tekanan

ENTROPI SEBAGAI FUNGSI SUHU Entropi merupakan fungsi suhu dan volum sehingga Differensial total : Pada hukum pertama termodinamika , yakni : Jika proses reversibel dan kerja yang dilakukan hanya kerja volum maka Untuk perubahan entropi. Persamaan diatas dibagi dg suhu sehingga : d. U sebagai fungsi T dan V :

Jika proses berlangsung dalam volum tetap, Pada suhu tetap , maka persamaannya Differensial total entropi sebagai fungsi suhu dan volume : Dengan alfa dan beta koefisien ekspansi termal dan koefisien kompresibilitas.

ENTROPI SEBAGAI FUNGSI SUHU DAN TEKANAN Secara matematis entropi pada fungsi suhu dan tekanan dinyatakan dalam : Differensial totalnya dinyatakan dalam bentuk persamaan Differensial total untuk entropi sebagai fungsi suhu dan tekanan Dengan alfa koefisien ekspansi termal

PERHITUNGAN PERUBAHAN ENTROPI Definisi termodinamika entropi didasarkan pada Untuk perubahan terukur antara dua kondisi bagian i dan f ekspresi ini diintegrasikan ke: Energi yang diserap sebagai panas selama ekspansi isotermal reversibel dari gas sempurna dapat dihitung dari ∆U = q + w sehingga ∆ U = 0, yang menyiratkan bahwa q = -w secara umum dan oleh karena itu qrev = -w rev untuk perubahan reversibel. Untuk perubahan entropi adalah jumlah integral dari perubahan yang sangat kecil. Jika temperatur konstan maka : Untuk perubahan volume reversibel isotermal dalam sistem yang terdiri dari gas ideal, qrev diberikan oleh Persamaan.

PROSES REVERSIBEL Sistem dan lingkungan dalam kesetimbangn termal S = q /T d. S = dq/T q = qrev dq = dqrev d. S = dqrev/T ∆S = qrev /T

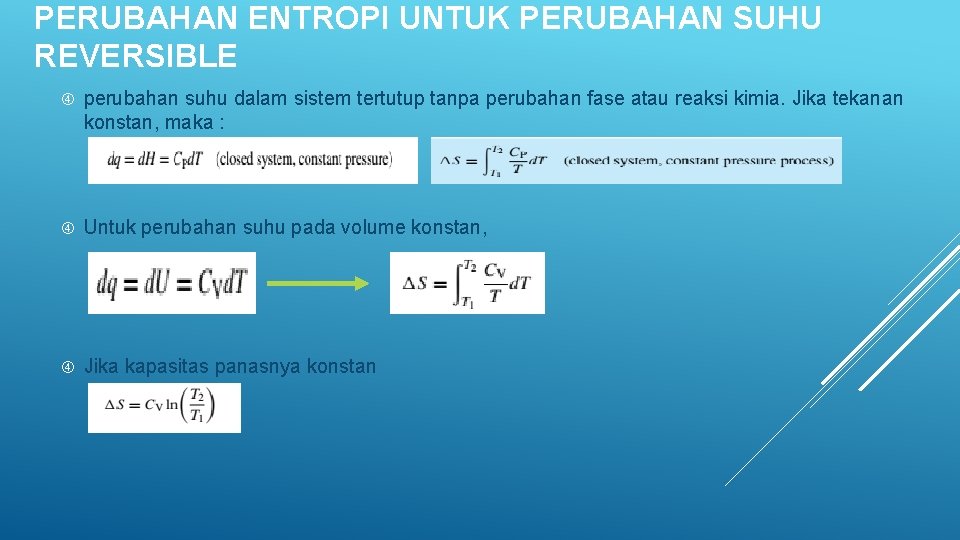
PERUBAHAN ENTROPI UNTUK PERUBAHAN SUHU REVERSIBLE perubahan suhu dalam sistem tertutup tanpa perubahan fase atau reaksi kimia. Jika tekanan konstan, maka : Untuk perubahan suhu pada volume konstan, Jika kapasitas panasnya konstan

PROSES IRREVERSIBEL Jika suatu sistem mengalami proses ireversibel dengan keadaan awal dan akhir kesetimbangan, kita dapat menghitung perubahan entropi dari sistem menggunakan proses reversibel itu misalnya perubahan fasa cair menjadi gas bukan pada keadaan transisinya , maka cara tersebut tidak dapat dilakukan. Perubahan entropi untuk proses irreversibel dapat ditentukan dengan cara memecah proses tersebut menjadi beberapa tahap reversible. Entropi merupakan fungsi keadaan , jadi jalan yang ditempuh tidaklah penting , perubahan entropi hanya pada keadaan awal dan akhir. Besarnya dapat dihitung dengan hukum Hess.

Suniv = Ssis + Ssurr Suniv > 0 Suniv = Ssis + Ssurr > 0 Ssis > - Ssurr d. Ssis > - d. Ssurr d. S > dq/T Ketidaksamaan Clausius Proses Adiabatik dq = 0, tdk ada kalor yg dipindah Hk 1…. d. U = dq + d. W = 0 dan dq = 0 d. Suniv > 0 Reaksi spontan

PERUBAHAN ENTROPI UNTUK PROSES IRREVERSIBLE Ex : Pembekuan 1 mol air lewat dingin (supercooled) pada suhu -10°C adalah proses reversible. Diketahui perubahan entalpi kristalisasi air cair pada 0°C , ∆H = -6004 J/mol. Kapasitas kalor air 75, 3 J/Kmol , dan untuk air padat (es) 36, 8 j/K mol pada rentang suhu tersebut. Tentukan perubahan entropi ketika satu mol air cair pada - 10°C berubah menjadi es pada -10°C pada tekanan tetap Upi Kimfis hal 110

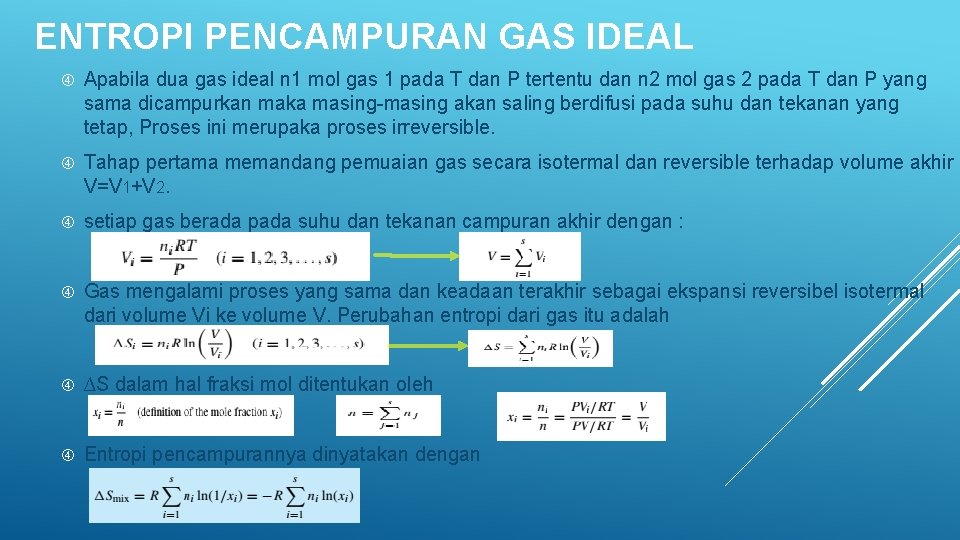
ENTROPI PENCAMPURAN GAS IDEAL Apabila dua gas ideal n 1 mol gas 1 pada T dan P tertentu dan n 2 mol gas 2 pada T dan P yang sama dicampurkan maka masing-masing akan saling berdifusi pada suhu dan tekanan yang tetap, Proses ini merupaka proses irreversible. Tahap pertama memandang pemuaian gas secara isotermal dan reversible terhadap volume akhir V=V 1+V 2. setiap gas berada pada suhu dan tekanan campuran akhir dengan : Gas mengalami proses yang sama dan keadaan terakhir sebagai ekspansi reversibel isotermal dari volume Vi ke volume V. Perubahan entropi dari gas itu adalah ∆S dalam hal fraksi mol ditentukan oleh Entropi pencampurannya dinyatakan dengan

Jika suatu proses tidak isotermal tetapi memiliki suhu akhir yang sama dengan suhu awal, kita dapat menghitung ∆S untuk proses dengan mengintegrasikan dqrev / T d. U dan d. S tidak bergantung pada bagaimana perubahan itu terjadi dan khususnya tidak bergantung pada apakah proses bersifat reversible atau ireversibel Pada keadaan statis entropi T=0 K = 1, 381 x 10 -23 J/K

Sebatang aluminium dengan massa 4, 00 kg dipanaskan dari suhu 717 °C sampai 962°C. Jika kalor jenis aluminium sebesar 910 J/kg. K, hitunglah perubahan entropinya!

Perubahan Entropi dalam suatu Sistem ( Ssis) Entropi pada reaksi kimia Entropi reaksi standar ( S 0 ) adalah perubahan entropi rxn untuk reaksi yang terjadi pada 1 atm dan 250 C. a. A + b. B c. C + d. D S 0 rxn = [ c. S 0(C) + d. S 0(D) ] - [ a. S 0(A) + b. S 0(B) ] S 0 rxn = S n. S 0(produk) - S m. S 0(reaktan)

Contoh soal : 1. Berapakah perubahan entropi standar untuk reaksi 2 CO (g) + O 2 (g) 2 CO 2 (g) pada 250 C? S 0(CO) = 197, 9 J/K • mol S 0(CO 2) = 213, 6 J/K • mol S 0(O 2) = 205, 0 J/K • mol S 0 rxn = 2 x S 0(CO 2) – [2 x S 0(CO) + S 0 (O 2)] S 0 rxn = 427, 2 – [395, 8 + 205, 0] = -173, 6 J/K • mol


HUKUM KETIGA TERMODINAMIKA

ENTROPI ZAT PADA TITIK LELEHNYA

ENTROPI STANDAR ZAT PADA TITIK DIDIHNYA

ENTROPI SEBAGAI KRITERIA KESPONTANAN PROSES