HP CHT C OXI CA CLO I S















- Slides: 19

HỢP CHẤT CÓ OXI CỦA CLO

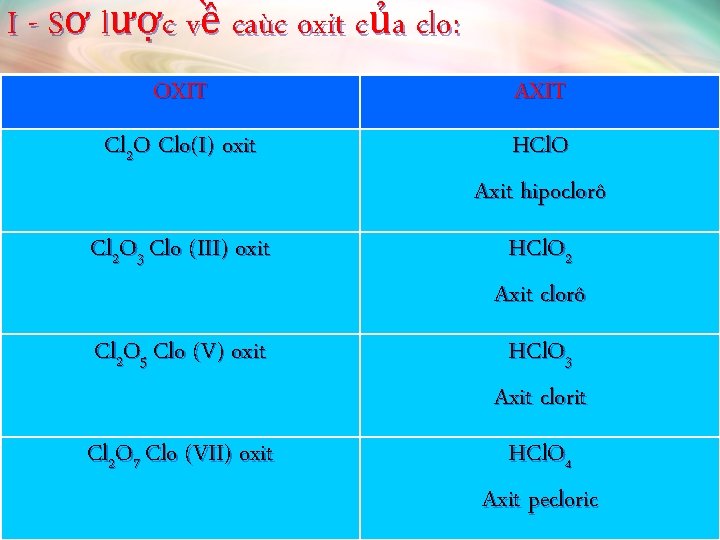
I - Sơ lược về caùc oxit của clo: OXIT AXIT Cl 2 O Clo(I) oxit HCl. O Axit hipoclorô Cl 2 O 3 Clo (III) oxit HCl. O 2 Axit clorô Cl 2 O 5 Clo (V) oxit HCl. O 3 Axit clorit Cl 2 O 7 Clo (VII) oxit HCl. O 4 Axit pecloric

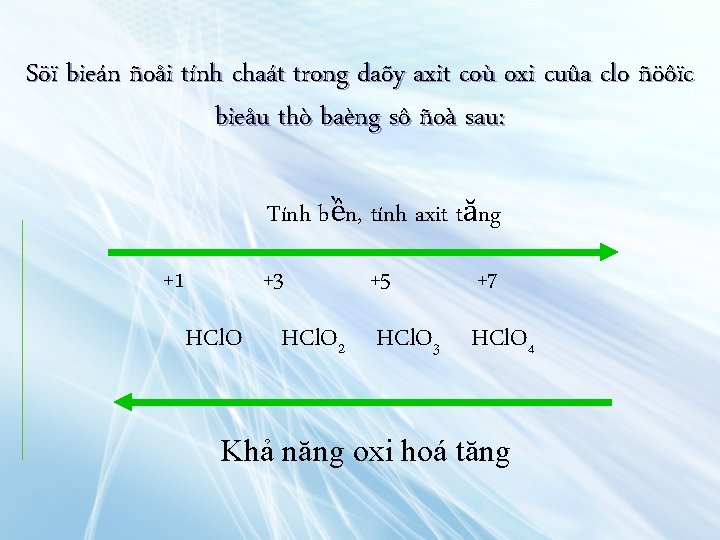
+1 +3 +5 +7 HCl. O 2 HCl. O 3 HCl. O 4 So saùnh ñoä aâm ñieän cuûa clo vaø oxi, ta coù theå giaûi thích ñöôïc vì sao trong caùc hôïp chaát coù oxi cuûa clo, clo coù soá oxi hoùa döông

Söï bieán ñoåi tính chaát trong daõy axit coù oxi cuûa clo ñöôïc bieåu thò baèng sô ñoà sau: Tính bền, tính axit tăng +1 +3 HCl. O +5 +7 HCl. O 2 HCl. O 3 HCl. O 4 Khả năng oxi hoá tăng

Trong dãy này axit hipoclorơ là chất oxi hoá mạnh nhất, axit peclorit là chất oxi hoá yếu nhất Và ngựơc lại , axit hipoclorơ là axit yếu nhất còn axit peclorit là axit mạnh nhất Các muối của những axit trên có nhiều ứng dụng trong thực tế, trong đó có: Nước Javel, Clorua vôi, muối clorat

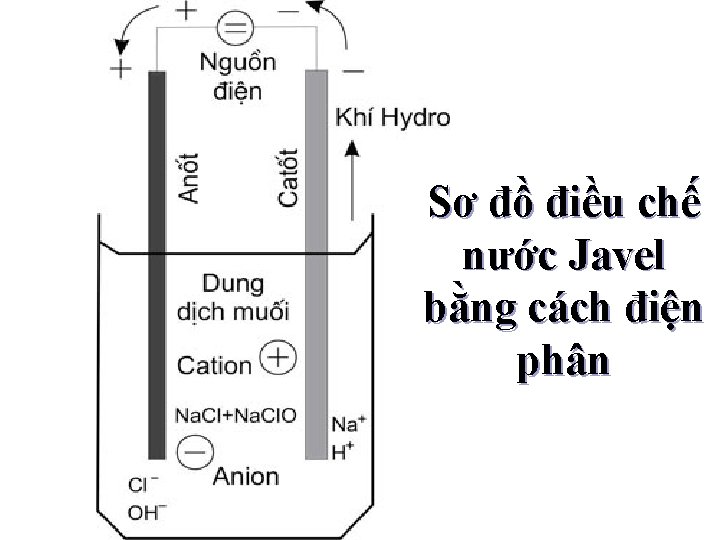
II - Nước Javel, Clorua vôi, muối clorat: 1. Nước Javel: Nước Javel được điều chế bằng cách : Cho Clo vào dung dịch Na. OH: 2 Na. OH + Cl 2 Na. Cl + Na. Cl. O + H 2 O Điện phân dung dịch muối ăn trong nước không có vách ngăn: đp 2 Na. OH + 2 H 2 O 2 Na. OH + H 2 + Cl 2

Sơ đồ điều chế nước Javel bằng cách điện phân

Là muối của một axit rất yếu, natri hipoclorit dễ tác dụng với cacbon đioxit của không khí tạo thành axit hipoclorơ: Na. Cl. O + CO 2 + H 2 O Na. HCO 3 + HCl. O Do tính oxi hoá mạnh, HCl. O có tác dụng sát trùng, tẩy trắng sợi, vải, giấy. Nước Javel chứa Na. Cl. O mang số oxi hoá +1 nên tính oxi hoá rất mạnh dùng để tẩy trắng. Ngoài ra còn được dùng để xát trùng và tẩy uế nhà vệ sinh và các khu vực ô nhiễm.

Những ứng dụng NÖÔÙC JAVEL

2. Clorua vôi: Clorua vôi là chất bột màu trắng, có mùi xốc của khí clo, có tính oxi hóa mạnh Khi cho khí Clo tác dụng với vôi tôi Ca(OH)2 ta thu được clorua vôi: Ca(OH)2 + Cl 2 Ca. OCl 2 + H 2 O Clorua vôi -1 Công thức cấu tạo: Cl +1 Ca O - Cl Tác dụng với vôi tôi: Cl 2 + Ca(OH)2 (r) Ca. OCl 2 + H 2 O

Tác dụng với axit clohiđric, clorua vôi giải phóng hidro: Ca. Cl. O 2 + 2 HCl Ca. Cl 2 + H 2 O Trong không khí ẩm, clorua vôi tác dụng với cacbon đioxit, làm thoát ra HCl. O 2 Ca. OCl 2 + CO 2 + H 2 O Ca. CO 3 + Ca. Cl 2 + 2 HCl. O Clorua vôi dễ phân huỷ thành oxi nguyên tử có tính oxi hoá mạnh được dùng làm chất tẩy. Ca. OCl 2 Ca. Cl 2 + O Ngoài ra một lượng lớn clorua vôi được dùng để xử lí chất độc, tinh chế dầu mỏ

3. Muối clorat: Clorat là muối của axit cloric (HCl. O 3). Muối clorat quan trọng hơn cả là kali clorat (KCl. O 3) a) Điều chế: Khí Clo tác dụng với dung dịch kiềm nóng thì phản ứng không tạo ra muối hipoclorit mà tạo ra muối clorat: 1000 C 6 KOH + 3 Cl 2 5 KCl + KCl. O 3 +3 H 2 O Ngoài ra Kali clorat còn được điều chế bằng cách điện phân dung dịch KCl 25% ở nhiệt độ 700 C - 750 C

b) Tính chất: Kali clorat là chất rắn kết tinh, không màu nóng chảy ở 3560 C. Tan nhiều trong nước nhưng ít tan trong nước lạnh. Vì vậy, khi làm lạnh dung dịch bão hoà, KCl. O 3 dễ dàng tách khỏi dung dịch. Kali clorat khi đun nóng trên 5000 C( không có xúc tác), kali clorat rắn bị phân huỷ : -1 0 +5 -2 t 0 2 KCl. O 3 2 KCl + 3 O 2

Phản ứng này xảy ra ở nhiệt độ thấp hơn nếu có chất xúc tác Mn. O 2 và được dùng để điều chế oxi trong phòng thí nghiệm KCl. O 3 t 0 Mn. O 2 KCl + 3 2 O 2 Ở trạng thái rắn, kali clorat là chất oxi hóa mạnh. Phot pho bốc cháy khi được trộn với kali clorat. Hỗn hợp Kali clorat với lưu huỳnh và cacbon sẽ nổ khi đập mạnh

c) Ứng dụng: Kali clorat được dùng để chế tạo thuốc nổ, sản xuất pháo hoa, ngòi nổ và những hổn hợp dễ cháy khác. Kali clorat còn được dùng trong công nghiệp diêm. Thuốc ở đầu que diêm chiếm 50% KCl. O 3

Ứng dụng Kali clorat

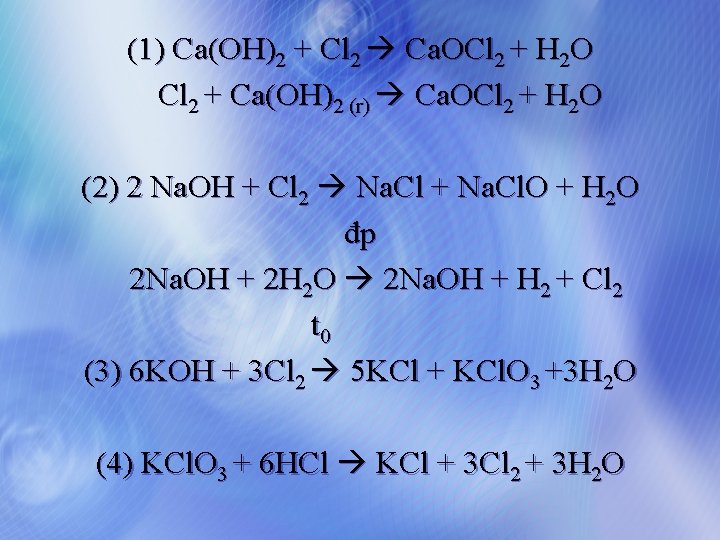
Hoàn thành chuỗi biến đổi sau bằng phương trình phản ứng Clorua vôi (2 cách) (1) (2) Cl 2 ) (3 (4 Javen (2 cách) ) Kali clorat

(1) Ca(OH)2 + Cl 2 Ca. OCl 2 + H 2 O Cl 2 + Ca(OH)2 (r) Ca. OCl 2 + H 2 O (2) 2 Na. OH + Cl 2 Na. Cl + Na. Cl. O + H 2 O đp 2 Na. OH + 2 H 2 O 2 Na. OH + H 2 + Cl 2 t 0 (3) 6 KOH + 3 Cl 2 5 KCl + KCl. O 3 +3 H 2 O (4) KCl. O 3 + 6 HCl KCl + 3 Cl 2 + 3 H 2 O

CÁM ƠN CÔ VÀ CÁC BẠN ĐÃ THEO DÕI PHẦN THUYẾT TRÌNH CỦA NHÓM 5