Hoofdstuk 3 Stoffen en reacties Elektrisch geleidingsvermogen en




















































- Slides: 63

Hoofdstuk 3 Stoffen en reacties

Elektrisch geleidingsvermogen en naamgeving Stoffen kunnen worden ingedeeld in groepen door te kijken naar het elektrisch geleidend vermogen.

Wat is elektrische stroom? Letterlijk: transport van geladen deeltjes Er zijn twee mogelijkheden: 1) Elektronen die door een draad bewegen (natuurkunde) 2) Ionen (alleen in vloeibare fase of in oplossingen)

Drie groepen Moleculaire stoffen (niet- metalen) Zouten (metaal + niet- metaal) Metalen (metalen)

Moleculaire stoffen Bestaan alleen uit niet-metaal atomen Bevatten atoombindingen Geleiden nooit stroom Voorbeelden: Aardgas CH 4 Zuurstof O 2 Glucose C 6 H 12 O 6

Verbinding Als de atomen verschillend zijn Bijvoorbeeld: NO 2 Stikstofdioxide http: //vimeo. com/4433312

Zuiver water is een moleculaire stof en kan geen stroom geleiden. Opstelling:

Voorbeelden Kaarsvet bestaat uit stearinezuur en heeft de volgende formule: C 17 H 35 COOH Kan gesmolten kaarsvet stroom geleiden? Oplossing Kijk naar de formule van kaarsvet: Kijk met behulp van Binas tabel 99 of de atomen in kaarsvet niet-metalen zijn Ja C = niet metaal H= niet metaal O = niet metaal Kaarsvet is moleculair kan dus geen stroom geleiden

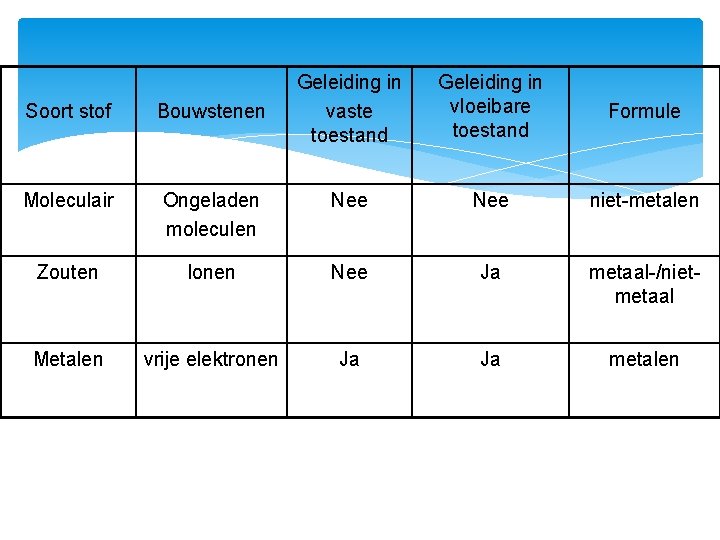
Geleiding in vaste toestand Geleiding in vloeibare toestand Formule Soort stof Bouwstenen Moleculair Ongeladen moleculen Nee niet-metalen Zouten Ionen Nee Ja metaal-/nietmetaal Metalen vrije elektronen Ja Ja metalen


Bouw van moleculaire stoffen Molecuulrooster De molecuulstructuur bepaalt de vorm van het rooster

Bouw van zouten Bevatten positieve ionen en negatieve ionen Sterke binding door ladingsverschil Ionrooster

Bouw van metalen Metaalrooster Elektronen bewegen zich vrij langs de positieve metaal- ionen


Binding in moleculen

Molecuulformule Aan een molecuulformule kun je zien hoeveel en welke atomen aan elkaar zijn gebonden. Bijvoorbeeld : coëfficent Water: notatie : 3 H 2 O 3 moleculen water die elk bestaan uit 2 index waterstof en 1 zuurstofatoom

Systematische naamgeving Moleculaire stoffen Wat is de chemische naam van water? H 2 O Het eerste symbool = volledige naam = waterstof Het tweede symbool krijgt het achtervoegsel ide = oxide

Systematische naamgeving De index 2 in de molecuulformule geven we aan met een voorvoegsel di (BINAS 66 C): diwaterstof INDEX voorvoegsel 1 mono 2 di 3 tri 4 tetra 5 penta 6 hexa

Tweede symbool O S N Naam oxide sulfide nitride P Se fosfide selenide Voorbeeld 1: H 2 O diwaterstof(mono-)oxide

Voorbeeld 2 Systematische naam PCl 5 Index P-atoom: 1 (mono) Index Cl-atoom: 5 penta De naam wordt dan: (mono)waterstofpentachloride

Voorbeeld 3 Systematische naam P 2 O 5 Index P-atoom: 2 di Index O-atoom: 5 penta De naam wordt dan difosforpentaoxide telwoord- atoomsoort- telwoord-atoomsoort-ide

Voorbeeld 4 As 2 Br 3 As = niet-metaal Br = niet-metaal Index As = 2 di Index Br = 3 tri Naam: diarseentribromide

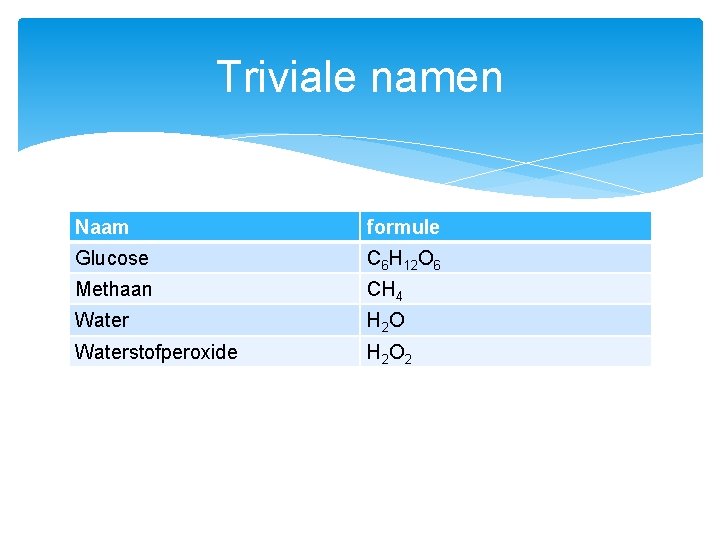
Triviale namen Naam formule Glucose C 6 H 12 O 6 Methaan CH 4 Water H 2 O Waterstofperoxide H 2 O 2

3. 3 Atoombindingen

Structuurformule Kun je zien hoe de atomen in een molecuul zijn gebonden Atoombindingen worden aangegeven met streepjes. Een atoombinding wordt ook wel covalente binding genoemd.

Covalentie Getal dat aangeeft hoeveel atoombindingen een atoomsoort kan vormen. Elementen Covalentie H , F, I, Cl , Br 1 O 2 N 3 C 4

Structuurformules pentaan 2 - methylbutaan

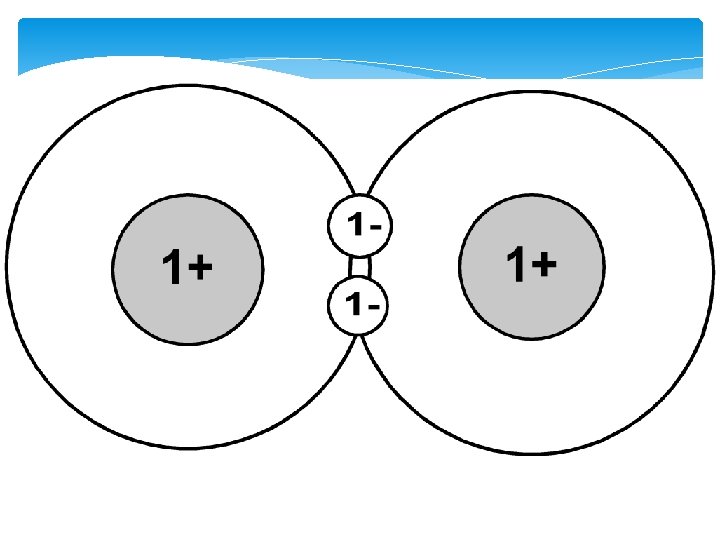
Atoom(covalente)binding Elk atoom levert per atoombinding 1 e-. De 2 e- samen noemt men het: bindings- of gemeenschappelijk e- - paar Als moleculen kapot gaan worden er atoombindingen verbroken.

ion versus covalente atoombinding


Waterstof heeft maar 1 e- dus kan ook nooit meer dan 1 binding vormen. Alleen de e- in de buitenste schil spelen een rol, deze enoemt de valentie-e-.

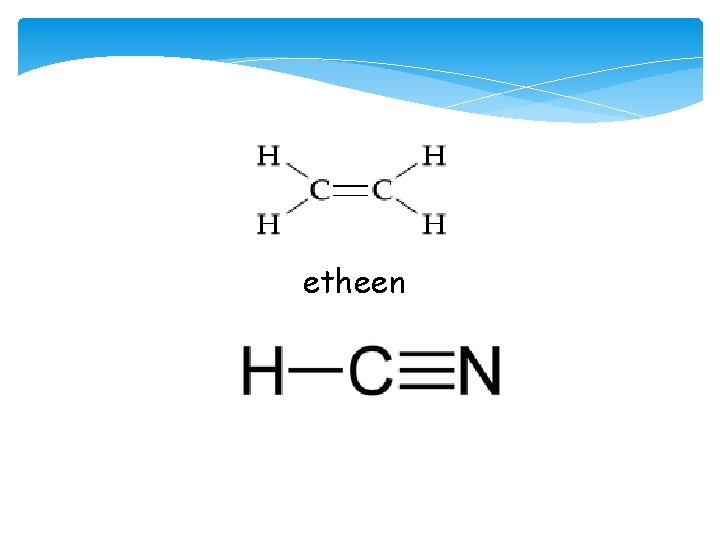
Meervoudige bindingen Een koolstofatoom heeft covalentie 4. Er moeten dus altijd vier bindingen om heen getekend worden, dit heeft soms tot gevolg dat er een meervoudige binding ontstaat. Voorbeelden: Etheen (C 2 H 4) HCN

etheen

Lewisstructuren 8 elektronen in de buitenste schil zorgt voor verhoogde stabiliteit Alleen de valentie- elektronen (elektronen in de buitenste baan) spelen hierbij een rol

Een Lewisstructuur tekenen gaat op dezelfde manier als een structuurformule, alleen moet je ook rekening houden met vrije elektronenparen.

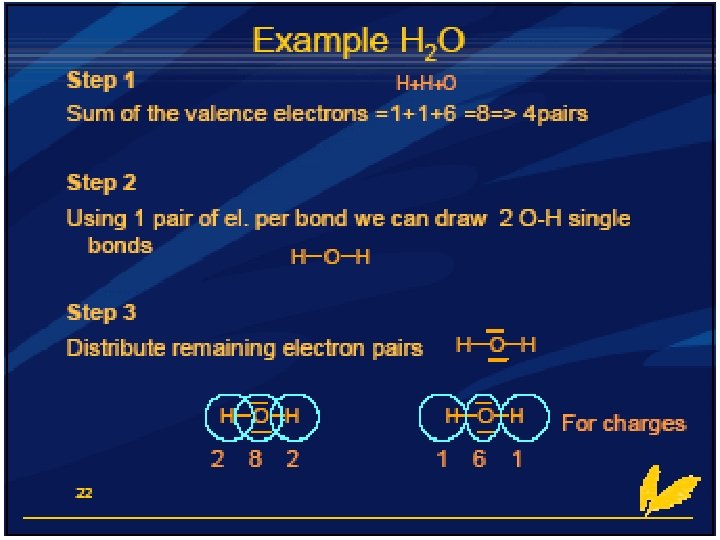
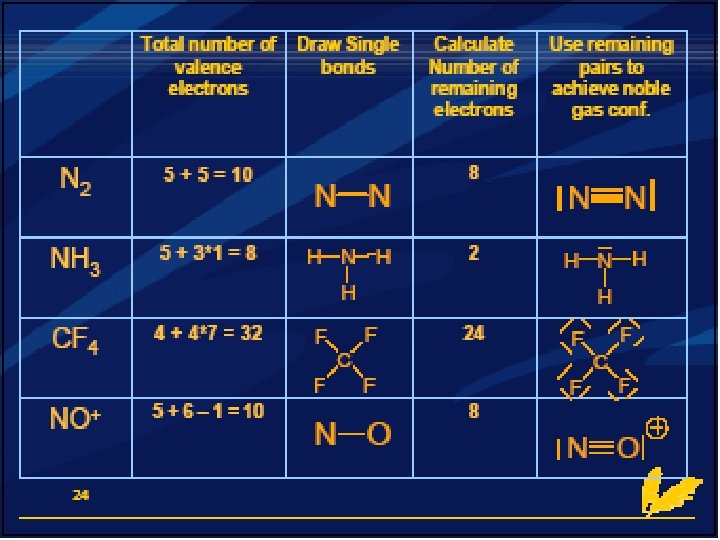
Stappen Lewisstructuur: - Bereken hoeveel valentie-elektronen het molecuul heeft - Deel dit aantal door 2= aantal paren - Teken per 2 - tal één atoombinding en zorg dat de octet-regel klopt - Let op de covalentie van de verschillende atoomsoorten




Het tekenen van een lewisstructuur Tekenen van Lewisstructuren

Wat is elektronegativiteit? Elektronegativiteit is een getal dat aangeeft hoe sterk een atoom elektronen aantrekt. Hoe groter de elektronegativiteit, hoe sterker een atoom elektronen aantrekt. De elektronegativiteit kun je opzoeken in binas-tabel 40 A.

De atoombinding tussen twee atomen in een moleculaire stof wordt gevormd door een gemeenschappelijk elektronenpaar tussen die twee atomen. Als voorbeeld kiezen we de atoombinding in een HCl-molecuul:

Uit tabel 40 A blijkt dat de EN van chloor 2, 8 bedraagt. De EN van waterstof is 2, 1. Het chlooratoom trekt dus sterker aan de ein de atoombinding dan het waterstofatoom.

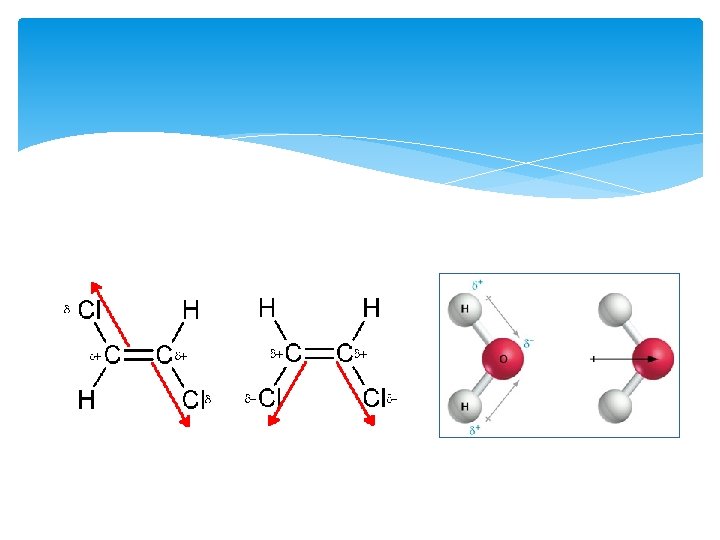
We kunnen dit schematisch weergeven door middel van een pijl. : Deze pijl loopt evenwijdig aan de atoombinding en wijst naar het meest elektronegatieve atoom

Polaire atoombinding In het voorbeeld hierboven zag je dat het verschil in EN (ΔEN) tussen de twee atomen 0, 7 was. We noemen de atoombinding in een HClmolecuul daarom ook wel een: polaire atoombinding omdat ΔEN groter is dan 0, 4.

Het verschil in elektronegativiteit tussen twee atomen geeft dus aan met voor een soort atoombinding je te maken hebt. Een verschil groter dan 0, 4 duidt op een polaire atoombinding

ONTHOUD: ΔEN ≤ 0, 4 gewone atoombinding 0, 4 < ΔEN < 1, 7 polaire atoombinding ΔEN > 1, 7 ionbinding

Vanderwaalsbindingen

Vander. Waalsbindingen Aantrekkende krachten tussen moleculen: cohesie. Er geldt in het algemeen: Hoe groter de molecuulmassa, hoe sterker de Vanderwaalsbindingen, hoe hoger het smelt, kookpunt.

Fase-overgangen Bij een fase-overgang spelen alleen de Fvdw een rol Bijvoorbeeld: verdampen Als een stof verdampt worden de Fvdw verbroken. De atoombindingen blijven heel. Bij een chemische reactie worden er ook atoombindingen verbroken.

Kookpunten moleculaire stoffen CH 4 heeft een massa van 16 u en een kookpunt van 112 K H 2 O heeft een massa van 18 u en een kookpunt van 373 K Hoe kunnen we dit verklaren?

Polaire moleculen Moleculen met een ladingsverdeling noemen we polair ofwel dipoolmoleculen. Tussen de dipoolmoleculen zit een dipoolbinding. Sterker dan Vanderwaals

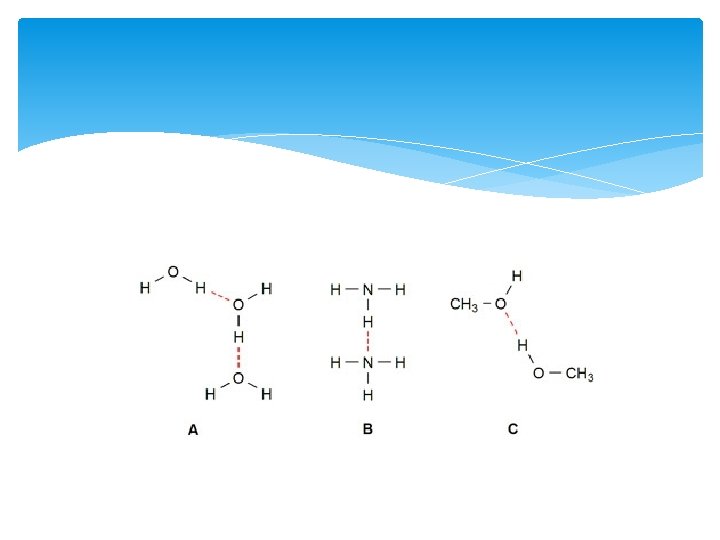
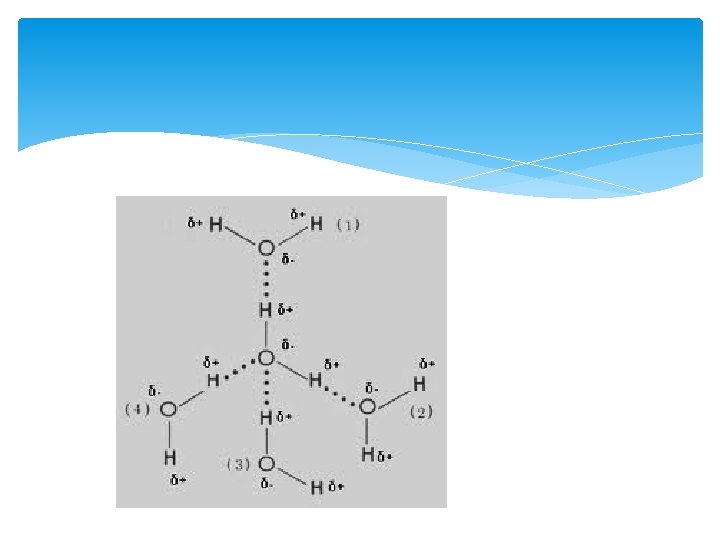
Waterstofbruggen Extra binding TUSSEN de moleculen. Kan aanwezig als 0, 4 < ΔEN < 1, 7, dus wanneer er een polaire atoombinding is gevormd tussen twee atomen. Bij O-H en N- H.



Apolaire moleculen Moleculen zonder polaire atoombindingen zijn altijd apolair. Er bestaan echter ook stoffen met polaire atoombindingen die toch apolair zijn. Hoe kan dit?



Bindingen In een molecuul: Atoombinding (polair of apolair) Tussen moleculen: Vanderwaals (altijd) dipool- dipoolbinding (polaire moleculen) waterstofbrug (OH of NH)

Kookpunt Methanal wordt meestal bereid uit methanol. Het kookpunt van methanal (254 K) is aanmerkelijk lager dan het kookpunt van methanol (338 K). Verklaar het verschil in kookpunt aan de hand van de gegeven structuren

Chloor is bij kamertemperatuur een gas met formule Cl 2. We koelen chloorgas af tot het vloeibaar wordt. 1 Leg uit welke bindingstypen voorkomen in vloeibaar chloor. Water is bij kamertemperatuur een vloeistof met formule H 2 O. 2 Welke bindingstypen komen voor in vloeibaar water?

3 Teken drie moleculen van vloeibaar water. Geef in je tekening de in vorige vraag genoemde bindingstypen aan. 4 De molecuulmassa van chloor is bijna vier maal zo groot als de molecuulmassa van water. Toch is water bij kamertemperatuur een vloeistof en chloor een gas. Geef hiervoor een verklaring.

Silicium komt in de natuur voor als een mengsel drie isotopen: Isotoop Percentage massa (u) 28 Si 92, 23 % 27, 97693 29 Si 4, 67 % 28, 97650 Si 3, 10 % x De gemiddelde atoommassa van silicum is 28, 08551 u. Bereken de massa van deze derde isotoop.
 Lewisstructuren tekenen
Lewisstructuren tekenen Rekenen aan reacties
Rekenen aan reacties Reactie vergelijkingen kloppend maken
Reactie vergelijkingen kloppend maken Reactievergelijking rekenmachine
Reactievergelijking rekenmachine Endotherme reactie grafiek
Endotherme reactie grafiek Geaard
Geaard Hoofdstuk 4 wiskunde havo 4
Hoofdstuk 4 wiskunde havo 4 Begeleidingsstijlen leerling
Begeleidingsstijlen leerling Samenvatting bespiegeling hoofdstuk 9 massacultuur
Samenvatting bespiegeling hoofdstuk 9 massacultuur Radiaal veld
Radiaal veld Joint drehmaschine elektrisch
Joint drehmaschine elektrisch Aardrijkskunde hoofdstuk 2 havo 4
Aardrijkskunde hoofdstuk 2 havo 4 Hoofdstuk in een opera
Hoofdstuk in een opera Badehilfen haßfurt
Badehilfen haßfurt Symbool relais
Symbool relais Hoofdstuk 6
Hoofdstuk 6 Foto elektrisch effect
Foto elektrisch effect Wiskunde 3 havo
Wiskunde 3 havo Naughts and crosses chapter summary
Naughts and crosses chapter summary Watt grootheid
Watt grootheid Samenvatting belofte van pisa
Samenvatting belofte van pisa Atomaire stoffen
Atomaire stoffen Regulerende stoffen
Regulerende stoffen Zuurconstante tabel
Zuurconstante tabel Waterstofperbromaat
Waterstofperbromaat Gevaarlijke stoffen etiketten
Gevaarlijke stoffen etiketten Wat is zwaarder
Wat is zwaarder Zoutzuur notatie
Zoutzuur notatie Zure stoffen
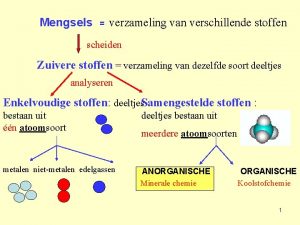
Zure stoffen Mengen en scheiden
Mengen en scheiden L
L Structuurformule kaarsvet
Structuurformule kaarsvet Kleuren gasflessen vca
Kleuren gasflessen vca Voorvoegels
Voorvoegels Ruhe stoffen
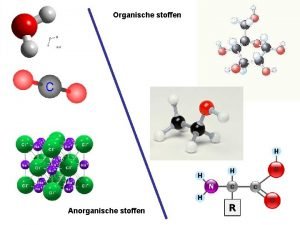
Ruhe stoffen Anorganische stoffen
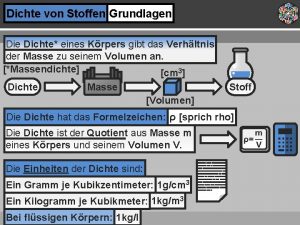
Anorganische stoffen Dichte von stoffen
Dichte von stoffen