HIV diagnostic virologique et suivi des patients infects





































- Slides: 50

HIV: diagnostic virologique et suivi des patients infectés Cours D 1 2010 -2011

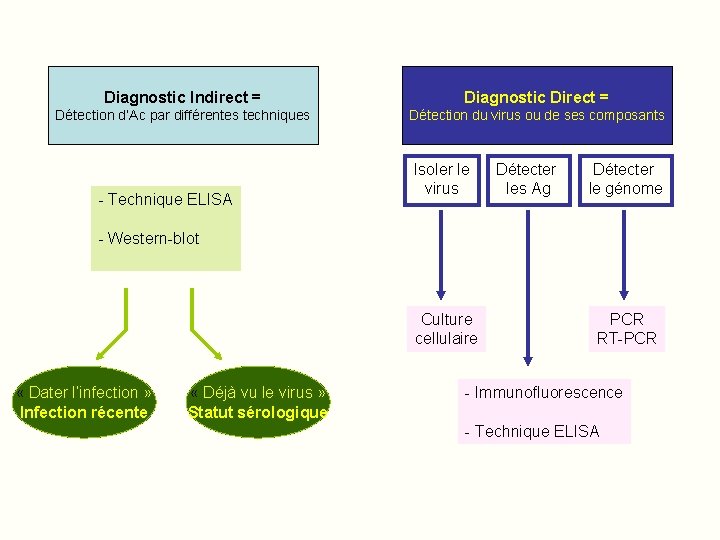
Diagnostic Indirect = Diagnostic Direct = Détection d’Ac par différentes techniques Détection du virus ou de ses composants - Technique ELISA Isoler le virus Détecter les Ag Détecter le génome - Western-blot Culture cellulaire « Dater l’infection » Infection récente « Déjà vu le virus » Statut sérologique PCR RT-PCR - Immunofluorescence - Technique ELISA

DIAGNOSTIC ET SUIVI VIROLOGIQUES HIV q Techniques q Diagnostic virologique d’une infection VIH chez l’adulte q Suivi virologique d’un sujet infecté par le VIH

Les techniques 1) Techniques de diagnostic indirect Ø Techniques de recherche des anticorps anti VIH q Tests de dépistage : techniques ELISA q Tests rapides q Tests de confirmation: test sur bandelette (Western blot ou test apparenté) 2) Techniques de diagnostic direct Ø Techniques permettant la mise en évidence du virus lui-même: q Antigénémie P 24 q ARN plasmatique q DNA proviral Ø Tests de résistance du virus aux ARV: technique de séquençage

Principe général de l’ELISA Contact de l’enzyme avec un chromogène : Réaction colorée « conjugué » : AC anti Ig humaine Couplé à une enzyme AC non spécifique AC anti VIH antigène plaque

Principe de l’ELISA - phase solide revêtue d'antigènes VIH - les anticorps anti-VIH se lient sur les antigènes - révélation par : . des Ac anti-Ig humaines conjugués à une enzyme. puis le substrat chromogène est ajouté si Ac anti-VIH : coloration de la cupule grâce à un chromogène soluble

Différentes générations de tests ELISA pour le dépistage VIH Ø Ø Ø 1ère : antigène = lysat viral purifié 2ème : antigène = protéines recombinantes ou peptides de synthèse 3ème : antigène = idem 2ème génération révélation : antigène conjugué à une enzyme ELISA de type « sandwich » Ø 4ème : détection à la fois des AC et de l’Ag p 24

Test de dépistage VIH = technique ELISA Tests ELISA de 4ème génération: Caractéristiques: Ø Tests mixtes = HIV 1 et HIV 2 Ø Tests combinés = détectent § les AC § et en même temps l’antigène p 24

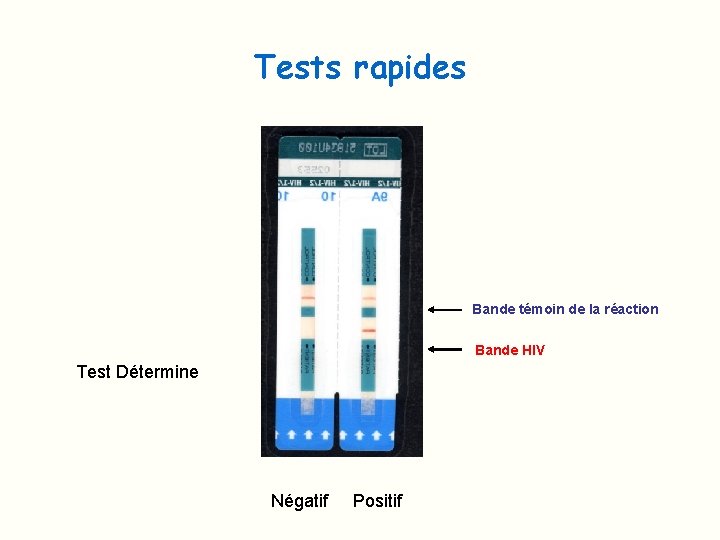
Tests rapides Test immunochromatographique: Ø Antigènes recombinants et peptides de synthèse immobilisés sur une membrane Ø Dépôt du sérum contenant éventuellement des AC spécifiques Ø Migration du sérum jusqu’aux AG immobilisés Ø Liaison des AC avec les Ag donnant une coloration visible à l’œil nu Ø Moins sensibles que l’ ELISA Ø Détection des AC anti VIH 1 et 2 (pas de détection de l’Ag p 24)

Tests rapides Bande témoin de la réaction Bande HIV Test Détermine Négatif Positif

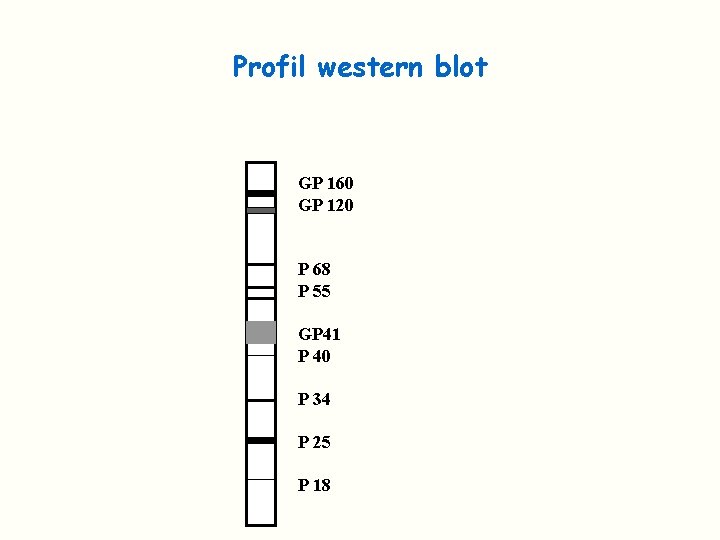
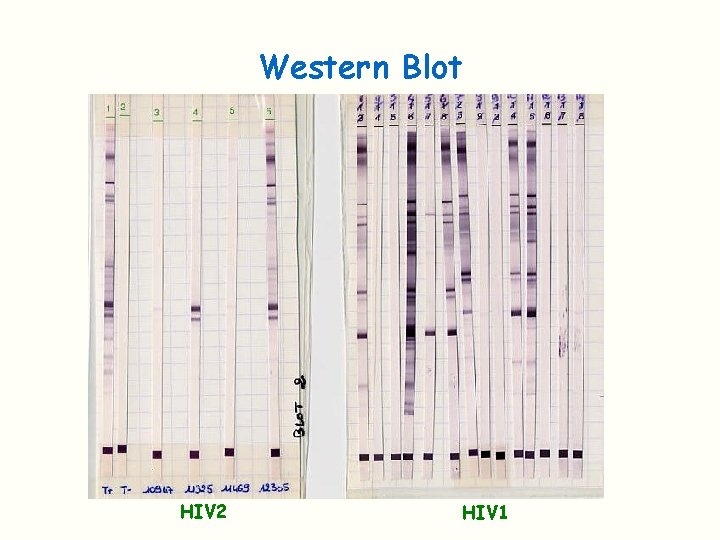
Test de confirmation Confirme la spécificité antigénique des anticorps détectés en ELISA Le test utilisé classiquement est le Western Blot On peut également utiliser un immunoblot avec des protéines recombinantes et des peptides synthétiques Bandelette de nitrocellulose sur laquelle les principaux antigènes viraux sont séparés et disposés en bande Lorsque les AC correspondants sont présents dans le sérum: réaction Ag/Ac et visualisation de la bande Des critères de positivité ont été définis (OMS)

Profil western blot GP 160 GP 120 P 68 P 55 GP 41 P 40 P 34 P 25 P 18

Western Blot HIV 2 HIV 1

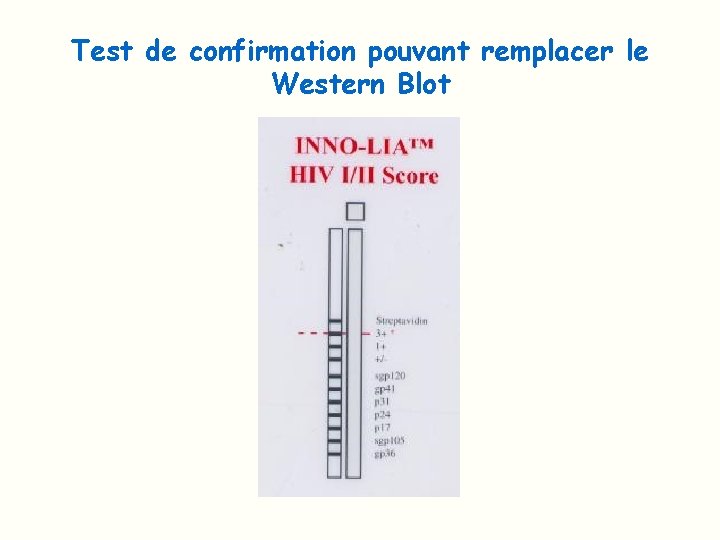
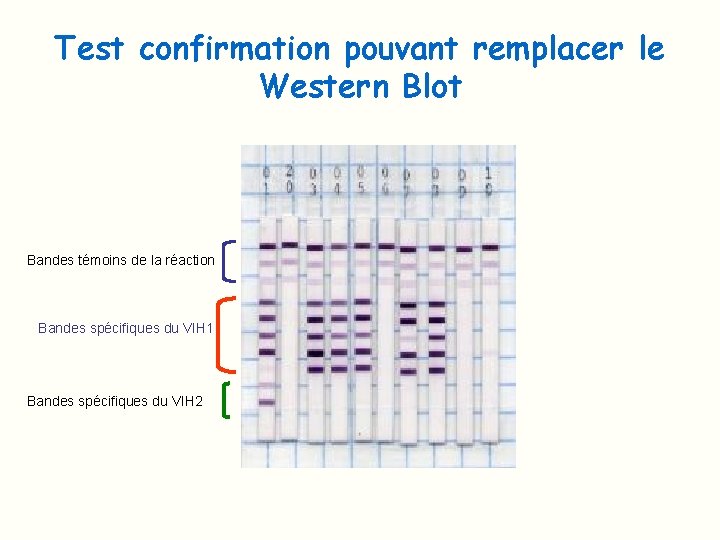
Test de confirmation pouvant remplacer le Western Blot

Test confirmation pouvant remplacer le Western Blot Bandes témoins de la réaction Bandes spécifiques du VIH 1 Bandes spécifiques du VIH 2

Techniques de mise en évidence du virus Ø Antigénémie P 24 Ø Quantification de l’ARN VIH plasmatique = charge virale plasmatique Ø Recherche (quantification) du DNA proviral

Différents états du VIH Réplication Virus intégré Recherche qualitative: Ø DNA proviral Quantification Ø DNA proviral quantitatif Virus plasmatique + Ag soluble Ø Ag p 24 CV plasmatique Ø Quantification de l’ARN plasmatique (PCR quantitative)

Antigénémie P 24 Ø L'antigénémie P 24 constitue un marqueur de réplication virale Ø Elle détecte les antigènes solubles produits en même temps que les particules virales lors de la réplication virale Ø La technique est un test ELISA qui met en évidence les antigènes HIV présents dans le sang

Charge virale Ø Dans le sang, évaluation de la charge virale : cellulaire : quantité de virus dans les cellules mononuclées = réservoir de virus plasmatique : quantité de virus libre dans le plasma = marqueur de réplication Ø Ces charges virales cellulaires et plasmatiques peuvent être évaluées par : des techniques de culture en dilution limite abandonnées au profit des techniques de biologie moléculaire Basées sur le principe de la PCR

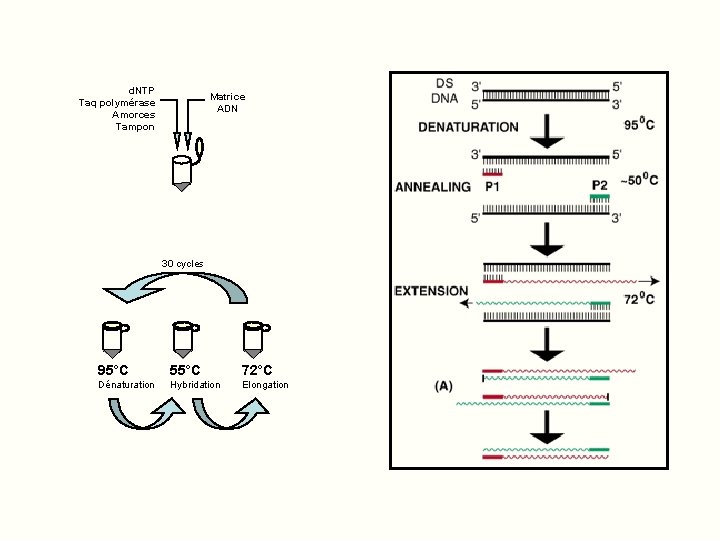
Principe de la PCR Ø Amplification exponentielle d’un ADN cible Ø 20 à 40 cycles d’amplification Ø Chaque cycle comprend 3 étapes: Ø Dénaturation de l’ADN par la chaleur à 95° : séparation des 2 brins Ø Hybridation avec 2 amorces de 10 à 20 nucléotides encadrant la région à amplifier Ø Élongation à partir des amorces grâce à une enzyme thermostable agissant à 72°

d. NTP Taq polymérase Amorces Tampon Matrice ADN 30 cycles 95°C 55°C 72°C Dénaturation Hybridation Elongation

Principe de la PCR

PCR – définitions Ø RT-PCR: la PCR est précédée d’une étape de « réverse transcription » Ø Formation d’un c. DNA Ø Utilisée dans le cas des virus à ARN Ø PCR quantitative: permet d’évaluer le nombre de copies de génome viral Quantification à l’aide d’un standard interne PCR en temps réel : technique utilisée le plus souvent actuellement Ø « nested PCR » ou PCR nichée: consiste à faire suivre une première série de cycles de PCR par une 2° utilisant des amorces situées à l’intérieur du premier fragment amplifié Augmente la sensibilité de la technique

PCR - précautions q Risques de contaminations Problème majeur de ces techniques: contamination par les produits amplifiés d’une manip précédante Ø Bonnes pratiques +++ : précautions dans les manipulations, pièces dédiées, système Ampérase. q Résultats faussement négatifs: Peuvent être liés à la présence de substances inhibitrices dans les prélèvements Ø Techniques d’extraction du matériel génétique avant amplification sont capitales

Quantification de l’ARN VIH plasmatique: = Charge Virale plasmatique Ø Prélèvement de sang sur anticoagulant (EDTA) Ø Centrifugation pour obtenir le plasma Ø Extraction de l’ARN des virus présents dans le plasma Ø RT PCR quantitative: Technique de PCR en temps réel Utilisation d’un standard interne

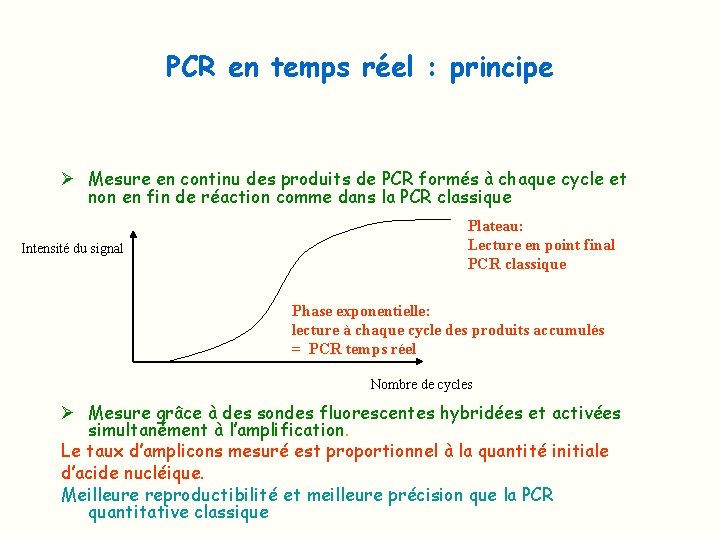
PCR en temps réel : principe Ø Mesure en continu des produits de PCR formés à chaque cycle et non en fin de réaction comme dans la PCR classique Intensité du signal Plateau: Lecture en point final PCR classique Phase exponentielle: lecture à chaque cycle des produits accumulés = PCR temps réel Nombre de cycles Ø Mesure grâce à des sondes fluorescentes hybridées et activées simultanément à l’amplification. Le taux d’amplicons mesuré est proportionnel à la quantité initiale d’acide nucléique. Meilleure reproductibilité et meilleure précision que la PCR quantitative classique

Automatisation de la CV par technique de PCR en temps réel extracteur PCR « temps réel »

Diagnostic virologique d’une infection HIV chez l’adulte

Diagnostic d’infection VIH chez l’adulte q Première étape : dépistage Permet la mise en évidence dans le sang périphérique: Ø des AC spécifiques dirigés contre les protéines de structure du virus Ø de l’antigène p 24 q Deuxième étape : confirmation

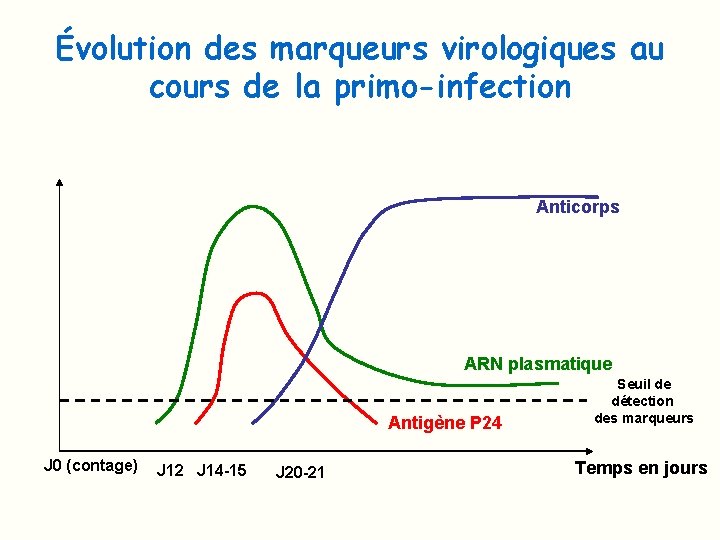
Évolution des marqueurs virologiques au cours de la primo-infection Anticorps ARN plasmatique Antigène P 24 J 0 (contage) J 12 J 14 -15 J 20 -21 Seuil de détection des marqueurs Temps en jours

Détection des différents marqueurs virologiques au cours de la primo-infection J 25 -26: AC anti VIH par WB J 20 -21: AC anti. VIH par ELISA 3° génération ou par test rapide J 15 -16: pic d’Ag P 24 Tests ELISA 4° génération Dure environ 10 jours J 12 -14: ARN plasmatique Charge virale Fenêtre silencieuse J 0 : contage temps

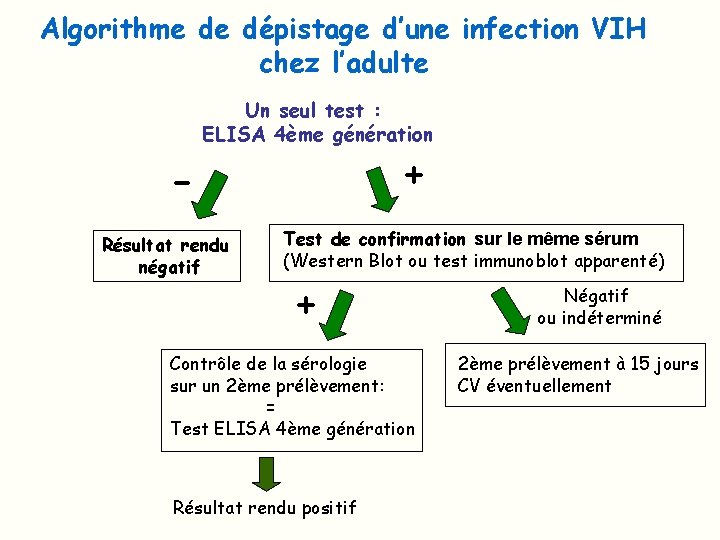
Algorithme de dépistage d’une infection VIH chez l’adulte Un seul test : ELISA 4ème génération + Résultat rendu négatif Test de confirmation sur le même sérum (Western Blot ou test immunoblot apparenté) + Contrôle de la sérologie sur un 2ème prélèvement: = Test ELISA 4ème génération Résultat rendu positif Négatif ou indéterminé 2ème prélèvement à 15 jours CV éventuellement

Interprétation du test de confirmation Ø moins sensible que l’ELISA Ø reste cependant obligatoire pour le diagnostic Ø test de confirmation positif: nouveau dépistage sur un 2° prélèvement obligatoire pour affirmer le diagnostic de séropositivité VIH Ø Test de confirmation indéterminé: plusieurs hypothèses

Test de confirmation indéterminé q Infection par VIH 2 Ø Western blot spécifique VIH 2 q Séroconversion en cours Ø Ag P 24, et surtout actuellement CV Ø Évolutivité des tests AC sur un 2° prélèvement 15 jours plus tard q Réactivité non spécifique Ø Seulement après avoir éliminé les autres hypothèses

Règles à respecter pour le dépistage q Test de dépistage est obligatoirement un test ELISA de 4ème génération q Consentement obligatoire q confidentialité absolue q Dépistage obligatoire pour : don de sang, de sperme, de tissu ou d’organe

Utilisation des tests Ag P 24 et CV Dans le cas particulier du diagnostic de la primoinfection: Le diagnostic n’est plus uniquement une recherche d’anticorps: > Mise en évidence du virus lui-même Ø Ag P 24: positif 15 à 16 jours après le contage durée du pic d’antigénémie: environ 10 jours valeur prédictive positive très élevée effectuée en même temps que la recherche d’AC dans le test de dépistage Ø ARN VIH plasmatique (= « charge virale » ) marqueur le plus précoce: 13 à 14 jours après le contage reste souvent positif en l’absence de traitement

Suivi virologique d’un patient infecté par le VIH 2 techniques virologiques sont utilisées en routine pour le suivi des sujets infectés: Ø Charge virale Ø Test de résistance génotypique

Patient infecté par VIH Ø Le taux de CD 4+ représente: q La distance qui sépare le véhicule du précipice 1000 Charge virale 10 0 00 10 Ø La charge représente: q La vitesse du véhicule Ø La réponse immunitaire et le traitement anti-rétroviral représentent: q Les freins 00 Taux de CD 4+ 1000 800 400 200 100 00

Charge virale plasmatique La charge virale représente: Ø Un marqueur pronostic ØUn marqueur permettant de suivre l’évolution de la maladie ØUn marqueur permettant de suivre l’efficacité d’un traitement antirétroviral

Suivi virologique d’un patient infecté par VIH Ø patient non traité ==> Charge virale tous les 4 à 6 mois si CD 4 > 500/mm 3 ==> Charge virale tous les 3 mois si CD 4 < 550/mm 3 Ø Mise sous traitement -Test génotypique de résistance - CV initiale Suivi de l’efficacité du traitement CV 1 mois après le début du traitement puis tous les 3 mois la 1° année Le but est d’obtenir une CV indétectable (<50 copies/ml) Ø au-delà d’un an de TRT: CV tous les 3 à 6 mois selon la clinique et les CD 4 Echappement virologique = CV redevient détectable tests de résistance aux ARV (et dosages pharmaco)

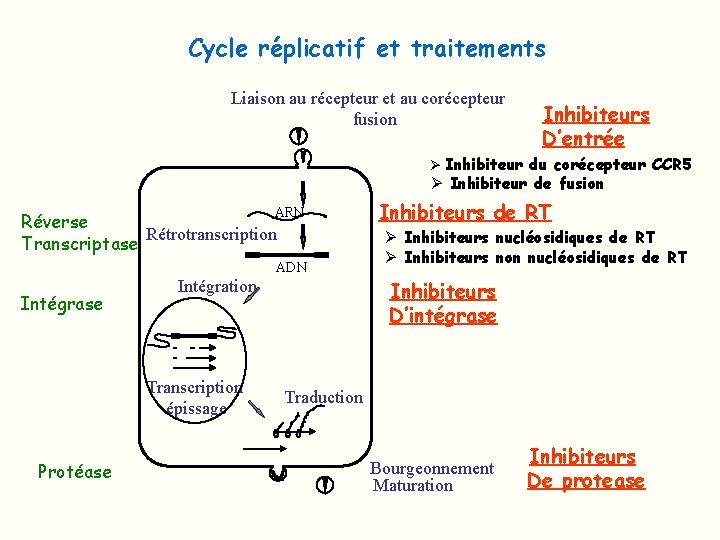
Cycle réplicatif et traitements Liaison au récepteur et au corécepteur fusion Inhibiteurs D’entrée Ø Inhibiteur du corécepteur CCR 5 Ø Inhibiteur de fusion ARN Réverse Rétrotranscription Transcriptase ADN Intégrase Intégration Transcription épissage Protéase Inhibiteurs de RT Ø Inhibiteurs nucléosidiques de RT Ø Inhibiteurs non nucléosidiques de RT Inhibiteurs D’intégrase Traduction Bourgeonnement Maturation Inhibiteurs De protease

Le VIH a une tendance naturelle à la mutation Multiplicité des cycles de réplication (1 à 10 milliards de particules /jour) + Grande variabilité au cours de la réplication = Variants génétiquement distincts provenant du virus initial contaminant (quasi-espèces)

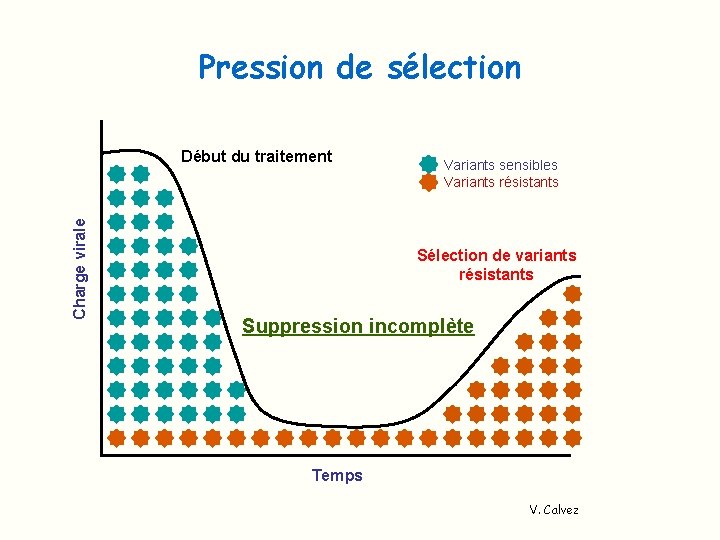
Phénomène de résistance Lié à des mutations entraînant une diminution de l’affinité de l’enzyme pour son inhibiteur Ø Préexistence des virus mutés chez les patients non traités Variabilité génétique importante des VIH q taux d’erreur important de la RT lors de la réplication q dynamique élevée de la réplication virale (109 particules/jour) --> population existe sous forme de quasi-espèces Ø Emergence des virus mutés résistants sous la pression de sélection thérapeutique

Pression de sélection Charge virale Début du traitement Variants sensibles Variants résistants Sélection de variants résistants Suppression incomplète Temps V. Calvez

Mesure de la résistance En routine, la mesure de la résistance est effectuée par la mise en évidence des mutations génétiques au niveau des sites d’action des médicaments = Résistance Génotypique Ce test de résistance est pratiqué chez les patients VIH traités et qui ont un échappement au traitement

Tests génotypiques Séquençage des gènes codant pour la RT, la protéase et l’intégrase : Pour les inhibiteurs de RT, Inhibiteurs de protéase, Inhibiteurs d’intégrase Séquençage du gène codant pour la gp 41 Pour les inhibiteurs de fusion Rétrotranscription de l'ARN viral PCR grâce à une enzyme thermostable 2ème PCR Séquençage du fragment PCR avec différent oligonucléotides Séparation des brins synthétisés par chromatographie Lecture de la séquence sur un séquenceur automatique

Séquenceur automatique

Lecture et interprétation des séquences

Tests génotypiques Ø Comparaison avec la séquence d’une souche de référence non mutée Ø Mise en évidence des mutations connues pour être associées à la résistance à un médicament Ø Rendu des résultats pour chaque médicament grâce à des algorithmes d’interprétation des mutations Ces algorithmes sont élaborés d’après les résultats des études cliniques (corrélations mutations/échec au médicament) Ø Adaptation du traitement anti-rétroviral en fonction des résistances

 Fiche projet type
Fiche projet type Carnet de suivi des apprentissages maternelle
Carnet de suivi des apprentissages maternelle Carnet de suivi des apprentissages cycle 1
Carnet de suivi des apprentissages cycle 1 Registre de suivi des déchets
Registre de suivi des déchets Des des des
Des des des Diagnostic et redressement des entreprises en difficulté
Diagnostic et redressement des entreprises en difficulté Livret devoirs faits
Livret devoirs faits Jai suivi
Jai suivi Matrice de suivi-évaluation
Matrice de suivi-évaluation E suivi de deux consonnes
E suivi de deux consonnes Projet suivi communautaire
Projet suivi communautaire Suivi de cohorte
Suivi de cohorte Kuehne nagel suivi
Kuehne nagel suivi Fiche suivi projet
Fiche suivi projet Application suivi diabete gestationnel
Application suivi diabete gestationnel Suivi vd
Suivi vd Tableau de bord suivi et évaluation
Tableau de bord suivi et évaluation Suivi évaluation
Suivi évaluation Pyramide poire écrasée
Pyramide poire écrasée Suivi du contenu
Suivi du contenu Matrice de suivi-évaluation
Matrice de suivi-évaluation Dicom suivi
Dicom suivi Budget des ventes
Budget des ventes Il existe des personnes qui sont des lumières pour tous
Il existe des personnes qui sont des lumières pour tous Volume d un corps
Volume d un corps Je t'offrirai des fleurs et des nappes en couleurs
Je t'offrirai des fleurs et des nappes en couleurs Modes verbaux
Modes verbaux Mesure de niveaux pour liquides et solides
Mesure de niveaux pour liquides et solides Robin des bois des alpes
Robin des bois des alpes Affiche propagande guerre froide
Affiche propagande guerre froide Cartographie des flux de valeur
Cartographie des flux de valeur Double des in cryptography
Double des in cryptography La diffusion des idées des lumières
La diffusion des idées des lumières Diversification des espaces et des acteurs de la production
Diversification des espaces et des acteurs de la production Stadium hiv
Stadium hiv Aids 101
Aids 101 Procentowe ryzyko zakażenia hiv
Procentowe ryzyko zakażenia hiv Simon collins hiv
Simon collins hiv Que hora é agora
Que hora é agora Chapter 25 sexually transmitted infections and hiv/aids
Chapter 25 sexually transmitted infections and hiv/aids Procentowe ryzyko zakażenia hiv
Procentowe ryzyko zakażenia hiv Hiv
Hiv Hiv
Hiv Hiv diagnostics conference
Hiv diagnostics conference Chii chinonzi hiv
Chii chinonzi hiv Főember az úton kocsi rázza
Főember az úton kocsi rázza Arv copenhagen
Arv copenhagen Sumptoms of hiv
Sumptoms of hiv Hiv lifecycle
Hiv lifecycle Retrovrus
Retrovrus Types of hiv counselling
Types of hiv counselling