HIU NG IN T 1 HIU NG IN










- Slides: 39

HIỆU ỨNG ĐIỆN TỬ 1

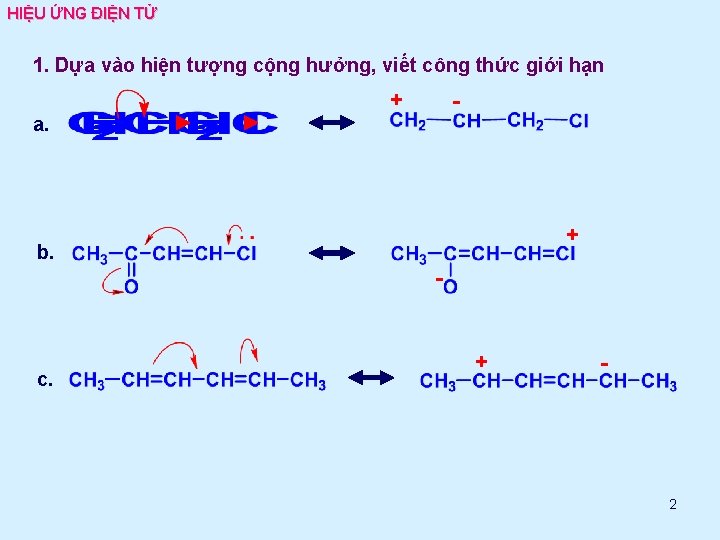
HIỆU ỨNG ĐIỆN TỬ 1. Dựa vào hiện tượng cộng hưởng, viết công thức giới hạn - + a. + b. - c. + - 2

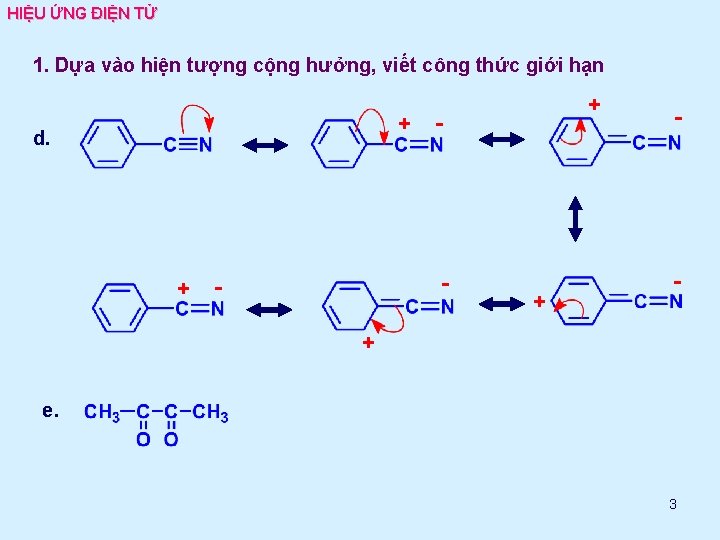
HIỆU ỨNG ĐIỆN TỬ 1. Dựa vào hiện tượng cộng hưởng, viết công thức giới hạn + - - + d. - - - + + + e. 3

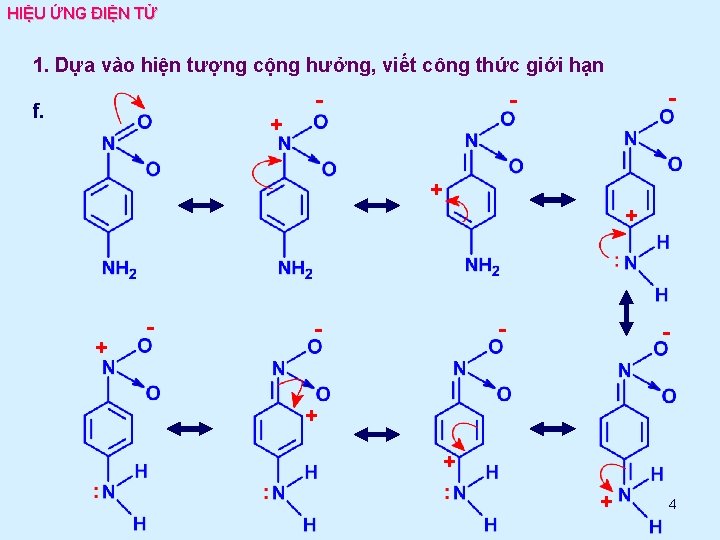
HIỆU ỨNG ĐIỆN TỬ 1. Dựa vào hiện tượng cộng hưởng, viết công thức giới hạn - - - f. + + - - + + + 4

HIỆU ỨNG ĐIỆN TỬ 1. Dựa vào hiện tượng cộng hưởng, viết công thức giới hạn g. + + - 5

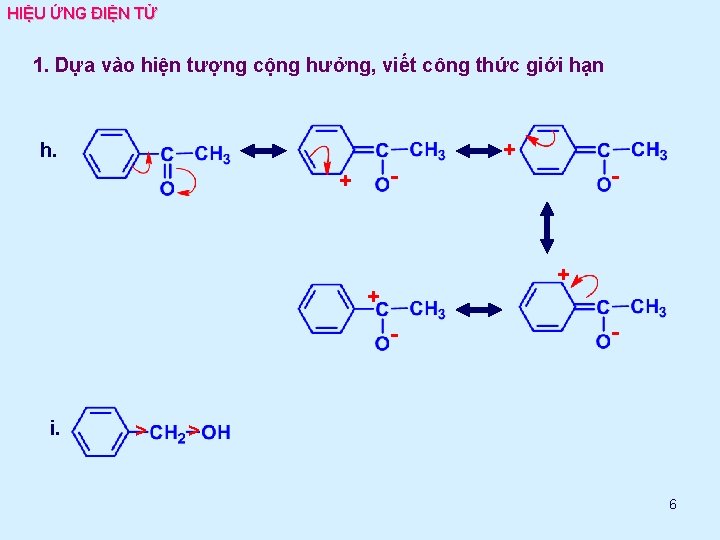
HIỆU ỨNG ĐIỆN TỬ 1. Dựa vào hiện tượng cộng hưởng, viết công thức giới hạn h. + - + + - i. > - > 6

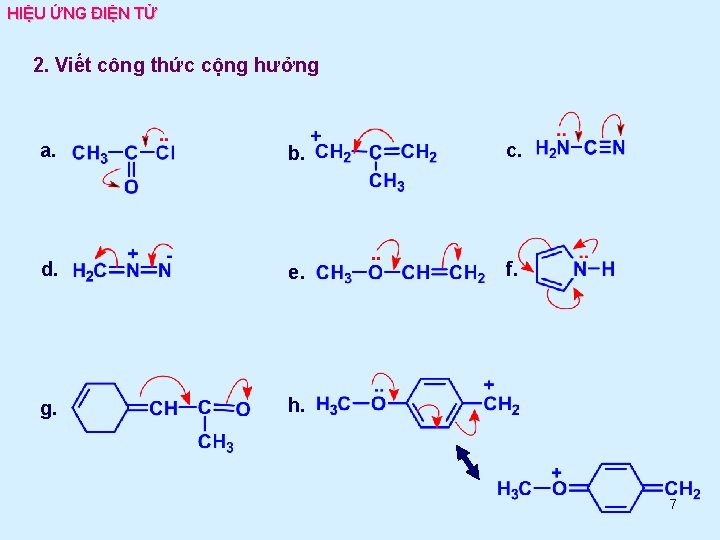
HIỆU ỨNG ĐIỆN TỬ 2. Viết công thức cộng hưởng a. b. c. d. e. f. g. h. 7

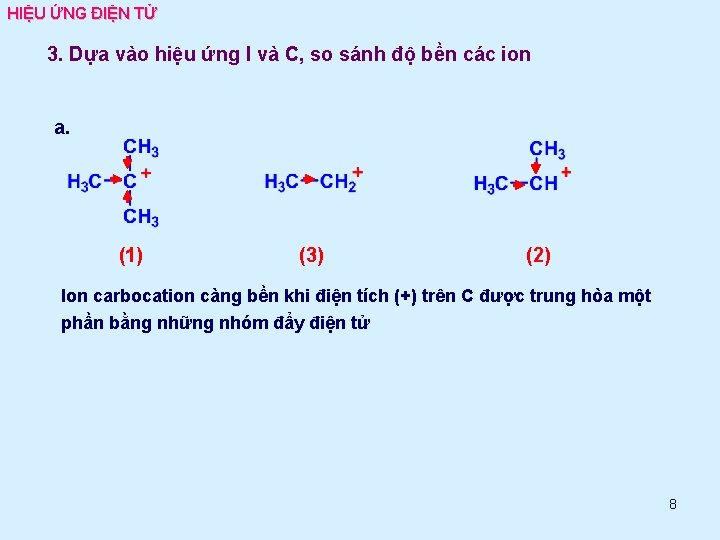
HIỆU ỨNG ĐIỆN TỬ 3. Dựa vào hiệu ứng I và C, so sánh độ bền các ion a. (1) (3) (2) Ion carbocation càng bền khi điện tích (+) trên C được trung hòa một phần bằng những nhóm đẩy điện tử 8

HIỆU ỨNG ĐIỆN TỬ 3. Dựa vào hiệu ứng I và C, so sánh độ bền các ion b. (3) (1) (2) Hiệu ứng cộng hưởng của đôi điện tử p trên O và N nên 2 ion này bền hơn N có độ âm điện nhỏ hơn O cho điện tử dễ hơn cộng hưởng xảy ra dễ hơn O bền hơn 9

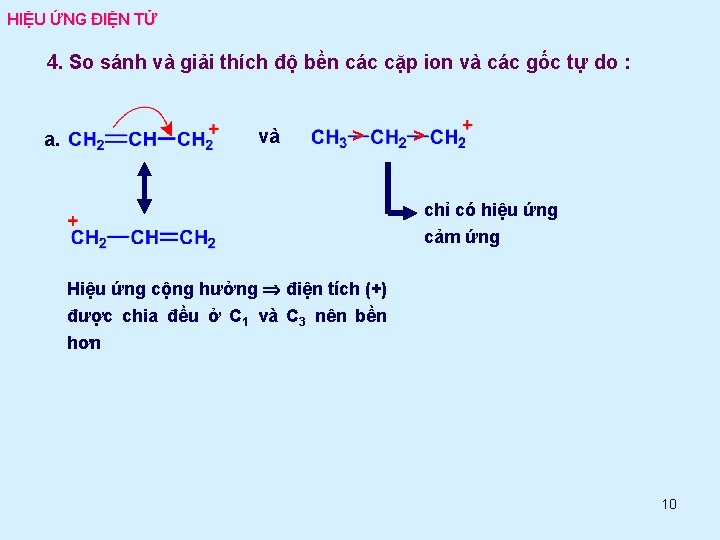
HIỆU ỨNG ĐIỆN TỬ 4. So sánh và giải thích độ bền các cặp ion và các gốc tự do : a. và > > chỉ có hiệu ứng cảm ứng Hiệu ứng cộng hưởng điện tích (+) được chia đều ở C 1 và C 3 nên bền hơn 10

HIỆU ỨNG ĐIỆN TỬ 4. So sánh và giải thích độ bền các cặp ion và các gốc tự do : b. và Điện tích (-) sẽ âm thêm Điện tích (-) trên C được chia do hiệu ứng cảm ứng đều cho C 1 và C 3 bền hơn 11

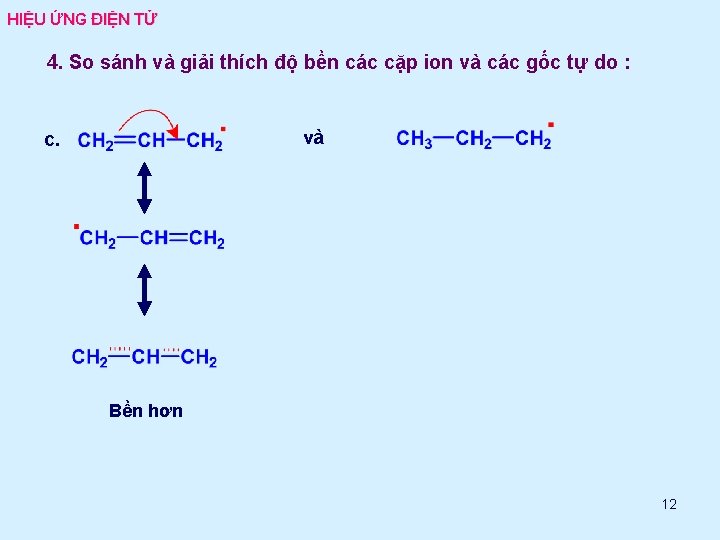
HIỆU ỨNG ĐIỆN TỬ 4. So sánh và giải thích độ bền các cặp ion và các gốc tự do : và c. Bền hơn 12

HIỆU ỨNG ĐIỆN TỬ 5. Sắp xếp độ mạnh tăng dần tính acid a. < (+C) > < (+I) < < (-C) Nhóm đẩy e : đôi e hóa trị giữa O-H ít lệch về phía O hơn tính acid giảm Nhóm rút e : đôi e hóa trị lệch về phía O hơn tính acid tăng 13

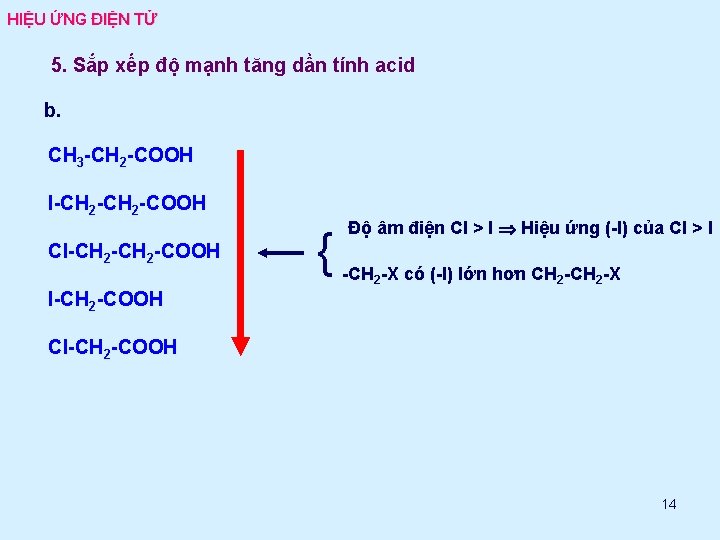
HIỆU ỨNG ĐIỆN TỬ 5. Sắp xếp độ mạnh tăng dần tính acid b. CH 3 -CH 2 -COOH I-CH 2 -COOH Cl-CH 2 -COOH { Độ âm điện Cl > I Hiệu ứng (-I) của Cl > I -CH 2 -X có (-I) lớn hơn CH 2 -X I-CH 2 -COOH Cl-CH 2 -COOH 14

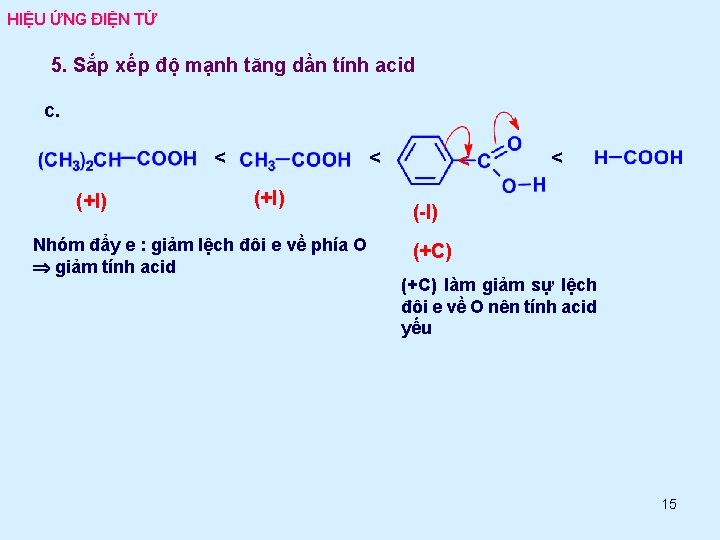
HIỆU ỨNG ĐIỆN TỬ 5. Sắp xếp độ mạnh tăng dần tính acid c. < (+I) Nhóm đẩy e : giảm lệch đôi e về phía O giảm tính acid < < (-I) (+C) làm giảm sự lệch đôi e về O nên tính acid yếu 15

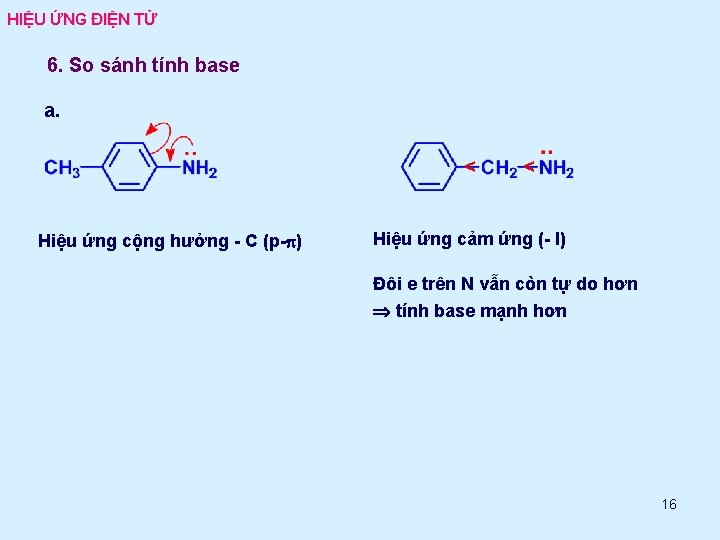
HIỆU ỨNG ĐIỆN TỬ 6. So sánh tính base a. < Hiệu ứng cộng hưởng - C (p-p) < Hiệu ứng cảm ứng (- I) Đôi e trên N vẫn còn tự do hơn tính base mạnh hơn 16

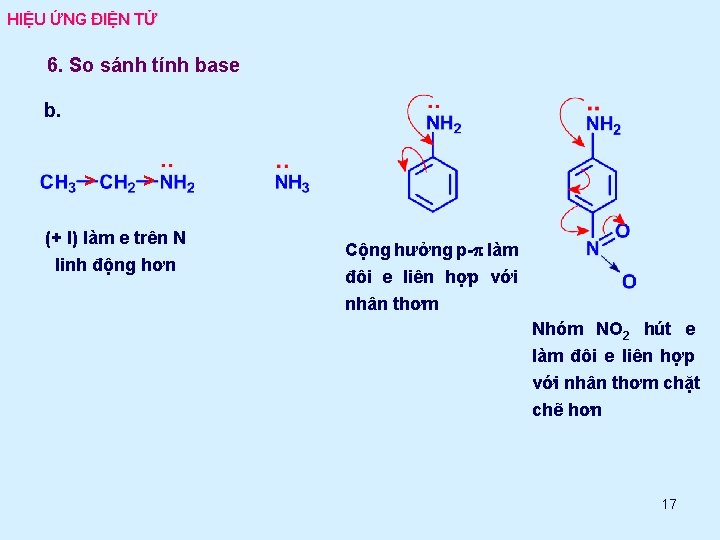
HIỆU ỨNG ĐIỆN TỬ 6. So sánh tính base b. > > (+ I) làm e trên N linh động hơn Cộng hưởng p-p làm đôi e liên hợp với nhân thơm Nhóm NO 2 hút e làm đôi e liên hợp với nhân thơm chặt chẽ hơn 17

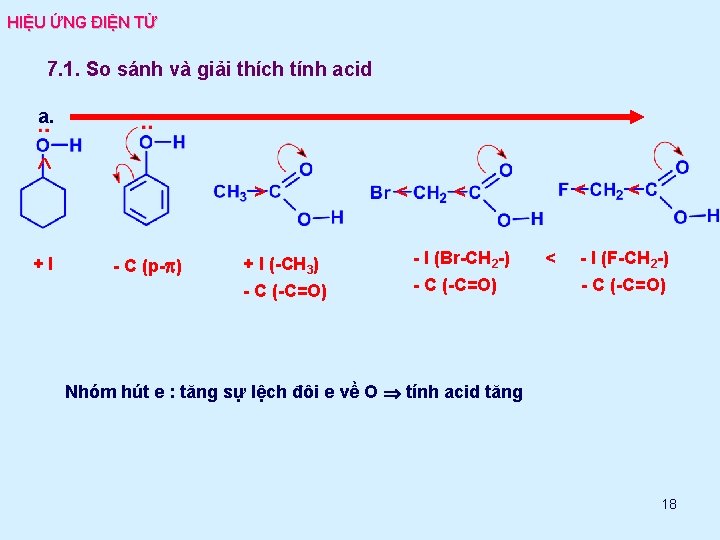
HIỆU ỨNG ĐIỆN TỬ 7. 1. So sánh và giải thích tính acid a. > +I - C (p-p) + I (-CH 3) - C (-C=O) < < < - I (Br-CH 2 -) - C (-C=O) < < - I (F-CH 2 -) - C (-C=O) Nhóm hút e : tăng sự lệch đôi e về O tính acid tăng 18

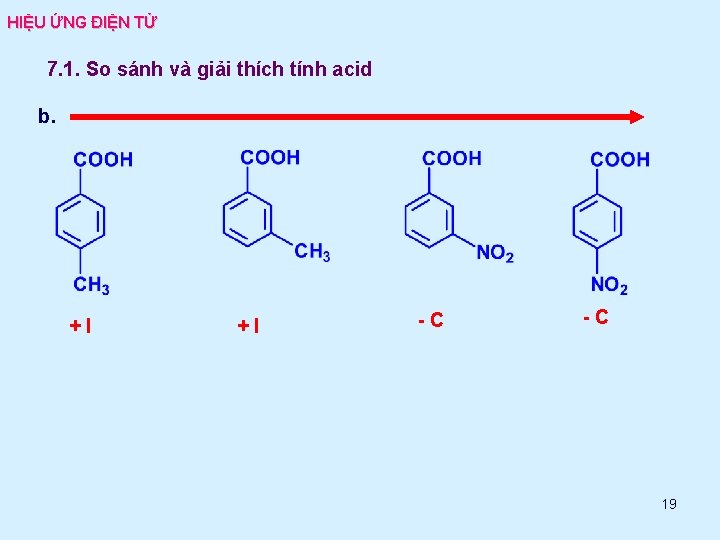
HIỆU ỨNG ĐIỆN TỬ 7. 1. So sánh và giải thích tính acid b. +I +I -C -C 19

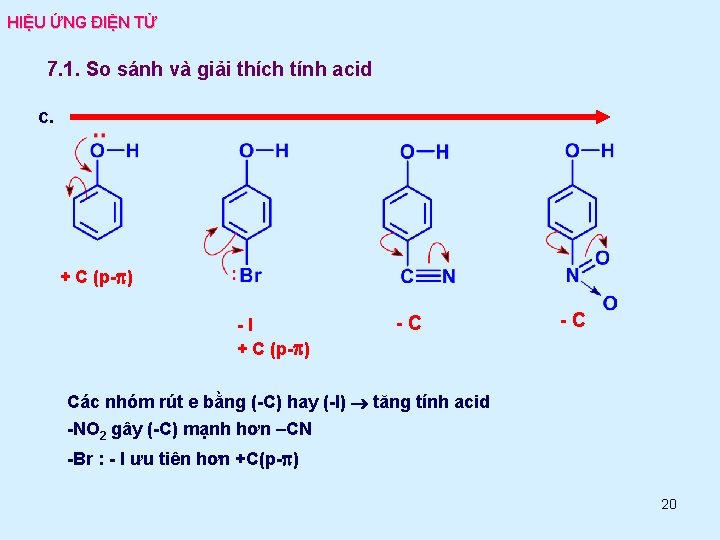
HIỆU ỨNG ĐIỆN TỬ 7. 1. So sánh và giải thích tính acid c. + C (p-p) -I + C (p-p) -C -C Các nhóm rút e bằng (-C) hay (-I) tăng tính acid -NO 2 gây (-C) mạnh hơn –CN -Br : - I ưu tiên hơn +C(p-p) 20

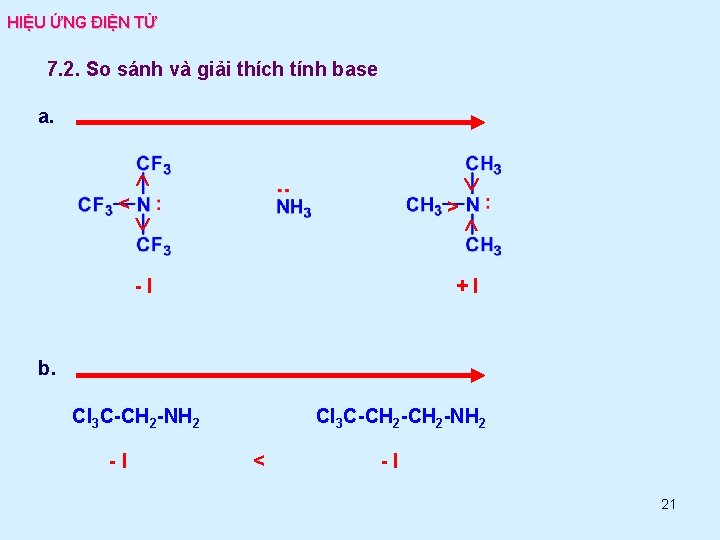
HIỆU ỨNG ĐIỆN TỬ 7. 2. So sánh và giải thích tính base a. < > -I +I b. Cl 3 C-CH 2 -NH 2 -I Cl 3 C-CH 2 -NH 2 < -I 21

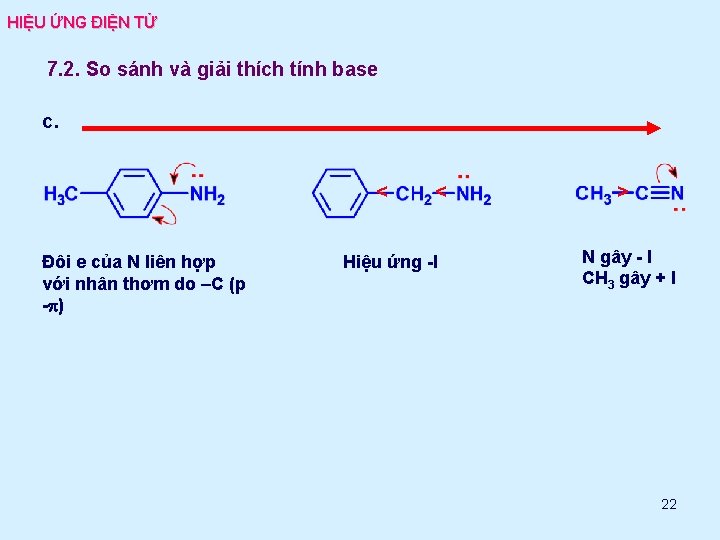
HIỆU ỨNG ĐIỆN TỬ 7. 2. So sánh và giải thích tính base c. < Đôi e của N liên hợp với nhân thơm do –C (p -p) < Hiệu ứng -I > N gây - I CH 3 gây + I 22

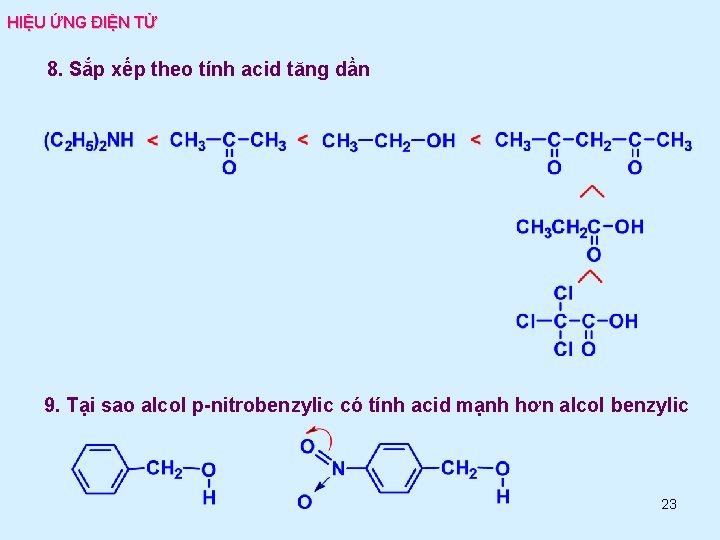
HIỆU ỨNG ĐIỆN TỬ 8. Sắp xếp theo tính acid tăng dần 9. Tại sao alcol p-nitrobenzylic có tính acid mạnh hơn alcol benzylic 23

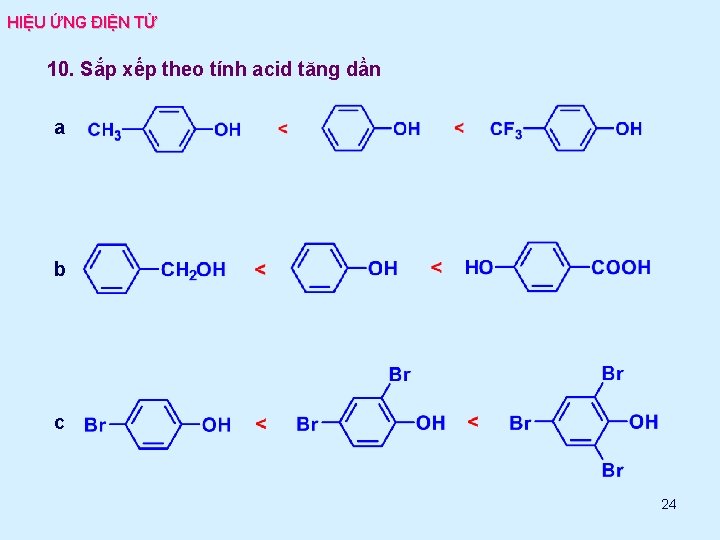
HIỆU ỨNG ĐIỆN TỬ 10. Sắp xếp theo tính acid tăng dần a b c 24

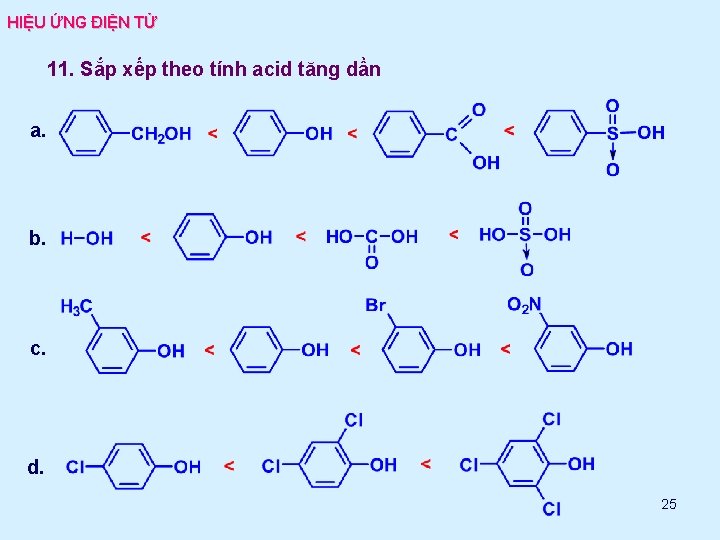
HIỆU ỨNG ĐIỆN TỬ 11. Sắp xếp theo tính acid tăng dần a. b. c. d. 25

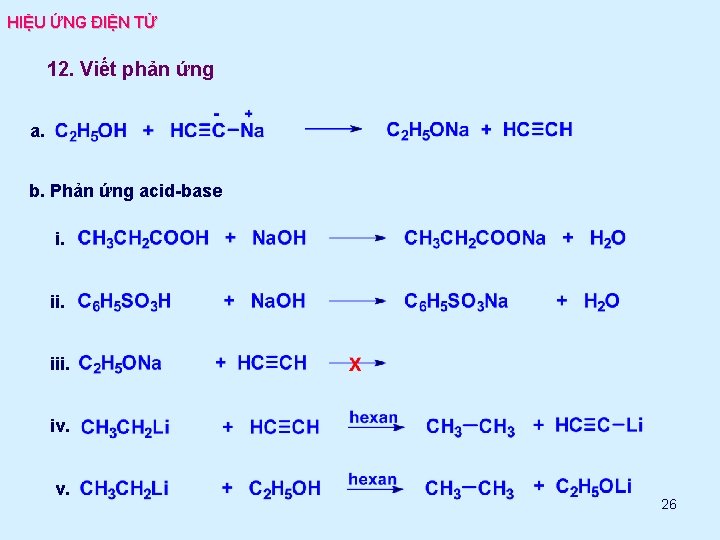
HIỆU ỨNG ĐIỆN TỬ 12. Viết phản ứng a. b. Phản ứng acid-base i. iii. iv. v. 26

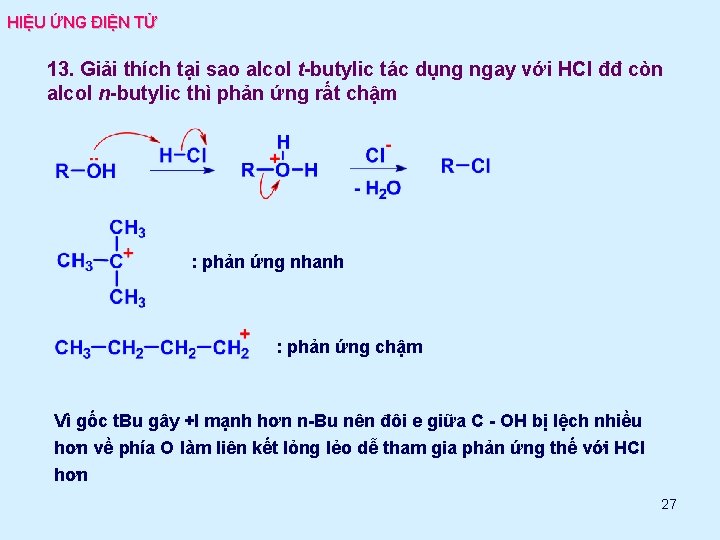
HIỆU ỨNG ĐIỆN TỬ 13. Giải thích tại sao alcol t-butylic tác dụng ngay với HCl đđ còn alcol n-butylic thì phản ứng rất chậm : phản ứng nhanh : phản ứng chậm Vì gốc t. Bu gây +I mạnh hơn n-Bu nên đôi e giữa C - OH bị lệch nhiều hơn về phía O làm liên kết lỏng lẻo dễ tham gia phản ứng thế với HCl hơn 27

HIỆU ỨNG ĐIỆN TỬ 14. Giải thích tại sao ion acetat bền hơn etylat > 28

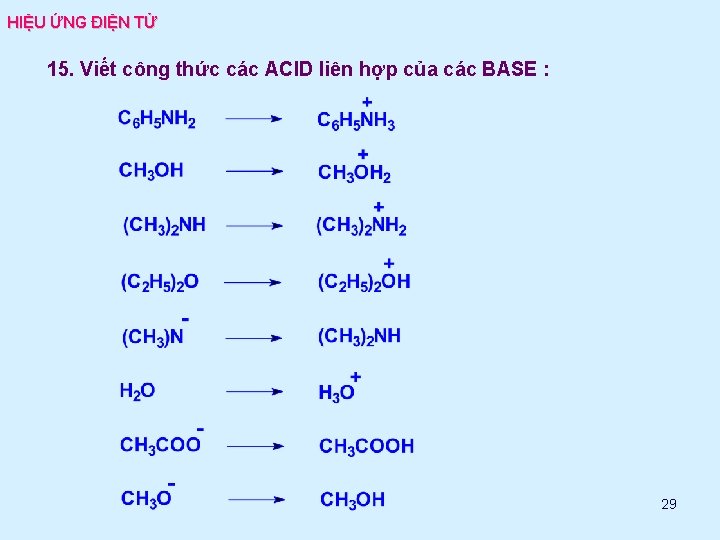
HIỆU ỨNG ĐIỆN TỬ 15. Viết công thức các ACID liên hợp của các BASE : 29

HIỆU ỨNG ĐIỆN TỬ 16. Viết công thức các BASE liên hợp của các ACID : 30

HIỆU ỨNG ĐIỆN TỬ 17 a. Sắp xếp theo tính acid giảm dần Độ âm điện O > N > C nên tính acid alcol > amin > alkan Tính base tăng dần của các base liên hợp : 31

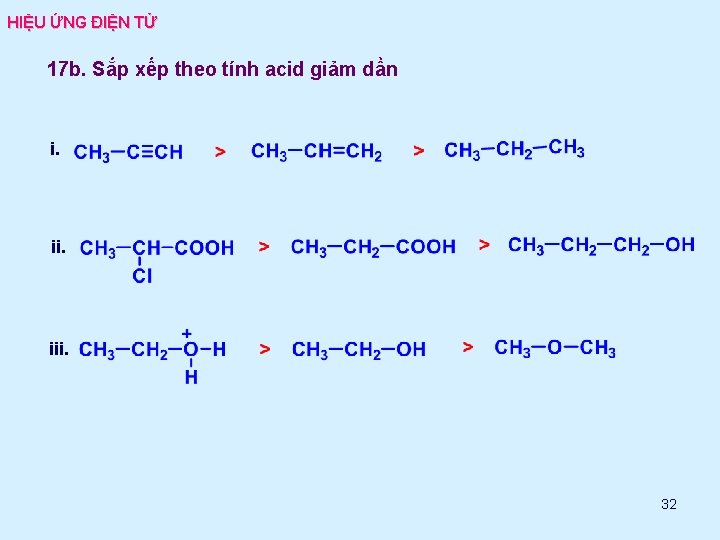
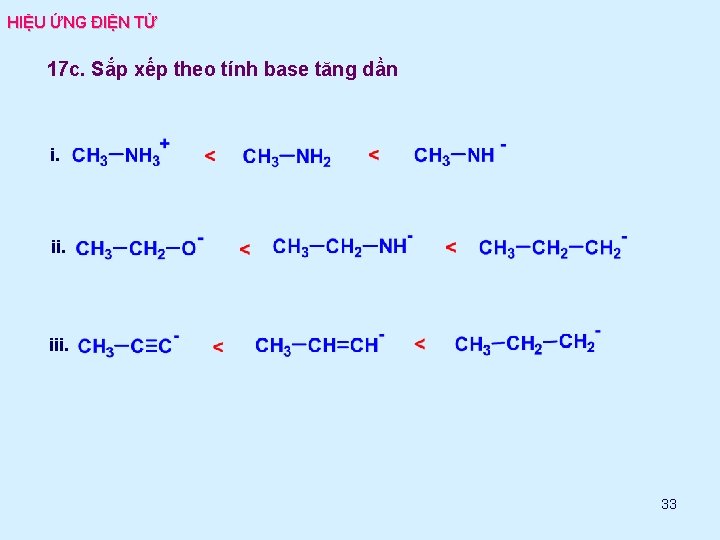
HIỆU ỨNG ĐIỆN TỬ 17 b. Sắp xếp theo tính acid giảm dần i. iii. 32

HIỆU ỨNG ĐIỆN TỬ 17 c. Sắp xếp theo tính base tăng dần i. iii. 33

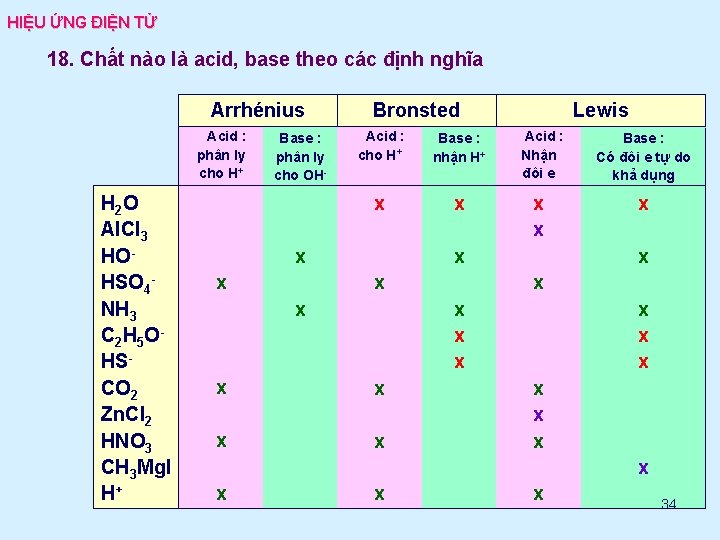
HIỆU ỨNG ĐIỆN TỬ 18. Chất nào là acid, base theo các định nghĩa Arrhénius Acid : phân ly cho H+ H 2 O Al. Cl 3 HOHSO 4 NH 3 C 2 H 5 O HSCO 2 Zn. Cl 2 HNO 3 CH 3 Mg. I H+ Base : phân ly cho OH- Bronsted Acid : cho H+ Base : nhận H+ Acid : Nhận đôi e Base : Có đôi e tự do khả dụng x x x x Lewis x x x x x x 34

HIỆU ỨNG ĐIỆN TỬ 19. Chỉ rõ chất tác động như một acid và chất tác động như một base acid a. b. c. d. e. f. 35

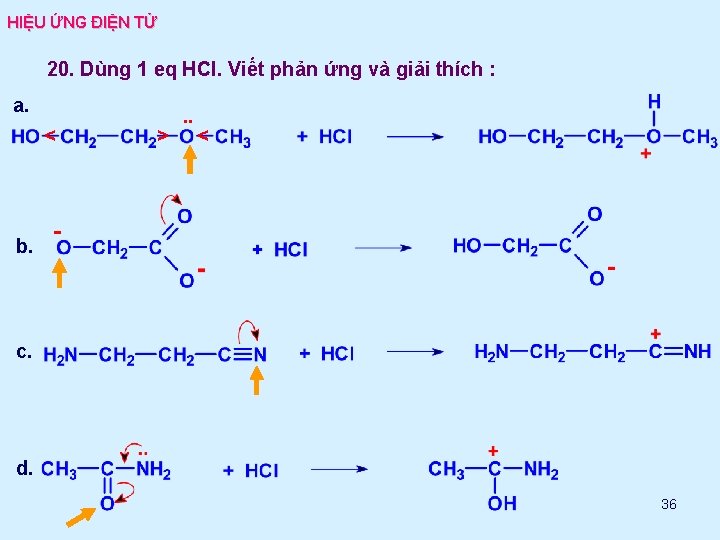
HIỆU ỨNG ĐIỆN TỬ 20. Dùng 1 eq HCl. Viết phản ứng và giải thích : a. < > . . < b. c. d. 36

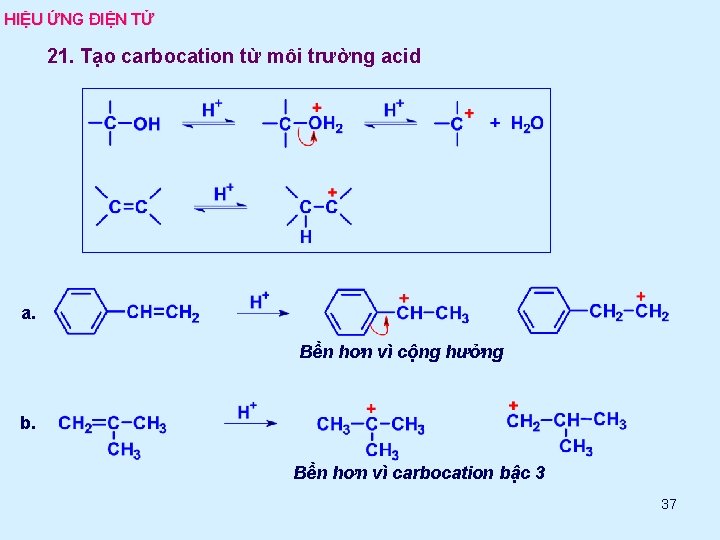
HIỆU ỨNG ĐIỆN TỬ 21. Tạo carbocation từ môi trường acid a. Bền hơn vì cộng hưởng b. Bền hơn vì carbocation bậc 3 37

HIỆU ỨNG ĐIỆN TỬ 21. Tạo carbocation từ môi trường acid Bền hơn vì carbocation bậc 3 c. d. e. Bền hơn vì cộng hưởng 38

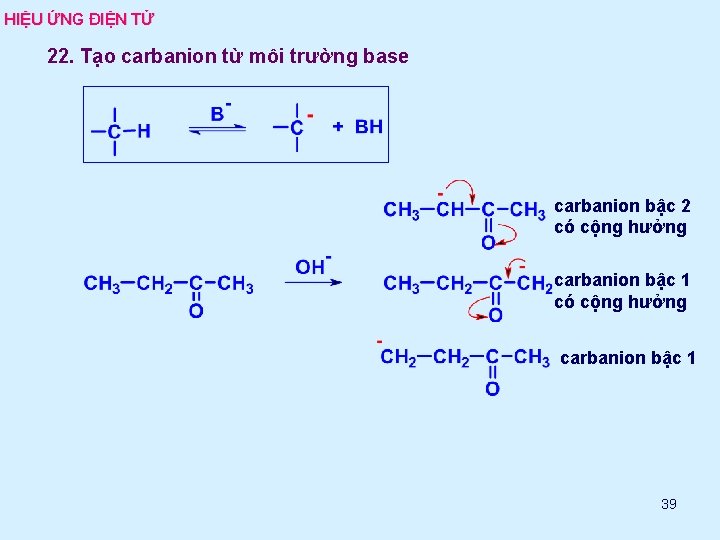
HIỆU ỨNG ĐIỆN TỬ 22. Tạo carbanion từ môi trường base carbanion bậc 2 có cộng hưởng carbanion bậc 1 39



























