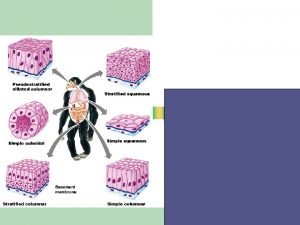
Histoteknik Dasar TIM HISTOLOGI VETERINER 2014 Histoteknik adalah














































- Slides: 51

Histoteknik Dasar TIM HISTOLOGI VETERINER 2014

Histoteknik adalah metoda membuat sajian histologi dari spesimen tertentu melalui suatu rangkaian proses hingga menjadi sajian yang siap untuk dianalisis. Sumber Jaringan: 1. Manusia 2. Hewan

Rangkaian Proses 1. Pengawetan (Fixation); 2. Dehidrasi (Dehydration); 3. Pembeningan (Clearing); 4. Pembenaman (Infiltration/Impregnation/Embedding); 5. Pengecoran (Blocking/Casting); 6. Pengirisan Jaringan (Sectioning); 7. Pewarnaan (Staining); 8. Perekatan (Mounting); 9. Pelabelan (Labelling)

1. Pengawetan Efek fiksasi terhadap jaringan yang diproses: 1. Menghambat proses pembusukan dan autolisis 2. Pengawetan jaringan 3. Pengerasan jaringan 4. Pemadatan koloid 5. Differensiasi optik 6. Pengaruh terhadap pewarnaan Cara melakukan fiksasi: 1. Supravital/intravital; 2. Merendam dalam larutan fiksatif.

Hal-hal yang harus diperhatikan dalam fiksasi jaringan histologi adalah: 1. Tebal irisan. 2. Volume larutan pengawet. 3. Jenis larutan pengawet.

Kelompok Zat Pengawet • Formaldehyde – Formaldehyde (Formalin), Paraformaldehyde, Glutaraldehyde, • Picrates – Picric Acid Bouin’s Solution • Mercurials – Helly ‘s Fluid (Zenker Formol) • Oxidizing Agents – Osmium tetroxide • Alcohol – Methanol, Alcohol (etanol) • Potassium Dichromate – Muller

JENIS CAIRAN FIKSATIF FORMALIN MULLER BOUIN CARNOY ZENKER FORMAL (CAIRAN HELLY) ETANOL ASAM ASETAT-ALKOHOL-FORMALIN (TELLYESNICZKY) • dll • •

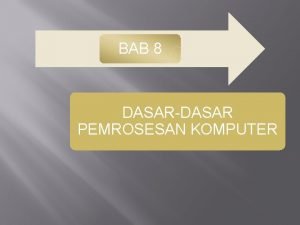
FORMALIN • Yg digunakan adalah bentuk monomer: dibuat dengan menetralkan/alkalis larutan • Mengakibatkan crosslink protein • Formal saline, formal calcium, 10% neutral buffered formalin, buffer formalin sukrosa • Kelebihan dan kekurangan

Human, 10% Formalin, HE 612 x

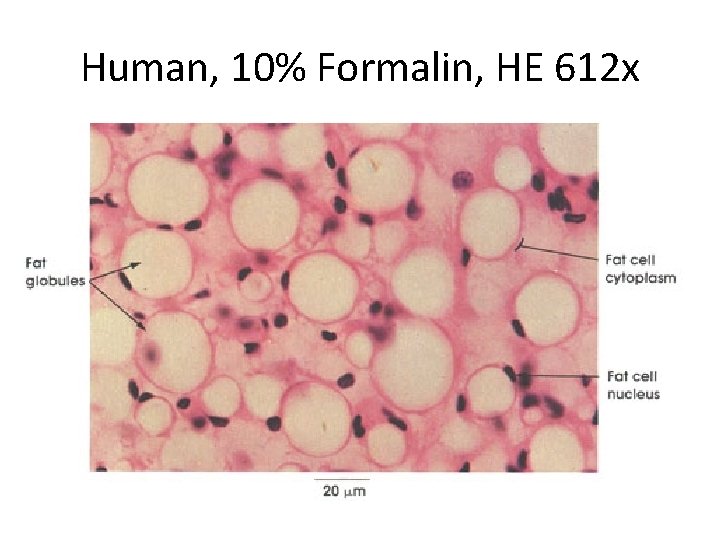
BOUIN • Mengandung asam pikrat, meledak kalau kering • Mudah dikenali saat pemotongan warna kuning • Mempunyai daya penetrasi yang cepat dan merata • Jaringan mengalami pengerutan

Rat, Bouin’s Solution, HE, Testis 400 x

Zenker Formol (Cairan Helly) • Mengandung merkuri klorida • Daya fiksasinya cepat dan kuat, tetapi kecepatan penetrasinya berkurang setelah meresap sejauh beberapa milimeter pertama dan potongan jaringan yang melebihi ketebalan 5 mm pada umumnya cenderung untuk menjadi keras (rapuh), overfixed di bagian pinggir sementara di bagian tengah menjadi lunak karena underfixed • Fiksatif ini sangat baik untuk fiksasi sumsum tulang dan limpa, mitochondria.

Rat, Helly Fluid, HE 162 x

Etanol • • Cytological fixatives Etanol 95% Digunakan untuk Pap test, swab Mempertahankan antigenisitas cocok IHC


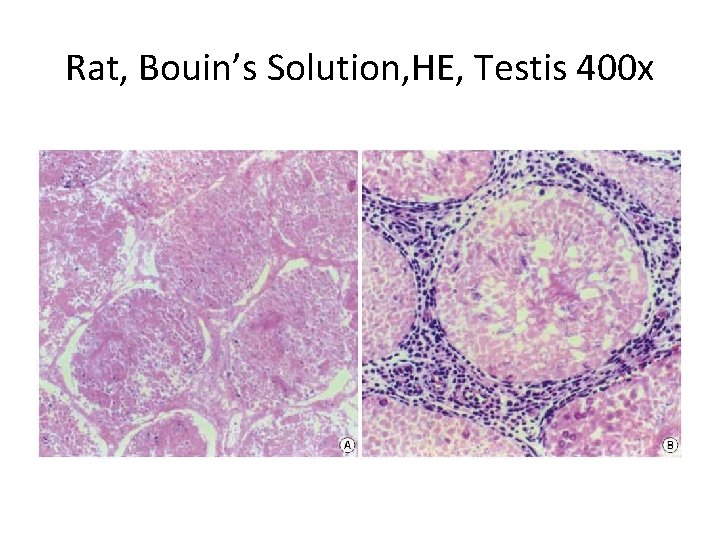
LARUTAN CARNOY • mengawetkan substansia Nissl dan glikogen • daya penetrasi yang cepat • Fiksasi ini sering digunakan apabila suatu diagnosis perlu ditegakkan dengan cepat, misalnya untuk diagnosis kanker pada saat pembedahan. Fiksasi umumnya selesai setelah 1 -2 jam, sedangkan potongan kecil selesai difiksasi dalam 15 menit. • efek pengerutan: kuat

Mus musculus, Carnoy, Liver

Pasca fiksasi, jaringan yang keras mendapat perlakuan khusus • Tulang: dekalsifikasi formic acid 8% • Kulit: teknik lendrum • Cuci dengan air kran mengalir/alkohol 90% • Fenol 4% dalam akuades (v/v) selama 1 -3 hari

dehidrasi • Tahapan dehidrasi • Cara I – Alkohol 70% 3 hari ( 3 x ganti) – Alkohol 95% 3 hari ( 3 x ganti) – Alkohol 100% 3 hari ( 3 x ganti) • Cara II – Alkohol 70%, 80%, 90%, masing-masing 1 hari; – Alkohol 95% 2 hari ( 2 x ganti); – Alkohol 100 % 2 hari ( 2 x ganti). • Sukrosa 20% (untuk cryostat): Sukrosa 20% selama 2 hari; • Metanol: jarang digunakan tetapi dapat digunakan seperti etanol; • Aseton : 3 x 20 menit.

PEMBENINGAN (CLEARING) • Bahan yang digunakan : – Cedar wood oil; – Chloroform; – Benzene/benzol; – Benzyl benzoat; – Methyl benzoat; – Xylene/xylol; – Toluene

Cedar Wood Oil • Keuntungan • Sifat clearing-nya paling baik. • Tak mengeraskan jaringan – Jaringan yang halus sangat baik. – Kadang digunakan untuk jaringan keras (kulit dan jaringan ikat padat) • Dapat disimpan dalam waktu lama (berbulan)

Chloroform • Keuntungan : – Paling sering dipakai • Bersifat toleran (dapat disimpan semalaman tanpa menjadi keras) • Kerugian – Titik akhir tak dapat dilihat dengan mata • Saat menjadi bening dan transparan tak jelas • Cara mengatasi : waktu pembeningan diperpanjang – Lebih mahal dari xylene dan benzene tetapi lebih murah dari cedar wood oil.

Benzyl Benzoate • Metoda : • Benzyl benzoat I selama 24 jam hingga jaringan tenggelam. Jaringan menjadi bening dan transparan. • Benzyl benzoat II selama 2 -3 jam. • Benzol-Paraffin selama ½ - 1 jam. Campuran benzol dan paraffin cair dengan perbandingan sama. • Masukkan ke dalam paraffin cair.

Methyl Benzoate • Metode : • Methyl benzoat I sampai jaringan tenggelam. – Daya penetrasi lebih cepat dari benzol benzoat; – Jaringan mudah rapuh. • Methyl benzoat II selama 1 -2 jam. • Benzol-Paraffin. Campuran benzol dan paraffin dengan perbandingan sama. • Masukkan ke dalam paraffin cair.

Benzene dan Xylene • Keuntungan – Waktu clearing cepat : ½ - 1 jam. – Benzene lebih lambat dari xylene tetapi kerapuhan jaringan lebih berkurang dibanding xylene • Kerugian – Karsinogenik • Metode – Direndam dalam xylol 2 kali @ 1 menit hingga bening dan transparan – Volume 50 – 1000 kali volume jaringan – Setelah itu masukkan ke dalam paraffin cair

Toluene • Sama dgn xylene tetapi lebih lambat • Menimbulkan sedikit pengerasan distorsi jaringan • Mudah menguap

PEMBENAMAN • Impregnasi adalah proses pengeluaran cairan pembening (clearing agent) dari jaringan dan menggantikannya dengan paraffin. • Dilakukan dengan menggunakan paraffin oven • Clearing agent yang tersisa dapat mengkristal dalam jaringan sehingga saat dipotong dengan mikrotom jaringan akan robek. • Teknik Pembenaman – Paraffin/ paraplast I selama 2 jam; – Paraffin/ paraplast II selama 1 jam; – Paraffin/ paraplast III selama 2 jam. • Setelah pembenaman, proses dilanjutkan dengan pengecoran (blocking).

PENGECORAN (BLOCKING/CASTING) • Alat Cetak : • Besi potongan berbentuk L (Leuckhart) • Susun 2 buah potongan besi si atas lembaran logam sehingga membentuk ruang kubus; • Tuangkan sedikit paraffin cair di bagian pinggir agar tidak bocor; • Letakkan jaringan sesuai dengan keinginan saat jaringan diiris; • Tuangkan paraffin secukupnya agar menutupi jaringan seluruhnya; • Hindarkan terbentuknya air bubble. • Histoplate dari plastik (casette) dan piringan logam (mold). • Spatula untuk melekatkan blok paraffin. • Beri label identitas jaringan saat blocking.

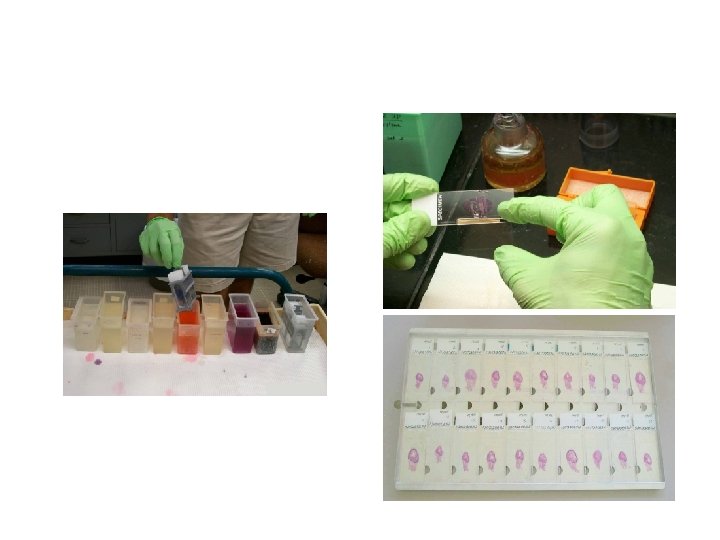
PENGIRISAN JARINGAN (SECTIONING) Persiapan: - Microtome knive vs Microtome blade (disposable) Letakkan pisau pada mikrotom dengan sudut tertentu. Rekatkan blok paraffin yang akan dipotong pada holder dengan menggunakan spatula atau scalpel blade yang panas. Letakkan holder berikut blok preparat pada tempatnya di mikrotom. - Siapkan coated slides: Albumin (putih telur); Gelatin; Super. Frost Poly-L-Lysine - Waterbath berisi air hangat 55 o. C; - Sengkelit.


Teknik Pemotongan • ketebalan + 5 – 10 m (disesuaikan kebutuhan) • Atur jarak preparat yang dipegang oleh holder ke arah pisau sedekat mungkin; • Gerakkan rotor (putaran) pada mikrotom secara ritmis, • Buang pita-pita paraffin awal yang tanpa jaringan; • Setelah potongan mengenai jaringan, potong blok preparat secara hati-hati; • pindahkan secara hati-hati dengan sengkelit ke atas air di dalam waterbath yang diatur pada suhu 55 o. C; • Setelah pita paraffin terkembang dengan baik, tempelkan paraffin ke kaca objek; • Simpan kaca objek berisi potongan paraffin dan jaringan sampai saatnya untuk diwarnai.


Pewarnaan (Staining)

Pertimbangan Pewarnaan • Unsur yang akan didemonstrasikan – Pigmen pengganggu • Mis: melanin → bleaching • Fixing fluid/fixatives – Muller fluid → jaringan dicuci dgn air mengalir selama 24 jam – Zenker → lugol’s iodine → larutan hypo

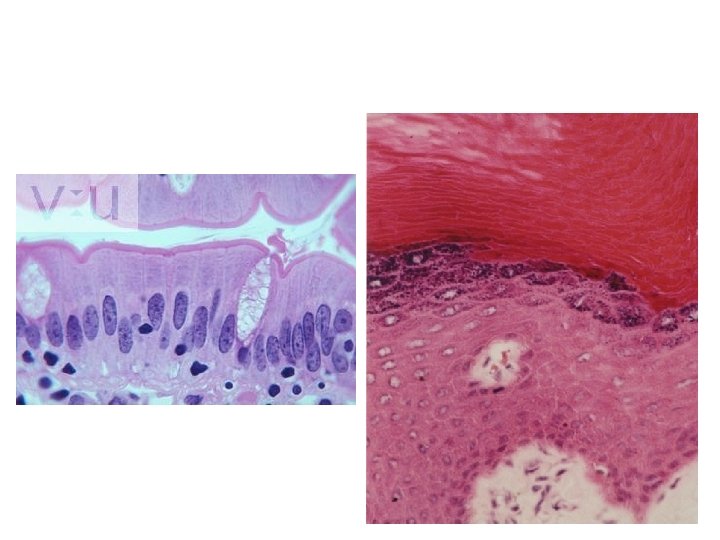
Jenis Pewarnaan • Hematoxylin & Eosin (Rutin) • Khusus – PAS, PTAH, Impregnasi perak – Sudan → lipid • Sitologik – Pap test – Blood smear – Swab mucosa • Imunohistokimia


Hematoxylin dan Eosin • Paling banyak digunakan → rutin • HE dapat menunjukkan sebagian besar struktur histologi • Demonstrasi nuklei adalah penting • Variasi dalam hasil

• • Hematein (oxidized hematoxylin) adalah zat warna Nucleus mengandung RNA dan DNA (bersifat asam) Hematoxylin mewarnai nuclei Afinitas hematein thd nuclei adalah jelek bila tanpa mordant. – Mordant adalah penghubung haematoxyllin dan DNA – Logam: Al, Fe, tungsten, molybdenum, lead – Tipe mordant mempengaruhi tipe jaringan yang terwarnai dan hasil akhir pewarnaan • Klasifikasi didasarkan jenis mordant yg digunakan – Al; Iron; Tungsten haematoxyllin, etc & tanpa mordant

• Natural ripening vs artificial ripening • Artificial ripening: penggunaan mordant (Al, Fe, atau Pb) • Warna pertama adalah merah gelap, menjadi biru (blueing) bila diperlakukan dgn alkali lemah (air kran atau lithium carbonate) • Methods are – regressive – Progressive causing pale nuclei or colour cytoplasm – Counterstain (IHC)

Hematoxylin Penggunaan – Pewarnaan Nuclei – Struktur selain nuclei • Jenis formula hematoxylin untuk pewarnaan nuclei 1. Dellafield (1885) 2. Ehrlich (1886) 3. Heidenhains (1896) 4. Harris (1900) 5. Mayer (1903) 6. Weigert (1904) 7. Carazzi (1911) 8. Cole (1943) •

Haematoxyllin Mixtures • Connective tissue – Mallory phosphotungstic acid haematoxyllin • Elastic fibers – Verhoeff’s method • Myelin – – Kultschitzky Loyez Spielmeyer Weigert • Copper and lead – Mallory – Parker • Mucin – Mayer’s mucihematein

PEWARNAAN (STAINING) • Formula Hematoxylin Mayer – – – Haematoxylin kristal Akuades Sodium Iodate Ammonium/potassium alum Citric acid Chloral hydrate 1 gr 1000 ml 0, 2 gr 50 gr 1 gr 50 gr • Cara pembuatan Hematoxylin Mayer – – – Larutkan ammonium/potassium alum di dalam akuades. Tambahkan hematoxylin dan campurkan secara baik (aduk). Tambahkan sodium iodate, citric acid dan chloralhydrate. Campur dan aduk hingga seluruhnya tercampur dengan baik. Biarkan semalam dan saring dengan kertas saring besoknya.

Eosin Zat warna xanthene Ikatan Van der Waals Paling cocok dikombinasikan dgn alum haematoxyllin Memiliki nilai kemampuan differensiasi sendiri untuk membedakan antara sitoplasma dari tipe sel dan serabut jaringan ikat yang berbeda • Differensiasi terjadi selama dehidrasi oleh alkohol • Jenis eosin • • – Eosin Y (yellowish), water soluble – Eosin B (Bluish) – Ethyl Eosin (eosin S, eosin alkohol absolut)

Eosin Y • • • water soluble Paling banyak digunakan Zat warna asam sehingga berikatan dgn protein (basa) Dapat berpenetrasi pada struktur padat dan bersifat metakromatik Terdapat dalam 2 bentuk – Monomer: merah – Dimer : oranye-merah • Hasil pewarnaan – – Sitoplasma: merah Eritrosit : oranye-merah Nukleus piknotik: ungu Nucleolus: merah

Eosin • Formula Eosin – – Eosin-alkohol Stok 1% Eosin y ws Distilled water Larutkan dan tambahkan alkohol 95% 1 gr 20 ml 80 ml • Working Eosin Solution – Eosin-alkohol stok 1 bagian – Alkohol 80% 3 bagian – Dibuat sesaat sebelum digunakan dan tambahkan asam asetat glasial 0, 5 ml untuk setiap 100 ml larutan dan aduk dengan baik.

Mewarnai Preparat • • • Deparafinisasi dengan xylol (2 x 2 menit); Hidrasi dengan alkohol 100% (2 x 2 menit) – 95% (2 menit) – 90%(2 menit) – 80% (2 menit) – 70% (2 menit) – air kran (3 menit); Jaringan yang difiksasi dengan larutan yang mengandung merkuri klorida mengandung presipitat merkuri yang berwarna hitam. Deposit merkuri dapat dihilangkan sebelum pewarnaan. Irisan diinkubasi dalam larutan iodine 0, 5% dalam etanol 70% selama 5 – 10 menit. Irisan dibilas dengan air lalu diinkubasi dalam sodium thiosulphate 5% selama 5 menit dan dicuci dengan air kran mengalir. Inkubasi dalam larutan hematoxylin Mayer selama beberapa menit; Cuci dalam air mengalir selama 15 -20 menit; Observasi di bawah mikroskop, Counterstaining dengan eosin working solution selama beberapa menit. Dehidrasi dalam serial alkohol dengan gradasi meningkat Inkubasi dalam xylol 2 x 2 menit. mounting dengan entelan /balsam kanada. labelling



Acid Alcohol Rinse • Mengurangi warna biru hematoxyllin (to differentiate nuclear staining) • 0. 25 % acid rinse – Akuades 975 ml – HCl 25 ml • HCl 1% dalam alkohol 70% (v/v)

Blueing • Air kran (yang alkalis) – Jakarta: p. H air kran adalah 7. 8 • Lithium carbonate – Lithium carbonate………………. . 0, 5 gr – Akuades……………… 1000 ml – Campurkan dengan baik.

Terima kasih
 Histoteknik
Histoteknik Etika veteriner
Etika veteriner Siirt veteriner klinikleri
Siirt veteriner klinikleri Instrüksiyon
Instrüksiyon Veteriner reklam yasağı
Veteriner reklam yasağı Ankara üniversitesi veteriner fakültesi
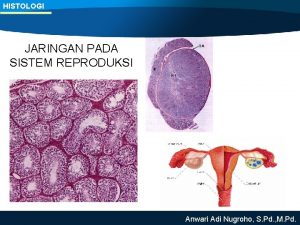
Ankara üniversitesi veteriner fakültesi Histologi sistem reproduksi wanita
Histologi sistem reproduksi wanita Bagian lidah
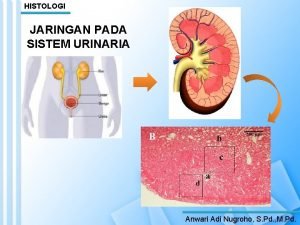
Bagian lidah Histologi vesica urinaria
Histologi vesica urinaria Histologi penis
Histologi penis Histologi
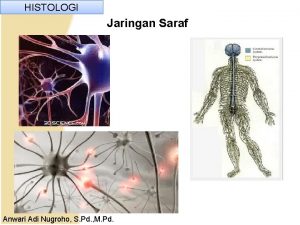
Histologi Endoneurium histology
Endoneurium histology Polihidral
Polihidral Jaringan meristem sekunder
Jaringan meristem sekunder Kelenjar alveolar majemuk
Kelenjar alveolar majemuk Lobus anterior alice
Lobus anterior alice Labium oris histology
Labium oris histology Jejunum arcades
Jejunum arcades Rumus hematokrit
Rumus hematokrit Sistem reproduksi pria
Sistem reproduksi pria Epitel
Epitel Konka nasalis superior
Konka nasalis superior Dasar dasar analisis fonem
Dasar dasar analisis fonem 4 konsep dasar bimbingan dan konseling
4 konsep dasar bimbingan dan konseling Fundamental software engineering
Fundamental software engineering Pertanyaan tentang korespondensi dalam komunikasi bisnis
Pertanyaan tentang korespondensi dalam komunikasi bisnis Ethical design meaning
Ethical design meaning Peta minda tentang sistem komputer
Peta minda tentang sistem komputer Dasar dasar pengambilan keputusan menurut george r terry
Dasar dasar pengambilan keputusan menurut george r terry Pengertian pengorganisasian dan pengembangan masyarakat
Pengertian pengorganisasian dan pengembangan masyarakat Laporan praktikum dasar pengukuran dan ketidakpastian pdf
Laporan praktikum dasar pengukuran dan ketidakpastian pdf Teori dasar kuliner pdf
Teori dasar kuliner pdf Dasar dasar prosedur pembukuan
Dasar dasar prosedur pembukuan Dasar dasar pengujian perangkat lunak
Dasar dasar pengujian perangkat lunak Dasar dasar korespondensi bisnis
Dasar dasar korespondensi bisnis Dasar sokongan kokurikulum
Dasar sokongan kokurikulum Dasar dasar prosedur pembukuan
Dasar dasar prosedur pembukuan Dasar dasar pemrosesan komputer
Dasar dasar pemrosesan komputer Konsep dasar advokasi kesehatan
Konsep dasar advokasi kesehatan Etika relasi karyawan dan perlakuan adil di tempat kerja
Etika relasi karyawan dan perlakuan adil di tempat kerja Faktor pembentuk kelompok sosial
Faktor pembentuk kelompok sosial Dasar dasar penelitian sejarah
Dasar dasar penelitian sejarah Konsep dasar unit pemrosesan dan dasar datapath
Konsep dasar unit pemrosesan dan dasar datapath Organisasi datapath
Organisasi datapath Materi dasar-dasar agronomi ipb
Materi dasar-dasar agronomi ipb Operasi dasar komputer
Operasi dasar komputer Dasar dasar manajemen
Dasar dasar manajemen Plc omron
Plc omron Dasar dasar manajemen
Dasar dasar manajemen Jaringan komputer dasar
Jaringan komputer dasar Dasar-dasar komunikasi dalam pembelajaran
Dasar-dasar komunikasi dalam pembelajaran Tim rapid health assessment terdiri dari
Tim rapid health assessment terdiri dari