Hinyoznak a mestersgesen ellltott rvid felezsi idej elemek






- Slides: 12

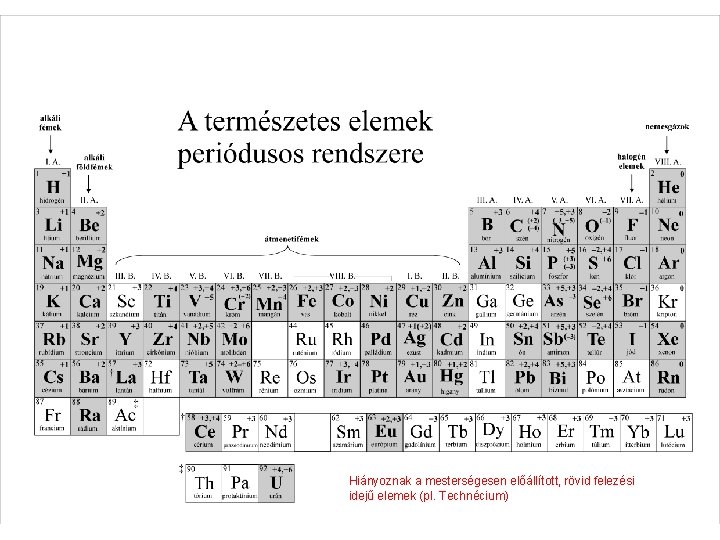
Hiányoznak a mesterségesen előállított, rövid felezési idejű elemek (pl. Technécium)

Az elemek periódusos (= ismétlődő) rendszere • Oszloponként hasonló tulajdonságok • Balról jobbra (és fentről lefelé) mindig eggyel nő a rendszám (protonszám, elektronszám) • Atom = atommag (benne protonok és neutronok) + elektronburok (elektronhéjakból épül fel) • Elektronhéjak: K (1. ), L (2. ), M (3. ), N (4. ) stb. => a periódusos rendszer minden sorában egy újabb elektronhéj töltődik fel. • Az éppen feltöltődő elektronhéj = vegyértékhéj (főcsoportbeli elemeknél ez a legkülső héj, mellékcsoportbeli elemeknél ez eggyel vagy kettővel beljebb levő héj; a rendszerben a főcsoportokat „A”, a mellékcsoportokat „B” betű jelzi)

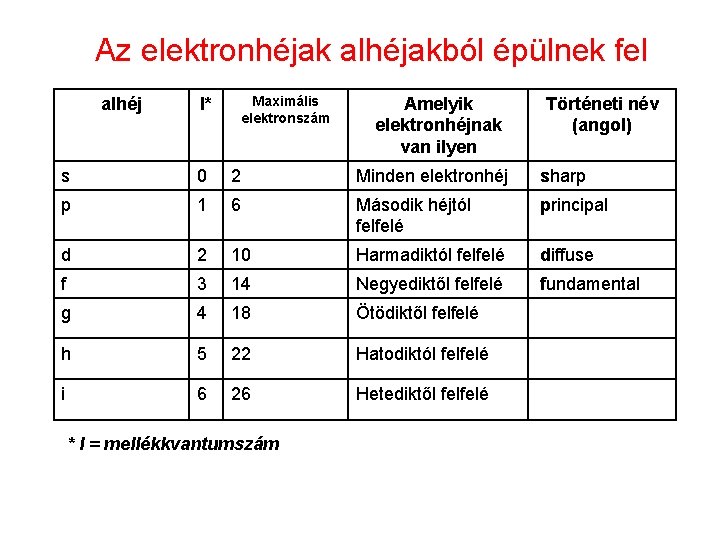
Az elektronhéjak alhéjakból épülnek fel alhéj Maximális elektronszám l* Amelyik elektronhéjnak van ilyen Történeti név (angol) s 0 2 Minden elektronhéj sharp p 1 6 Második héjtól felfelé principal d 2 10 Harmadiktól felfelé diffuse f 3 14 Negyediktől felfelé fundamental g 4 18 Ötödiktől felfelé h 5 22 Hatodiktól felfelé i 6 26 Hetediktől felfelé * l = mellékkvantumszám

Elektronhéj: a héj sorszámna, betűjele és a héjon lehetséges maximális elektronszám van feltüntetve alhéjak 1 K 2 2 L 8 3 M 18 4 N 28 5 O 32 6 P 50 7 Q 72 8 R 98 Elektronhéjak feltöltődése energetikailag szabályozott, mindig a legalacsonyabb energiájú alhéj töltődik fel.

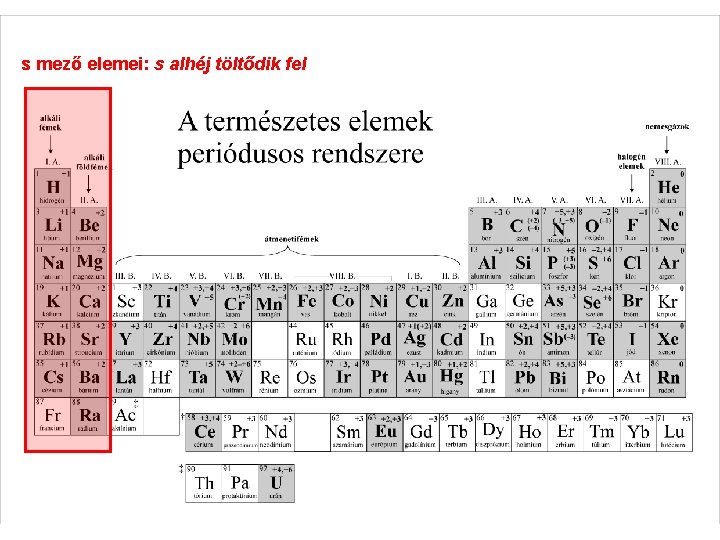
s mező elemei: s alhéj töltődik fel

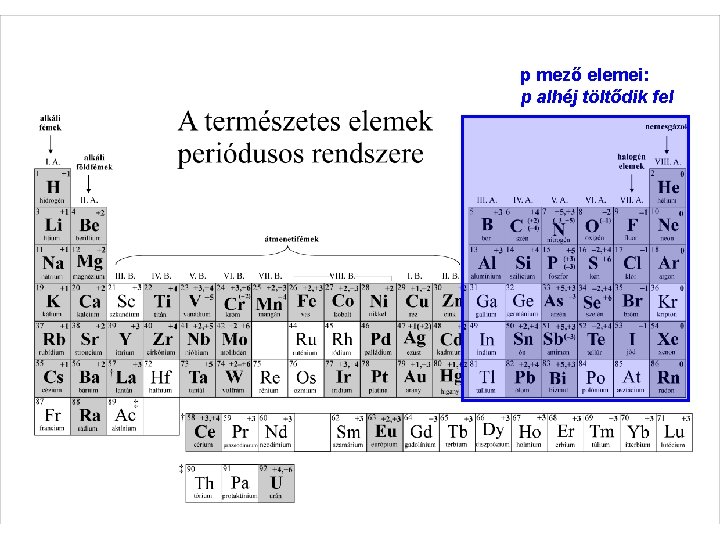
p mező elemei: p alhéj töltődik fel

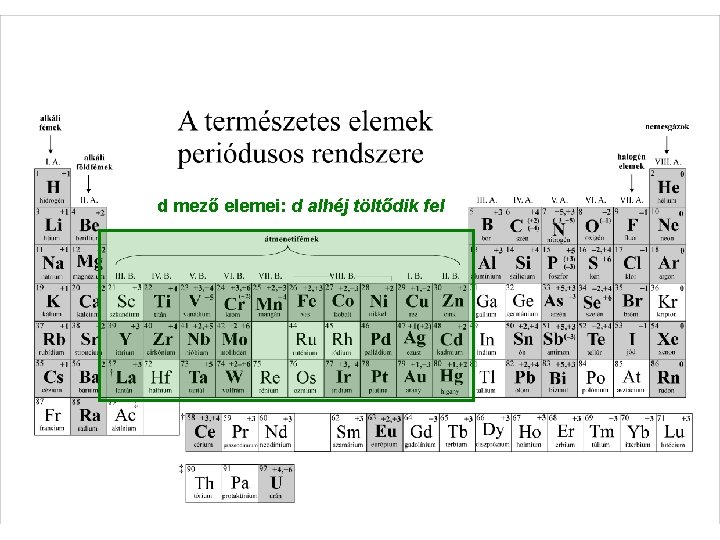
d mező elemei: d alhéj töltődik fel

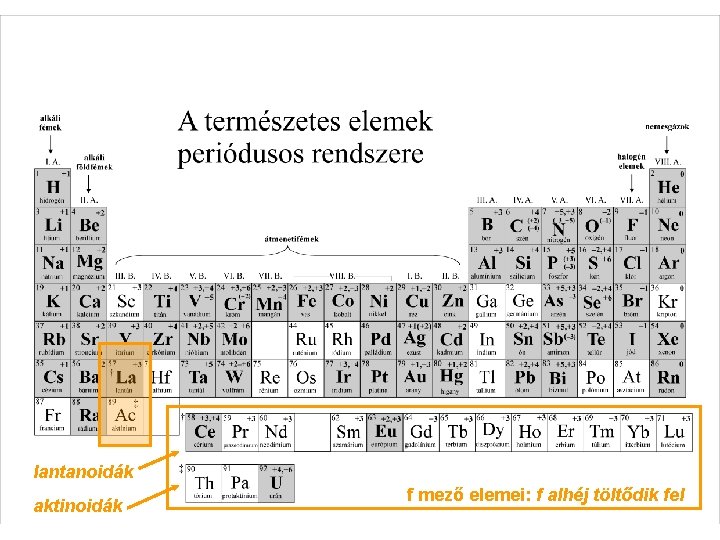
lantanoidák aktinoidák f mező elemei: f alhéj töltődik fel

s, p mező elemei: főcsoportok, legkülső elektronhéj töltődik fel, egy perióduson (soron) belül nagy különbségek vannak az elemek közt d, f mező elemei: mellékcsoportok, nem a legkülső héj, hanem kívülről a 2. , ill. 3. héj töltődik fel, ezért a perióduson belül a különböző elemek nem térnek el annyira egymástól.

Nemesgázok: lezárt külső héj, stabil, nem vesz részt reakciókban (minden más elem ilyen elektronszerkezetet szeretne. . . ) I, III (IV, V, VI) főcsoportok: vegyületeiben „leadja” a külső elektronokat, hogy nemesgáz szerkezetű legyen VI, VII (IV, V) főcsoportok: vegyületeiben „felvesz” még elektronokat, hogy nemesgáz szerkezetű legyen

Nemesgázok: lezárt külső héj, stabil, nem vesz részt reakciókban (minden más elem ilyen elektronszerkezetet szeretne. . . ) I, III (IV, V, VI) főcsoportok: vegyületeiben „leadja” a külső elektronokat, hogy nemesgáz szerkezetű legyen => oxidációs szám +1, +2, +3 (+4, +5, +6) VI, VII (IV, V) főcsoportok: vegyületeiben „felvesz” még elektronokat, hogy nemesgáz szerkezetű legyen => oxidációs szám – 1, – 2 (– 3, – 4) Megj. : A IV-V-VI. („A”) főcsoportban a többféle oxidációs szám abból is adódhat, hogy csak a p alhéj ürül ki elektronleadással (C 2+, Sn 2+, Pb 2+, As 3+, Sb 3+, S 4+), vagy az s alhéj is (C 4+, Sn 4+, Pb 4+, As 5+, Sb 5+, S 6+).

Oxidációs szám változással járó folyamatok Oxidáció: oxidációs szám növekedéssel járó folyamat Pl. égés, C(0) + O 2 = C(+4)O 2 Megjegyzés: minden reakciónál a nettó oxidációsszám változás 0. Itt az oxigén oxidációs száma 0 -ról -2 -re változott, két oxigénnél ez a változás összesen -4, a szén változása pedig +4, az eredő tehát 0. A szén oxidálódott, az oxigén redukálódott, a jelenség tehát a szén szempontjából oxidáció. Redukció: oxidációs szám csökkenéssel járó folyamat Pl. Cu(+2)O + H 2 = Cu(0) + H 2 O Megjegyzés: Itt az réz oxidációs száma 2 -ről -0 -ra változott, ez a változás összesen -2, a hidrogén oxidációs számváltozása pedig 0 -ról +1 -re darabonként +1, összesen +2, az eredő tehát megint 0. A réz redukálódott, a hidrogén oxidálódott, a jelenség tehát a réz szempontjából redukció, a hidrogén szempontjából oxidáció. A folyamatban az oxigén oxidációs száma változatlan, végig -2.