Hg oldatok trvnyei Kolligatv tulajdonsgok Nem illkony oldott





- Slides: 10

Híg oldatok törvényei. Kolligatív tulajdonságok • Nem illékony oldott anyagot tartalmazó oldatok speciális ún. kolligatív tulajdonságai: – Az oldat feletti egyensúlyi parciális nyomás (ún. tenzió) csökkenésének mértéke: Dp – Az oldat fagyáspontjának csökkenése: DTfagy – Az oldat forráspontjának emelkedése: DTforr – Az oldat ozmotikus nyomásának mértéke: p • Kolligatív tulajdonságok: Az oldott részecskék összmolszámával, összkoncentrációval egyenesen arányos, de az oldott anyag mibenlététől (pl. glükóz, avagy karbamid, sít. ) független tulajdonságok. Felhasználásuk: Egyféle oldott anyag esetén molkoncentrációmérés moltömegmérés • Hígoldatok, mivel az egyenes arányosság szigorúan csak kis koncentrációk esetén teljesül.

Az oldott anyag molszámát tartalmazó oldatkoncentráció egységek • Moláris koncentráció: • Moltört: • Molalitás:

Az oldatok feletti eredő telítettgőznyomás ideális és nem ideális oldatokra • Illékony oldott anyag esetén (ideális oldat) az eredő nyomás a moltörtek (x. A, x. B, ahol x. A+x. B=1) arányában tevődik össze a tiszta oldószer és az oldott anyag telített gőznyomásának értékeiből (p. A, ill. p. B) : • Ha B nem-illékony oldott anyag, akkor p. B igen kicsi és x. Bp. B elhanyagolható az oldószertől származó nyomásrész (x. Ap. A) mellett: • A tiszta oldószerhez képest észlelhető gőznyomás- (tenzió-) csökkenés mértéke éppen arányos lesz a B nem-illékony anyag moltörtjével (Raoult-törvénye, ilyen nem-ideális, híg oldatokra):

Telítettgőznyomás-(tenzió-)csökkenés nemideális oldatokra • A Raoult-féle tenziócsökkenés következményei egyaránt: • mind az oldat fagyáspontjának csökkenése: DTfagy • mind forráspontjának emelkedése: DTforr

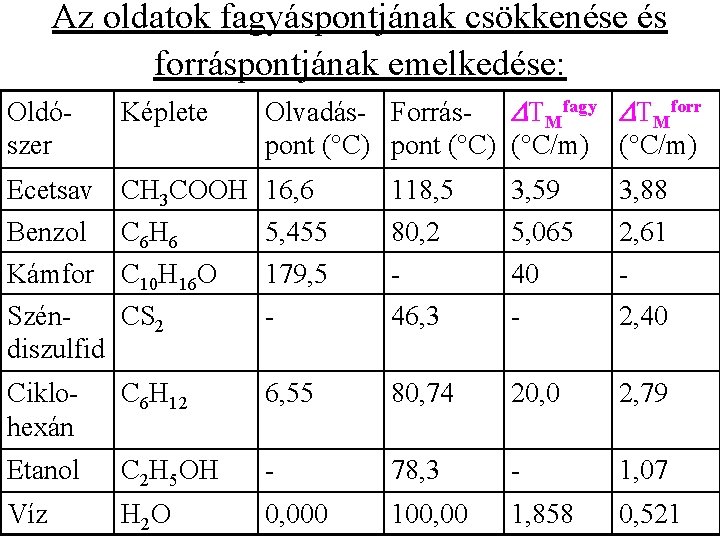
Az oldatok fagyáspontjának csökkenése és forráspontjának emelkedése: • Egy c. M molalitású oldat fagyáspontjának csökkenése: DTfagy =c. M DTMfagy, oldószer , ahol DTMfagy, oldószer az oldószer molális fagyáspont-csökkenése. • Egy c. M molalitású oldat forráspontjának emelkedése: DTforr =c. M DTMforr, oldószer , ahol DTMforr, oldószer az oldószer molális forráspont-emelkedése.

Az oldatok fagyáspontjának csökkenése és forráspontjának emelkedése: Oldószer Képlete Olvadás- Forrás- DTMfagy DTMforr pont (°C) (°C/m) Ecetsav CH 3 COOH 16, 6 Benzol C 6 H 6 5, 455 118, 5 80, 2 3, 59 5, 065 3, 88 2, 61 Kámfor C 10 H 16 O 179, 5 - 40 - Szén. CS 2 diszulfid - 46, 3 - 2, 40 Ciklohexán C 6 H 12 6, 55 80, 74 20, 0 2, 79 Etanol C 2 H 5 OH - 78, 3 - 1, 07 Víz H 2 O 0, 000 100, 00 1, 858 0, 521

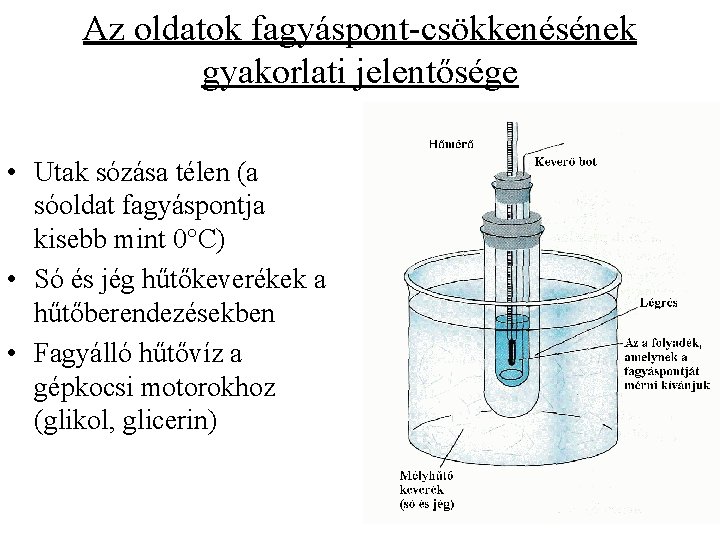
Az oldatok fagyáspont-csökkenésének gyakorlati jelentősége • Utak sózása télen (a sóoldat fagyáspontja kisebb mint 0°C) • Só és jég hűtőkeverékek a hűtőberendezésekben • Fagyálló hűtővíz a gépkocsi motorokhoz (glikol, glicerin)

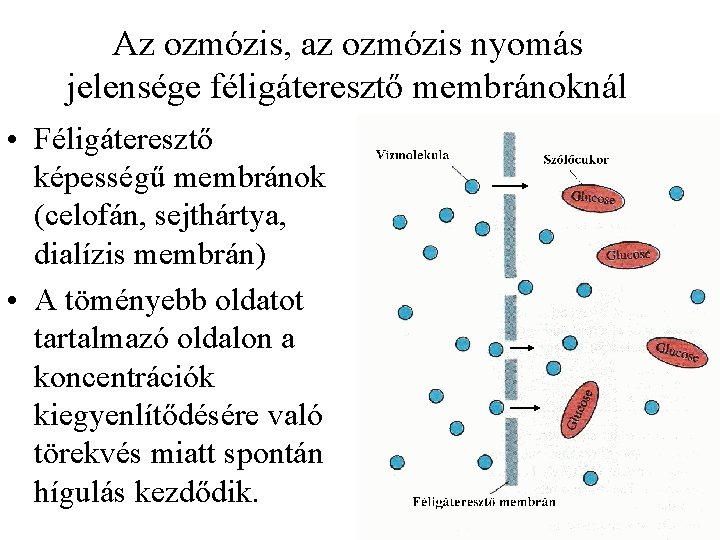
Az ozmózis, az ozmózis nyomás jelensége féligáteresztő membránoknál • Féligáteresztő képességű membránok (celofán, sejthártya, dialízis membrán) • A töményebb oldatot tartalmazó oldalon a koncentrációk kiegyenlítődésére való törekvés miatt spontán hígulás kezdődik.

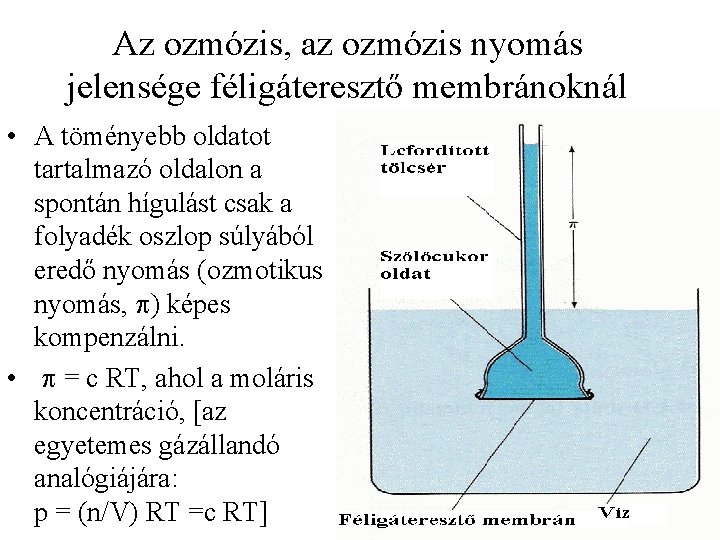
Az ozmózis, az ozmózis nyomás jelensége féligáteresztő membránoknál • A töményebb oldatot tartalmazó oldalon a spontán hígulást csak a folyadék oszlop súlyából eredő nyomás (ozmotikus nyomás, p) képes kompenzálni. • p = c RT, ahol a moláris koncentráció, [az egyetemes gázállandó analógiájára: p = (n/V) RT =c RT]

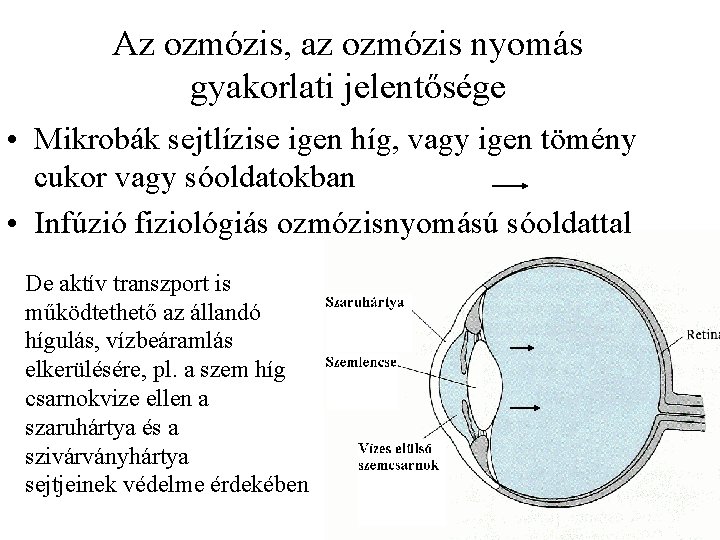
Az ozmózis, az ozmózis nyomás gyakorlati jelentősége • Mikrobák sejtlízise igen híg, vagy igen tömény cukor vagy sóoldatokban • Infúzió fiziológiás ozmózisnyomású sóoldattal De aktív transzport is működtethető az állandó hígulás, vízbeáramlás elkerülésére, pl. a szem híg csarnokvize ellen a szaruhártya és a szivárványhártya sejtjeinek védelme érdekében
 Nem rei nem lei nem paz nem guerra
Nem rei nem lei nem paz nem guerra Emzirme ekleyicisi
Emzirme ekleyicisi Nem olhos viram, nem ouvidos ouviram
Nem olhos viram, nem ouvidos ouviram Se eu fosse magico não existia droga nem fome nem policia
Se eu fosse magico não existia droga nem fome nem policia Orra van de nem szagol nyelve van de nem beszél
Orra van de nem szagol nyelve van de nem beszél Anyagi részecskék csoportosítása
Anyagi részecskék csoportosítása Plazmaexpander
Plazmaexpander Oldatok keverése
Oldatok keverése Vizes oldatok kémhatása
Vizes oldatok kémhatása Frases deus não nos deixa enganados e nem confundidos
Frases deus não nos deixa enganados e nem confundidos Nem ri
Nem ri


















