HEPATITES VIRAIS EPIDEMIOLOGIA DIAGNSTICO E TRATAMENTO Programa de




































- Slides: 63

HEPATITES VIRAIS: EPIDEMIOLOGIA, DIAGNÓSTICO E TRATAMENTO Programa de Educação Médica Continuada CREMESP MARCIA VILLANOVA Divisão de Gastroenterologia Departamento de Clínica Médica HCFMRP-USP

HEPATITE B Epidemiologia • Cerca de 1/3 da população mundial tem evidência sorológica de infecção atual ou passada de infecção pelo HBV • 350 milhões cronicamente infectados • 1 milhão de mortes por ano por cirrose e/ou carcinoma hepatocelular • 5 -10% dos transplantes de fígado • Genótipos A, B, C, D, E, F, G, H

Mecanismos de transmissão do vírus B Transfusões de sangue e hemoderivados Sexual Exposições parenterais Horizontal Transplantes de órgãos Hospitalar Vertical*

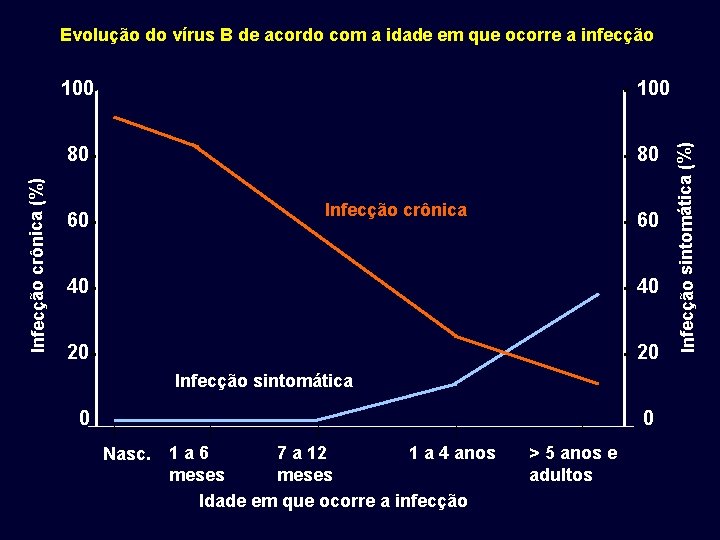
100 80 80 60 Infecção crônica 60 40 40 20 20 Infecção sintomática 0 0 7 a 12 1 a 4 anos Nasc. 1 a 6 meses Idade em que ocorre a infecção > 5 anos e adultos Infecção sintomática (%) Infecção crônica (%) Evolução do vírus B de acordo com a idade em que ocorre a infecção

Distribuição geográfica da hepatite B crônica 0, 5% 3% 77% 16% ³ 8% - Alta 2 -7% - Intermediária <2% - Baixa

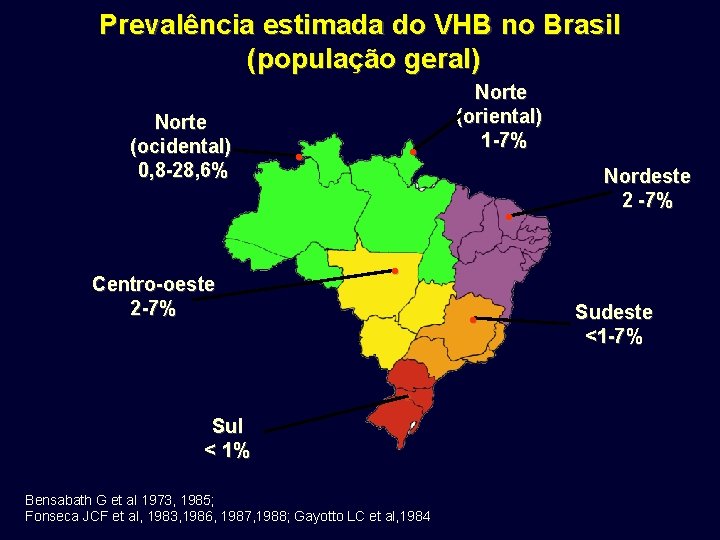
Prevalência estimada do VHB no Brasil (população geral) Norte (ocidental) 0, 8 -28, 6% • • Norte (oriental) 1 -7% • Centro-oeste 2 -7% Nordeste 2 -7% • • • Sul < 1% Bensabath G et al 1973, 1985; Fonseca JCF et al, 1983, 1986, 1987, 1988; Gayotto LC et al, 1984 Sudeste <1 -7%

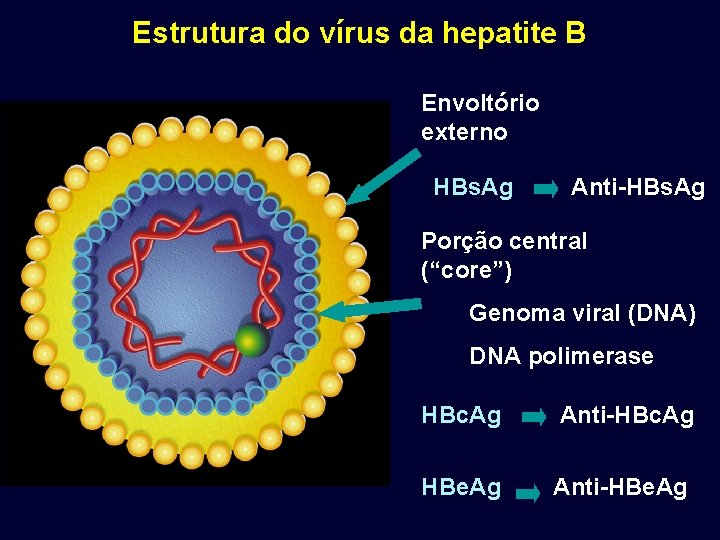
Estrutura do vírus da hepatite B Envoltório externo HBs. Ag Anti-HBs. Ag Porção central (“core”) Genoma viral (DNA) DNA polimerase HBc. Ag Anti-HBc. Ag HBe. Ag Anti-HBe. Ag

Vírus da hepatite B Genoma Estrutura 1 pre. S preco re 42 nm Envoltório externo-HBs. Ag Nucleocapsídeo-HBc. Ag - DNA polimerase - Genoma viral (DNA) Gene S - proteínas de superfícies gene P- DNA polimerase gene X- proteína X gene C - core: HBc. Ag - pré-core: HBe. Ag

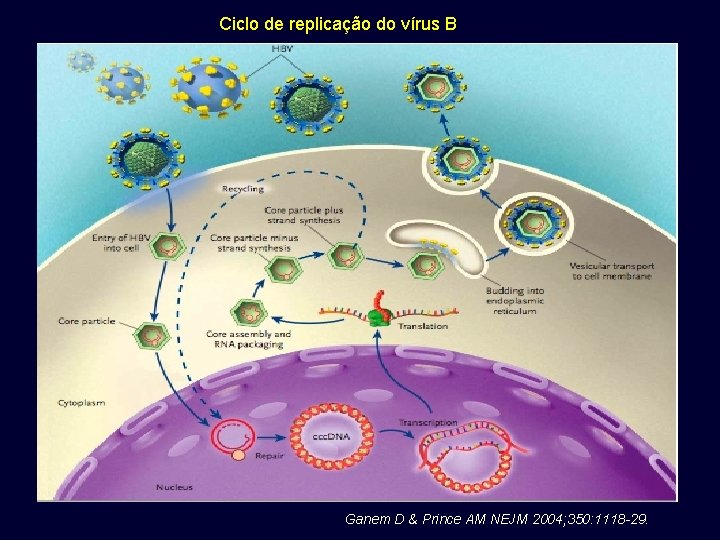
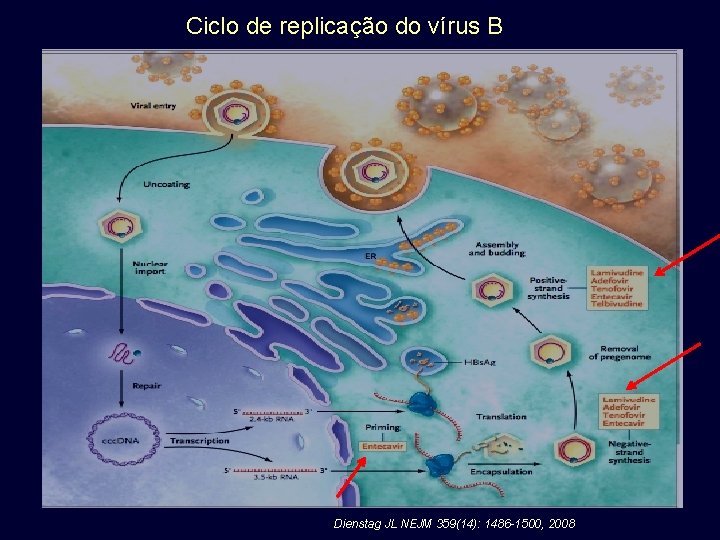
Ciclo de replicação do vírus B Ganem D & Prince AM NEJM 2004; 350: 1118 -29.

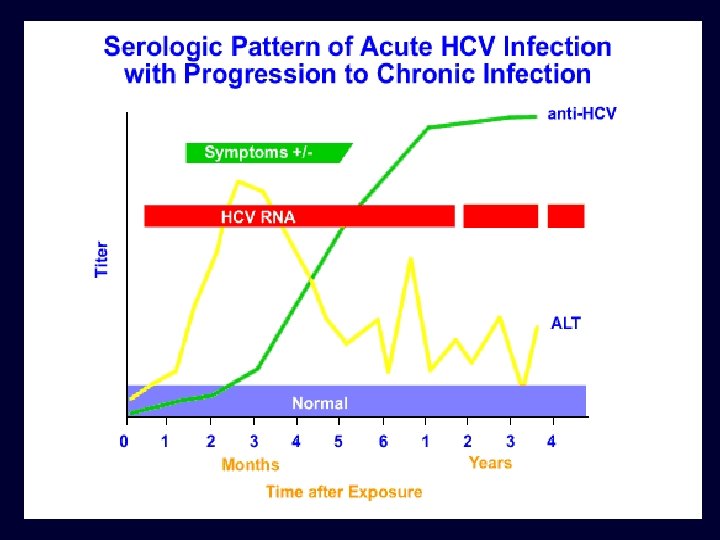
Padrão sorológico de infecção aguda pelo VHB com recuperação Sintomas HBe. Ag Anti-HBe anti-HBc Título anti-HBc Ig. M anti-HBs HBs. Ag 0 4 8 12 16 20 24 28 32 36 52 Semanas após a exposição 100

Padrão sorológico de infecção aguda pelo VHB com recuperação Sintomas HBe. Ag Anti-HBe anti-HBc Título anti-HBc Ig. M anti-HBs HBs. Ag 0 4 8 12 16 20 24 28 32 36 52 Semanas após a exposição 100

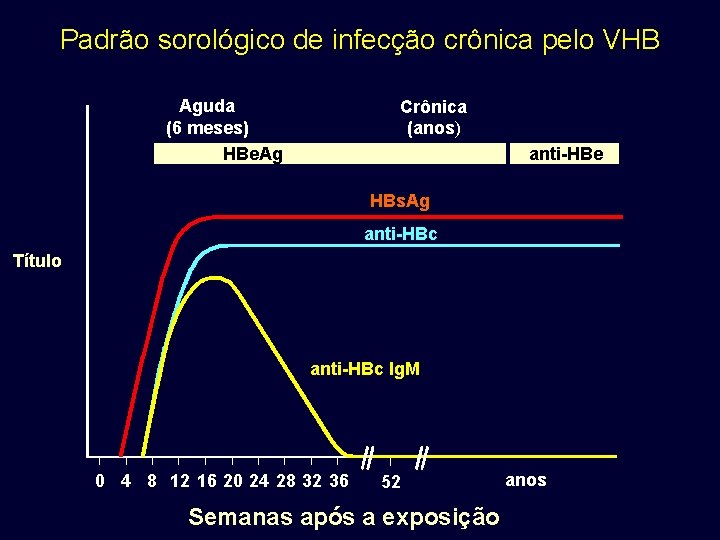
Padrão sorológico de infecção crônica pelo VHB Aguda (6 meses) HBe. Ag Crônica (anos) anti-HBe HBs. Ag anti-HBc Título anti-HBc Ig. M 0 4 8 12 16 20 24 28 32 36 52 Semanas após a exposição anos

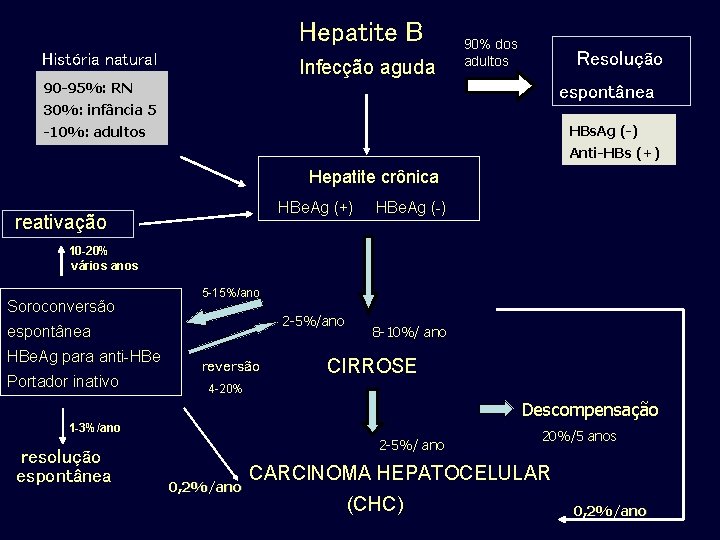
Hepatite B História natural Infecção aguda 90% dos adultos Resolução 90 -95%: RN espontânea 30%: infância 5 HBs. Ag (-) -10%: adultos Anti-HBs (+) Hepatite crônica HBe. Ag (+) HBe. Ag (-) reativação 10 -20% vários anos Soroconversão 5 -15%/ano 2 -5%/ano espontânea HBe. Ag para anti-HBe Portador inativo reversão 8 -10%/ ano CIRROSE 4 -20% Descompensação 1 -3%/ano resolução espontânea 2 -5%/ ano 0, 2%/ano 20%/5 anos CARCINOMA HEPATOCELULAR (CHC) 0, 2%/ano

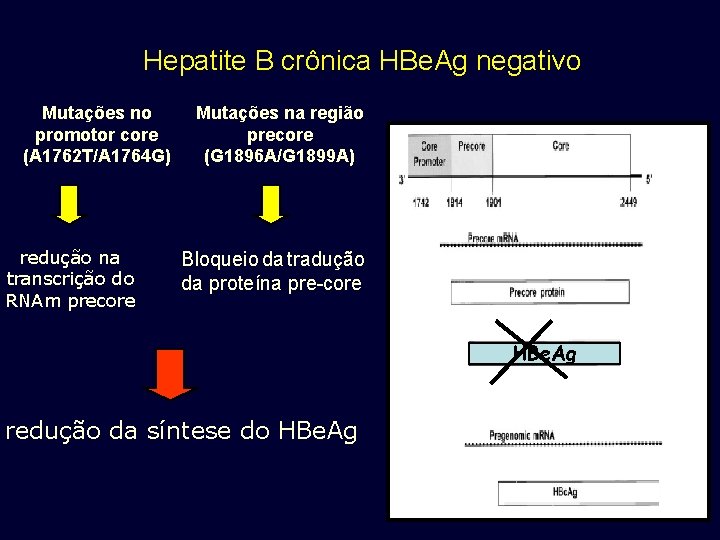
Hepatite B crônica HBe. Ag negativo Mutações no promotor core (A 1762 T/A 1764 G) redução na transcrição do RNAm precore Mutações na região precore (G 1896 A/G 1899 A) Bloqueio da tradução da proteína pre-core HBe. Ag redução da síntese do HBe. Ag

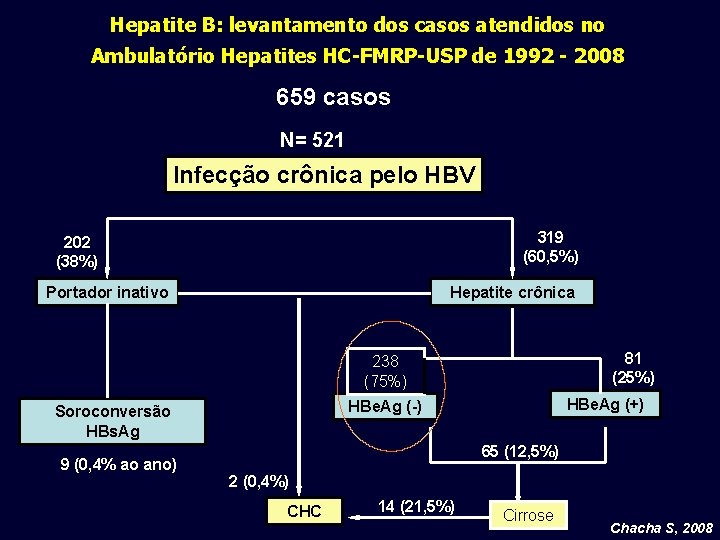
Hepatite B: levantamento dos casos atendidos no Ambulatório Hepatites HC-FMRP-USP de 1992 - 2008 659 casos N= 521 Infecção crônica pelo HBV 319 (60, 5%) 202 (38%) Portador inativo Hepatite crônica 81 (25%) 238 (75%) 9 (0, 4% ao ano) HBe. Ag (+) HBe. Ag (-) Soroconversão HBs. Ag 65 (12, 5%) 2 (0, 4%) CHC 14 (21, 5%) Cirrose Chacha S, 2008

HEPATITE B: Avaliação diagnóstica Fase aguda Avaliação clínica ALT/ AST Função hepática HBs. Ag Ig. M anti-HBc HBe. Ag/anti. HBe Avaliar comunicantes: HBs. Ag, anti-HBs, anti-HBc total Fase crônica Avaliação clínica ALT/ AST Avaliação da função hepática (Albumina, BT, INR) Hbs. Ag; Ig. G anti-HBc HBe. Ag; anti-HBe HBVDNA (carga viral) Biópsia hepática US abdômen Fase avançada: endoscopia digestiva alta Atenção: Todos os casos devem ser notificados!!!

Quem deve ser submetido a triagem sorológica? HBs. Ag / Ig. G anti. HBc üHistória de hemotransfusão üComunicantes sexuais üComunicantes domésticos Vacinação dos susceptíveis üFilhos de mães portadoras do vírus B ü Pacientes HIV positivo ü Pacientes renais crônicos/tratamento hemodialítico ü Grávidas

Objetivos do tratamento da hepatite B • Suprimir a replicação viral – – Normalização das enzimas hepáticas Soroconversão HBe. Ag ----- anti. Hbe Soroconversão HBs. Ag ----- anti. HBs Melhora das alterações histológicas • Evitar a progressão para cirrose, insuficiência hepática e CHC (melhora da qualidade de vida/sobrevida) • Interromper a propagação da doença - A infecção não pode ser completamente erradicada pela persistência do ccc. DNA no núcleo dos hepatócitos

Tratamento da Hepatite B Decisão de tratar: ü Avaliar risco de evolução da doença X risco de desenvolvimento de cepas resistentes ü Dar preferência a drogas eficazes com alta barreira genética para evitar o desenvolvimento de resistência ü Conscientizar quanto a importância de adesão ao tratamento ü Monitorização do paciente a fim de reconhecer/ diagnosticar resposta inadequada ou resistência ü Rastreamento do carcinoma hepatocelular EASL, 2011; AASLD, 2009

Tratamento da Hepatite B • Interferon convencional/ peguilado (imunomodulador) Ø Vantagens: . Tempo finito de tratamento. Sem risco de resistência viral Ø Desvantagens. Efeitos colaterais. Via subcutânea • Análogos nucleosídeos/nucleotídeos Vantagens: . Via oral. Poucos efeitos colaterais Ø Desvantagens. Uso por tempo indeterminado. Risco de resistência viral Ø

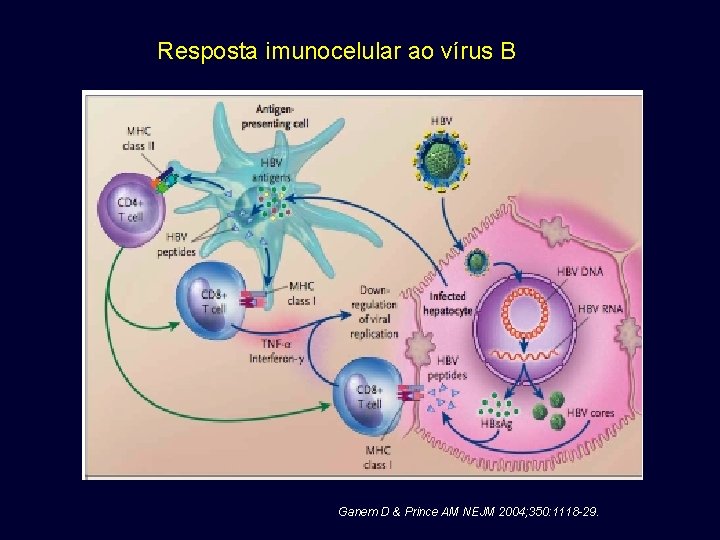
Resposta imunocelular ao vírus B Ganem D & Prince AM NEJM 2004; 350: 1118 -29.

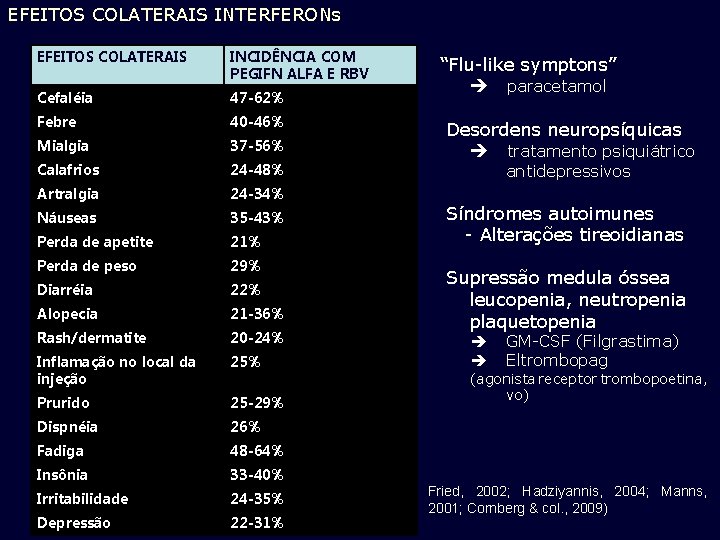
EFEITOS COLATERAIS INTERFERONs EFEITOS COLATERAIS INCIDÊNCIA COM PEGIFN ALFA E RBV Cefaléia 47 -62% Febre 40 -46% Mialgia 37 -56% Calafrios 24 -48% Artralgia 24 -34% Náuseas 35 -43% Perda de apetite 21% Perda de peso 29% Diarréia 22% Alopecia 21 -36% Rash/dermatite 20 -24% Inflamação no local da injeção 25% Prurido 25 -29% Dispnéia 26% Fadiga 48 -64% Insônia 33 -40% Irritabilidade 24 -35% Depressão 22 -31% “Flu-like symptons” paracetamol Desordens neuropsíquicas tratamento psiquiátrico antidepressivos Síndromes autoimunes - Alterações tireoidianas Supressão medula óssea leucopenia, neutropenia plaquetopenia GM-CSF (Filgrastima) Eltrombopag (agonista receptor trombopoetina, vo) Fried, 2002; Hadziyannis, 2004; Manns, 2001; Cornberg & col. , 2009)

Tratamento da Hepatite B • Interferon convencional/ peguilado (imunomodulador) Ø Vantagens: . Tempo finito de tratamento. Sem risco de resistência viral Ø Desvantagens. Efeitos colaterais. Via subcutânea • Análogos nucleosídeos/nucleotídeos Vantagens: . Via oral. Poucos efeitos colaterais Ø Desvantagens. Uso por tempo indeterminado. Risco de resistência viral Ø

Ciclo de replicação do vírus B Dienstag JL NEJM 359(14): 1486 -1500, 2008

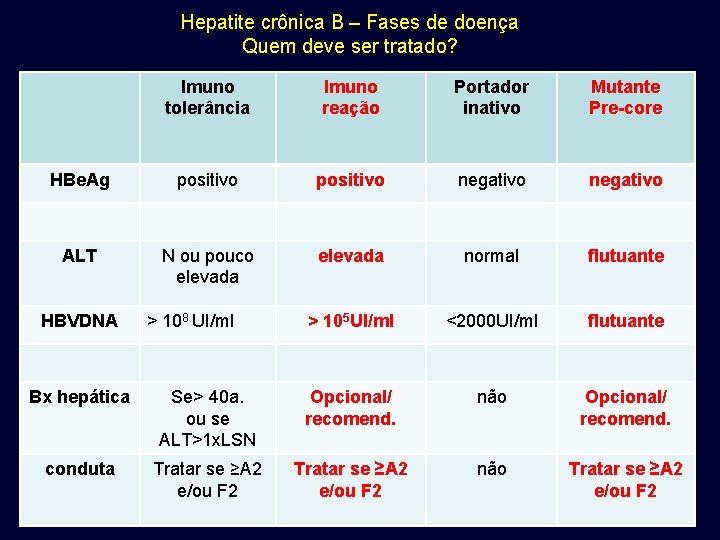
Hepatite crônica B – Fases de doença Quem deve ser tratado? Imuno tolerância Imuno reação Portador inativo Mutante Pre-core HBe. Ag positivo negativo ALT N ou pouco elevada normal flutuante > 105 UI/ml <2000 UI/ml flutuante HBVDNA > 108 UI/ml Bx hepática Se> 40 a. ou se ALT>1 x. LSN Opcional/ recomend. não Opcional/ recomend. conduta Tratar se ≥A 2 e/ou F 2 não Tratar se ≥A 2 e/ou F 2

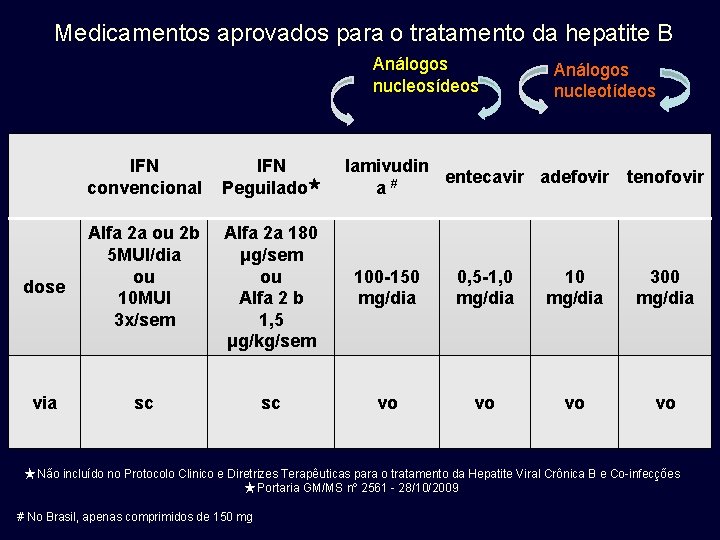
Medicamentos aprovados para o tratamento da hepatite B Análogos nucleosídeos dose via Análogos nucleotídeos IFN convencional IFN Peguilado★ lamivudin entecavir adefovir tenofovir a# Alfa 2 a ou 2 b 5 MUI/dia ou 10 MUI 3 x/sem Alfa 2 a 180 μg/sem ou Alfa 2 b 1, 5 μg/kg/sem 100 -150 mg/dia 0, 5 -1, 0 mg/dia 10 mg/dia 300 mg/dia sc sc vo vo ★ Não incluído no Protocolo Clinico e Diretrizes Terapêuticas para o tratamento da Hepatite Viral Crônica B e Co-infecções ★ Portaria GM/MS nº 2561 - 28/10/2009 # No Brasil, apenas comprimidos de 150 mg

Tratamento da Hepatite B • Interferon convencional/ peguilado Ø Fatores preditivos de resposta: . ALT >3 x LSN. Baixa carga viral - HBVDNA <107 UI/ml . Biópsia Metavir ≥A 2. Genótipos A e B Ø Contra-indicação: Cirrose descompensada • Análogos nucleosídeos/nucleotídeos Ø Fatores preditivos de resposta . Baixa carga viral - HBVDNA < 107 UI/ml. ALT ≥ 3 x LSN. Biópsia: METAVIR ≥ A 2

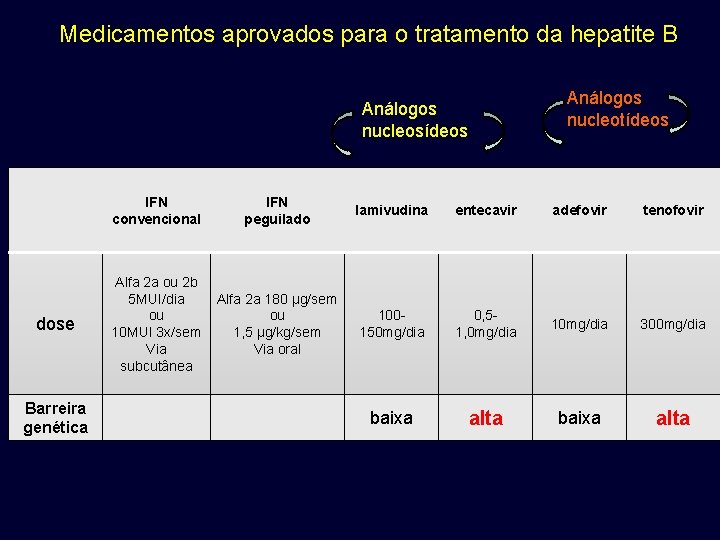
Medicamentos aprovados para o tratamento da hepatite B Análogos nucleotídeos Análogos nucleosídeos dose Barreira genética IFN convencional IFN peguilado lamivudina entecavir adefovir tenofovir Alfa 2 a ou 2 b 5 MUI/dia ou 10 MUI 3 x/sem Via subcutânea Alfa 2 a 180 μg/sem ou 1, 5 μg/kg/sem Via oral 100150 mg/dia 0, 51, 0 mg/dia 10 mg/dia 300 mg/dia baixa alta

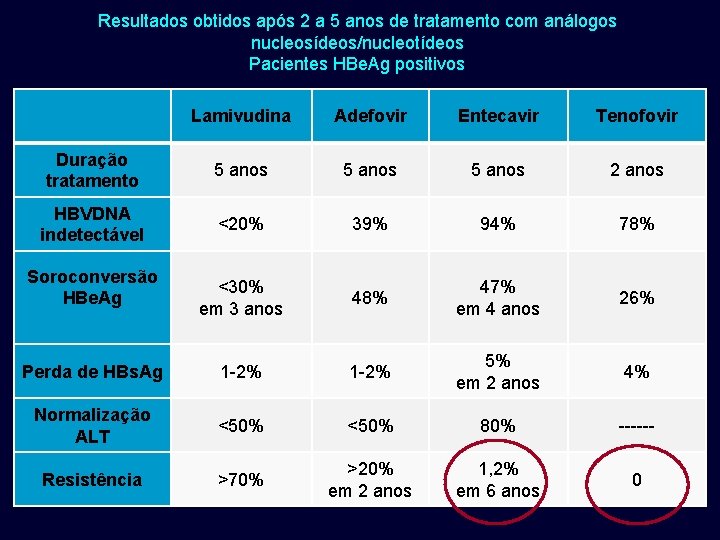
Resultados obtidos após 2 a 5 anos de tratamento com análogos nucleosídeos/nucleotídeos Pacientes HBe. Ag positivos Lamivudina Adefovir Entecavir Tenofovir Duração tratamento 5 anos 2 anos HBVDNA indetectável <20% 39% 94% 78% <30% em 3 anos 48% 47% em 4 anos 26% Perda de HBs. Ag 1 -2% 5% em 2 anos 4% Normalização ALT <50% 80% ------ Resistência >70% >20% em 2 anos 1, 2% em 6 anos 0 Soroconversão HBe. Ag

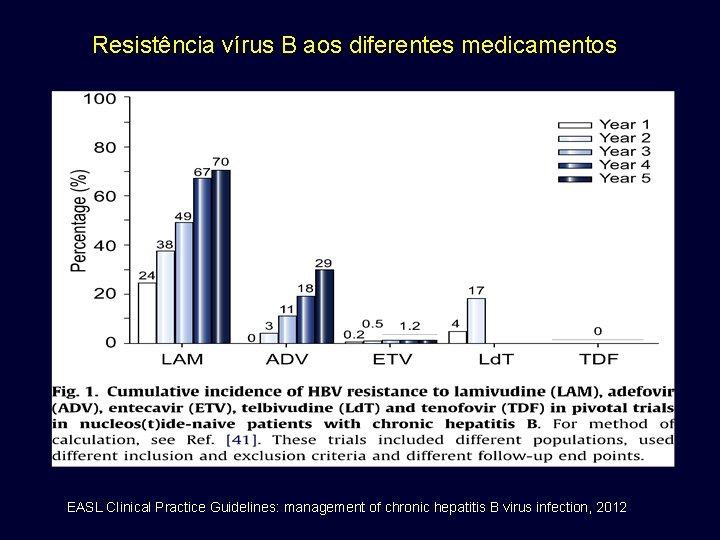
Resistência vírus B aos diferentes medicamentos EASL Clinical Practice Guidelines: management of chronic hepatitis B virus infection, 2012

Hepatite C > 170 milhões de infectados no mundo • 1, 5 - 3, 0 % da população mundial (> 170 milhões de infectados) • Brasil – inquérito capitais: 1, 38 -1, 56% 2, 6 – 3, 0 milhões de infectados • Principal causa de doença hepática crônica: • 70% dos casos de hepatite crônica • 40% dos casos de cirrose hepática • Principal indicação de transplante hepático • Seis genótipos (1, 2, 3, 4, 5, 6); 50 subtipos • genótipo 1 é o mais prevalente

VÍRUS DA HEPATITE C RNA 5’ C E 1 E 2 UTR NS-2 NS-3 NS-4 NS-5 3010 -3033 AMINOÁCIDOS Proteína ESTRUTURAL NÃO-ESTRUTURAL Ciclo de vida do vírus Proteína core (C) e 2 glicoproteínas do envelope (E 1 e E 2) Proteases (NS 2/3 e NS 3), helicase (NS 3), RNA polimerase RNA dependente (NS 5) 3’

Mecanismos de transmissão do vírus C Parenteral • Transfusões de hemoderivados • Compartilhamento de seringas, agulhas e outros objetos cortantes • Tatuagens, “piercings” • Acidentes ocupacionais Vertical: risco < 6% Sexual: monogâmicos <3% promíscuos 2 -12% Ribeirão Preto: profissionais do sexo (prostitutas/michês): 3, 7% travestis: 11, 3% (Passos, 1999/2000)


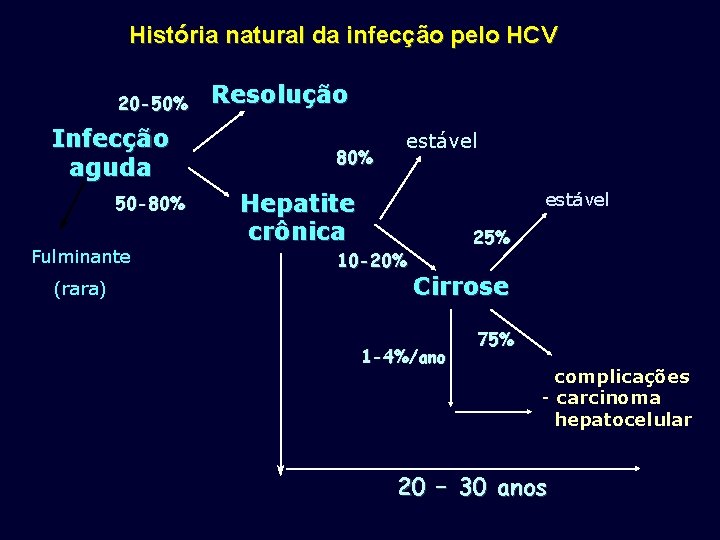
História natural da infecção pelo HCV 20 -50% Infecção aguda 50 -80% Fulminante (rara) Resolução 80% estável Hepatite crônica 10 -20% 25% Cirrose 1 -4%/ano 75% complicações - carcinoma hepatocelular 20 – 30 anos

HEPATITE C Diagnóstico Anamnese e exame físico - ênfase na história epidemiológica - na maioria dos casos o diagnóstico é casual - dissociação entre achados clínicos, laboratoriais e histológicos

HEPATITE C Diagnóstico 1) Anti HCV Teste sorológico de triagem 2) RNA HCV Mandatório em pacientes anti. HCV positivo Confirmação da infecção pelo HCV 3) Genotipagem do VHC Planejamento da dose e duração do tratamento Estimativa de resposta ao tratamento



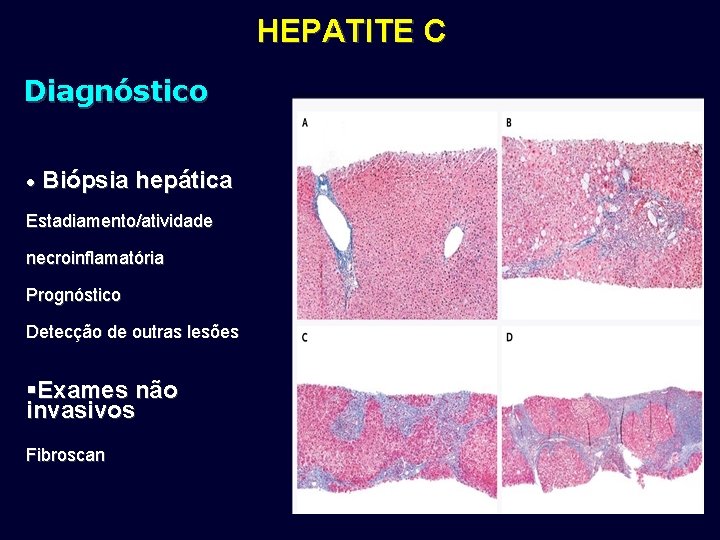
HEPATITE C Diagnóstico • Biópsia hepática Estadiamento/atividade necroinflamatória Prognóstico Detecção de outras lesões §Exames não invasivos Fibroscan

HEPATITE C Manifestações extra-hepáticas -forte associação Crioglobulinemia mista Porfiria cutânea tardia Glomerulonefrite membranoproliferativa

HEPATITE C Candidatos à triagem sorológica Usuários de drogas ilícitas injetáveis (passado recente ou remoto) Portadores de condições associadas a alta prevalência da infecção pelo HCV: a) portadores de HIV b) hemofílicos com história de transfusão por fator de coagulação antes de 1987 c) pacientes submetidos à hemodiálise d) pacientes com aumento inexplicável das aminotransferases e) portadores de tatuagens f) uso intranasal de cocaína

HEPATITE C Candidatos à triagem sorológica Receptores de transfusões ou doações de órgãos - Pessoas que receberam hemotransfusões antes de julho de 1992 - Receptores de transplantes de julho de 1992 Crianças de mães infectadas pelo HCV Profissionais da área da saúde Parceiros sexuais de pessoas portadoras de HCV Coorte nascida entre 1945 -1964 EASL, 2011

Fatores preditivos de resposta favorável ao tratamento da hepatite C Ø genótipo 2 ou 3 (RVS em cerca de 80% casos) Ø caucasianos Ø carga viral baixa Ø ausência de cirrose ou fibrose em ponte Ø sexo feminino Ø idade < 40 anos Ø adesão ao tratamento Ø cinética viral durante o tratamento Ø IL 28 B: genótipo CC > CT > TT Poynard & col. , 1998; Fried, NEJM, 2002 Hadziyannis Ann Int Med. , 2004; Rosen, NEJM, 2011 ;

Fatores preditivos de resposta desfavorável ao tratamento da hepatite C ü genótipo 1 ou 4 ü carga viral elevada (>600000 -800000 UI/ml, independente do genótipo) ü cirrose ou fibrose em ponte ü sexo masculino ü idade > 40 anos ü co-infecção HIV-HCV ü resistência à insulina, IMC elevado ü alcoolismo, uso de drogas Foster, EASL, 2005, Romero Gomez, Gastroenterology, 2005; Zeuzem, Gastroenterology, 2005

Objetivos do tratamento Ø Erradicar a infecção pelo vírus C Ø “endpoint”: resposta virológica sustentada (RVS) – que equivale a cura da infecção em >99% dos casos Ø Diminuir/impedir a propagação da doença Ø Prevenir o desenvolvimento de formas avançadas da doença/complicações (CHC)

TRATAMENTO DA HEPATITE C INTERFERON alfa 2 a ou 2 b - 3 MUI sc 3 x/semana -Brasil: genótipo 2/3; virgens de tto; RNAHCV < 600000 UI/ml; não cirróticos INTERFERON PEGUILADO ALFA 2 a – 180 µg sc 1 x/semana Seringa com 0, 5 ml=180µg INTERFERON PEGUILADO ALFA 1 x/semana Apresentações de 80, 100 e 120 µg RIBAVIRINA 250 mg – 15 mg/kg/dia Até 75 kg – 1000 mg/dia > 75 kg – 1250 mg/dia 2 b 1, 5µg/kg sc

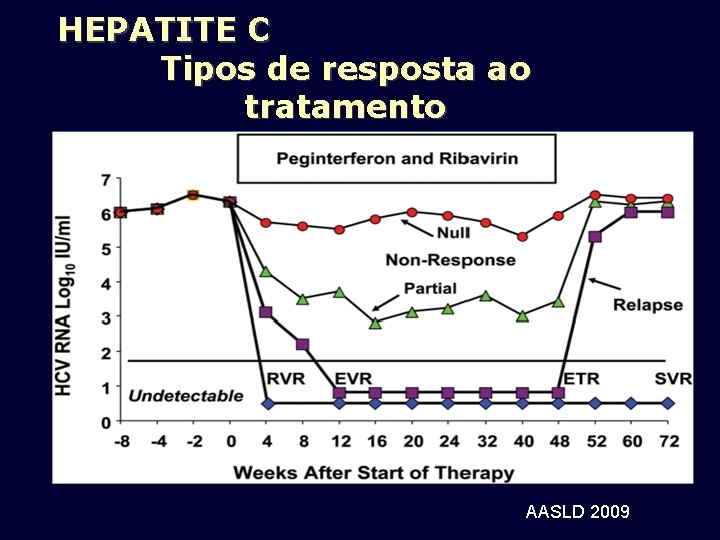
HEPATITE C Tipos de resposta ao tratamento AASLD 2009

TIPOS DE RESPOSTA RVS – RESPOSTA VIROLÓGICA SUSTENTADA : RNAHCV indetectável 24 semanas após término de tratamento RVR – RESPOSTA VIROLÓGICA RÁPIDA: RNA HCV indetectável na semana 4 de tratamento, mantida até o final do tratamento RVP – RESPOSTA VIROLÓGICA PRECOCE: RNA HCV detectável na semana 4, mas indetectável na semana 12, mantida até o final do tratamento RVL – RESPOSTA VIROLÓGICA LENTA: RNA com queda ≥ 2 log, mas detectável na semana 12, RNAHCV indetectável na semana 24, mantido até o final do tratamento RN – “null responder”: Queda <2 log na semana 12 em relação ao nível basal RP – Partial nonresponse: Queda >2 log na semana 12 em relação ao nível basal, porém com RNAHCV detectável nas semanas 12 e 24.

Hepatite C: Evolução do tratamento 1986 1998 2002 2001 4050% 42 39 34 Resposta virológica sustentada 16 6 IFN 6 m 12 m IFN/RB V 6 m IFN/RBV PEGIFN/RBV 12 m 12 m Adaptado Strader & col. , Hepatology,

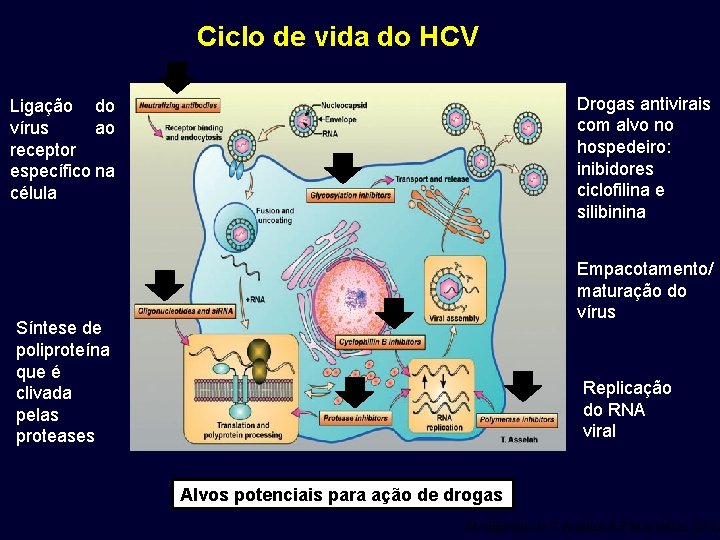
Ciclo de vida do HCV Drogas antivirais com alvo no hospedeiro: inibidores ciclofilina e silibinina Ligação do vírus ao receptor específico na célula Síntese de poliproteína que é clivada pelas proteases Empacotamento/ maturação do vírus Replicação do RNA viral Alvos potenciais para ação de drogas Modificado de T Asselah & P Marcellin, 2012

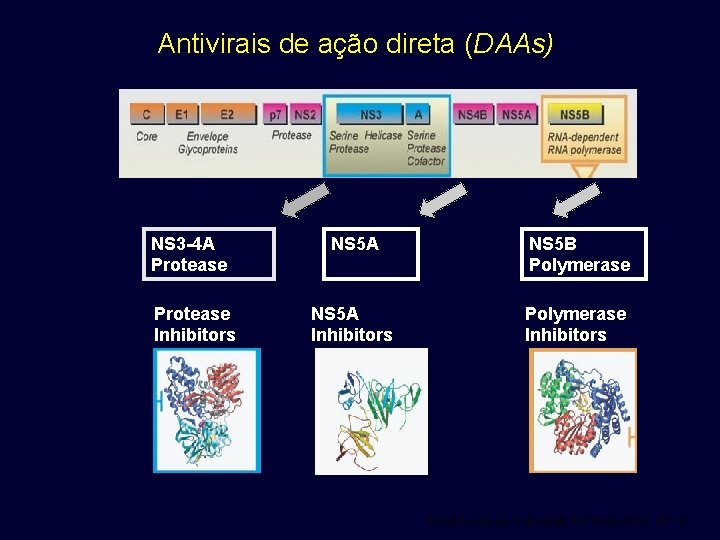
Antivirais de ação direta (DAAs) NS 3 -4 A Protease Inhibitors NS 5 A NS 5 B Polymerase NS 5 A Inhibitors Polymerase Inhibitors Modificado de T Asselah & P Marcellin, 2012

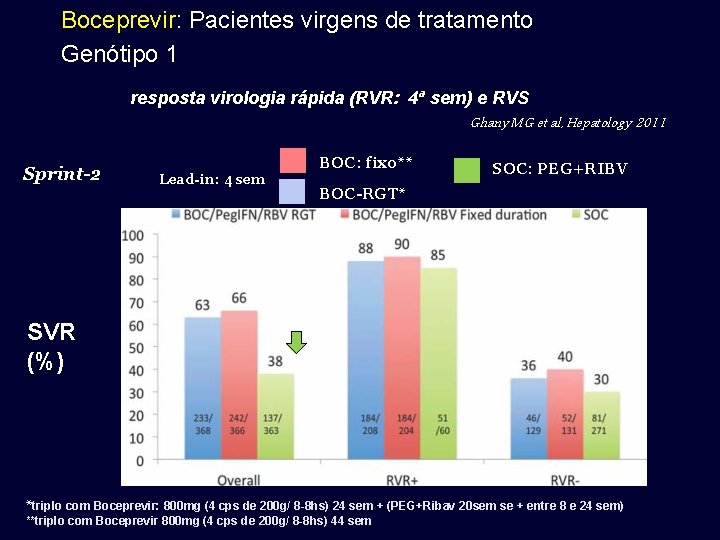
Boceprevir: Pacientes virgens de tratamento Genótipo 1 SPRINT-2 BOC: fixo** BOC-RGT* Ghany MG et al, Hepatology 2011 SOC: PEG+RBV Lead-in: 4 sem 30% SVR (%) *triplo com Boceprevir: 800 mg (4 cps de 200 g/ 8 -8 hs) 24 sem + (PEG+Ribav 20 sem se + entre 8 e 24 sem) **triplo com Boceprevir 800 mg (4 cps de 200 g/ 8 -8 hs) 44 sem

Boceprevir: Pacientes virgens de tratamento Genótipo 1 resposta virologia rápida (RVR: 4ª sem) e RVS Ghany MG et al, Hepatology 2011 Sprint-2 SVR (%) Lead-in: 4 sem BOC: fixo** SOC: PEG+RIBV BOC-RGT* *triplo com Boceprevir: 800 mg (4 cps de 200 g/ 8 -8 hs) 24 sem + (PEG+Ribav 20 sem se + entre 8 e 24 sem) **triplo com Boceprevir 800 mg (4 cps de 200 g/ 8 -8 hs) 44 sem

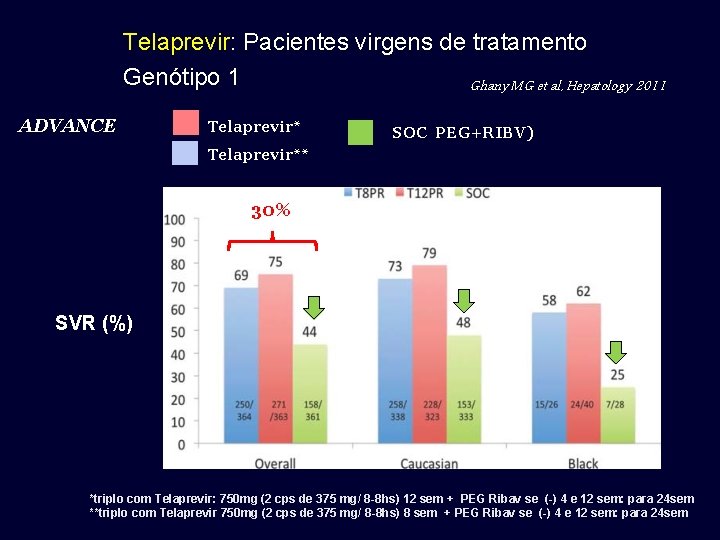
Telaprevir: Pacientes virgens de tratamento Genótipo 1 Ghany MG et al, Hepatology 2011 ADVANCE Telaprevir* SOC PEG+RIBV) Telaprevir** 30% SVR (%) *triplo com Telaprevir: 750 mg (2 cps de 375 mg/ 8 -8 hs) 12 sem + PEG Ribav se (-) 4 e 12 sem: para 24 sem **triplo com Telaprevir 750 mg (2 cps de 375 mg/ 8 -8 hs) 8 sem + PEG Ribav se (-) 4 e 12 sem: para 24 sem

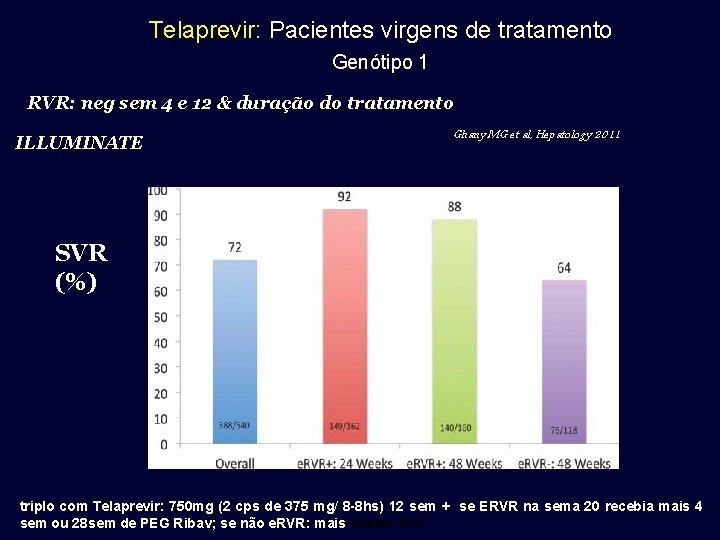
Telaprevir: Pacientes virgens de tratamento Genótipo 1 RVR: neg sem 4 e 12 & duração do tratamento Ghany MG et al, Hepatology 2011 ILLUMINATE SVR (%) triplo com Telaprevir: 750 mg (2 cps de 375 mg/ 8 -8 hs) 12 sem + se ERVR na sema 20 recebia mais 4 sem ou 28 sem de PEG Ribav; se não e. RVR: mais 24 sem SOC

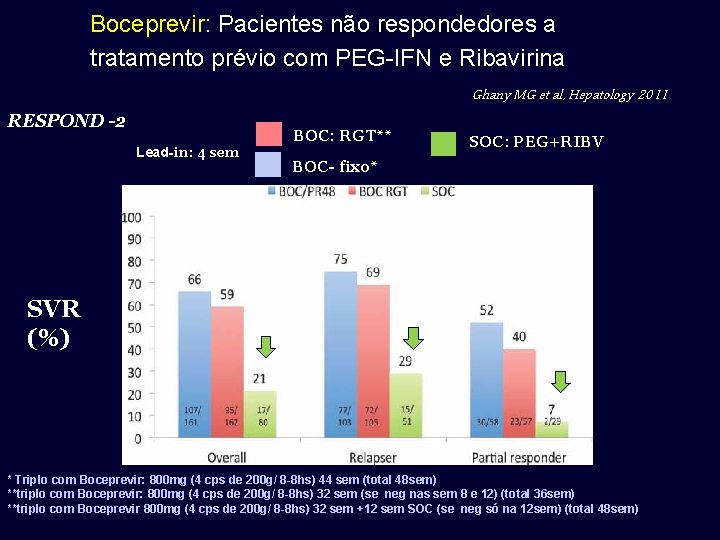
Boceprevir: Pacientes não respondedores a tratamento prévio com PEG-IFN e Ribavirina Ghany MG et al, Hepatology 2011 RESPOND -2 Lead-in: 4 sem SVR (%) BOC: RGT** SOC: PEG+RIBV BOC- fixo* * Triplo com Boceprevir: 800 mg (4 cps de 200 g/ 8 -8 hs) 44 sem (total 48 sem) **triplo com Boceprevir: 800 mg (4 cps de 200 g/ 8 -8 hs) 32 sem (se neg nas sem 8 e 12) (total 36 sem) **triplo com Boceprevir 800 mg (4 cps de 200 g/ 8 -8 hs) 32 sem +12 sem SOC (se neg só na 12 sem) (total 48 sem)

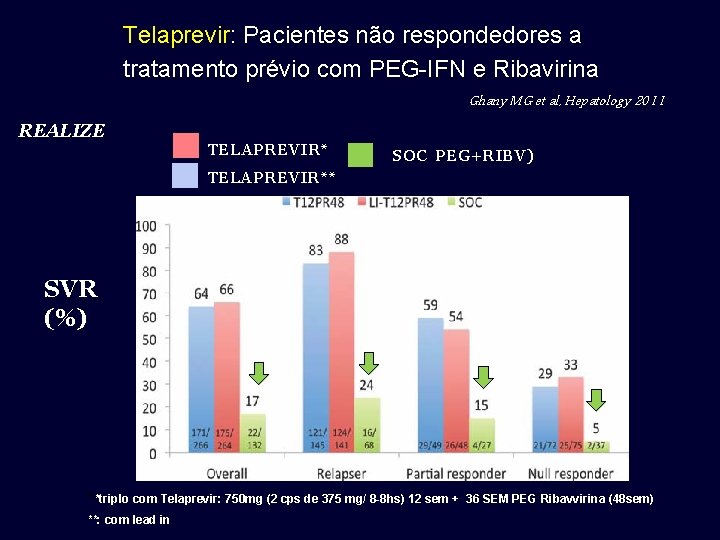
Telaprevir: Pacientes não respondedores a tratamento prévio com PEG-IFN e Ribavirina Ghany MG et al, Hepatology 2011 REALIZE TELAPREVIR* SOC PEG+RIBV) TELAPREVIR** SVR (%) **triplo com Telaprevir: 750 mg (2 cps de 375 mg/ 8 -8 hs) 12 sem + 36 SEM PEG Ribavvirina (48 sem) **: com lead in

Inibidores de protease: interação droga-droga Ø Boceprevir e Telaprevir: metabolização hepática (via cit. P 450 CYP 3 A ). Ø Inibidores do CYP 3 A : podem aumentar a concentração plasmática de drogas metabolizadas pela mesma via: . prolongar efeito terapêutico e/ou. provocar toxicidade Ø Uso concomitante de drogas que induzem CYP 3 A pode : diminuir a concentração plasmática de boceprevir ou telaprevir e reduzir seus efeitos terapêuticos ØTelaprevir: inibidor do transporte de PGP e pode aumentar a concentração plasmática de drogas que são substratos para PGP transporte e aumentar reações adversas. University of Liverpool (http: //www. hep-druginteractions. org)

Inibidores de protease: efeitos colaterais Mauss et al, 2012 Telaprevir Boceprevir Ø Anemia Ø prurido cutâneo ØDisgeusia Ø rash cutâneo Ø prurido cutâneo Ø Desconforto anal Ø rash cutâneo Ø dor anal ØDesconforto anal Ø dor anal ØSangramento anal ØNáusea Ø vômitos ØSangramento anal ØDiarreia ØNáusea Ø Anemia ØDiarreia ØInsônia Øcefaleia

Mensagens Øincorporação do Boceprevir e Telaprevir no arsenal terapêutico melhorou a taxa de RVS em pacientes genótipo 1. Ø A resposta guiada permite encurtar o tratamento para 24 -28 semanas em proporção significativa de pacientes. Ø Uso em combinação com PEG-IFN e Ribavirina Ø Efeito limitado em não respondedores parciais e nulos Ø Limitação: resistência viral, efeitos colaterais, interação de drogas, não tolerância/não resposta em um grupo imunossuprimido, doença hepática avançada). de pacientes (transplante,

Mensagens ØNovas abordagens usando combinações de DAAs sem IFN com ou sem ribavirina estão em estudo, sendo observada rápida e profunda queda HCV RNA. Ø O HCV poderá ser erradicado com regime sem IFN. Ø A combinação ideal ainda não foi encontrada mas espera-se progresso nesse sentido nos próximos 5 -10 anos. Ø A eficácia das novas drogas e combinações têm potencial de propiciar tratamento finito e de curar todos os pacientes infectados.

Prof. Dra. Ana Martinelli adlcmart@fmrp. usp. br Dra. Marcia Villanova marciagvillanova@gmail. com Divisão de Gastroenterologia Departamento de Clínica Médica HCFMRP – USP