Haz Ahora 3 minutos Anota la pregunta y



















- Slides: 26

Haz Ahora… 3 minutos Anota la pregunta y respuesta en el cuaderno ¿Podemos ver un átomo?

Respuesta. No podemos verlo, el átomo es tan pequeño que si aislamos uno y lo iluminamos para observarlo, la energía de la luz sería suficiente para interactuar con él, alterándolo y moviéndolo de nuestro campo visual.

Pero si no podemos verlo: ¿cómo hemos llegado hoy día a conocer el átomo? El entenderlo ha sido un proceso largo y a veces infructuoso; sin embargo, la investigación de muchos hombres y mujeres de ciencia, ha permitido construir un modelo del átomo… Y la historia de esta búsqueda es la que revisaremos en las siguientes clases.

Clase N° 1 Modelo atómico de Dalton y Thomsom 8 vo año de enseñanza Básica Objetivo: Diferenciar ambos modelos atómicos, los científicos que los postulan y sus descubrimientos.

¿Qué es un modelo científico? Los modelos, son representaciones de la realidad que los científicos construyen con la información obtenida en sus experimentos. Suelen tener una validez «provisoria» , ya que en la medida que mejoran los métodos de investigación, la información es más precisa y permite ajustar dichos modelos.

Desde la antigua Grecia, los hombres dedicados a la ciencia trataron de comprender la composición de la materia. En el siglo V A. C. , el filósofo Demócrito se preguntaba lo siguiente: ¿Hasta qué límite podemos dividir la materia? Tratando de dar una respuesta, propuso que la materia estaba conformada por pequeñas partículas, invisibles al ojo humano, a las que llamó «átomos» , y que eran la parte más pequeña de materia posible. La palabra átomo (del griego «a» sin, «tomo» división), sugiere la idea de estructuras imposibles de dividir.

Teoría atómica de Dalton. La primera descripción científica sobre la constitución de la materia mediante átomos se debe a John Dalton, en 1808. Propone que los átomos son la parte más pequeña de un elemento, y que poseen las propiedades características de ese elemento. Para Dalton el átomo aún conservaba su carácter de indivisible, lo que no es muy distinto a la idea planteada por Demócrito. Sin embargo, propone la existencia de diferentes tipos de átomos (diferenciados por su masa) cuya combinación da lugar a diferentes sustancias.

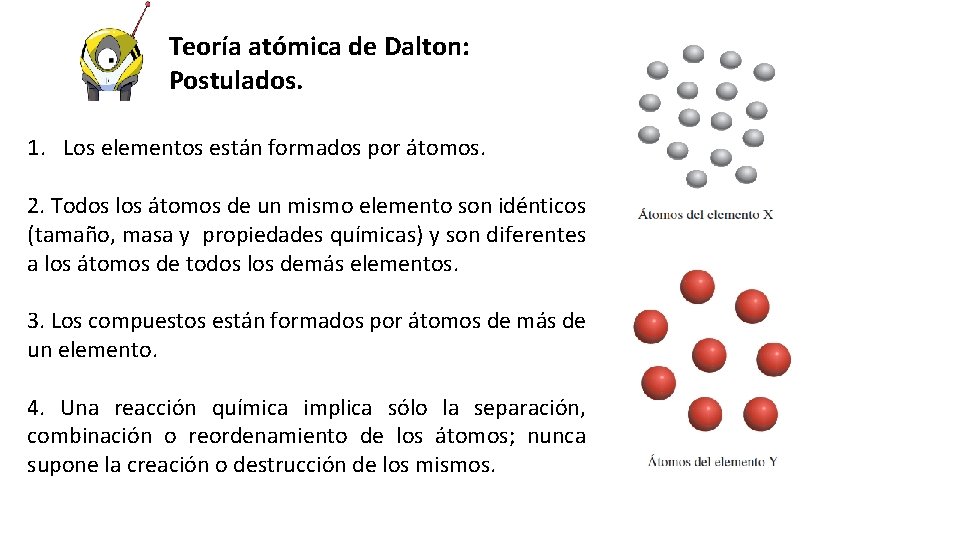
Teoría atómica de Dalton: Postulados. 1. Los elementos están formados por átomos. 2. Todos los átomos de un mismo elemento son idénticos (tamaño, masa y propiedades químicas) y son diferentes a los átomos de todos los demás elementos. 3. Los compuestos están formados por átomos de más de un elemento. 4. Una reacción química implica sólo la separación, combinación o reordenamiento de los átomos; nunca supone la creación o destrucción de los mismos.

Esto daba lugar a la siguiente interrogante: ¿cómo es el interior del átomo? La respuesta a esta pregunta necesariamente requirió establecer un modelo de átomo más complejo que lo propuesto por Dalton.

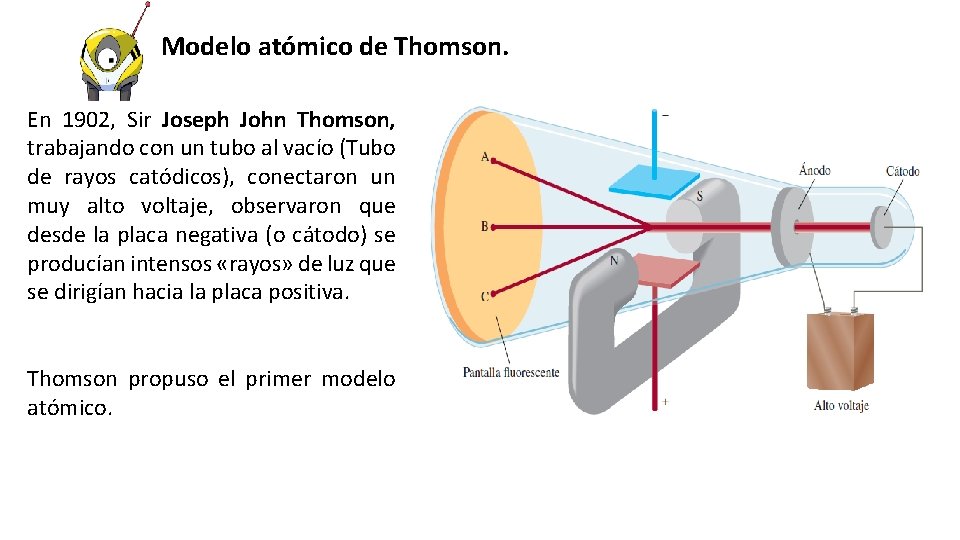
Modelo atómico de Thomson. En 1902, Sir Joseph John Thomson, trabajando con un tubo al vacío (Tubo de rayos catódicos), conectaron un muy alto voltaje, observaron que desde la placa negativa (o cátodo) se producían intensos «rayos» de luz que se dirigían hacia la placa positiva. Thomson propuso el primer modelo atómico.

Experimentación. Rayo catódico producido en un tubo de descarga. Consta de un tubo de vidrio del cual se ha evacuado casi todo el aire. Si se colocan dos placas metálicas y se conectan a una fuente de alto voltaje, la placa con carga negativa, llamada cátodo, emite un rayo invisible. Este rayo catódico se dirige hacia la placa con carga positiva, llamada ánodo, que pasa por una perforación y continúa su trayectoria hasta el otro extremo del tubo.

El rayo catódico se inclina hacia abajo (imagen superior) cuando se le acerca el polo norte del imán y cuando la polaridad del imán se invierte, el rayo se inclina hacia la dirección opuesta. Experimentando con un imán, Thomson estableció que no era luz sino que diminutas partículas cargadas negativamente y que provenían desde el átomo, a las que llamó electrones. De acuerdo con esto, Thomson postuló que uno de los componentes del átomo eran estas partículas, que frente a determinados estímulos, podían abandonar el átomo.

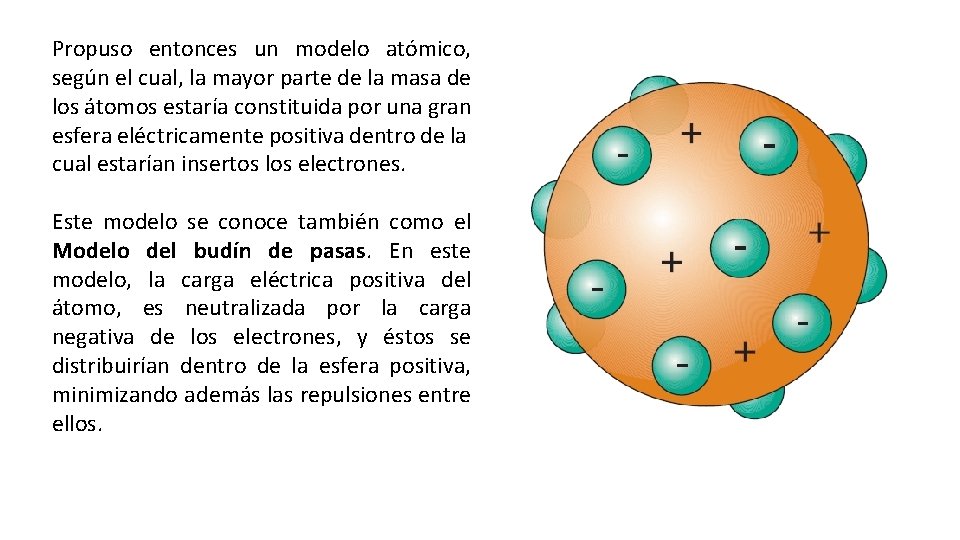
Propuso entonces un modelo atómico, según el cual, la mayor parte de la masa de los átomos estaría constituida por una gran esfera eléctricamente positiva dentro de la cual estarían insertos los electrones. Este modelo se conoce también como el Modelo del budín de pasas. En este modelo, la carga eléctrica positiva del átomo, es neutralizada por la carga negativa de los electrones, y éstos se distribuirían dentro de la esfera positiva, minimizando además las repulsiones entre ellos.

Actividad: Responda las preguntas de su guía de trabajo de Modelos atómicos.

Ticket de salida 3 minutos Anota la pregunta y respuesta en el cuaderno ¿Qué es un modelo científico?

Haz Ahora… 5 minutos Anota la pregunta y respuesta en el cuaderno ¿Cuáles son los postulados de Dalton?

Respuesta. 1. Los elementos están formados por átomos. 2. Todos los átomos de un mismo elemento son idénticos (tamaño, masa y propiedades químicas) y son diferentes a los átomos de todos los demás elementos. 3. Los compuestos están formados por átomos de más de un elemento. 4. Una reacción química implica sólo la separación, combinación o reordenamiento de los átomos; nunca supone la creación o destrucción de los mismos.

Clase N° 2 Modelo atómico de Rutherford y Bohr 8 vo año de enseñanza Básica Objetivo: Diferenciar ambos modelos atómicos, los científicos que los postulan y sus descubrimientos.

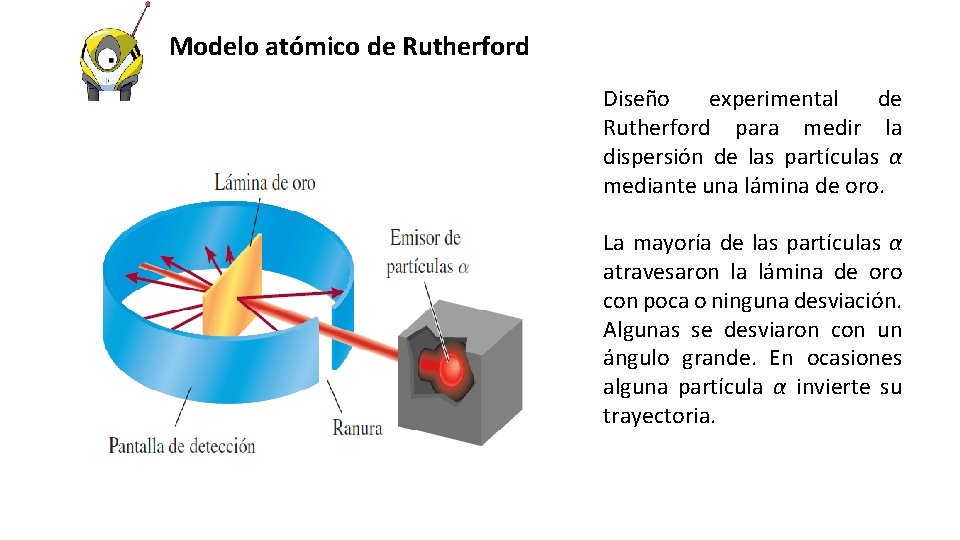
Modelo atómico de Rutherford. Algunos años después, Ernest Rutherford, realizó un experimento para «poner a prueba» el Modelo del budín de pasas. Dicho experimento consideraba el «bombardeo» de una delgadísima lámina de oro con cargas positivas. Los resultados obtenidos fueron realmente sorprendentes. Rutherford observó que algunas partículas positivas pasaban de largo sin experimentar ninguna alteración, y otras, en cambio, se desviaban levemente.

Modelo atómico de Rutherford Diseño experimental de Rutherford para medir la dispersión de las partículas α mediante una lámina de oro. La mayoría de las partículas α atravesaron la lámina de oro con poca o ninguna desviación. Algunas se desviaron con un ángulo grande. En ocasiones alguna partícula α invierte su trayectoria.

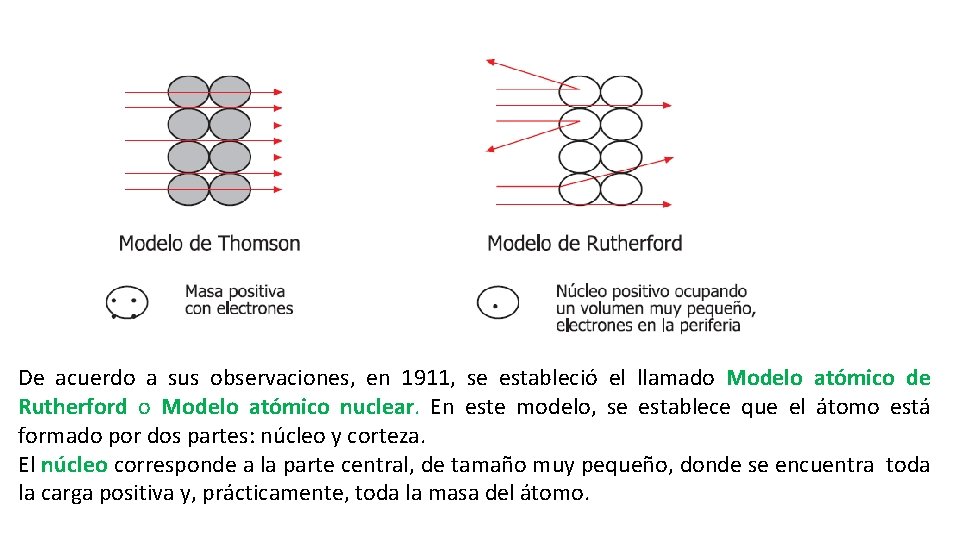
De acuerdo a sus observaciones, en 1911, se estableció el llamado Modelo atómico de Rutherford o Modelo atómico nuclear. En este modelo, se establece que el átomo está formado por dos partes: núcleo y corteza. El núcleo corresponde a la parte central, de tamaño muy pequeño, donde se encuentra toda la carga positiva y, prácticamente, toda la masa del átomo.

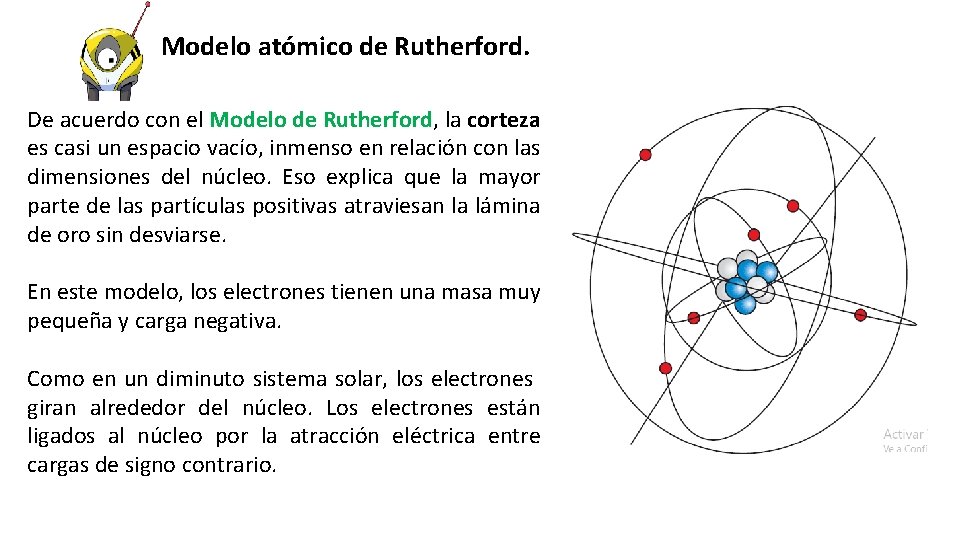
Modelo atómico de Rutherford. De acuerdo con el Modelo de Rutherford, la corteza es casi un espacio vacío, inmenso en relación con las dimensiones del núcleo. Eso explica que la mayor parte de las partículas positivas atraviesan la lámina de oro sin desviarse. En este modelo, los electrones tienen una masa muy pequeña y carga negativa. Como en un diminuto sistema solar, los electrones giran alrededor del núcleo. Los electrones están ligados al núcleo por la atracción eléctrica entre cargas de signo contrario.

Modelo atómico de Bohr. Aunque el modelo de Rutherford era bastante consistente y permitía explicar los fenómenos observados hasta el momento, no proveía explicación acerca de por qué se producen algunos fenómenos luminiscentes, es decir, no permitía explicar por qué algunas sustancias, al absorber energía o ser calentadas levemente, posteriormente emitían energía en forma de luz. Esto fue explicado por el físico danés Niels Bohr, quien, en 1913, dio una hipótesis conocida como Teoría atómica de Bohr.

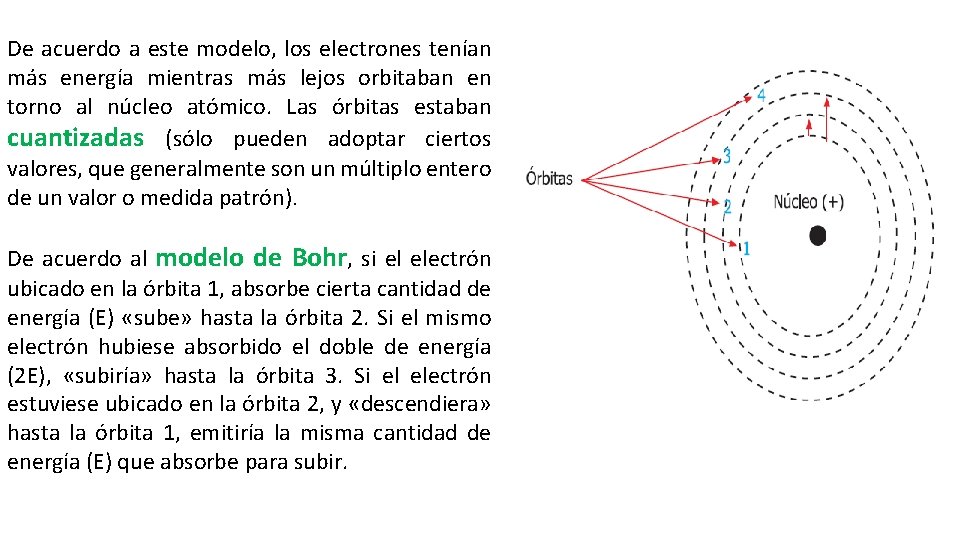
De acuerdo a este modelo, los electrones tenían más energía mientras más lejos orbitaban en torno al núcleo atómico. Las órbitas estaban cuantizadas (sólo pueden adoptar ciertos valores, que generalmente son un múltiplo entero de un valor o medida patrón). De acuerdo al modelo de Bohr, si el electrón ubicado en la órbita 1, absorbe cierta cantidad de energía (E) «sube» hasta la órbita 2. Si el mismo electrón hubiese absorbido el doble de energía (2 E), «subiría» hasta la órbita 3. Si el electrón estuviese ubicado en la órbita 2, y «descendiera» hasta la órbita 1, emitiría la misma cantidad de energía (E) que absorbe para subir.

Actividad: Responda las preguntas de su Guía de trabajo de Modelos atómicos.

3 minutos La determinación del núcleo atómico corresponde a: A) Dalton. B) Rutherford. C) Chadwick. D) Thomson. E) Goldstein.
 Informe expositivo ejemplos
Informe expositivo ejemplos Argumento logico
Argumento logico Haz ahora
Haz ahora Escribe en tu cuaderno de
Escribe en tu cuaderno de Derişim pil formülü
Derişim pil formülü Affirmative verbs spanish
Affirmative verbs spanish Ertsey attila
Ertsey attila Oracion del catequista señor haz que yo sea tu testigo
Oracion del catequista señor haz que yo sea tu testigo Lavar command
Lavar command Haz plant
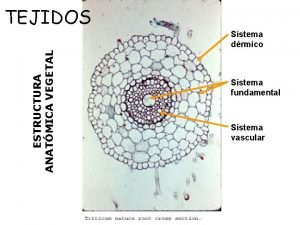
Haz plant Atactostele
Atactostele Ven di sal
Ven di sal Padre nuestro
Padre nuestro Csenger művelődési ház
Csenger művelődési ház Mapa conceptual del sistema nervioso
Mapa conceptual del sistema nervioso Ház terv
Ház terv Cromatismo en las medias rojas
Cromatismo en las medias rojas Archicerebelo
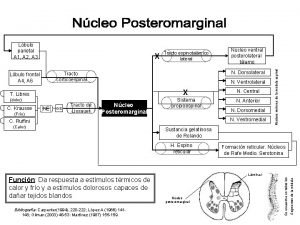
Archicerebelo Nucleo posteromarginal
Nucleo posteromarginal Paleoespinotalamico
Paleoespinotalamico Vin di sal haz ten ve pon se
Vin di sal haz ten ve pon se Ház alaprajz lekérdezés
Ház alaprajz lekérdezés �zge�mi? haz?rlama
�zge�mi? haz?rlama Paleocerebelo
Paleocerebelo Laura sinema
Laura sinema Mandatos en espanol
Mandatos en espanol Buttering in welding
Buttering in welding