HARMONISATION DE LA REGLEMENTATION PHARMACEUTIQUES AU SEIN DE















- Slides: 28

HARMONISATION DE LA REGLEMENTATION PHARMACEUTIQUES AU SEIN DE L’UEMOA ET DE L’OOAS Dr Carmelle HOUNNOU Pharm. D, M. Sc Santé Publique/Réglementation Cellule pour l’Harmonisation de la Règlementation et la Coopération Pharmaceutiques (CHRCP)

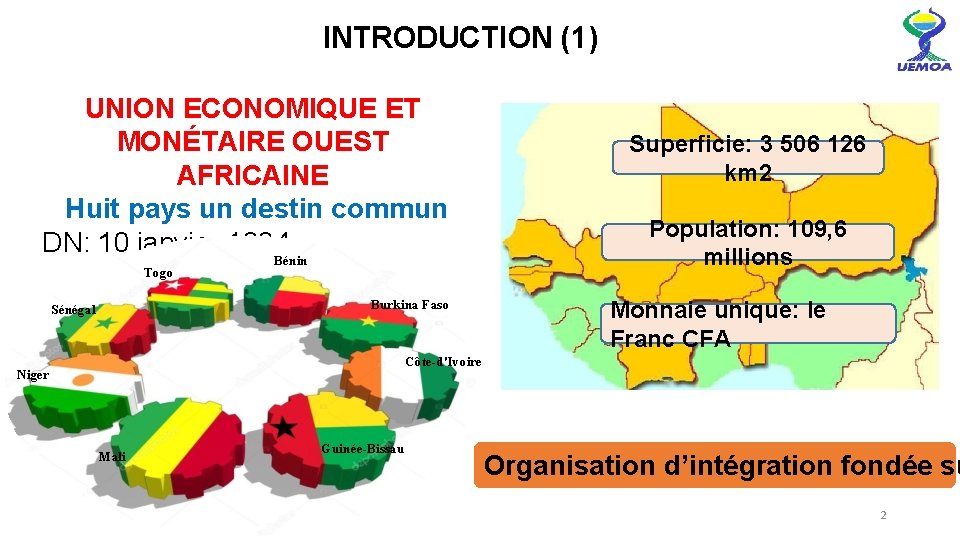
INTRODUCTION (1) UNION ECONOMIQUE ET MONÉTAIRE OUEST AFRICAINE Huit pays un destin commun DN: 10 janvier 1994 Bénin Togo Burkina Faso Sénégal Superficie: 3 506 126 km 2 Population: 109, 6 millions Monnaie unique: le Franc CFA Côte-d'Ivoire Niger Mali Guinée-Bissau Organisation d’intégration fondée su 2

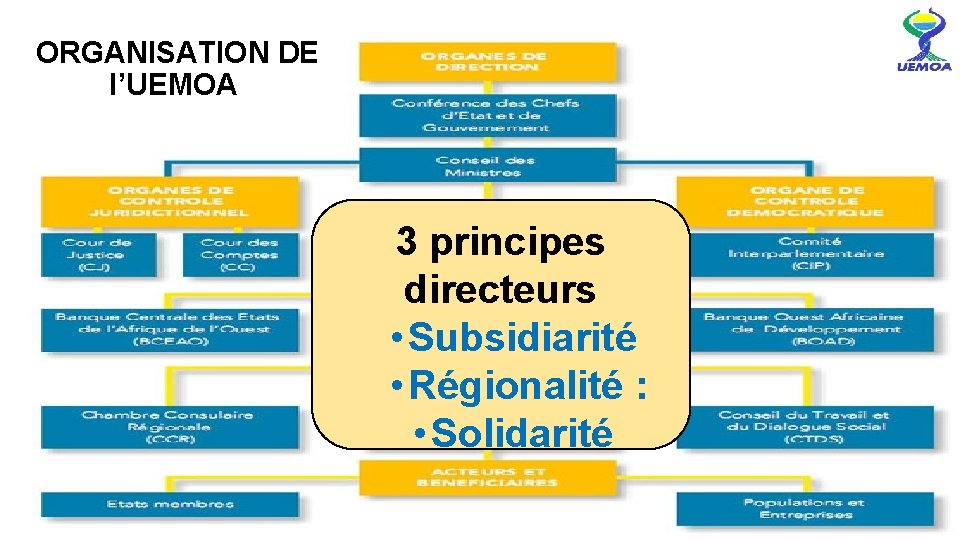
ORGANISATION DE l’UEMOA 3 principes directeurs • Subsidiarité • Régionalité : • Solidarité

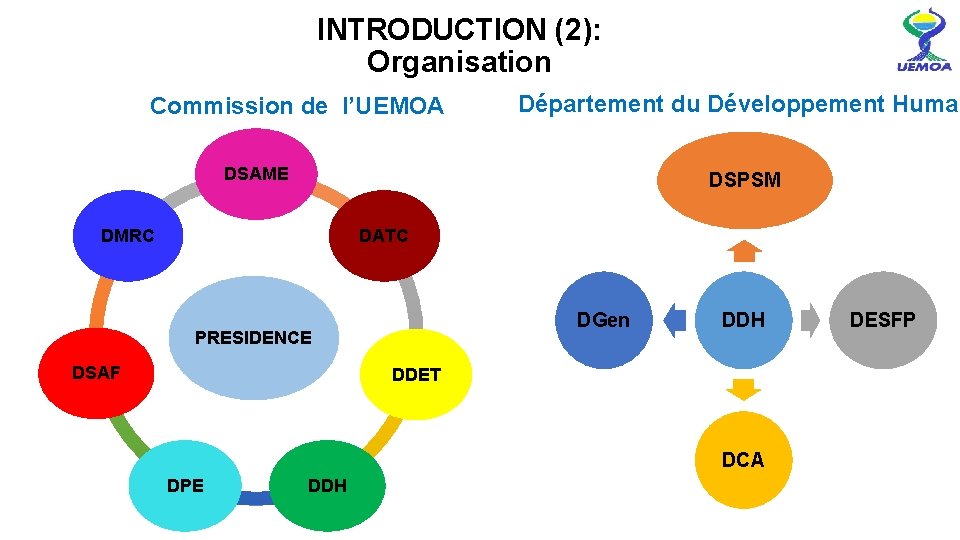
INTRODUCTION (2): Organisation Commission de l’UEMOA Département du Développement Humai DSAME DSPSM DMRC DATC DGen PRESIDENCE DSAF DDH DDET DCA DPE DDH DESFP

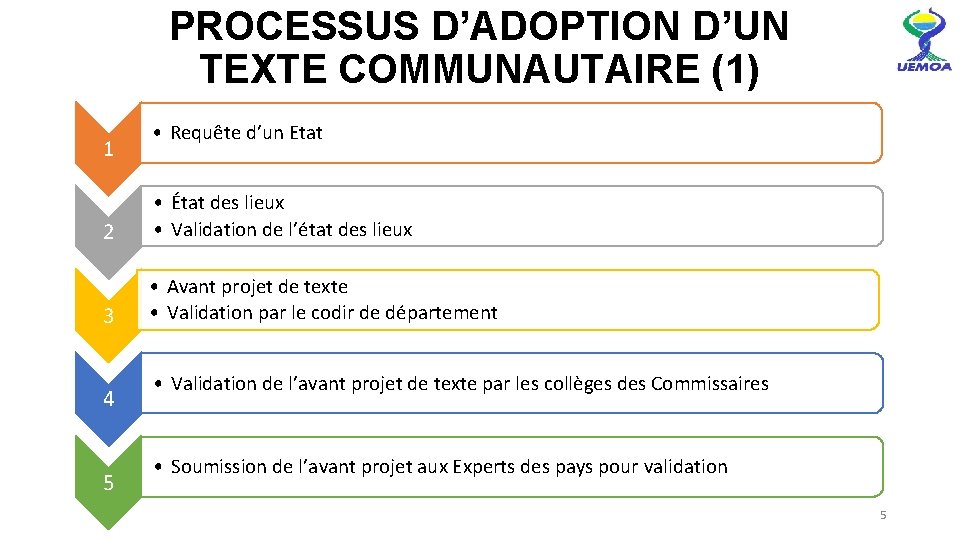
PROCESSUS D’ADOPTION D’UN TEXTE COMMUNAUTAIRE (1) 1 • Requête d’un Etat 2 • État des lieux • Validation de l’état des lieux 3 • Avant projet de texte • Validation par le codir de département 4 5 • Validation de l’avant projet de texte par les collèges des Commissaires • Soumission de l’avant projet aux Experts des pays pour validation 5

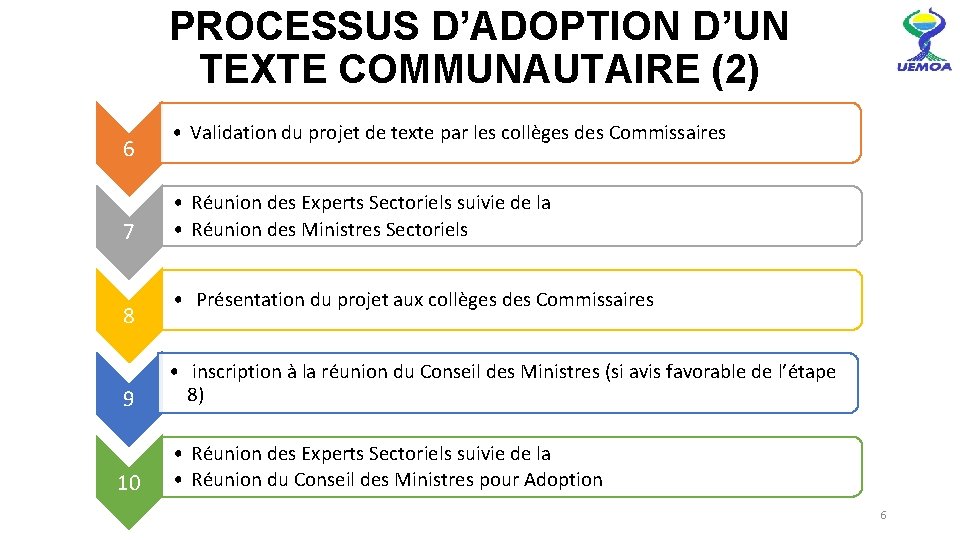
PROCESSUS D’ADOPTION D’UN TEXTE COMMUNAUTAIRE (2) 6 7 8 • Validation du projet de texte par les collèges des Commissaires • Réunion des Experts Sectoriels suivie de la • Réunion des Ministres Sectoriels • Présentation du projet aux collèges des Commissaires 9 • inscription à la réunion du Conseil des Ministres (si avis favorable de l’étape 8) 10 • Réunion des Experts Sectoriels suivie de la • Réunion du Conseil des Ministres pour Adoption 6

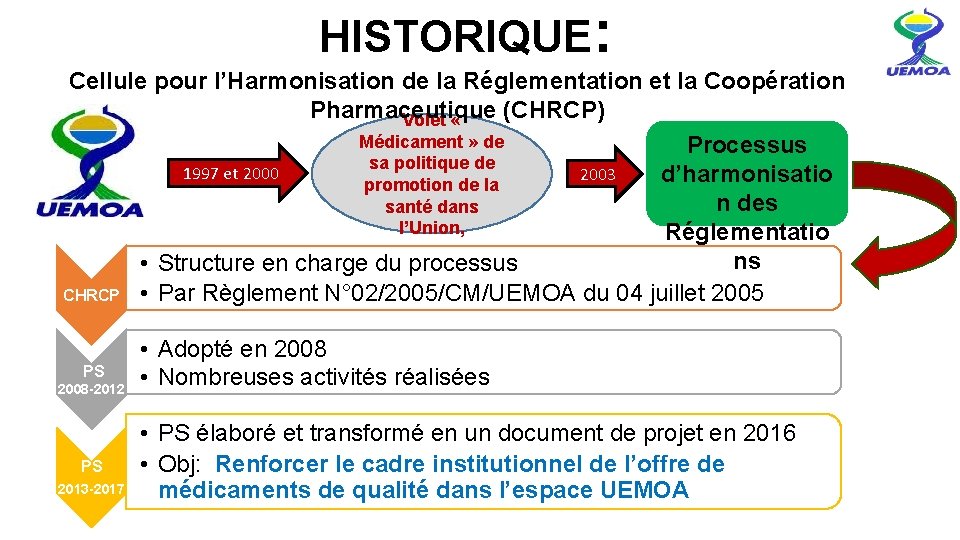
HISTORIQUE: Cellule pour l’Harmonisation de la Réglementation et la Coopération Pharmaceutique (CHRCP) Volet « Médicament » de Processus sa politique de 1997 et 2000 2003 d’harmonisatio promotion de la n des santé dans l’Union, Réglementatio ns • Structure en charge du processus CHRCP • Par Règlement N° 02/2005/CM/UEMOA du 04 juillet 2005 PS 2008 -2012 PS 2013 -2017 • Adopté en 2008 • Nombreuses activités réalisées • PS élaboré et transformé en un document de projet en 2016 • Obj: Renforcer le cadre institutionnel de l’offre de médicaments de qualité dans l’espace UEMOA www. uemoa. int www. izf. net

ETAT DES LIEUX AU DÉPART DU PROCESSUS D’HARMONISATION DANS L’ESPACE UEMOA EN 2006 ANRP Coopération technique et échanges Fonctions de la Réglementation 8

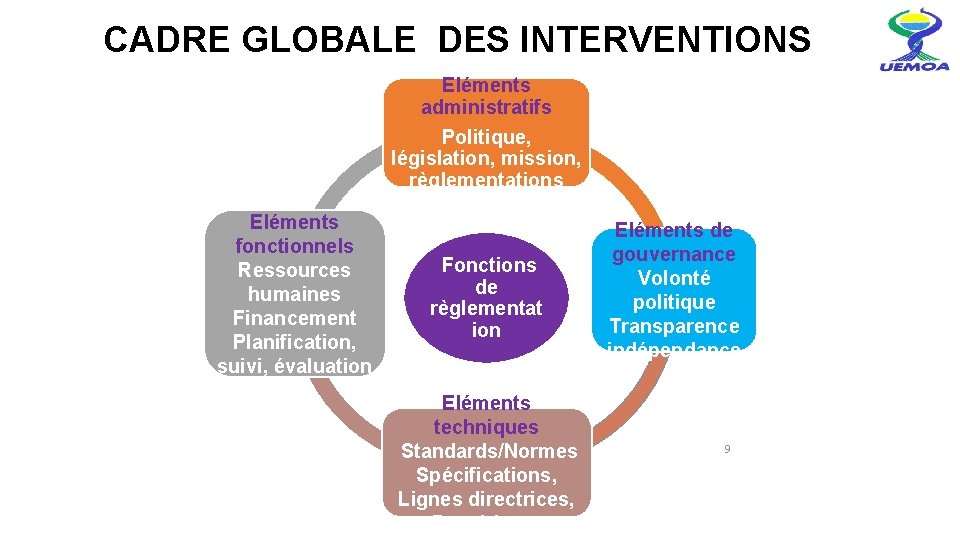
CADRE GLOBALE DES INTERVENTIONS Eléments administratifs Politique, législation, mission, règlementations Eléments fonctionnels Ressources humaines Financement Planification, suivi, évaluation Fonctions de règlementat ion Eléments techniques Standards/Normes Spécifications, Lignes directrices, Procédures Eléments de gouvernance Volonté politique Transparence indépendance 9

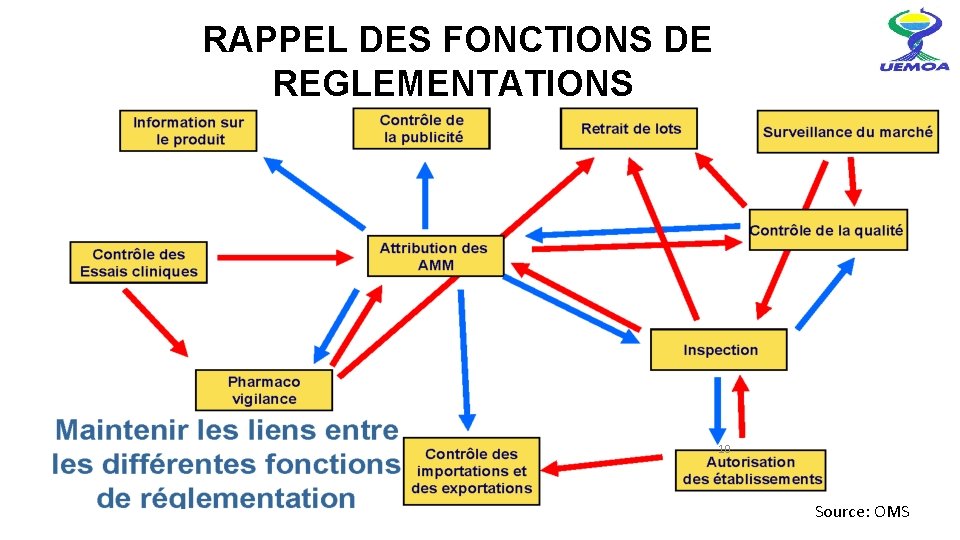
RAPPEL DES FONCTIONS DE REGLEMENTATIONS 10 Source: OMS

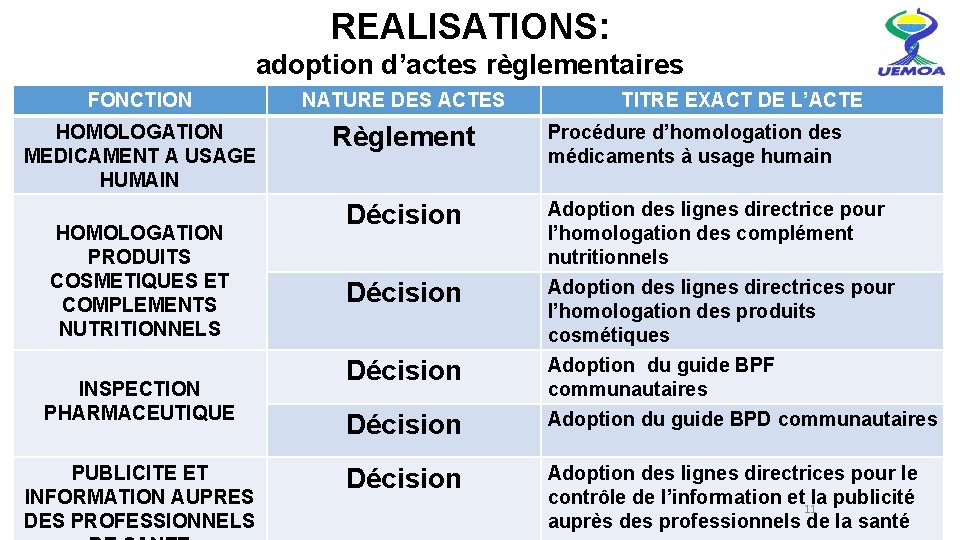
REALISATIONS: adoption d’actes règlementaires FONCTION NATURE DES ACTES HOMOLOGATION MEDICAMENT A USAGE HUMAIN Règlement HOMOLOGATION PRODUITS COSMETIQUES ET COMPLEMENTS NUTRITIONNELS INSPECTION PHARMACEUTIQUE PUBLICITE ET INFORMATION AUPRES DES PROFESSIONNELS Décision Décision TITRE EXACT DE L’ACTE Procédure d’homologation des médicaments à usage humain Adoption des lignes directrice pour l’homologation des complément nutritionnels Adoption des lignes directrices pour l’homologation des produits cosmétiques Adoption du guide BPF communautaires Adoption du guide BPD communautaires Adoption des lignes directrices pour le contrôle de l’information et la publicité 11 auprès des professionnels de la santé

REALISATIONS (2) • Adoption de la directive portant détermination de la liste commune des médicaments, produits pharmaceutiques, de matériels et produits médicaux exonérés de TVA • Etude sur la fiscalité du médicament • Formation avec l’appui de l’OMS sur les bonnes pratiques de fabrication et de distribution du médicament • Elaboration d’un document de plaidoyer pour lutter contre le marché illicite et la contrefaçon des méd. • Réalisation d’une étude sur l’usage rationnel des médicaments et consommables essentiels • Organisation des ateliers nationaux de sensibilisation et de vulgarisation des textes communautaires • Suivi de la mise en en œuvre des textes communautaires

REALISATIONS (3) • Étude de faisabilité sur le changement de statut des Autorités de Réglementation Pharmaceutiques des Etats Membres de l’UEMOA • Evaluation des Autorités Nationales de Réglementation Pharmaceutiques des Etats Membres de l’UEMOA • Réactualisation des textes de la CHRCP • Mise en place et fonctionnement des Comités techniques consultatifs homologation, inspection et contrôle qualité • Renforcement des capacités des Etats Membres à travers des formations sous régionales en inspection, en homologation • Élaboration du projet de Directive portant changement de statut des Autorités de Réglementation Pharmaceutique des EM

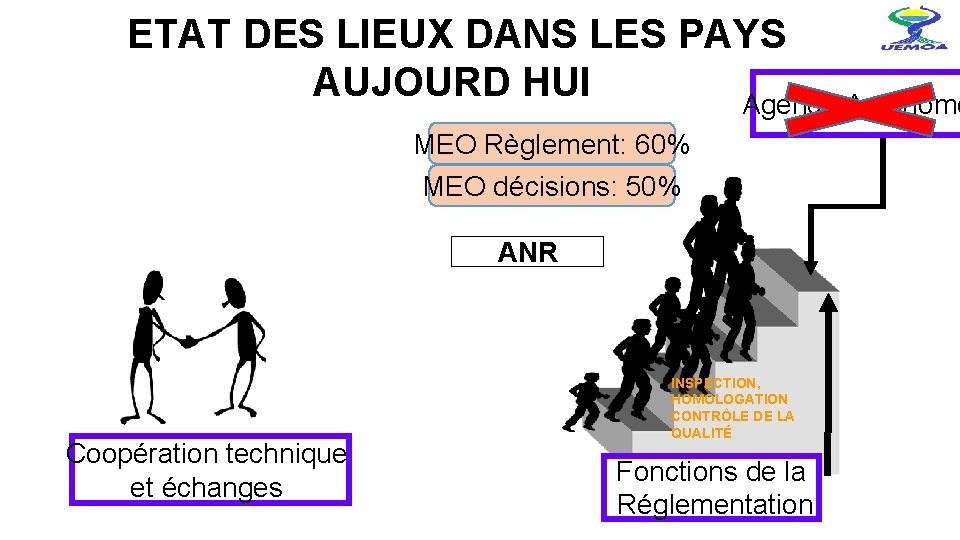
ETAT DES LIEUX DANS LES PAYS AUJOURD HUI Agence Autonome MEO Règlement: 60% MEO décisions: 50% ANR Coopération technique et échanges INSPECTION, HOMOLOGATION CONTRÔLE DE LA QUALITÉ Fonctions de la Réglementation 14

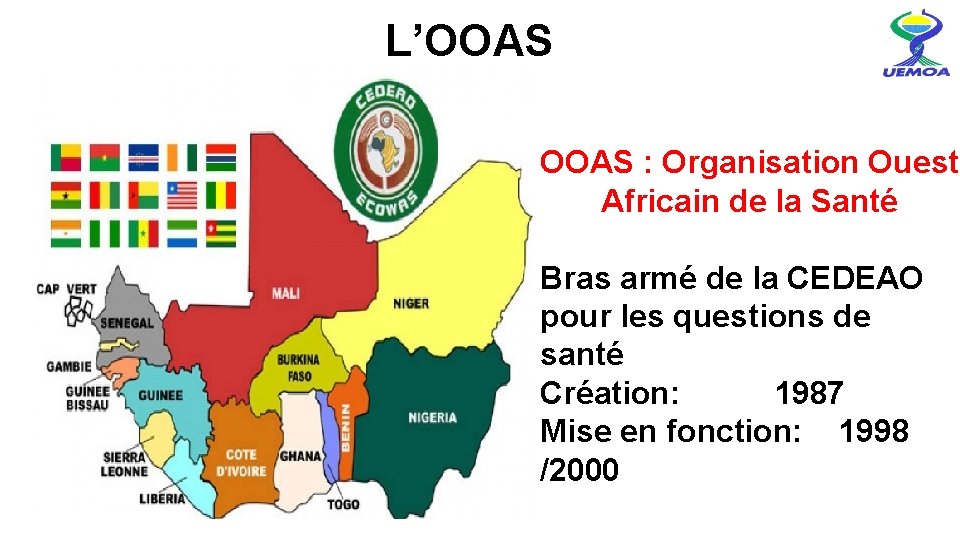
L’OOAS : Organisation Ouest Africain de la Santé Bras armé de la CEDEAO pour les questions de santé Création: 1987 Mise en fonction: 1998 /2000

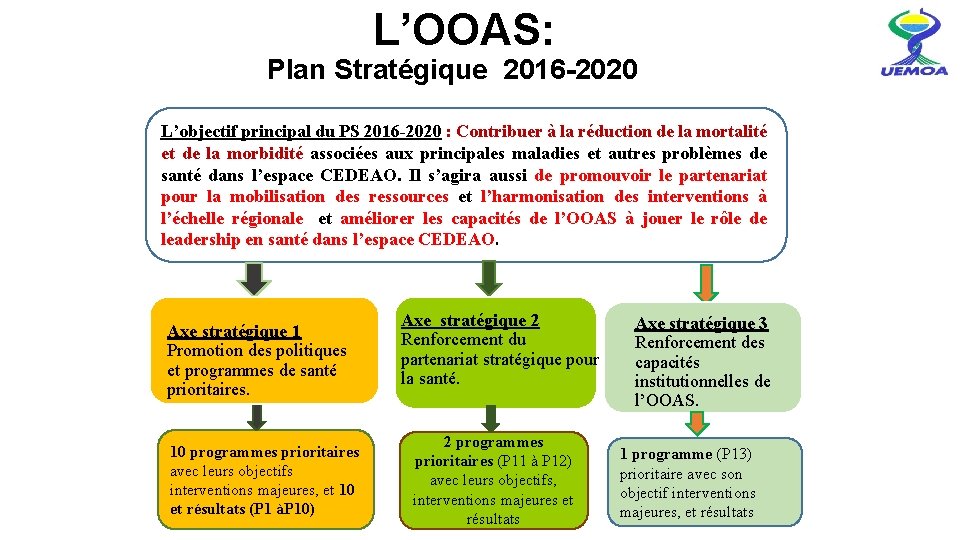
L’OOAS: Plan Stratégique 2016 -2020 L’objectif principal du PS 2016 -2020 : Contribuer à la réduction de la mortalité et de la morbidité associées aux principales maladies et autres problèmes de santé dans l’espace CEDEAO. Il s’agira aussi de promouvoir le partenariat pour la mobilisation des ressources et l’harmonisation des interventions à l’échelle régionale et améliorer les capacités de l’OOAS à jouer le rôle de leadership en santé dans l’espace CEDEAO. Axe stratégique 1 Promotion des politiques et programmes de santé prioritaires. 10 programmes prioritaires avec leurs objectifs interventions majeures, et 10 et résultats (P 1 àP 10) Axe stratégique 2 Renforcement du partenariat stratégique pour la santé. 2 programmes prioritaires (P 11 à P 12) avec leurs objectifs, interventions majeures et 16 résultats Axe stratégique 3 Renforcement des capacités institutionnelles de l’OOAS. 1 programme (P 13) prioritaire avec son objectif interventions majeures, et résultats

L’OOAS: Quelques domaines d’interventions ØPlan pharmaceutique Régionale (élaboration et adoption) Ø Contrôle qualité • analyse situationnelle des laboratoires de CQ • accompagnement pour le SMQ, • accompagnement pour la certification ISO 17025 • projet SWEDD ØPharmacovigilance (analyse situationnelle des pays) ØLutte contre les faux Médicaments • Plan stratégie régionale

COLLABORATION AVEC L’OOAS: contexte et justification Ø Le Sommet de l’UA tenu en juillet 2012 a approuvé la feuille de route sur la responsabilité partagée et la solidarité mondiale pour lutter contre le SIDA, la tuberculose et le paludisme en Afrique. Ø Le programme d’harmonisation de la réglementation des médicaments en Afrique (AMRH) est un programme du NEPAD. Ø L'objectif du programme d’harmonisation de la réglementation des médicaments en Afrique (AMRH) est d'établir et d'améliorer les normes et les exigences 18

COLLABORATION AVEC L’OOAS: contexte et justification (2) Le programme AMRH se concentre sur trois domaines d’intervention clés à savoir: (1) les réformes politiques et réglementaires; (2) le renforcement des capacités de régulation et 19

COLLABORATION AVEC L’OOAS: contexte et justification (2) • • • Acquis du Programme lancement des programmes AMRH régionaux adoption d’une loi type pour réglementer les médicaments à l'échelle continentale lancement de centres régionaux 20

COLLABORATION AVEC L’OOAS: AMRH en Afrique de l’Ouest Dates/évènements importants Ø 2009: Lancement initiative AMRH (NEPAD et partenaires) ØMars 2011: soumission de 2 projets OOAS, UEMOA Exigence: 1 projet unique discussions!!!! ØAvril 2013: mise en place d’un protocole d’accord entre l'OOAS et de l'UEMOA • Avril 2014: Accord => Feuille de route, mécanismes de gouvernance partagée, période transitoire 3 ans avec 2 sousprojets • Juillet 2014: Réunion validation+accord 15 ANR et Partenaires • Février 2015: Lancement projet AMRH_AO et mise en place 21

COLLABORATION AVEC L’OOAS: état de mise en œuvre ØMars 2015: Participation Comité de pilotage programme AMRH_EAC (Secrétariats OOAS_UEMOA) ØJuin à Août 2015: Programme Twinning & training entre ANRs ØAvril 2016: Atelier de validation du CTD commun et 2ème Comité de pilotage du programme AMRH_AO ØAvril 2016: Réunion pour le pré-approval d’un projet financé par la BM pour appuyer le programme AMRH-AO ØJuin 2016: Réunion des responsables des Laboratoires Nationaux de Contrôle de Qualité des Médicaments (LNCQM) des pays de l’espace CEDEAO, de la Mauritanie et du Tchad dans le cadre du projet SWEED. 22

COLLABORATION AVEC L’OOAS: état de mise en œuvre (2) ØMai 2016: 4ème Réunion du GTT- Politique des Médicaments et des Réformes Réglementaires sur la domestication de la loi type UA et 5ème réunion du Comité Consultatif de l'Harmonisation de la Réglementation des Médicaments en Afrique (AMRH); ØSeptembre 2016: Rencontre de concertation avec le NEPAD sur la domestication de Ø la loi type UA dans les Etats membres de l’UEMOA; ØOctobre 2016: Approval du projet financé par la BM pour appuyer le programme AMRH-AO (3 M $); ØFévrier 2017: Réunion des partenaires de l’initiative AMRH; 23 ØMai 2017: Avis favorable de la BM du projet AMRH AO (instance

PERSPECTIVES Ø Poursuite mise en œuvre projet AMRH_AO: • Réunion Comité de pilotage conjoint • Mise en œuvre du projet BM • Mise en place des GTT_AO • Finalisation et adoption du CTD commun ( 15 pays CEDEAO) • Evaluation du SRP des pays • Activités d’inspection et d’évaluation conjointes 24

PERSPECTIVES (2) ØPoursuite des initiatives de l’UEMOA dans les sens des directives conjointement retenues • Renforcement du plaidoyer et de la sensibilisation des pays sur les questions pharmaceutiques et pour le renforcement du cadre institutionnel des ARNP; • Finalisation et adoption des textes communautaires dans le pipeline • Renforcement de l’arsenal des textes règlementaires • Collaboration entre la CHRCP et l’ACAME • Poursuite du soutien aux pays à travers des projets d’appui

CONCLUSION ØL’harmonisation de la règlementation dans les Etats membres de l’UEMOA constitue encore un chantier immense; ØAujourd’hui, beaucoup d’efforts restent à faire; ØCependant amélioration lente mais progressive des pratiques dans les pays; ØImportance d’une coordination des interventions et des initiatives d’harmonisation; ØImportance d’un plaidoyer fort et constant de tous les acteurs à

MERCI de votre attention

• INTRODUCTION • HISTORIQUE • REALISATIONS • COLLABORATION AVEC L OOAS • PERSPECTIVES • CONCLUSION