Halov prvky halogeny Atomy halogen kol 1 Dopl



















- Slides: 23
Halové prvky /halogeny/

Atomy halogenů: Úkol 1: Doplň značky prvků (pracuj s periodickou tabulkou): 127 53 35 17 19 9 80 35

Kontrola úkolu 1 I Cl F Br

Postavení halogenů v PSP IA IIIB IVB VB VIIB VIIIB IB IIIA IVA VA VIIA Úkol 2: Napiš, ve které skupině najdeš halogeny: VIIIA 1 H 2 Li Be B C N O F Ne 3 Na Mg Al Si P S Cl Ar 4 K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr 5 Rb Sr Y Yr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe 6 Cs Ba La Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn 7 Fr Ra Ac Rf Db Sg Bh Hs Mt He

Kontrola úkolu 2 VII. A podskupina

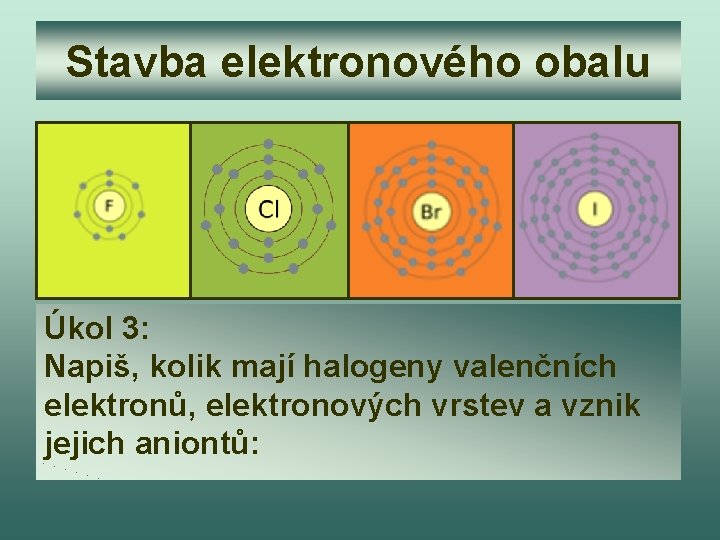
Stavba elektronového obalu Úkol 3: Napiš, kolik mají halogeny valenčních elektronů, elektronových vrstev a vznik jejich aniontů:

Kontrola úkolu 3 Fluór Počet valenčních elektronů 7 Počet elektronových vrstev 2 Chlór 7 3 Bróm 7 4 Jód 7 5 Halový prvek Clo + 1 e- → Cl. Fo + 1 e- → FBro + 1 e- → Br. Io + 1 e- → I-

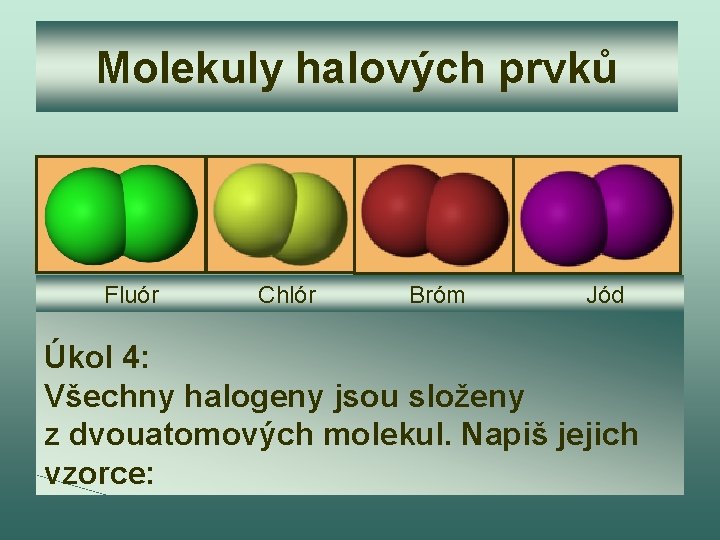
Molekuly halových prvků Fluór Chlór Bróm Jód Úkol 4: Všechny halogeny jsou složeny z dvouatomových molekul. Napiš jejich vzorce:

Kontrola úkolu 4 F 2, Cl 2, Br 2, I 2

Výskyt halogenů Protože jsou halogeny velmi reaktivní, vyskytují se v přírodě pouze vázané ve sloučeninách. Chlór - sůl kuchyňská, Na. Cl Bróm, jód se vyskytují v mořské vodě. Fluór - kazivec, Ca. F 2

Příprava chlóru Chlór se připravuje reakcí oxidu manganičitého, Mn. O 2 nebo manganistanu draselného s kyselinou chlorovodíkovou, HCl. Při demonstračním pokusu sledujte vlastnosti chlóru, hlavně jeho barvu, zápach, hustotu a porovnejte ji s hustotou vzduchu. HCl Mn. O 2 Cl 2

Pozoruj vlastnosti halogenů Bróm Jód Chlór Jód

Pozoruj další vlastnosti halogenů Bělicí účinky chlóru Rozpustnost jódu ve vodě a v lihu → Sublimace jódu

Úkol 5: Podle snímků 11, 12 a 13 doplň vlastnosti halogenů: Chlór je ………. . plyn, …… oční sliznici, je …. . než vzduch, má dezinfekční a …… účinky. Je dobře rozpustný ve vodě. Jód je ………, pevná látka, nerozpustná ve …. , rozpustná v …. na jodovou ……. . . Zahříváním jód ………, přechází z pevného skupenství přímo v …. . Bróm je …………, jedovatá kapalina. Fluór je žlutý, jedovatý plyn.

Kontrola úkolu 5 Chlór je žlutozelený plyn, dráždí oční sliznici, je těžší než vzduch, má dezinfekční a bělicí účinky. Je dobře rozpustný ve vodě. Jód je šedočerná, pevná látka, nerozpustná ve vodě, rozpustná v lihu na jodovou tinkturu. Zahříváním jód sublimuje, přechází z pevného skupenství přímo v plyn. Bróm je červenohnědá, jedovatá kapalina. Fluór je žlutý, jedovatý plyn.

Bezpečnost práce s halogeny Úkol 6: Při práci s halogeny se můžete setkat s níže uvedenými výstražnými symboly s písmenným označením. Napiš, jakou nebezpečnou vlastnost každý symbol představuje: T 1 Xn 2 C 3 T+ 4 N 5

Kontrola úkolu 6 1/ toxický 2/ zdraví škodlivý 3/ žíravý 4/ vysoce toxický 5/ nebezpečný pro životní prostředí

Úkol 7: Důkaz jódu, doplň text: Jód dokážeme, když ……. tinkturu kápneme na brambor. Ten se zbarví …. . .

Kontrola úkolu 7 Jód dokážeme, když jodovou tinkturu kápneme na brambor. Ten se zbarví modře.

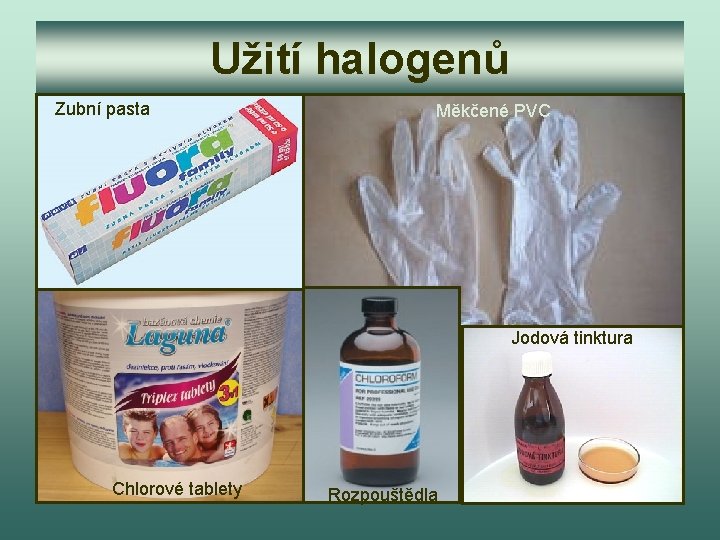
Užití halogenů Zubní pasta Měkčené PVC Jodová tinktura Chlorové tablety Rozpouštědla

Úkol 8: Podle snímku 20 doplň text: Největší použití má chlór. Používá se k ………. vody, k výrobě ………. hmot a ………… Fluór zvyšuje odolnost proti zubnímu …. , a proto se přidává do …… past. Jód se používá k přípravě …… tinktury, která má ………. . účinky.

Kontrola úkolu 8 Největší použití má chlór. Používá se k dezinfekci vody, k výrobě plastických hmot a rozpouštědel. Fluór zvyšuje odolnost proti zubnímu kazu, a proto se přidává do zubních past. Jód se používá k přípravě jodové tinktury, která má dezinfekční účinky.

Veškeré použité obrázky pocházejí z vlastních zdrojů nebo wikimedia commons. Mgr. Vaněk Vlastimil, autor