Halogenuros de alquilo y alcoholes Reacciones de Eliminacin























- Slides: 49

Halogenuros de alquilo y alcoholes Reacciones de Eliminación y sustitución

Halogenuros de alquilo. Estructura y usos. n n Solventes: el cloruro de metileno (CH 2 CI 2) y el cloroformo (CHCI 3) también son buenos disolventes para la limpieza y desengrasado. El cloroformo es más tóxico y carcinógeno que el cloruro de metileno, y ha sido reemplazado por éste último y otros disolventes en la mayoría de los desengrasantes industriales y removedores de pinturas. Incluso los disolventes halogenados más seguros, como el cloruro de metileno y el 1, 1, 1 -tricloroetano, deben utilizarse con cuidado. Todos son potencialmente tóxicos y carcinógenos, y disuelven los ácidos grasos que protegen la piel. Reactivos: muchas síntesis utilizan haluros de alquilo como materias primas para formar moléculas más complejas. Anestésicos: el cloroformo (CHCI 3) fue la primera sustancia que se descubrió que producía anestesia general, lo que trajo nuevas posibilidades para cirugías cuidadosas con pacientes inconscientes y relajados. Sin embargo, el cloroformo es tóxico y cancerígeno y pronto dejó de usarse. Pesticidas: los haluros de alquilo han contribuido a la salud de los seres humanos por su función como insecticidas.

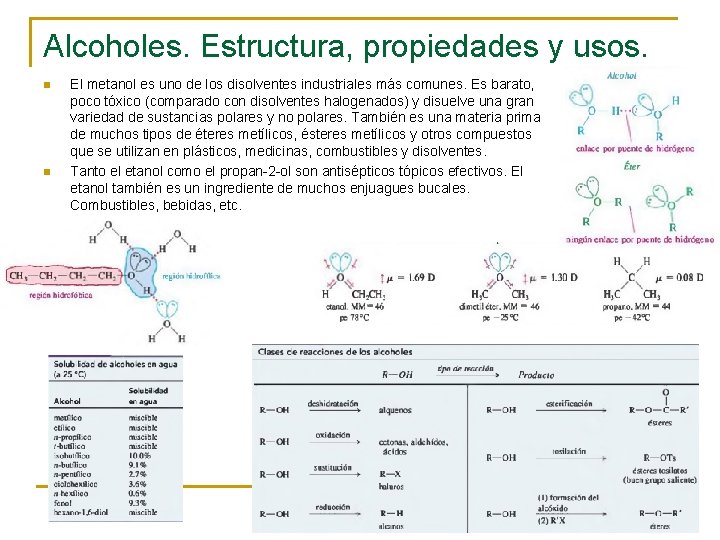
Alcoholes. Estructura, propiedades y usos. n n El metanol es uno de los disolventes industriales más comunes. Es barato, poco tóxico (comparado con disolventes halogenados) y disuelve una gran variedad de sustancias polares y no polares. También es una materia prima de muchos tipos de éteres metílicos, ésteres metílicos y otros compuestos que se utilizan en plásticos, medicinas, combustibles y disolventes. Tanto el etanol como el propan-2 -ol son antisépticos tópicos efectivos. El etanol también es un ingrediente de muchos enjuagues bucales. Combustibles, bebidas, etc.

Un nucleófilo (amante de núcleos) es una especie que reacciona cediendo un par de electrones libres a otra especie (el electrófilo), combinándose y enlazándose covalentemente con ella. Un nucleófilo, es también por definición una base de lewis. Un nucleófilo puede ser un anión o una molécula neutra con un par de electrones libres. Un electrófilo es un reactivo químico atraído hacia zonas ricas en electrones que participa en una reacción química aceptando un par de electrones formando un enlace con un nucleófilo. Ya que los electrófilos aceptan electrones, ellos son ácidos de lewis. La mayoría de los electrófilos están cargados positivamente, tienen un átomo que lleva una carga positiva parcial o bien no posee un octeto de electrones.

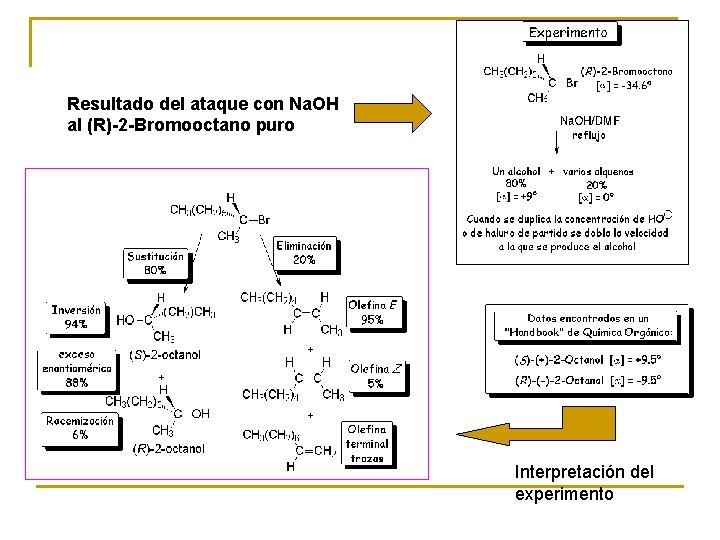
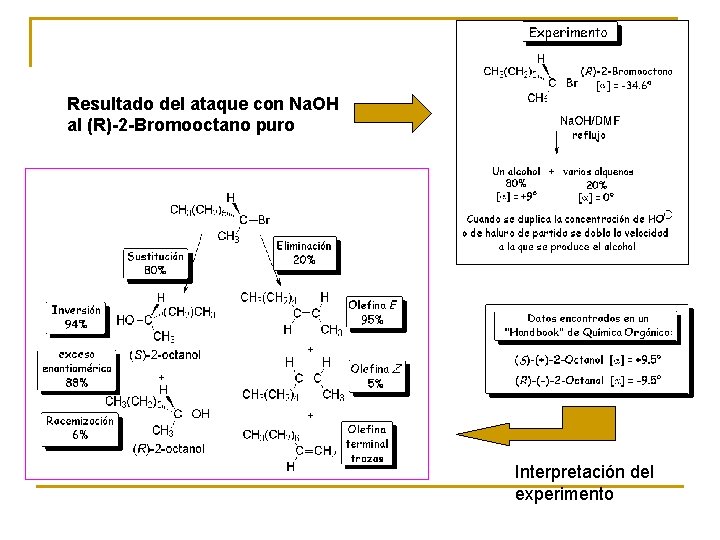
Resultado del ataque con Na. OH al (R)-2 -Bromooctano puro Interpretación del experimento

Estos resultados permiten hacer las siguientes deducciones lógicas: • El halógeno se ha sustituido por un grupo OH en su mayor parte. • El halógeno se ha eliminado en una pequeña parte. Este proceso parece complejo porque se forma una mezcla de varios alquenos u olefinas. • La configuración del alcohol es mayoritariamente S, la contraria del haluro de alquilo de partida. Por tanto, la reacción de sustitución se ha producido mayoritariamente con inversión de la configuración. • Se ha obtenido una pequeña cantidad de alcohol R, lo que sugiere que ha ocurrido un pequeño porcentaje de racemización. • La velocidad de reacción depende de los dos reactivos, haluro de alquilo y nucleófilo. Ambos deben intervenir en la etapa limitante de la velocidad.

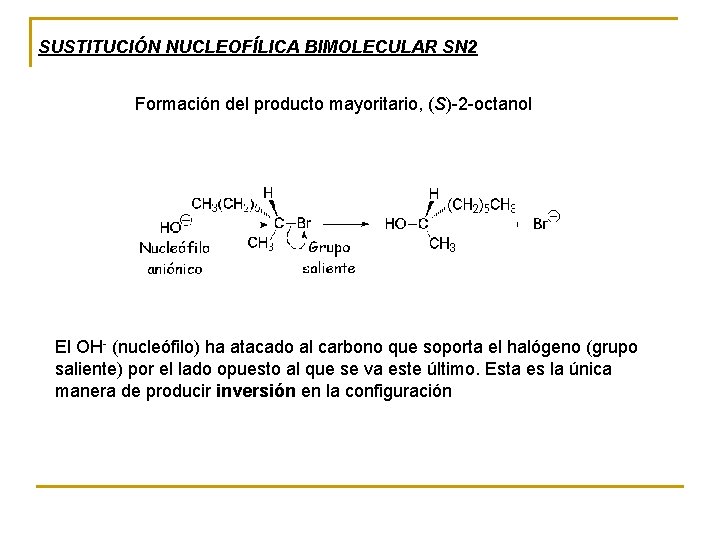
SUSTITUCIÓN NUCLEOFÍLICA BIMOLECULAR SN 2 Formación del producto mayoritario, (S)-2 -octanol El OH- (nucleófilo) ha atacado al carbono que soporta el halógeno (grupo saliente) por el lado opuesto al que se va este último. Esta es la única manera de producir inversión en la configuración

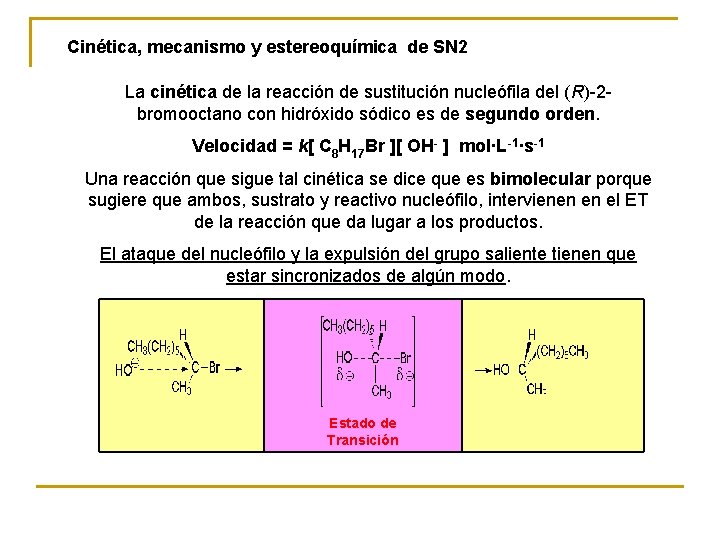
Cinética, mecanismo y estereoquímica de SN 2 La cinética de la reacción de sustitución nucleófila del (R)-2 bromooctano con hidróxido sódico es de segundo orden. Velocidad = k[ C 8 H 17 Br ][ OH- ] mol·L-1·s-1 Una reacción que sigue tal cinética se dice que es bimolecular porque sugiere que ambos, sustrato y reactivo nucleófilo, intervienen en el ET de la reacción que da lugar a los productos. El ataque del nucleófilo y la expulsión del grupo saliente tienen que estar sincronizados de algún modo. Estado de Transición

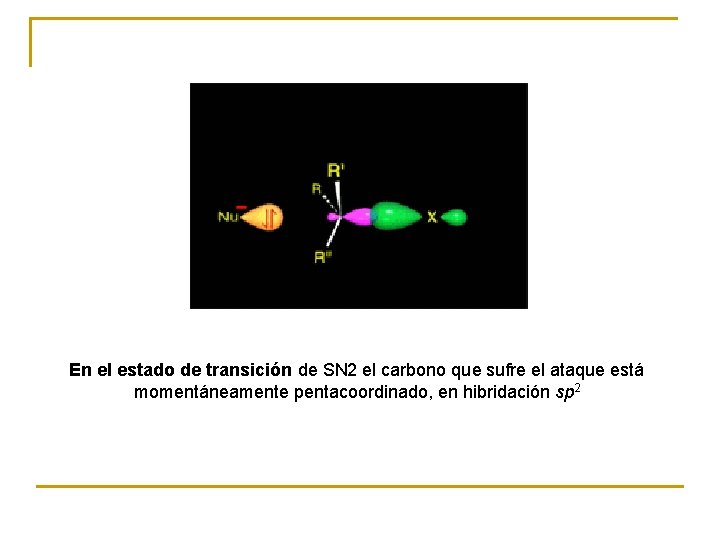
En el estado de transición de SN 2 el carbono que sufre el ataque está momentáneamente pentacoordinado, en hibridación sp 2

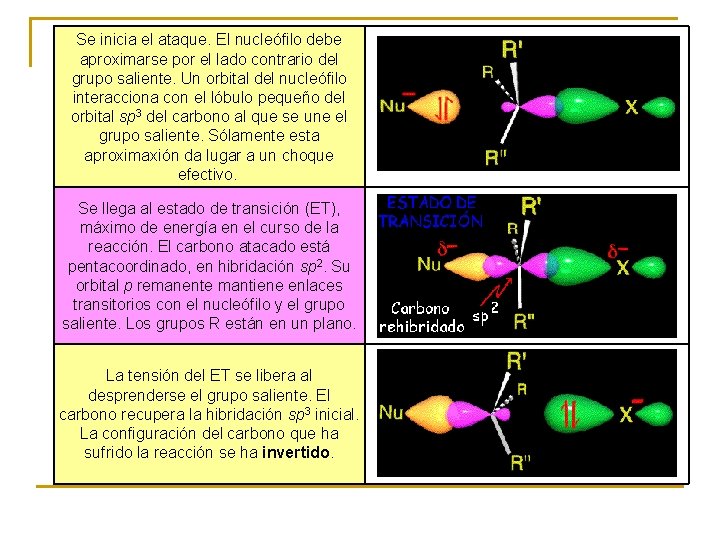
Se inicia el ataque. El nucleófilo debe aproximarse por el lado contrario del grupo saliente. Un orbital del nucleófilo interacciona con el lóbulo pequeño del orbital sp 3 del carbono al que se une el grupo saliente. Sólamente esta aproximaxión da lugar a un choque efectivo. Se llega al estado de transición (ET), máximo de energía en el curso de la reacción. El carbono atacado está pentacoordinado, en hibridación sp 2. Su orbital p remanente mantiene enlaces transitorios con el nucleófilo y el grupo saliente. Los grupos R están en un plano. La tensión del ET se libera al desprenderse el grupo saliente. El carbono recupera la hibridación sp 3 inicial. La configuración del carbono que ha sufrido la reacción se ha invertido.

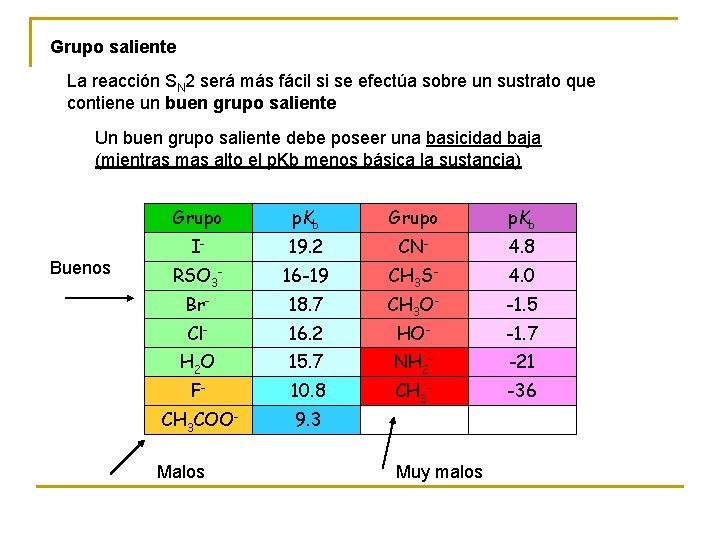
Grupo saliente La reacción SN 2 será más fácil si se efectúa sobre un sustrato que contiene un buen grupo saliente Un buen grupo saliente debe poseer una basicidad baja (mientras mas alto el p. Kb menos básica la sustancia) Buenos Grupo p. Kb I- 19. 2 CN- 4. 8 RSO 3 - 16 -19 CH 3 S- 4. 0 Br- 18. 7 CH 3 O- -1. 5 Cl- 16. 2 HO- -1. 7 H 2 O 15. 7 NH 2 - -21 F- 10. 8 CH 3 - -36 CH 3 COO- 9. 3 Malos Muy malos

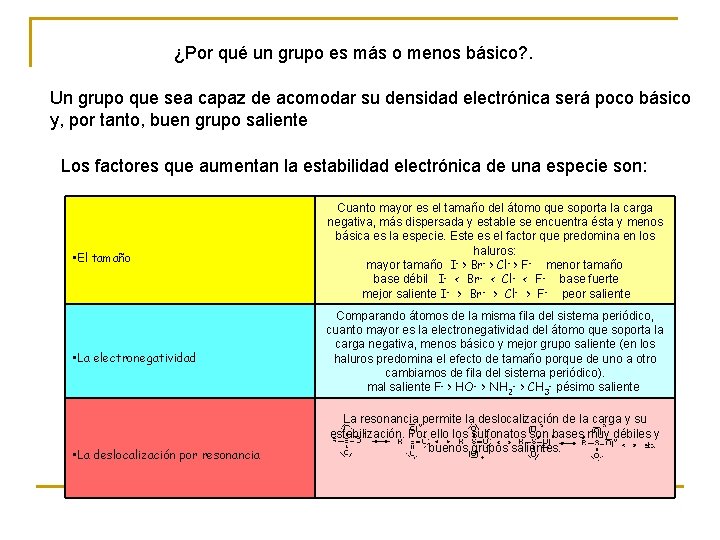
¿Por qué un grupo es más o menos básico? . Un grupo que sea capaz de acomodar su densidad electrónica será poco básico y, por tanto, buen grupo saliente Los factores que aumentan la estabilidad electrónica de una especie son: • El tamaño Cuanto mayor es el tamaño del átomo que soporta la carga negativa, más dispersada y estable se encuentra ésta y menos básica es la especie. Este es el factor que predomina en los haluros: mayor tamaño I > Br- > Cl- > F- menor tamaño base débil I- < Br- < Cl- < F- base fuerte mejor saliente I- > Br- > Cl- > F- peor saliente • La electronegatividad Comparando átomos de la misma fila del sistema periódico, cuanto mayor es la electronegatividad del átomo que soporta la carga negativa, menos básico y mejor grupo saliente (en los haluros predomina el efecto de tamaño porque de uno a otro cambiamos de fila del sistema periódico). mal saliente F- > HO- > NH 2 - > CH 3 - pésimo saliente • La deslocalización por resonancia La resonancia permite la deslocalización de la carga y su estabilización. Por ello los sulfonatos son bases muy débiles y buenos grupos salientes.

La reacción SN 2 será más fácil si se efectúa con un buen nucleófilo atacante. ¿Qué hace que un nucleófilo sea bueno? . En general, el nucleófilo mas básico es el mas reactivo. . • La carga Entre un par de nucleófilos que contienen el mismo átomo reactivo, la especie con carga negativa neta es la más reactiva: La nucleofilia aumenta al disminuir la electronegatividad del átomo reactivo*: • La electronegatividad *esto se cumple solo si seguimos el mismo renglón de la tabla periódica, La solvatación, es decir, la interacción entre el nucleófilo y el disolvente, modifica e invierte incluso la relación aparente nucleofilia-basicidad. • La solvatación En los iones halogenuros, el factor que determina la relación inversa entre basicidad y nucleofilicidad es la solvatación. Los aniones mas pequeños, debido a su alta proporción de carga-tamaño, son solvatados con mas fuerza que los mas grandes. Por lo tanto, mayor tamaño I- > Br- > Cl- > F- menor tamaño base débil I- < Br- < Cl- < F- base fuerte Nucleófilo mas fuerte I- > Br- > Cl- > F- Nucleófilo mas débil

Resonancia - La resonancia disminuye la nucleofilia. El ión acetato es peor nucleófilo que el ión hidróxido debido a la deslocalización de la carga sobre ambos oxígenos.

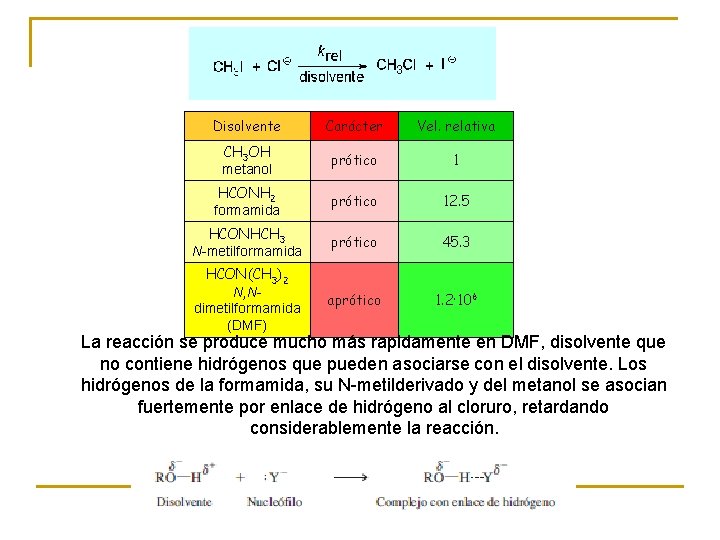
Efecto del disolvente en la SN 2 Cuanto más concentrada esté la carga en el átomo reactivo, mayor será en principio su nucleofilia, pero mayor su interacción con el disolvente, y éste actúa como pantalla disminuyendo la nucleofilia Por tanto, la naturaleza del disolvente es de primordial importancia en una reacción de sustitución nucleófila. Hay dos tipos fundamentales de disolventes: • Próticos • Aproticos Tienen hidrógenos unidos a oxígeno o nitrógeno y, por ello, forman enlaces de hidrógeno con el nucleófilo. Dan lugar a solvatación fuerte, enmascaran la nucleofilia y las reacciones se ralentizan. No tienen hidrógenos unidos a oxígeno o nitrógeno y, por ello, no forman enlaces de hidrógeno. La solvatación es débil y las reacciones se aceleran.

Disolvente Carácter Vel. relativa CH 3 OH metanol prótico 1 HCONH 2 formamida prótico 12. 5 HCONHCH 3 N-metilformamida prótico 45. 3 HCON(CH 3)2 N, Ndimetilformamida (DMF) aprótico 1. 2· 106 La reacción se produce mucho más rapidamente en DMF, disolvente que no contiene hidrógenos que pueden asociarse con el disolvente. Los hidrógenos de la formamida, su N-metilderivado y del metanol se asocian fuertemente por enlace de hidrógeno al cloruro, retardando considerablemente la reacción.

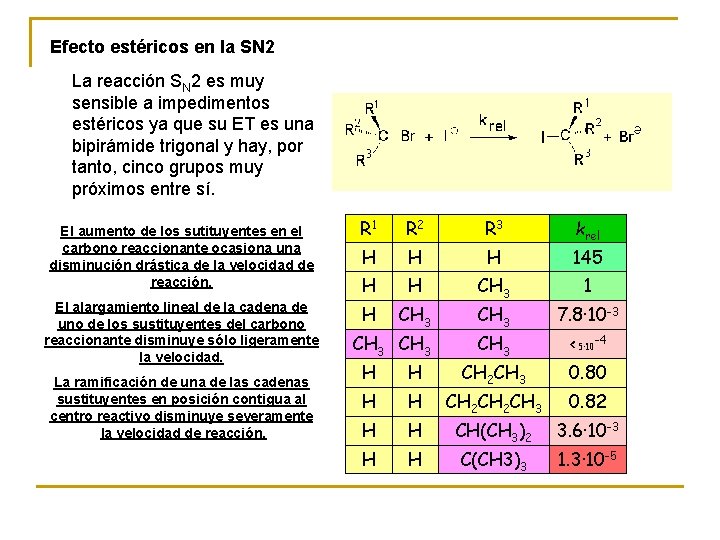
Efecto estéricos en la SN 2 La reacción SN 2 es muy sensible a impedimentos estéricos ya que su ET es una bipirámide trigonal y hay, por tanto, cinco grupos muy próximos entre sí. El aumento de los sutituyentes en el carbono reaccionante ocasiona una disminución drástica de la velocidad de reacción. El alargamiento lineal de la cadena de uno de los sustituyentes del carbono reaccionante disminuye sólo ligeramente la velocidad. La ramificación de una de las cadenas sustituyentes en posición contigua al centro reactivo disminuye severamente la velocidad de reacción. R 1 R 2 R 3 krel H H H 145 H H CH 3 1 H CH 3 7. 8· 10 -3 CH 3 < 5· 10 -4 H H CH 2 CH 3 0. 80 H H CH 2 CH 3 0. 82 H H CH(CH 3)2 3. 6· 10 -3 H H C(CH 3)3 1. 3· 10 -5

Resultado del ataque con Na. OH al (R)-2 -Bromooctano puro Interpretación del experimento

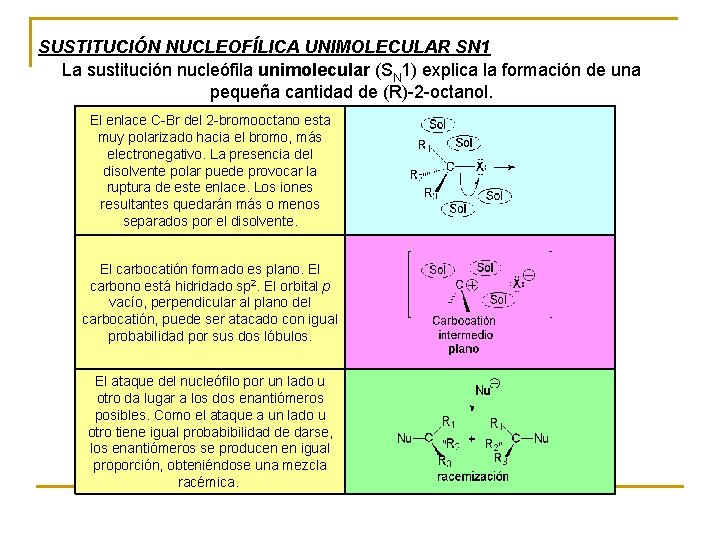
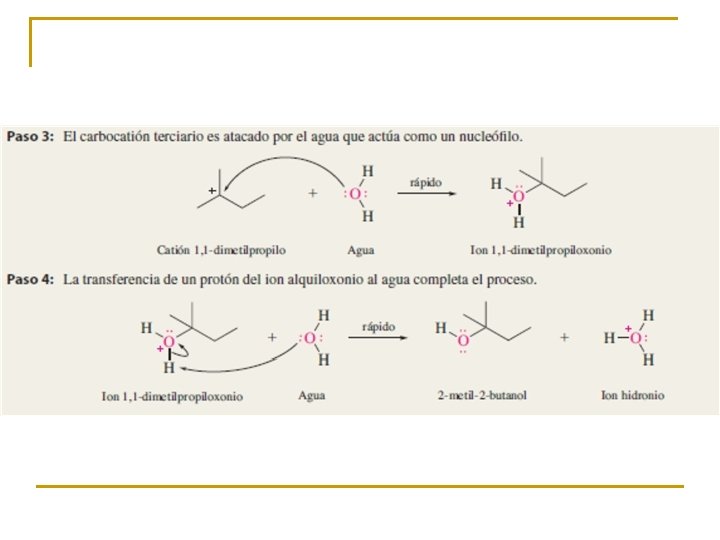
SUSTITUCIÓN NUCLEOFÍLICA UNIMOLECULAR SN 1 La sustitución nucleófila unimolecular (SN 1) explica la formación de una pequeña cantidad de (R)-2 -octanol. El enlace C-Br del 2 -bromooctano esta ¿Cómo se obtiene la pequeña cantidad de (R)-2 -octanol? muy polarizado hacia el bromo, más electronegativo. La presencia del disolvente polar puede provocar la ruptura de este enlace. Los iones resultantes quedarán más o menos separados por el disolvente. El carbocatión formado es plano. El carbono está hidridado sp 2. El orbital p vacío, perpendicular al plano del carbocatión, puede ser atacado con igual probabilidad por sus dos lóbulos. El ataque del nucleófilo por un lado u otro da lugar a los dos enantiómeros posibles. Como el ataque a un lado u otro tiene igual probabibilidad de darse, los enantiómeros se producen en igual proporción, obteniéndose una mezcla racémica.

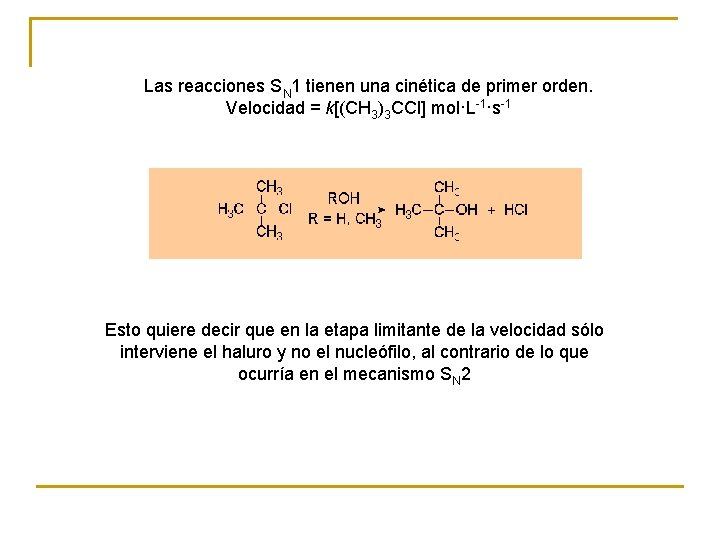
Las reacciones SN 1 tienen una cinética de primer orden. Velocidad = k[(CH 3)3 CCl] mol·L-1·s-1 Esto quiere decir que en la etapa limitante de la velocidad sólo interviene el haluro y no el nucleófilo, al contrario de lo que ocurría en el mecanismo SN 2


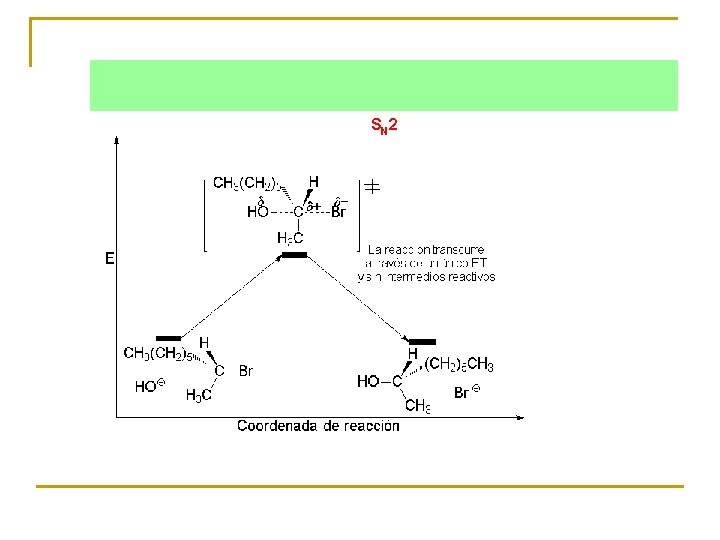
Los perfiles de energía de ambos procesos SN 1 y SN 2 son: La reacción SN 1 carece de estereoespecificidad al transcurrir a través de un intermedio carbocatiónico plano. S N 1

S N 2

3. 3. - COMPETENCIA ENTRE SN 1 Y SN 2 SN 1 SN 2 Los disolventes polares favorecen el mecanismo SN 1. Los disolventes polares dificultan el mecanismo SN 2. El ET tiene un desarrollo de cargas mínimo y no se favorece especialmente por la polaridad del disolvente. Sin embargo, el nucleófilo puede estar solvatado El intermedio carbocatión tiene una carga por un disolvente polar y dificultarse el neta y se estabiliza por solvatación. mecanismo SN 2. La presencia de grupos salientes buenos favorece el mecanismo SN 1. La presencia de grupos salientes buenos favorece el mecanismo SN 2. La fortaleza del nucleófilo no afecta a la velocidad del mecanismo SN 1. La fortaleza del nucleófilo aumenta la velocidad del mecanismo SN 2. La sustitución en el carbono reaccionante favorece el mecanismo SN 1. La sustitución en el carbono reaccionante impide el mecanismo SN 2.

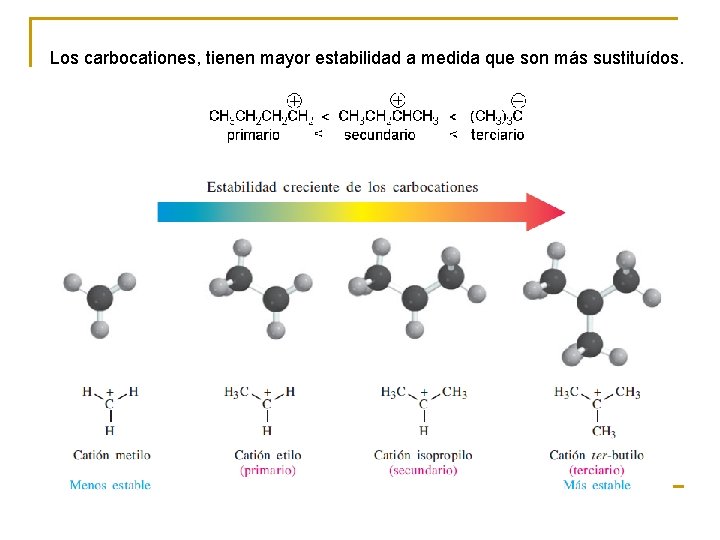
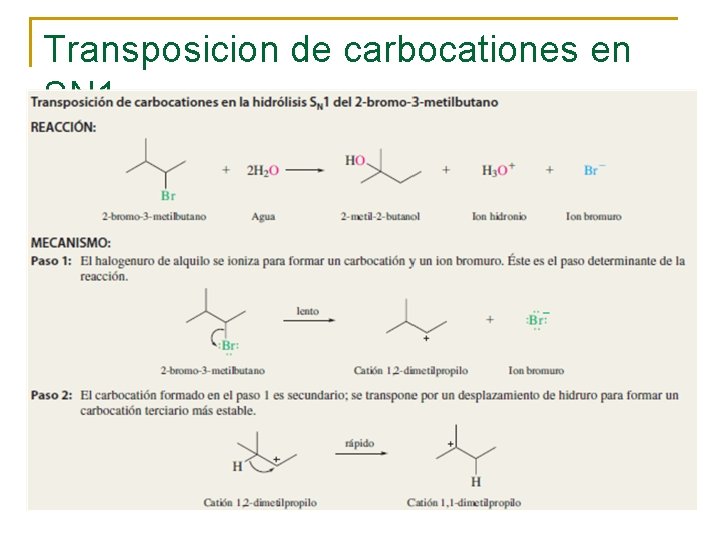
Los carbocationes, tienen mayor estabilidad a medida que son más sustituídos.


Transposicion de carbocationes en SN 1


La proporción de moléculas que reaccionarán según los mecanismos SN 1 ó SN 2, con las implicaciones estereoquímicas que ello conlleva (racemización o inversión), depende de su estructura: R-X SN 1 SN 2 Nunca se da en disolución. Muy rápida con buenos nucleófilos y buenos grupos salientes. primario Nunca se da en disolución. Igual al anterior. Difícil cuando el carbono contiguo está ramificado. secundario Lenta. Se acelera con un buen grupo saliente y en disolventes próticos. Lenta. Se acelera con una concentración alta de un buen nucleófilo y en disolventes apróticos. terciario Muy rápida, sobre todo en disolventes polares próticos y con buenos grupos salientes. Extremadamente lenta. metil





Resultado del ataque con Na. OH al (R)-2 -Bromooctano puro Interpretación del experimento

Formación de alquenos: eliminación



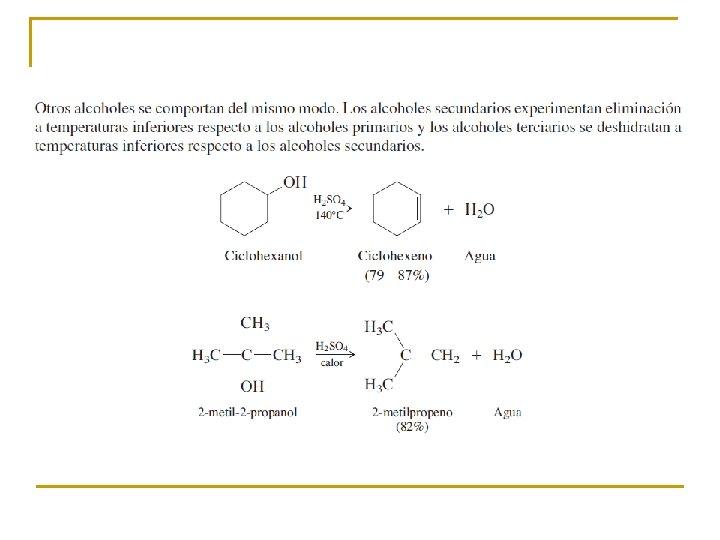
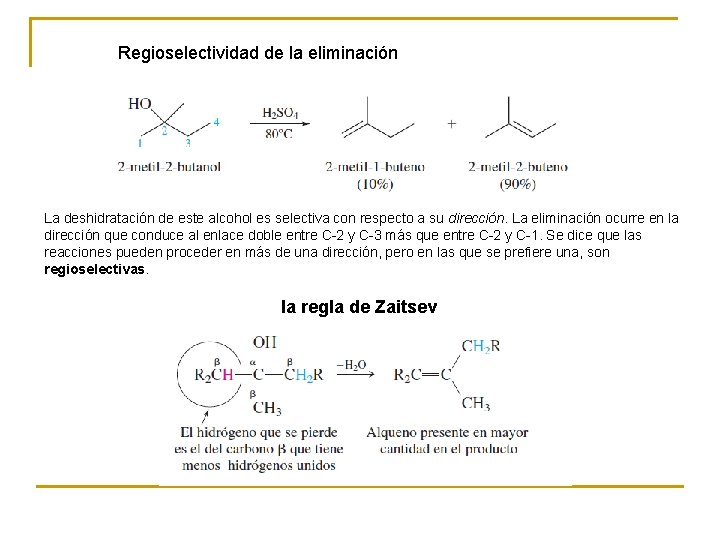
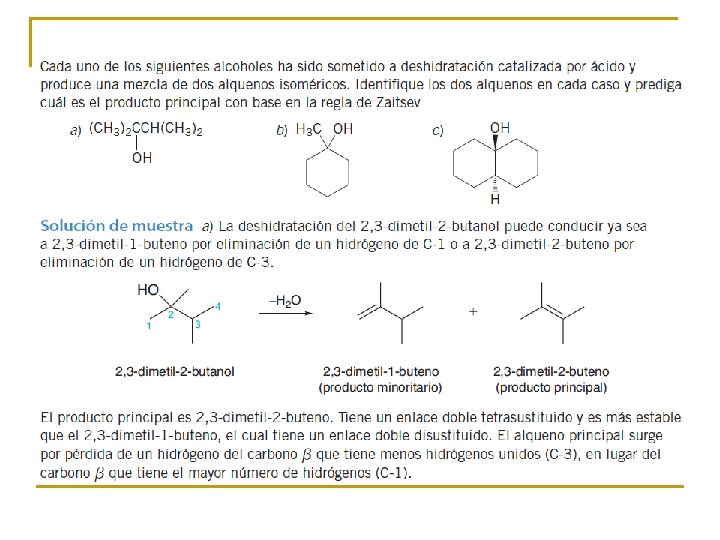
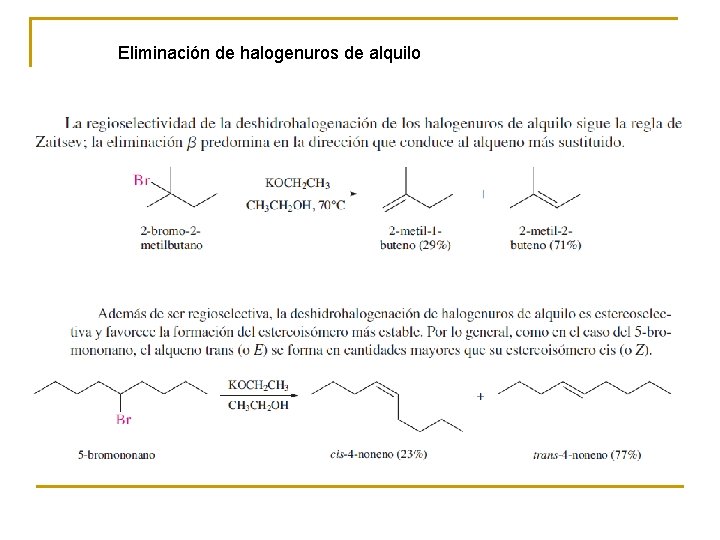
Regioselectividad de la eliminación La deshidratación de este alcohol es selectiva con respecto a su dirección. La eliminación ocurre en la dirección que conduce al enlace doble entre C-2 y C-3 más que entre C-2 y C-1. Se dice que las reacciones pueden proceder en más de una dirección, pero en las que se prefiere una, son regioselectivas. la regla de Zaitsev


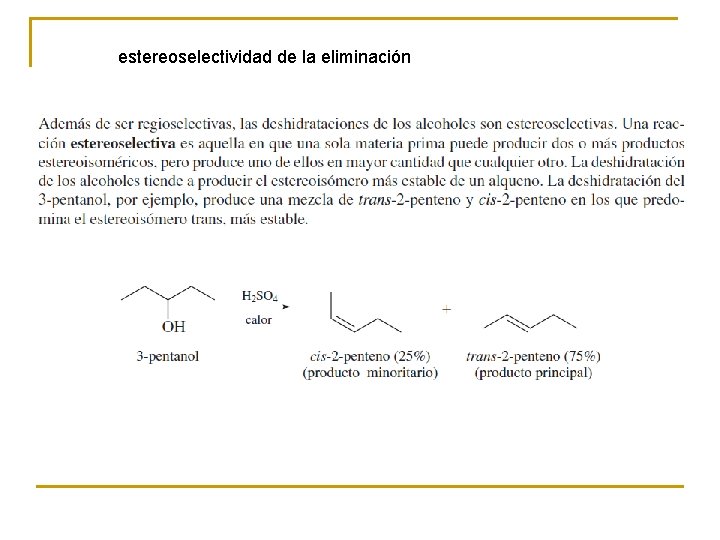
estereoselectividad de la eliminación


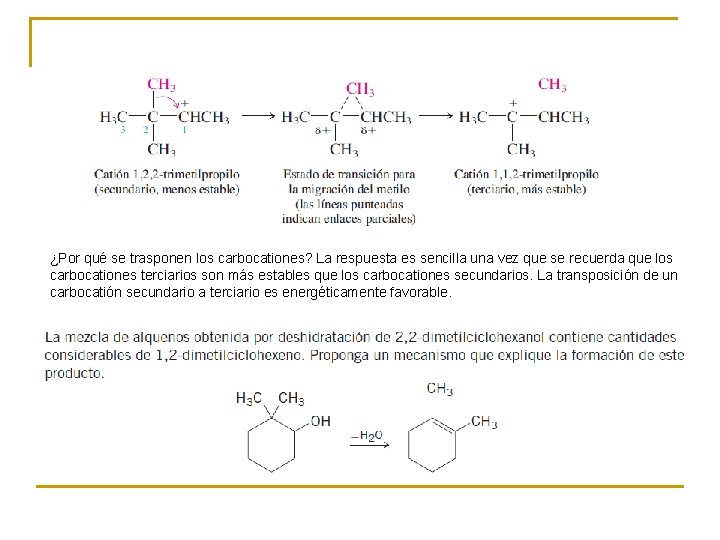
¿Por qué se trasponen los carbocationes? La respuesta es sencilla una vez que se recuerda que los carbocationes terciarios son más estables que los carbocationes secundarios. La transposición de un carbocatión secundario a terciario es energéticamente favorable.

Muchas transposiciones de carbocationes implican la migración de un hidrógeno. Éstos se llaman desplazamientos de hidruro. Se aplican los mismos requerimientos a los desplazamientos de hidruro que a las migraciones de grupos alquilo; proceden en la dirección que conduce a un carbocatión más estable; el origen y destino del hidrógeno que migra son carbonos adyacentes, uno de los cuales debe tener carga positiva; el hidrógeno migra con un par de electrones. Los desplazamientos de hidruro ocurren con frecuencia durante la deshidratación de alcoholes primarios. Por lo tanto, aunque se esperaría que el 1 -buteno fuera el único alqueno formado por deshidratación del 1 -butanol, de hecho está acompañado de una mezcla de cis- y trans-2 -buteno.

Eliminación de halogenuros de alquilo

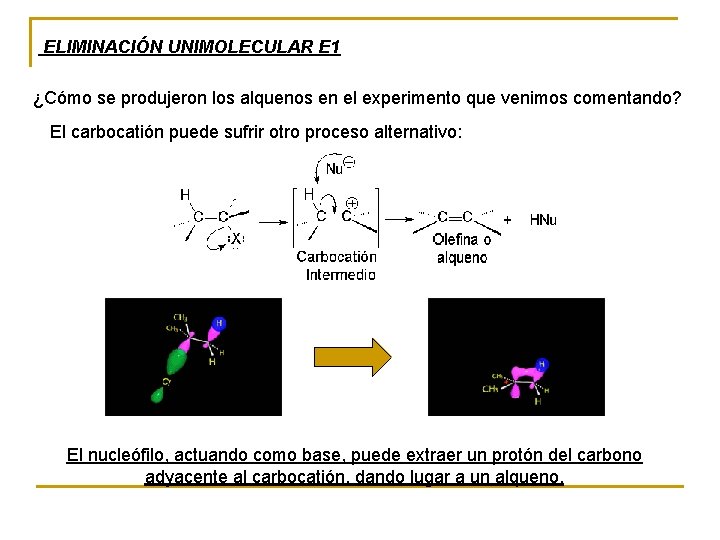
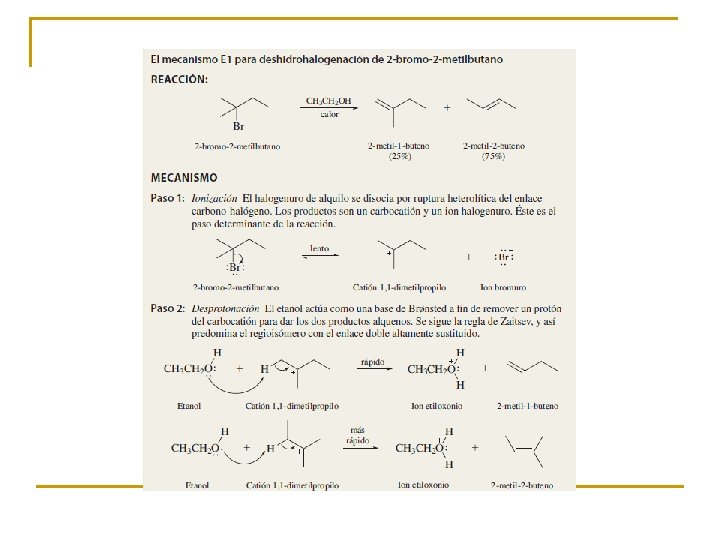
ELIMINACIÓN UNIMOLECULAR E 1 ¿Cómo se produjeron los alquenos en el experimento que venimos comentando? El carbocatión puede sufrir otro proceso alternativo: El nucleófilo, actuando como base, puede extraer un protón del carbono adyacente al carbocatión, dando lugar a un alqueno.

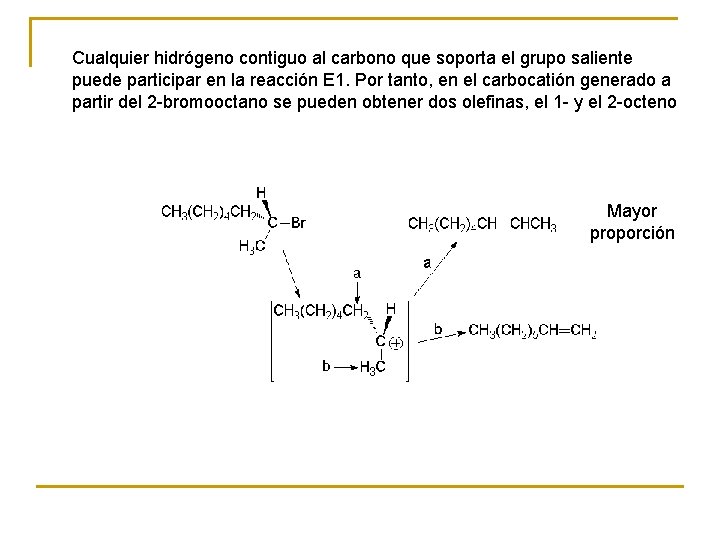
Cualquier hidrógeno contiguo al carbono que soporta el grupo saliente puede participar en la reacción E 1. Por tanto, en el carbocatión generado a partir del 2 -bromooctano se pueden obtener dos olefinas, el 1 - y el 2 -octeno Mayor proporción


ELIMINACIÓN BIMOLECULAR E 2 La eliminación bimolecular E 2 transcurre sin intermedios y consta de un único ET, en el que la base abstrae el protón, el grupo saliente se va y los dos carbonos implicados se rehibridan desde la sp 3 a la sp 2. La cinética depende del haluro y de la base/nucleófilo y es, por tanto, de segundo orden. La reacción E 2 es bimolecular La reacción E 2 tiene lugar con una estereoquímica definida: el grupo saliente y el hidrógeno sobre el carbono en posición contigua han de estar en disposición antiperiplanar

 Ch3-ch-ch2-ch-ch3
Ch3-ch-ch2-ch-ch3 Geocities quimica
Geocities quimica Propiedades fisicas de los halogenuros de alquilo
Propiedades fisicas de los halogenuros de alquilo Halogenuros de alquilo usos
Halogenuros de alquilo usos Slidetodoc. com
Slidetodoc. com Ch2=ch-ch=ch-ch3 nombre del compuesto
Ch2=ch-ch=ch-ch3 nombre del compuesto Nomenclatura iupac ejemplos
Nomenclatura iupac ejemplos Reaccion de alcanos
Reaccion de alcanos Alquinos nomenclatura del 1 al 20
Alquinos nomenclatura del 1 al 20 El prefijo iso se utiliza cuando
El prefijo iso se utiliza cuando Nomenclatura común
Nomenclatura común Grupo funcional ester
Grupo funcional ester Tipos de glucidos
Tipos de glucidos Resistencia
Resistencia Alcohol etilico
Alcohol etilico Uso de los alcoholes
Uso de los alcoholes Clculas
Clculas Mol reacciones quimicas
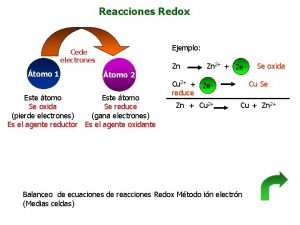
Mol reacciones quimicas Reacciones redox
Reacciones redox Mapa conceptual de reacciones endotérmicas y exotérmicas
Mapa conceptual de reacciones endotérmicas y exotérmicas Ejemplo de reacciones químicas
Ejemplo de reacciones químicas Reacciones anapleroticas
Reacciones anapleroticas Reacciones supravitales
Reacciones supravitales Proceso electrolitico
Proceso electrolitico Reacciones de neutralización ejemplos
Reacciones de neutralización ejemplos Reacciones contra el proyecto moderno
Reacciones contra el proyecto moderno Fes química
Fes química Combustion etanol
Combustion etanol Calcular peso molecular
Calcular peso molecular Reacciones químicas
Reacciones químicas Ecuacion ionica total y neta
Ecuacion ionica total y neta Reacciones de neutralización
Reacciones de neutralización Catabolizar
Catabolizar Reacciones de vinculo
Reacciones de vinculo Desforilacion
Desforilacion Semirreacciones redox ejemplos
Semirreacciones redox ejemplos Ejemplos de reacciones irreversibles
Ejemplos de reacciones irreversibles Reacciones de aminas
Reacciones de aminas Que es un enlace polar
Que es un enlace polar Reacciones supravitales
Reacciones supravitales Reacciones adversas a medicamentos antituberculosos
Reacciones adversas a medicamentos antituberculosos Reaccion de oxidacion
Reaccion de oxidacion Simbologia quimica
Simbologia quimica Nitrato de plata y yoduro de potasio reacción
Nitrato de plata y yoduro de potasio reacción Pila redox
Pila redox Mol reacciones quimicas
Mol reacciones quimicas Examen externo autopsia
Examen externo autopsia Reacciones quimicas reversibles
Reacciones quimicas reversibles Reacciones de neutralización ejemplos
Reacciones de neutralización ejemplos Reacciones de adicion electrofilica
Reacciones de adicion electrofilica