Halgenos Grupo 17 Equipo Platino Integrantes Cruz Reyes
























































- Slides: 64

Halógenos Grupo 17 Equipo : Platino Integrantes: Cruz Reyes Víctor Manuel Gutiérrez Lastiri Beatriz Virginia Hernández Ventura Cristina López Salazar Fátima Ponce Navarrete Gustavo Yessenia

Un poco de Historia Scheele Döbereiner Henri Moissan Bertha Karlik

Halógeno La palabra proviene del griego hals, “sal” y, genes “nacido”

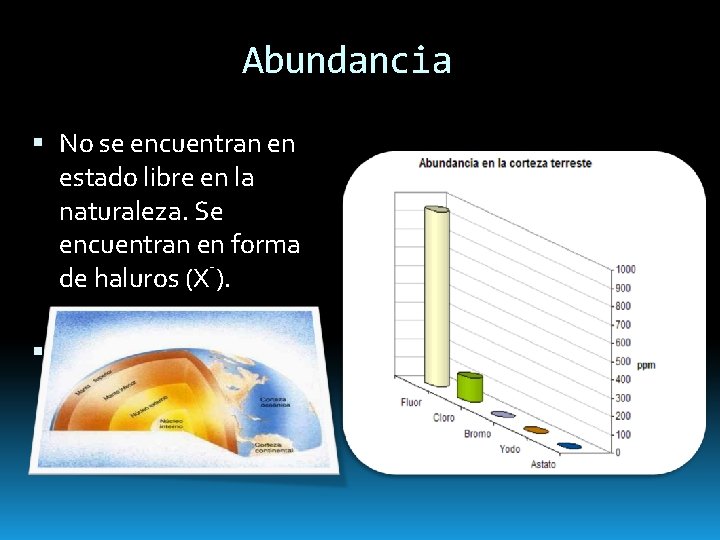
Abundancia No se encuentran en estado libre en la naturaleza. Se encuentran en forma de haluros (X¯).

Estados de agregación Flúor Yodo Bromo Cloro Astato

Propiedades físicas Elemento Configuración Masa Atómica (uma) Punto de Fusión (K) Punto de Ebullición (K) Densidad (kg/m³) Calor de Fusión (k. J/mol) Calor de Vaporización (k. J/mol) Calor de Atomización (k. J/mol de átomos) Estados de Oxidación 1ª Energía de Ionización (k. J/mol) 2ª Energía de Ionización (k. J/mol) 3ª Energía de Ionización (k. J/mol) Afinidad Electrónica (k. J/mol) Radio Atómico (Å) Radio Covalente (Å) Flúor [He]2 s 2 p 5 18, 9984 53, 6 85 Cloro [Ne]3 s 2 p 5 35, 4527 172, 18 239, 2 Bromo [Ar]3 d 104 s 2 p 5 79, 904 265, 9 331, 94 Yodo [Kr]4 d 105 s 2 p 5 126, 90447 386, 7 1516 1, 0 2030 6, 4 4050 10, 8 4930 6, 5 20, 4 29, 6 79, 0 121, 0 112, 0 -1 -1, +3 , +4, +5, +7 1681 -1, +2, +3 , +4, +5, +6, +7 1251, 1 3374, 1 2297, 3 2103, 4 6050, 3 3821, 8 3473, 4 328 349 324, 7 0, 57 0, 72 F- = 1, 31 0, 97 0, 99 Cl- = 1, 81 Å Cl+7 = 0, 26 Å 1, 12 1, 14 Br- = 1, 95 Br+7 = 0, 39 17, 1 22, 7 23, 5 0, 6 3, 98 2, 2 3, 16 3, 1 2, 96 Radio Iónico (Å) Volumen Atómico (cm³/mol) Polarizabilidad (ų) Electronegatividad (Pauling) 1139, 9 457, 5 15, 3 42, 0 107, 0 -1, +3 , +5, +7 1008, 4 1845, 8 3184 295, 2 1, 33 I- = 2, 16 I+7 = 0, 50 25, 74 5 2, 66

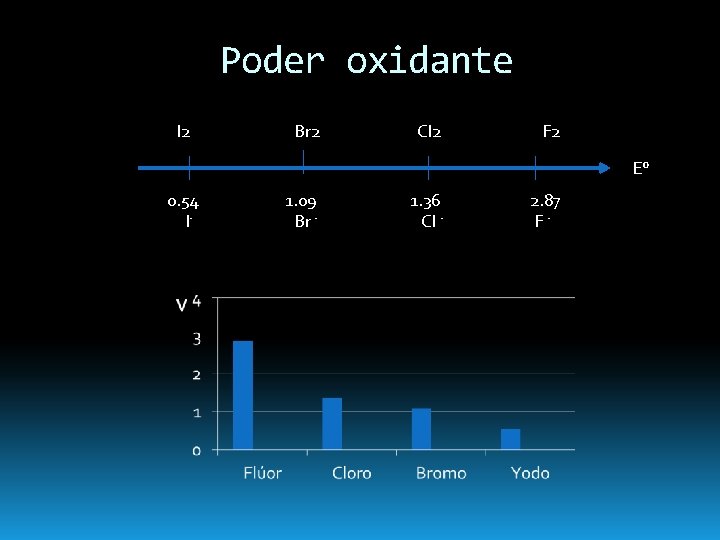
Poder oxidante I 2 Br 2 Cl 2 F 2 E° 0. 54 1. 09 1. 36 2. 87 I- Br - Cl - F -

Halogenuros de hidrógeno Se pueden formar por la combinación directa de sus elementos: H 2(g) + X 2(g) 2 HX(g) +H 2 O H 3 O+(ac) + X- (ac) HF(ac)<<HCl(ac)<HBr(ac)<HI(ac)

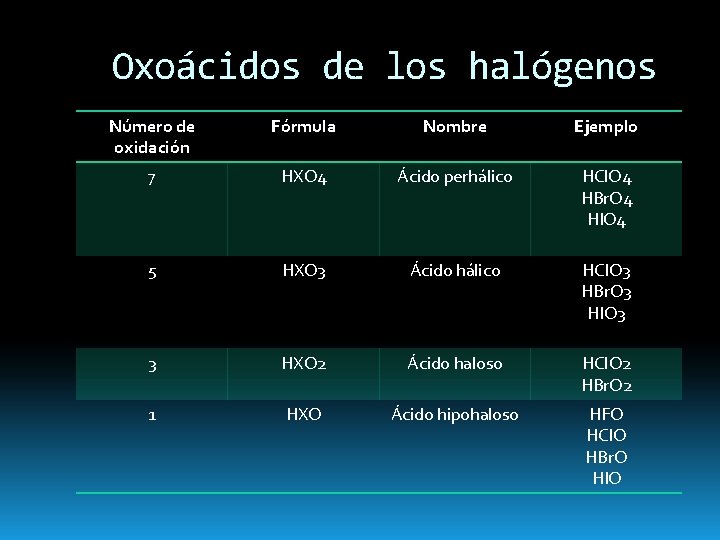
Oxoácidos de los halógenos Número de oxidación Fórmula Nombre Ejemplo 7 HXO 4 Ácido perhálico HCl. O 4 HBr. O 4 HIO 4 5 HXO 3 Ácido hálico HCl. O 3 HBr. O 3 HIO 3 3 HXO 2 Ácido haloso HCl. O 2 HBr. O 2 1 HXO Ácido hipohaloso HFO HCl. O HBr. O HIO

Compuestos interhalógenados Los compuestos interhalógenados son derivados formados entre dos diferentes elementos halógeno. Para compuestos neutros: XY, XY 3, XY 5 y XY 7 X y Y son halógenos diferentes X es el átomo más grande de los dos

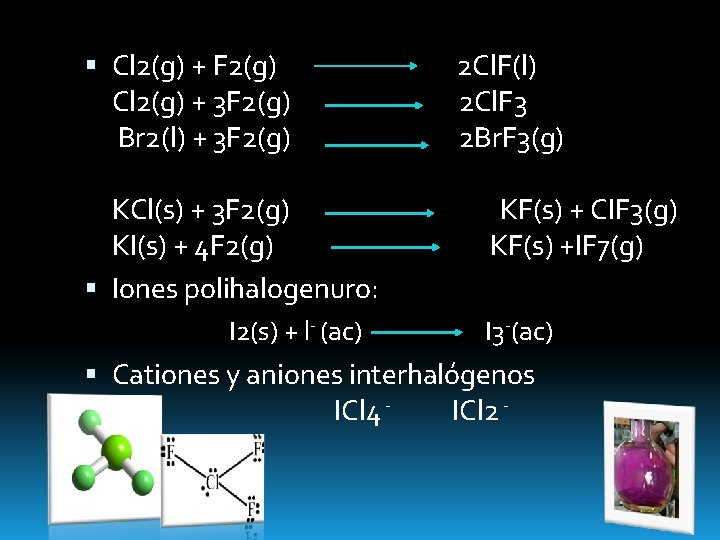
Cl 2(g) + F 2(g) 2 Cl. F(l) Cl 2(g) + 3 F 2(g) 2 Cl. F 3 Br 2(l) + 3 F 2(g) 2 Br. F 3(g) KCl(s) + 3 F 2(g) KF(s) + CIF 3(g) KI(s) + 4 F 2(g) KF(s) +IF 7(g) Iones polihalogenuro: I 2(s) + l- (ac) I 3 -(ac) Cationes y aniones interhalógenos ICl 4 - ICl 2 -

Flúor (F) Características Generales Número atómico: 9 Peso molecular: 18. 998 g/mol Configuración electrónica: [He]2 s 22 p 5 Estado de oxidación: -1 Punto de fusión: -220ºC Punto de ebullición: -188 ºC Radio covalente: 71 pm Radio iónico: 133 pm Afinidad electrónica: -328 KJ/mol Electronegatividad: 4. 0 Isótopos: 19 F y 18 F Fue descrito en 1529 por Georgius Agricola, formando parte Ca. F 2.

El flúor es un gas amarillo pálido, formado por moléculas diatómicas F 2, que reacciona con la mayoría de las moléculas orgánicas e inorgánicas y con los gases nobles (Xe y Rn). El flúor es el halógeno más abundante en la corteza terrestre, con una concentración de 950 ppm. Los minerales más importantes en los que está presente son la fluorita, Ca. F 2, el fluorapatio, Ca 5(PO 4)3 F y la criolita, Na 3 Al. F 6.

Es el más electronegativo y reactivo de todos los elementos (Eº= 2. 866 V). Es el que muestra mayor tendencia a ganar electrones, y por lo tanto es el agente oxidante más fuerte entre los halógenos. En la naturaleza aparece en combinación con otros elementos, y solamente en disolución acuosa, el flúor se presenta en forma de ión fluoruro (F-).

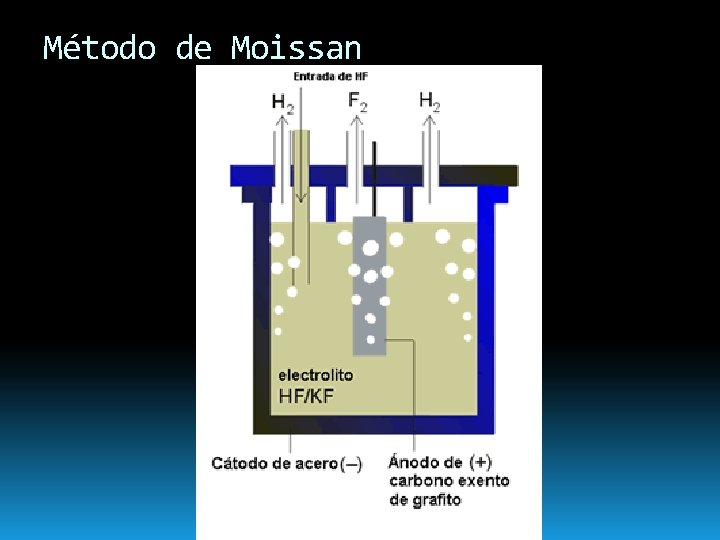
Obtención de Flúor: método de Moissan (con mezcla fundida de HF+KF) Consistente en las reacciones de electrodo: Ánodo: Catodo: v Se produce la oxidación de los fluoruros v En el cátodo se descarga hidrógeno, por lo que es necesario evitar que entren en contacto estos dos gases para que no haya riesgo de explosión. v Este es el único método importante en la industria

Método de Moissan

Reacciones El fluoruro de hidrógeno (HF aq)es un ácido mucho más débil que los otros halogenuros de hidrógeno. Una propiedad muy conocida del HF es su capacidad de grabar (y finalmente disolver) el vidrio. Esta reacción es similar a la reacción entre el HF y la sílice, Si. O 2 Debido a esta reacción, el HF debe almacenarse en recipientes especiales recubiertos de teflón o polietileno. El HF se puede obtener mediante:

Fluoruros de halógeno La mayoría de los interhalógenos son fluoruros: XY Cl. F(g) Br. F (g) XY 3 Cl. F 3 (g) Br. F 3 (l) XY 5 Cl. F 5 (g) Br. F 5 (l) IF 5(l) XY 7 IF 7(g) Dichos compuestos tienen un interés especial debido a que son intermediarios altamente reactivos, ya que son agentes oxidantes fuertes. El Cl. F 3 reacciona de manera vigorosa (y con frecuencia explosiva) con la materia orgánica:

Óxidos de flúor Los únicos óxidos de flúor son el OF 2 y el O 2 F 2 siendo el OF 2 el compuesto binario de oxígeno y flúor más estable, y para obtenerlo se pasa flúor a través de una solución diluida de hidróxido acuoso: El O 2 F 2 se puede sintetizar a partir de la fotólisis de una mezcla líquida de los dos elementos. Es un agente de fluoración más agresivo que Cl. F 3; oxida al plutonio metálico: Oxoácidos El flúor forma sólo FOH:

Fluorocarbonos Las moléculas de fluorocarbonos y polímeros fluorocarbonados son resistentes a la oxidación, pero son atacadas por metales alcalinos. La relación directa entre un hidrocarburo alifático con un fluoruro metálico oxidante produce enlaces fuertes C-F y genera HF como subproducto: Cuando R es arilo, el Co. F 3 produce un fluoruro cíclico saturado: El poderoso agente oxidante fluorinante que se utiliza en estas reacciones, el Co. F 3, se regenera por medio de la reacción del Co. F 2 con flúor:

Aplicaciones La síntesis de compuestos fluorocarbonados tiene una gran importancia tecnológica debido a que tienen aplicaciones que van desde la cubiertas antiadherentes de los utensilios de cocina, pasando por los recipientes de laboratorio que son resitentes a los halógenos, hasta los volátiles fluorocarbonos que se utilizan como refrigerantes en los dispositivos de aire acondicionado y en los refrigeradores. El politetrafluoroetileno (PTFE), es un polímero denominado comúnmente teflón. Material aislante muy resistente al calor y a la corrosión, usado para articulaciones y revestimientos así como en la fabricación de ollas y sartenes.

Aplicaciones A partir de HF se obtienen F 2, Al. F 3, Na 3 Al. F 6 y fluorocarbonos. Se emplea UF 6 en la obtención de combustible de uranio para reactores nucleares. Na 3 Al. F 6 se emplea en la obtención de alumnio. Cl. F 3 se utiliza en la fluoración y en el reprocesado de combustibles nucleares. Li. F se utiliza en la obtención de cerámica y soldadura. Sn. F 2 se usa en la preparación de pasta de dientes.

Datos curiosos La primera producción comercial de flúor fue para la bomba atómica del Proyecto Manhattan, en la obtención de hexafluoruro de uranio, UF 6, empleado para la separación de isótopos de uranio. Este proceso se sigue empleando para aplicaciones de energía nuclear. El flúor y el HF deben ser manejados con gran cuidado y se debe evitar totalmente cualquier contacto con la piel o con los ojos. El HF anhidro hierve a 19 °C y es capaz de destruir un cadáver, incluyendo sus huesos, sus vapores son muy irritantes y tóxicos, sus descubridores murieron por su acción.

CLORO

Cloro El cloro de número atómico 17, no se encuentra en estado puro en la naturaleza se presenta principalmente como cloruro de sodio (Na. Cl) en el agua de mar o en diversos lagos salados, y como depósitos sólidos que se originaron probablemente de la evaporación de los lagos salados en la prehistoria. En condiciones normales y en estado puro forma dicloro (Cl 2); un gas denso y tóxico de color verde claro. En la naturaleza se encuentran dos isótopos estables de cloro. Uno de masa 35 uma, y el otro de 37 uma.

Métodos de Obtención La preparación industrial del cloro se efectúa por hidrolisis de una solución de cloruro de sodio (Salmuera). Na+ (ac) +Cl- (ac) + H 2 O(l) Na+ OH- (ac) + 1/2 Cl 2 (g) +1/2 H 2 (ac) La forma más fácil de preparar cloro gaseoso en el laboratorio es añadir ácido clorhídrico concentrado a permanganato de potasio sólido. El ion cloruro se oxida a dicloro y el ion permanganato se reduce al ion manganeso (II). 2 Mn. O 4 - (ac) + 10 Cl- (ac) +16 H 3 O+ (ac) 2 Mn 2+(ac) + 5 Cl 2(g) + 8 H 2 O (l)

Reacciones Reacciona con muchos elementos, por lo regular para dar el estado de oxidación común más alto del elemento. Por ejemplo: El hierro arde para dar cloruro de hierro (III), no cloruro de hierro (II). 2 Fe(s) + 3 Cl 2(g) 2 Fe. Cl 3(s) El fósforo arde en exceso de cloro para dar pentacloruro de fósforo 2 P(s) + 5 Cl 2(g) 2 PCl 5(s)

El dicloro puede actura como agente clorante. Un ejemplo es mezclar eteno; C 2 H 4, con dicloro se forma 1, 2 -diclorometano, C 2 H 4 Cl 2 CH 2=CH 2(g) + Cl 2(g) CH 2 Cl—CH 2 Cl(g) El cloro es una gente oxidante fuerte con un potencial de reducción estándar positivo. Cl 2(g) + 2 e- 2 Cl- (ac) E°=+1. 36 V El dicloro reacciona con agua para dar una mezcla de ácido clorhídrico y acido hipocloroso. Cl 2(ac) + H 2 O(l) H 3 O+(ac) + Cl-(ac) + HCl. O(ac) El ion hipoclorito en equilibrio con el acido hipocloroso, más que el cloro mismo, se usa como agente oxidante ( blanqueador) activo. HCl. O(ac) + H 2 O(l) H 3 O+(ac) + Cl. O-(ac)

Ácido Clorhídrico (HCl) El ácido clorhídrico es en extremo soluble en agua, es un líquido incoloro con olor ácido pronunciado, que se debe al equilibrio entre el cloruro de hidrógeno gaseoso y acuoso; HCl(ac) HCl(g) Además es un ácido fuerte (p. Ka=-7), y se ioniza casi totalmente. El método tradicional para obtener cloruro de hidrógeno gaseoso es por medio de cloruro de sodio y acido sulfúrico. Primera etapa a 150°C Na. Cl(s) + H 2 SO 4(l) Na. HSO 4(s) +HCl(g) Segunda etapa a 550°C Na. HSO 4(s) + Na. Cl(s) Na 2 SO 4(s) + HCl(g)

Otra forma de producir cloruro de hidrógeno es por la combinación directa de dicloro y dihidrógeno gaseosos: H 2(g) + Cl 2(g) 2 HCl(g) La mayor cantidad de cloruro de hidrógeno que se produce actualmente es subproducto de otros procesos industriales, como la síntesis de tetracloruro de carbono. CH 4(g) + 4 Cl 2(g) CCl 4 + 4 HCl(g)

Aplicaciones del HCl Este ácido tiene una amplia gama de usos: • Se usa domésticamente en la limpieza de superficies de concreto • En la purificación de glucosa y jarabe de maíz • En el tratamiento con ácido de pozos petroleros y de gas • En la fabricación de compuestos clorados. Dato curioso: Un número muy reducido de personas es incapaz de sintetizar suficiente jugo gástrico y deben ingerir cápsulas de ácido clorhídrico diluido, en cada comida.

Aplicaciones comerciales El cloro se produce a gran escala a cerca de 108 toneladas anuales en todo el mundo. La mayor parte de su producción se utiliza en la sintesís de compuestos organoclorados. Cantidades apreciables de Cl se usan en la industria de la pulpa y papel para blanquearlo. En la purificación de agua. En la producción de cloruro de titanio IV (Ti. Cl 4), que es un paso intermedio en la extracción de titanio de sus menas.

El ion cloruro actúa en el balance de iones en nuestro cuerpo. Al parecer no desempeña un papel activo pero si balancea los iones positivos de sodio y potasio. El HCl está presente en los jugos digestivos; algunas afecciones de desarrollo en lactantes se han relacionado con la deficiencia de cloro.

Datos curiosos Debido a que el cloro gaseoso es un gas de naturaleza densa y toxica fue usado como un arma en la I Guerra Mundial por Tampico el 22 de abril de 1915, como resultado de un ataque alemán con cloro, 20 000 soldados quedaron incapacitados y 500 de ellos murieron. El cloro aún así tiene algunos beneficios ya que en bajas concentraciones se usa para aniquilar microorganismo y ha salvado millones de vidas humanas. El presidente estadounidense Calvin Coolidge (18721933) pasaba ratos en cámaras de cloro para aliviar sus resfriados.

Química de las albercas La irritación de los ojos que se experimenta en las albercas se relaciona con la alta concentración de cloro en estas. Sin embargo el problema se debe a la presencia de cloraminas como NH 2 Cl en el agua, que se forman por la reacción de ácido hipocloroso con compuestos de amoniaco, como LA UREA DE LA ORINA VERTIDA POR LOS BAÑISTAS. NH 3(ac) + HCl. O(ac) NH 2 Cl(ac) + H 2 O(l) Para destruir las cloraminas, es preciso añadir más dicloro, en un proceso llamado “supercloración”. 2 NH 2 Cl(ac) + Cl 2(ac) N 2(g) + 4 HCl(ac)

B R O M O

Características Líquido rojo, denso y volátil. “bromos” Moderadamente soluble en agua (33. 6 g/L a 25°C) y solventes no polares CS 2 y CCl 4 Antoine Jérômo Balard 1826 Isótopos Naturales: 79 Br y 81 Br, 29 inestables. Números de oxidación: 1 -, 1+, 3+, 5+ y 7+ Se une a casi todos los elementos en humedad (tántalo) Estructura cristalina ortorrombica centrada en las bases.

Fuentes de Obtención 1860. Se encuentra en el agua de mar (88 ppm), salmueras y legías con bromuros de la industria potásica; y algunos minerales: Bromoargirita (Ag. Br), emboalita (Ag. Br. I), iodemboalita (Ag. Br. I). 500 millones de kg al año. Estados Unidos e Israel.

Obtención Sales de bromuro de metales alcalinos y alcalinotérreos. Se obtiene de las salmueras y agua de mar por oxidación de bromuros con cloro. Laboratorio

Estados de oxidación 1 -, 1+, 3+ y 5+ 1+ : poco estable, muy oxidante, en disolución acuosa y desproporciona a estados de oxidación 1 - y 5+. Por ej. : Br. O- (sólo estable a bajas temperaturas 0 °C).

3+. Poco estable en disolución acuosa y desproporciona a 1+ y 5+. Ej: Br. O-2 y HBr. O 2. 5+. Estable ante la desproporción en disolución acuosa. Ej: Br. O-3 7+. Se reduce con facilidad y es dificil de preparar. Ej Br. O-4 Forma Compuestos con otros halógenos (interhalógenos). Ej: Br. F 5, Br. F 3, IBr, etc En disolución acuosa no ácida se desproporciona

Ácido Perbrómico y Perbromatos En pequeñas cantidades por oxidación electrolítica o la acción de Xe. F 2 Oxidación del Br. O-3 por el F 2 en disolución 5 M de Na. OH Br. O 3 - + F 2 +2 OH- Br. O 4 - + 2 F- + H 2 O No descompone hasta 6 M por tiempo indefinido Solución diluida oxidante lento y se reduce con I- o Br El ácido 3 M oxida facil al acero inoxidable Äcido 12 M oxida rápido Cl-. >275°C KBr. O 4 + ½ O 2 KBr. O 3 + O 2

Afinidad por el Hidrógeno H 2 S + Br 2 2 HBr + S Br 2 + H 2 2 HBr a 400°C ataca el vidrio Afinidad por los metales 2 Na. I + Br 2 - 2 Na. Br +I 2 Entre 50 y 80°C rendimientos cuantitativos de Br. O 33 Br 2 + 6 OH- 5 Br- + Br. O 3 - + 3 H 2 O

Óxidos de Bromo Baja estabilidad térmica. Br 2 O (l), café oscuro, descompone a velocidad cte >-50°C Br. O 3 O 8 (s), blanco inestable >-80°C, excepto en O 3 Br. O 2 (s), amarillo inestable >-40°C

Aplicaciones Decolorante. Desinfectante de piscinas. Fabricación de fibras artificiales Se adiciona a los dobles enlaces de las moléculas orgánicas Obtención de 1, 2 -dibromometano en la gasolina evitar óxidos de plomo en tubos de escape, forma Pb. Br 2. Bromuro de metilo en obtención de fumigantes Agentes antiinflamables Ag. Br lentes sensibles a la luz y películas fotográficas. CH 3 Br ataca los nervios y es mortal

Datos Curiosos Militares en la 2° guerra mundial lo utilizaban como anafrodisiaco Li. Br sedante en siglo XX, en los 40’s algunos pacientes de corazón murieron después de usarlo como sustituto de la sal común Como sólido al disminuir la temperatura se aclara hasta anaranjado rojizo En estado gaseoso sus moléculas diatómicas persisten hasta los 1500°C

Yodo üDel griego iώdhς- violeta üNo se encuentra libre en la naturaleza, sino siempre combinado y formando yoduros en salmueras y yodatos de Na y Ca. üDescubierto en 1811 por Bernard Courtis üEstados de oxidación 1, 1+, 3+, 5+ y 7+

Electronegatividad 2. 5 Punto de ebullición 183°C Punto de fusión 113. 7°C Densidad 4. 94 g/m. L 37 isótopos de los cuales 22 son sintéticos , 127 I el más estable de los isótopos Estructura cristalina ortorrombica El 131 I isótopo sintético mas estable abundancia 0. 114 ppm El yodo existe como moléculas diatómicas, I 2 en las fases sólida, líquida y de vapor, aunque a temperaturas elevadas (>200ºC, o sea, 390ºF) la disociación para formar átomos es apreciable.

Obtención de Yodo IO 3 - + 5 I- + 6 H+ → 3 I 2 + 3 H 2 O 2 I- + Cl 2 → I 2 + 2 Cl- 90 143 1 1 U + n → Sr+ Xe + 3 n 0 54 92 38 0 235 143 129 1 Xe → Xe+14 n 54 54 0 129 0 54 Xe I+ g 53 0 →

Características físicas de Yodo Sólido negro, brillante amorfo , sublima a P y T normales Poco soluble en agua ( 0. 33 g. L-1), muy soluble en compuestos orgánicos (color violeta) En disolución puede dimerizarse 2 I 2 I 4 La estructura de yodo en compuestos da color a las sustancias.

Óxidos de Yodo por hidrólisis parcial (IO)2 SO 4 I 2 O 4(sólido amarillo) Por ozonación 2 I 2+3 O 3 I 4 O 9 2 HIO 3 240°c I 2 O 5+H 2 O El óxido mas estable es I 2 O 5 por lo que a 100° c los óxidos de yodo resultan I 2 O 5

Compuestos de Yodo (III) Los compuestos de I (III) se combina con oxianiones, en donde los enlaces I-O son covalentes I 2+ Ag. Cl. O 4 -éter I(OCl. O 3)+Ag. I I 2+6 Cl. O 3 2 I(OCl. O 3)3+3 Cl 2 Cs. I+4 Cl. O 3 Cs[I(OCl. O 3)4]+2 Cl 2

Importancia biológica de de Yodo El yodo es indispensable en el metabolismo normal de las células e igualmente es un nutriente esencial en la producción de las hormonas tiroideas y en el funcionamiento normal de la glándula tiroides


Aplicaciones En los radiografías En los rayos X En microscopios pinturas Farmacia tratamientos de madera fluidos para trabajo en metal.

ASTATO PROPIEDADES • Entalpía de fijación electrónica del átomo (KJ/mol)= -270 (± 20) • No se ha registrado como molécula diatómica. • Radioactivo

Astato Se le llamó astatino, del griego, que significa inestable. Se obtuvo por primera vez (1940) en cantidades suficientes para conocer algunas de sus propiedades por la reacción de ciclotrón: Se estima que la corteza terrestre contiene alrededor de 44 mg de astato.

Se conocen alrededor de 20 isótopos, siendo el de la vida más larga el , con una vida media de 8. 3 horas. Todos los isótopos son radioactivos. Algunos se derivan de la desintegración de uranio y torio. Por espectroscopia de masas se ha comprobado la presencia de compuestos:

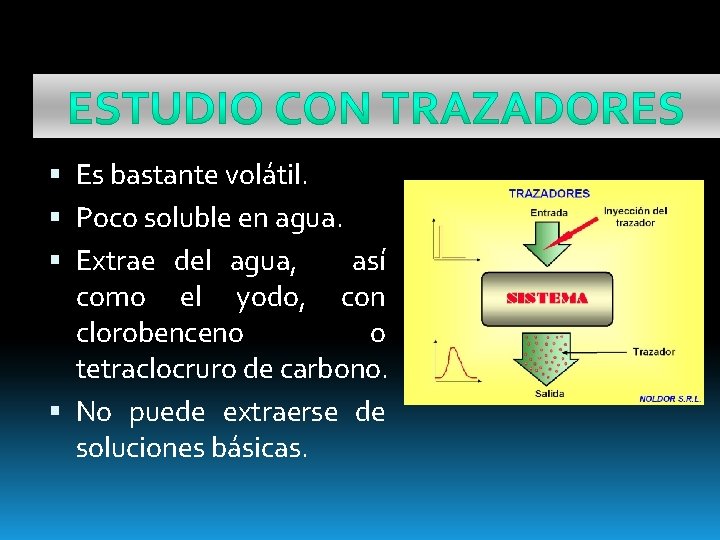
El conocimiento de la química del At se basa en el estudio con trazadores. Los estudios muestran su comportamiento de la extrapolación de las características de los otros halógenos. Es por ello que la química desarrollada es descriptiva. No se dispone de cantidades macroscópicas.

Es bastante volátil. Poco soluble en agua. Extrae del agua, así como el yodo, con clorobenceno o tetraclocruro de carbono. No puede extraerse de soluciones básicas.

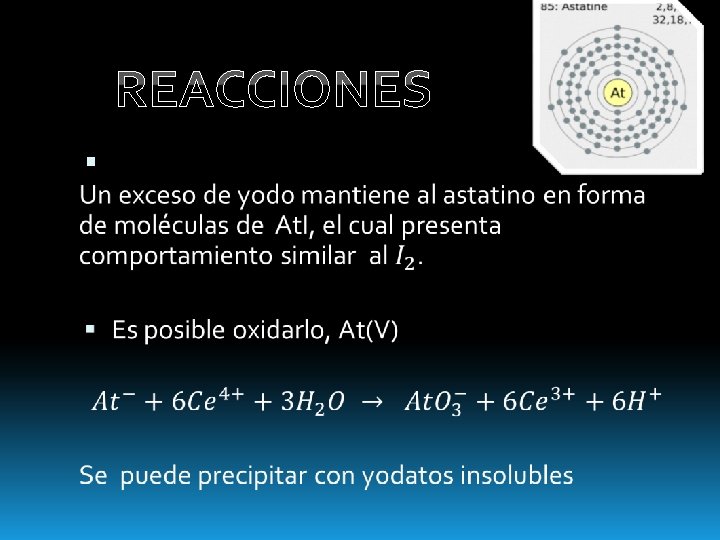
REACCIONES

REACCIONES

REACCIONES

APLICACIONES Por su reactividad, los radioisótopos presentan utilidad para el tratamiento contra el cáncer. Aplicaciones en la medicina para diversos tratamientos. Estudios demostraron su unión con la insulina, aplicándolo en el tratamiento de carcinoma en el hígado.
 Grupo 5 integrantes
Grupo 5 integrantes Grupo de 4 integrantes
Grupo de 4 integrantes Grupo 10 4 integrantes
Grupo 10 4 integrantes Amway zafiro
Amway zafiro Usos del platino
Usos del platino Yordanka reyes cruz
Yordanka reyes cruz Trabajo en grupo vs trabajo en equipo
Trabajo en grupo vs trabajo en equipo Trabajo en grupo vs trabajo en equipo
Trabajo en grupo vs trabajo en equipo Que es un equipo y un grupo
Que es un equipo y un grupo Diferencias entre grupo y equipo de trabajo
Diferencias entre grupo y equipo de trabajo Astato propiedades
Astato propiedades Halgenos
Halgenos Mario ademar cruz cruz
Mario ademar cruz cruz Transversalidad lourau
Transversalidad lourau Predicado
Predicado Grupo nominal e grupo verbal
Grupo nominal e grupo verbal Grupo nominal e grupo verbal
Grupo nominal e grupo verbal Miranda integrantes
Miranda integrantes Miss a integrantes
Miss a integrantes Lagos integrantes
Lagos integrantes Evanescence integrantes
Evanescence integrantes O que é objetivo indireto
O que é objetivo indireto Estructura organizacional de pronaca
Estructura organizacional de pronaca Integrantes
Integrantes Integrantes de la familia
Integrantes de la familia Integrantes de la red nacional de laboratorios colombia
Integrantes de la red nacional de laboratorios colombia Metodo de crout
Metodo de crout Paises que conforman el mercosur
Paises que conforman el mercosur Punto esquina
Punto esquina Termos integrantes da oração
Termos integrantes da oração Integrantes
Integrantes Malena miranda
Malena miranda The internet integrantes
The internet integrantes Integrantes de una agencia de publicidad
Integrantes de una agencia de publicidad Integrantes da elo
Integrantes da elo Organizacion social de los mayas
Organizacion social de los mayas Luca
Luca My chemical romance discografia
My chemical romance discografia Integrantes
Integrantes Termos da oração
Termos da oração Forgiven integrantes
Forgiven integrantes Tlc integrantes
Tlc integrantes Alejandra escudero
Alejandra escudero Integrantes
Integrantes Integrantes de luca
Integrantes de luca Reunanse en equipos de cuatro integrantes
Reunanse en equipos de cuatro integrantes Trabajar con equipos sin autorización.
Trabajar con equipos sin autorización. Cloruro de sodio
Cloruro de sodio 10 claves para trabajar en equipo
10 claves para trabajar en equipo Trabajo en equipo rubrica
Trabajo en equipo rubrica Modelo de diagnostico situacional
Modelo de diagnostico situacional Dos llaves de agua e y f
Dos llaves de agua e y f Referentes escolares de esi
Referentes escolares de esi El equipo de dios
El equipo de dios Reflexiones trabajo en equipo
Reflexiones trabajo en equipo Francisco estrada valle y octavio acuña rubio
Francisco estrada valle y octavio acuña rubio Homans george trabajo en equipo
Homans george trabajo en equipo Peter senge la quinta disciplina
Peter senge la quinta disciplina El pastor y su equipo de trabajo
El pastor y su equipo de trabajo Reunión de equipo docente
Reunión de equipo docente Equipo ministerial
Equipo ministerial Equipo 7
Equipo 7 Roles de un equipo de trabajo
Roles de un equipo de trabajo Equipo medico durable
Equipo medico durable Puncion glutea
Puncion glutea