H muitos anos atrs surgiu a expresso COMPOSTOS












- Slides: 33

Há muitos anos atrás surgiu a expressão COMPOSTOS ORG NICOS para indicar as substâncias produzidas por ORGANISMOS VIVOS Era a TEORIA DA FORÇA VITAL

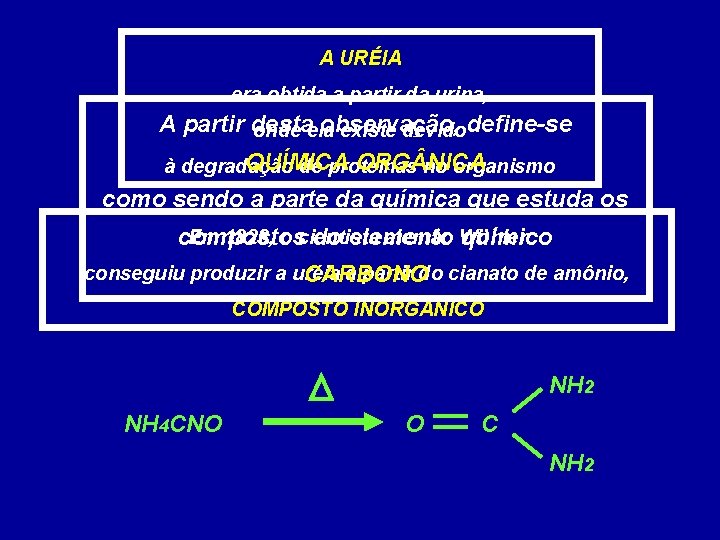
A URÉIA era obtida a partir da urina, A partir desta observação, onde ela existe devidodefine-se QUÍMICA ORG NICA à degradação de proteínas no organismo como sendo a parte da química que estuda os Em 1828, o cientista alemão Wöhler compostos do elemento químico conseguiu produzir a uréia a partir do cianato de amônio, CARBONO COMPOSTO INORG NICO NH 2 NH 4 CNO O C NH 2

GNV Álcool etílico gás natural veicular C 2 H 5 OH CH 4

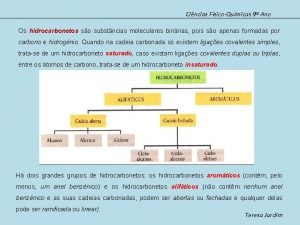
Existem substâncias como o CO, CO 2, H 2 CO 3 e demais carbonatos, HCN e demais cianetos, que são considerados compostos de transição Alguns elementos formam, praticamente, todos os compostos orgânicos, tais elementos são chamados de ORGANÓGENOS e, são constituídos pelos elementos C, H, O e N

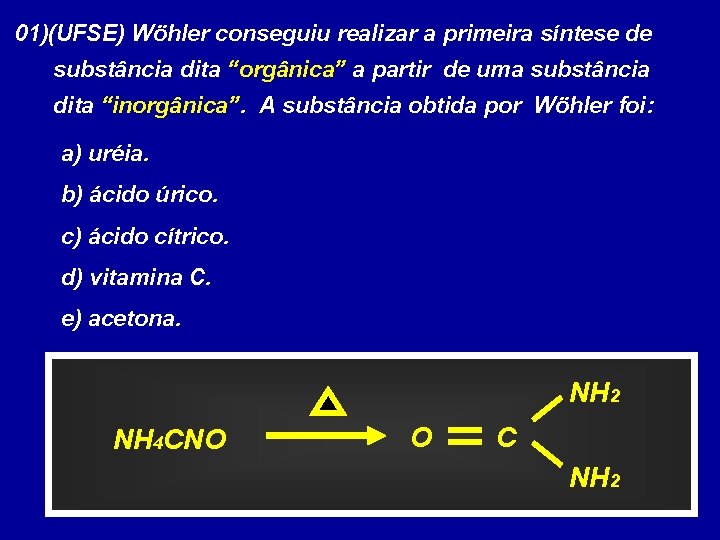
01)(UFSE) Wöhler conseguiu realizar a primeira síntese de substância dita “orgânica” a partir de uma substância dita “inorgânica”. A substância obtida por Wöhler foi: a) uréia. b) ácido úrico. c) ácido cítrico. d) vitamina C. e) acetona. NH 2 NH 4 CNO O C NH 2

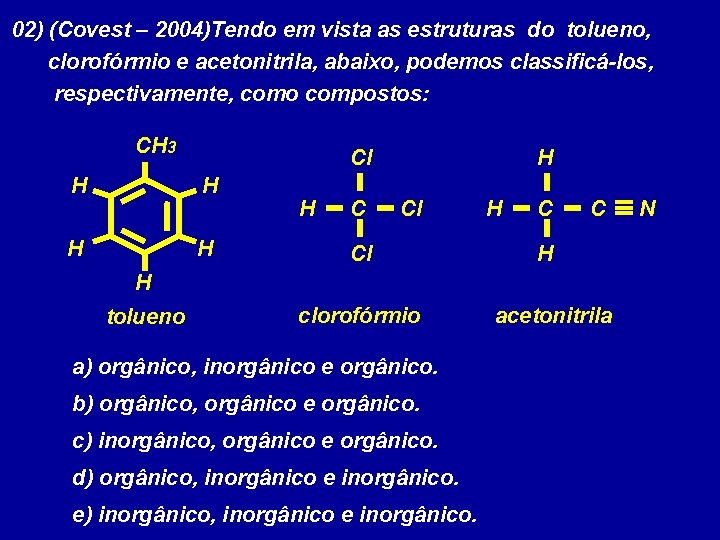
02) (Covest – 2004)Tendo em vista as estruturas do tolueno, clorofórmio e acetonitrila, abaixo, podemos classificá-los, respectivamente, como compostos: CH 3 Cl H H H Cl Cl H C C H H tolueno clorofórmio a) orgânico, inorgânico e orgânico. b) orgânico, orgânico e orgânico. c) inorgânico, orgânico e orgânico. d) orgânico, inorgânico e inorgânico. e) inorgânico, inorgânico e inorgânico. acetonitrila N

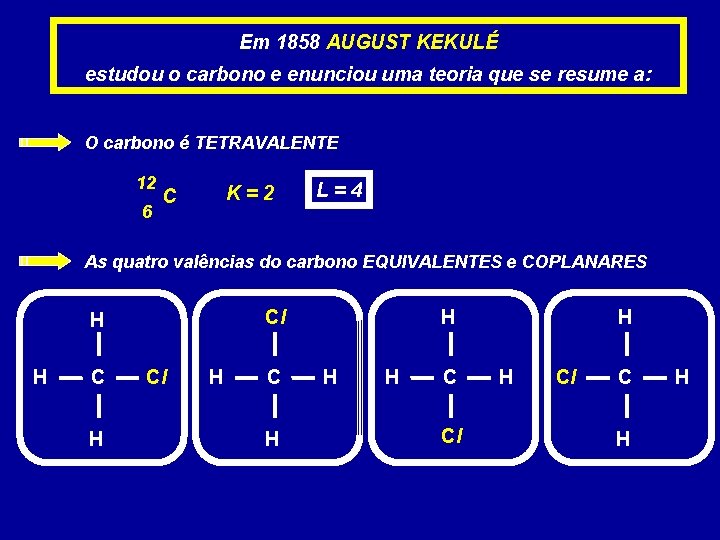
Em 1858 AUGUST KEKULÉ estudou o carbono e enunciou uma teoria que se resume a: O carbono é TETRAVALENTE 12 6 K=2 C L L == 44 As quatro valências do carbono EQUIVALENTES e COPLANARES Cl H H Cl H C H H C Cl H H Cl C H H

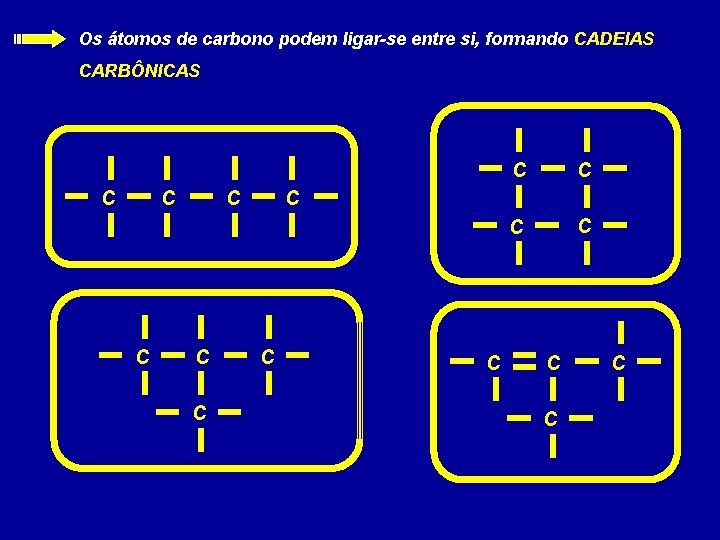
Os átomos de carbono podem ligar-se entre si, formando CADEIAS CARBÔNICAS C C C C

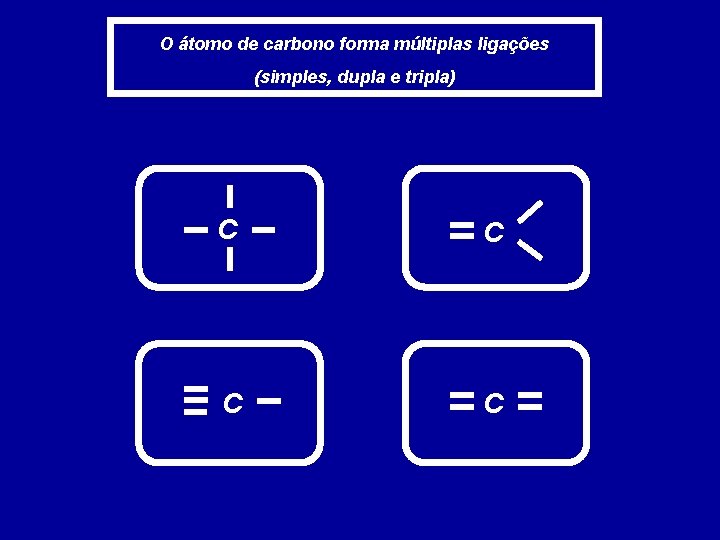
O átomo de carbono forma múltiplas ligações (simples, dupla e tripla) C C

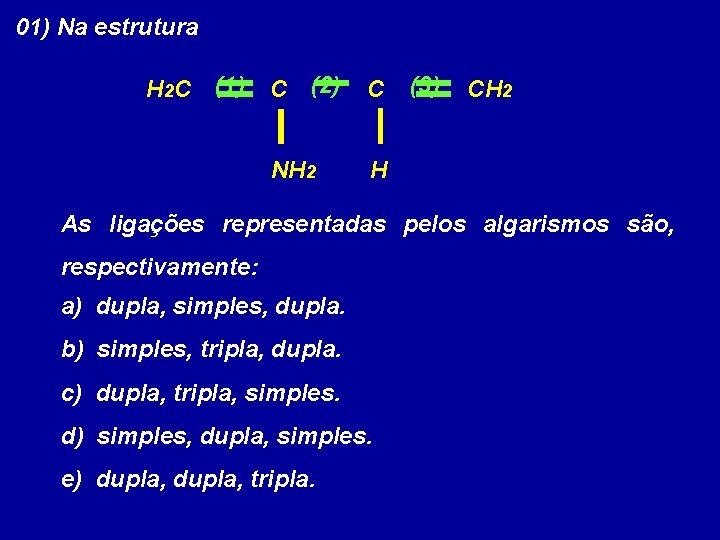
01) Na estrutura H 2 C (1) C (2) C NH 2 H (3) CH 2 As ligações representadas pelos algarismos são, respectivamente: a) dupla, simples, dupla. b) simples, tripla, dupla. c) dupla, tripla, simples. d) simples, dupla, simples. e) dupla, tripla.

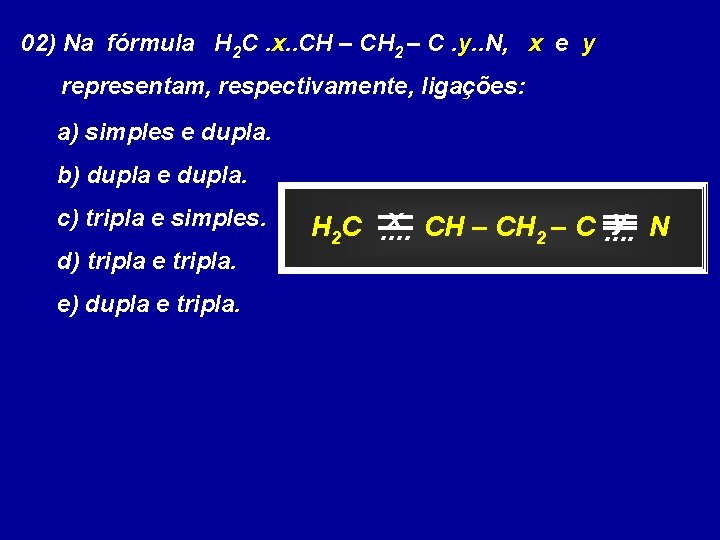
02) Na fórmula H 2 C. x. . CH – CH 2 – C. y. . N, x e y representam, respectivamente, ligações: a) simples e dupla. b) dupla e dupla. c) tripla e simples. d) tripla e tripla. e) dupla e tripla. x CH – C. . y N H 2 C. . 2

C O carbono tem geometria TETRAÉDRICA. O carbono tem ângulo entre suas valências de 109° 28’. O carbono tem 4 ligações sigma ( s ). O carbono se encontra hibridizado “sp 3 “.

C Com um ligação dupla e duas ligações simples: O carbono tem geometria TRIGONAL PLANA. O carbono tem ângulo entre suas valências de 120°. O carbono tem 3 ligações sigma ( s ) e 1 ligação pi ( p O carbono se encontra hibridizado “sp 2 “. ).

C Com duas ligações dupla: O carbono tem geometria LINEAR. O carbono tem ângulo entre suas valências de 180°. O carbono tem 2 ligações sigma ( s ) e 2 ligação pi ( O carbono se encontra hibridizado “sp“. p ).

C Com uma ligação tripla e uma ligação simples: O carbono tem geometria LINEAR. O carbono tem ângulo entre suas valências de 180°. O carbono tem 2 ligações sigma ( s ) e 2 ligação pi ( O carbono se encontra hibridizado “sp“. p ).

01) (UFV-MG) Considere a fórmula estrutural abaixo: H H C C C 4 3 2 1 5 H H São feitas das seguintes afirmativas: s (sigma). II. O átomo de carbono 3 forma 3 ligações s (sigma) e 1 ligação p (pi). III. O átomo de carbono 2 forma 3 ligações p (pi) e 1 ligação s (sigma). I. O átomo de carbono 5 forma 4 ligações IV. O total de ligações p (pi) na estrutura é igual a 3. Assinale a alternativa correta. a) Apenas as afirmativas I e IV são corretas. b) Apenas as afirmativas II e III são corretas. c) Apenas as afirmativas I, II e IV são corretas. d) Todas são corretas. e) Apenas as afirmativas I e II são corretas.

02) (UFRN) O ácido metanóico (fórmico), encontrado em algumas formigas e causador da irritação provocada pela picada desses insetos, tem a seguinte fórmula: sp H s 2 s O p C s O H O átomo de carbono dessa molécula apresenta hibridização: a) sp com duas ligações sigma ( s ) e duas ligações pi ( p ). b) sp 2 com três ligações sigma ( s ) e uma ligação pi (p ). c) sp 2 com uma ligações sigma ( s ) e três ligações pi ( p ). d) sp 3 com três ligações sigma ( s ) e uma ligação pi ( p ). e) sp 2 com duas ligações sigma ( s ) e duas ligações pi ( p ).

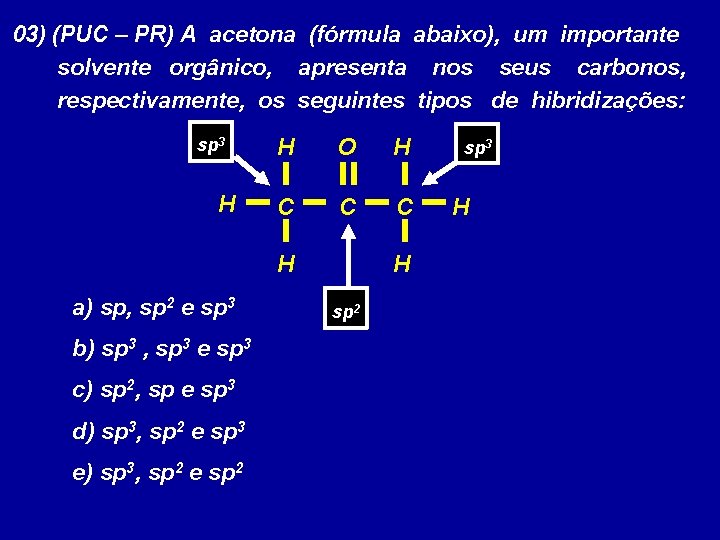
03) (PUC – PR) A acetona (fórmula abaixo), um importante solvente orgânico, apresenta nos seus carbonos, respectivamente, os seguintes tipos de hibridizações: sp 3 H H O H C C C H a) sp, sp 2 e sp 3 b) sp 3 , sp 3 e sp 3 c) sp 2, sp e sp 3 d) sp 3, sp 2 e sp 3 e) sp 3, sp 2 e sp 2 H sp 2 sp 3 H

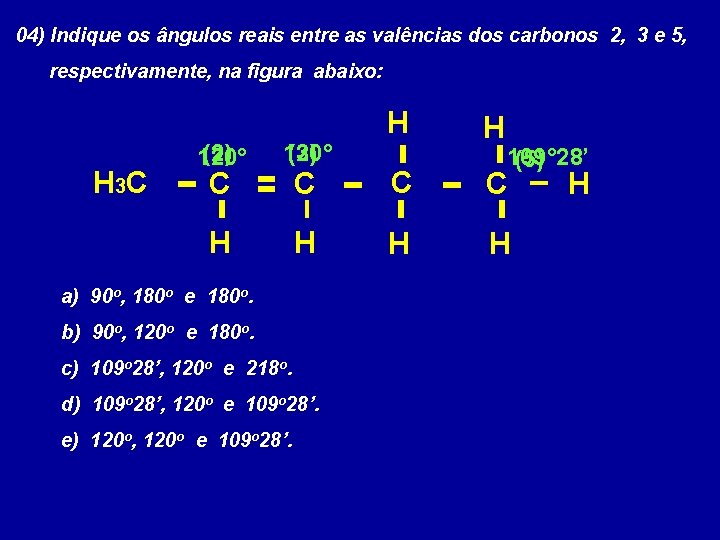
04) Indique os ângulos reais entre as valências dos carbonos 2, 3 e 5, respectivamente, na figura abaixo: H H 3 C H (2) 120° (3) C C H H a) 90 o, 180 o e 180 o. b) 90 o, 120 o e 180 o. c) 109 o 28’, 120 o e 218 o. d) 109 o 28’, 120 o e 109 o 28’. e) 120 o, 120 o e 109 o 28’. 109° 28’ (5) H

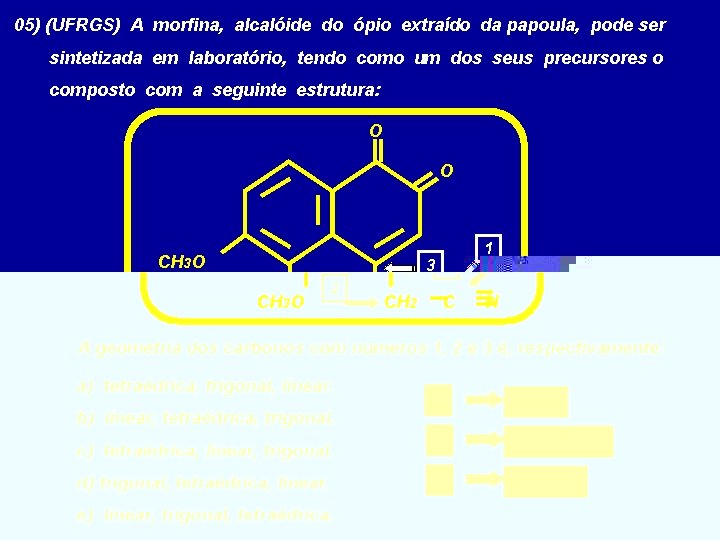
05) (UFRGS) A morfina, alcalóide do ópio extraído da papoula, pode ser sintetizada em laboratório, tendo como um dos seus precursores o composto com a seguinte estrutura: O O CH 3 O 1 3 CH 3 O 2 CH 2 C N A geometria dos carbonos com números 1, 2 e 3 é, respectivamente: a) tetraédrica, trigonal, linear. b) linear, tetraédrica, trigonal. c) tetraédrica, linear, trigonal. d) trigonal, tetraédrica, linear. e) linear, trigonal, tetraédrica. 1 linear 2 tetraédrica 3 trigonal

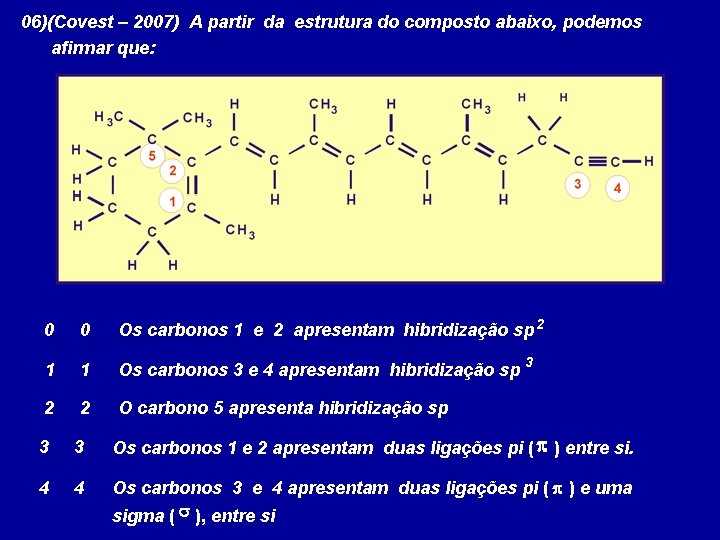
06)(Covest – 2007) A partir da estrutura do composto abaixo, podemos afirmar que: 0 0 Os carbonos 1 e 2 apresentam hibridização sp 2 1 1 Os carbonos 3 e 4 apresentam hibridização sp 2 2 O carbono 5 apresenta hibridização sp 3 3 3 Os carbonos 1 e 2 apresentam duas ligações pi ( p ) entre si. 4 4 Os carbonos 3 e 4 apresentam duas ligações pi ( p ) e uma sigma ( s ), entre si

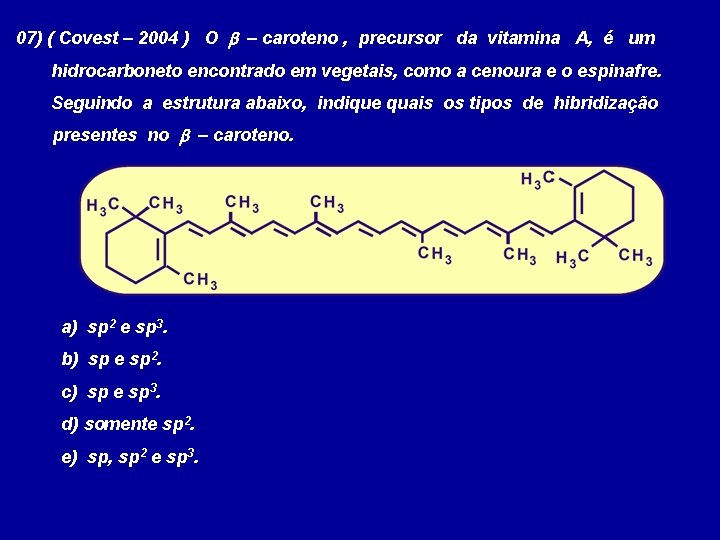
07) ( Covest – 2004 ) O b – caroteno , precursor da vitamina A, é um hidrocarboneto encontrado em vegetais, como a cenoura e o espinafre. Seguindo a estrutura abaixo, indique quais os tipos de hibridização presentes no b – caroteno. a) sp 2 e sp 3. b) sp e sp 2. c) sp e sp 3. d) somente sp 2. e) sp, sp 2 e sp 3.


Py Pz s s Px

A primeira ligação covalente entre dois átomos ocorre com orbitais de mesmo eixo (ligação sigma), as demais ligações ocorrem com orbitais paralelos e são chamadas de LIGAÇÕES pi ( p s p )

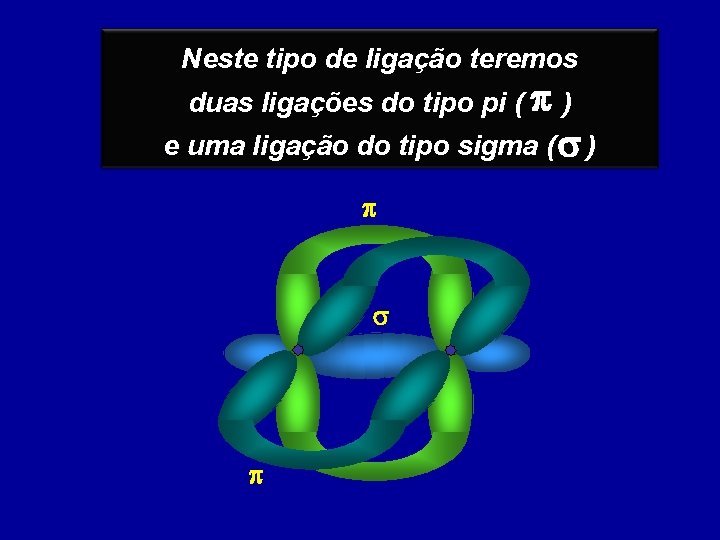
Neste tipo de ligação teremos duas ligações do tipo pi ( p ) e uma ligação do tipo sigma ( s ) p p s p

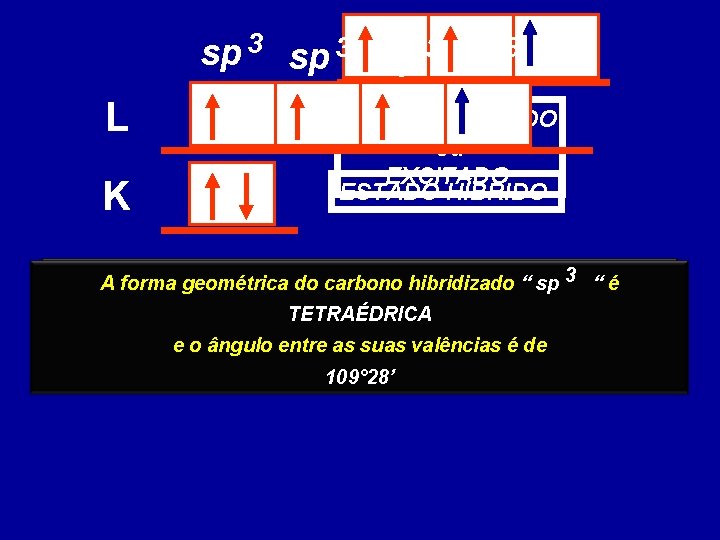
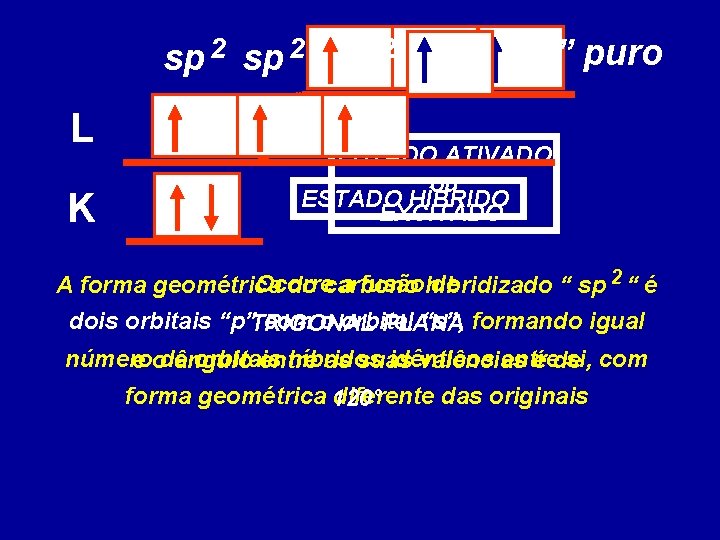
Apesar disso, o em todos os Observando carbono noseus estado normal concluiríamos ele só compostos o carbono que realiza teria condições de efetuar apenas quatro ligações. duas ligaçõeseste covalentes, Para justificar fato surgiupois a 3 2 possui somente dois elétrons TEORIA DA HIBRIDIZAÇÃO sp sp e sp desemparelhados

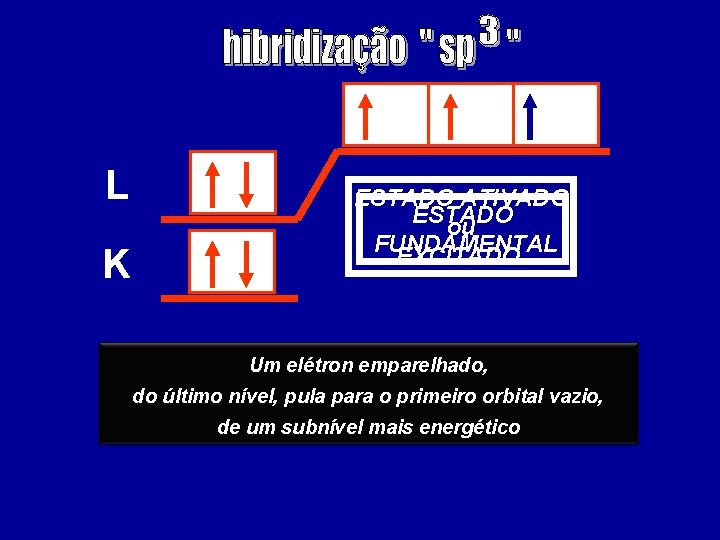
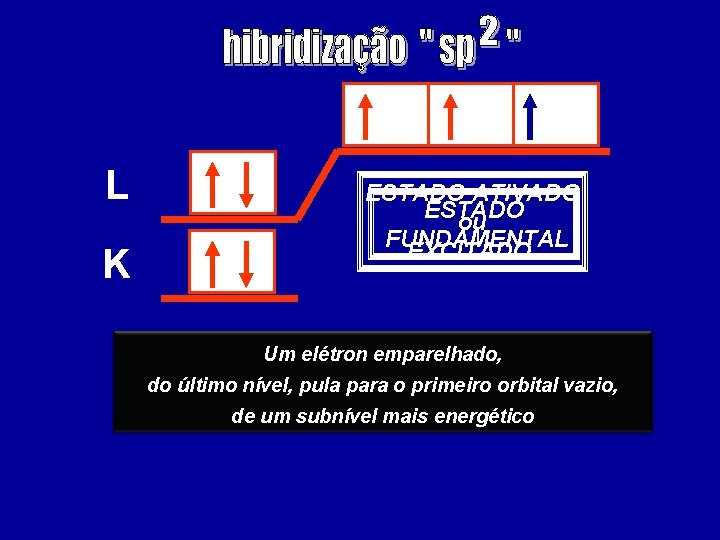
L K ESTADO ATIVADO ESTADO ou FUNDAMENTAL EXCITADO Um elétron emparelhado, do último nível, pula para o primeiro orbital vazio, de um subnível mais energético

sp 3 L K ESTADO ATIVADO ou EXCITADO ESTADO HÍBRIDO Ocorre a fusão dos contêm elétrons A forma geométrica doorbitais carbonoque hibridizado “ sp 3 “ é desemparelhados, formando igual número de orbitais híbridos TETRAÉDRICA idênticos entre com forma geométrica diferente e o si, ângulo entre as suas valências é dedas originais 109° 28’

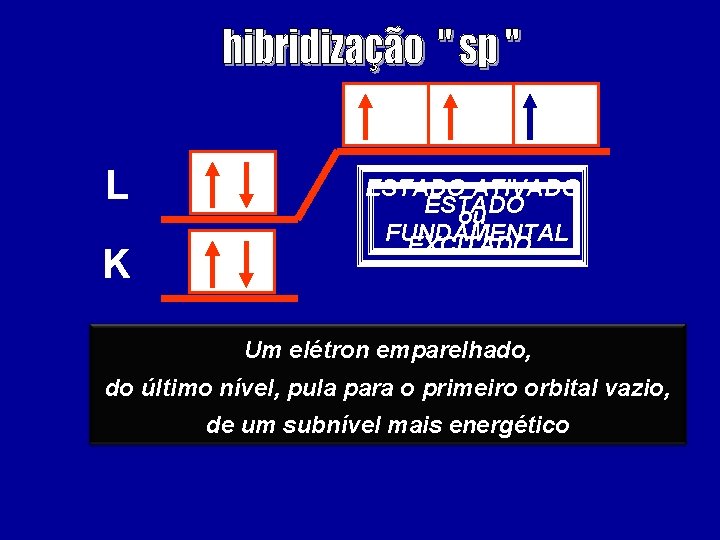
L K ESTADO ATIVADO ESTADO ou FUNDAMENTAL EXCITADO Um elétron emparelhado, do último nível, pula para o primeiro orbital vazio, de um subnível mais energético

sp 2 L K “p” puro ESTADO ATIVADO ou ESTADO HÍBRIDO EXCITADO Ocorre a fusãohibridizado de A forma geométrica do carbono “ sp 2 “ é dois orbitais “p”TRIGONAL com o orbital “s”, formando igual PLANA número orbitais híbridos idênticos entre si, com e ode ângulo entre as suas valências é de forma geométrica 120° diferente das originais

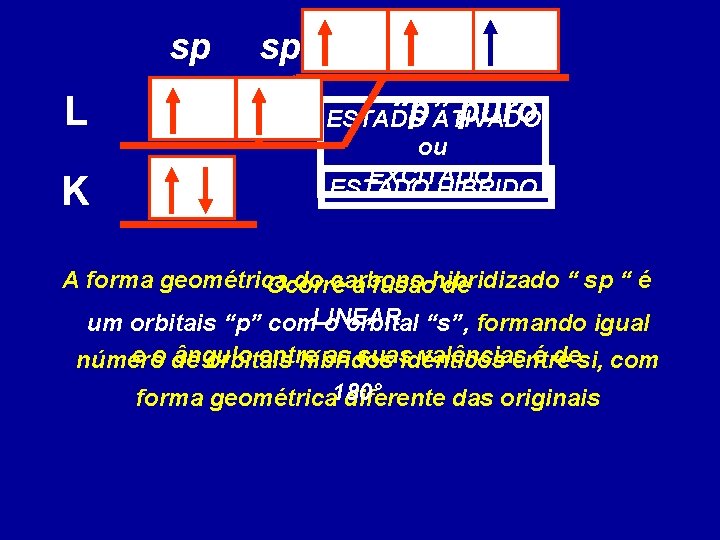
L K ESTADO ATIVADO ESTADO ou FUNDAMENTAL EXCITADO Um elétron emparelhado, do último nível, pula para o primeiro orbital vazio, de um subnível mais energético

sp L K sp “p”ATIVADO puro ESTADO ou EXCITADO ESTADO HÍBRIDO A forma geométrica do carbono “ sp “ é Ocorre a fusãohibridizado de um orbitais “p” com. LINEAR o orbital “s”, formando igual e o de ângulo entre as suas valências é desi, com número orbitais híbridos idênticos entre forma geométrica 180° diferente das originais
 Neo impressionismo
Neo impressionismo Tcoffee expresso
Tcoffee expresso Quando a luta greco-romana surgiu em competições
Quando a luta greco-romana surgiu em competições Como surgiu o voleibol
Como surgiu o voleibol A sociologia surgiu para suprir
A sociologia surgiu para suprir Como surgiu a arte conceitual
Como surgiu a arte conceitual Nas terras do oriente surgiu dos céus uma luz
Nas terras do oriente surgiu dos céus uma luz Como surgiu a bolsa de valores
Como surgiu a bolsa de valores De onde surgiu o narguile
De onde surgiu o narguile O realismo surgiu
O realismo surgiu Tatuagem quando surgiu
Tatuagem quando surgiu A origem da filosofia como ciência surgiu: *
A origem da filosofia como ciência surgiu: * Criação da escrita
Criação da escrita Juan carlos ceriani futsal
Juan carlos ceriani futsal Como surgiu a neuropsicologia
Como surgiu a neuropsicologia Muitos os chamados e poucos os escolhidos emmanuel
Muitos os chamados e poucos os escolhidos emmanuel Muitos smartphones e tablets não precisam mais de teclas
Muitos smartphones e tablets não precisam mais de teclas Muitos são chamados, poucos escolhidos espiritismo
Muitos são chamados, poucos escolhidos espiritismo Muitos os chamados poucos os escolhidos espiritismo
Muitos os chamados poucos os escolhidos espiritismo Muitos chamados poucos escolhidos
Muitos chamados poucos escolhidos Bíblia muitos serão chamados e poucos escolhidos
Bíblia muitos serão chamados e poucos escolhidos Talvez julguem que isto são voos de imaginação
Talvez julguem que isto são voos de imaginação Pronome pessoal
Pronome pessoal Subclasse dos verbos
Subclasse dos verbos Compostos ionics
Compostos ionics Formula juros compostos
Formula juros compostos O que são elementos organógenos
O que são elementos organógenos Compostos
Compostos Compostos alifáticos
Compostos alifáticos Formula de linhas
Formula de linhas Ciclohexino
Ciclohexino Verbs de la tercera conjugació
Verbs de la tercera conjugació Formas no finitas del verbo
Formas no finitas del verbo Ionicos
Ionicos