H 12 Polariteit van stoffen 10 minuten vraag















- Slides: 20

H 12. Polariteit van stoffen • 10 minuten vraag 1 • Bespreken opdracht 1 • Oplossen van stoffen in water. – Hydrofiel waterlievend – Hydrofoob watervrezend • Stoffen met H-brug vormende moleculen lossen op. – H gebonden aan elektronegatief atoom (tab 40). O-H/N-H – H-brug ontvangende groepen. C=O, CΞN, C-F, O-H, N-H • Dipoolmoment • Een moleculaire stof kan in principe alleen in water oplossen als in de moleculen ten minste een H-brug vormende of ontvangende groep voorkomt en het O=C=O dipoolmoleculen zijn

H 12. Polariteit van stoffen • Stearinezuur <-> 1 -butanol oplosbaar? – Grootte hydrofiel/hydrofoob • Emulgator= hydrofiel en hydrofoob gedeelte – Olie in water emulsie/ water in olie emulsie (fig 12. 7) • Suspensie, rook, nevel, schuim • Hydratatie= omringing van ion door water, ion -dipoolbinding • Micellen fig 12. 9 • Maken t/m 7

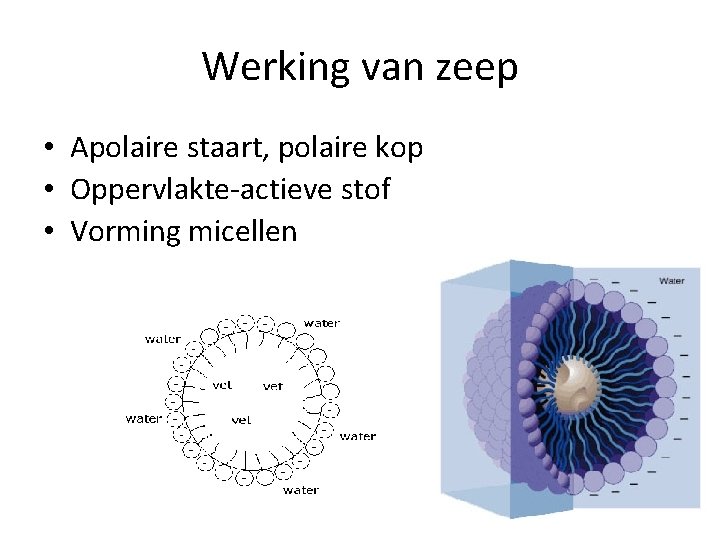
Werking van zeep • Apolaire staart, polaire kop • Oppervlakte-actieve stof • Vorming micellen

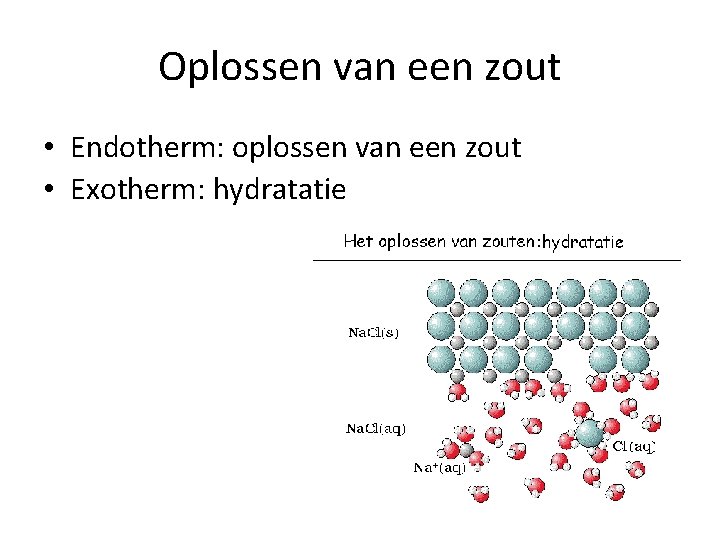
Oplossen van een zout • Endotherm: oplossen van een zout • Exotherm: hydratatie

§ 12. 3 Chromatografie • • • Wat is chromatografie Verdelingsconstante Gaschromatografie Kwantitatief en kwalitatief Toepassingen Voorbeeld GC

Wat is chromatografie • Mobiele fase / stationaire fase • Papierchromatografie (derdeklas, NLT) – Mengsel water/aceton – Water hecht aan papier(cellulose) wordt stationaire fase – Aceton blijft mobiele fase – Kleurstoffen [A] van inkt hechten aan stationaire [A]s of mobiele [A]m fase. Oftewel Am As – • Vloeistof-vloeistofchromatografie (LLC) Gas-Vloeistofchromatografie (GLC)

Verdelingsconstante • Verdelingsconstante, ook Relativeflow-waarde • Rf = afstand van startlijn tot zwaartepunt van een stofvlek afstand van startlijn tot vloeistoffront • • Plaatje: Rf = a/b Referentiestof Dunne laag Si. O 2 Kwalitatief?

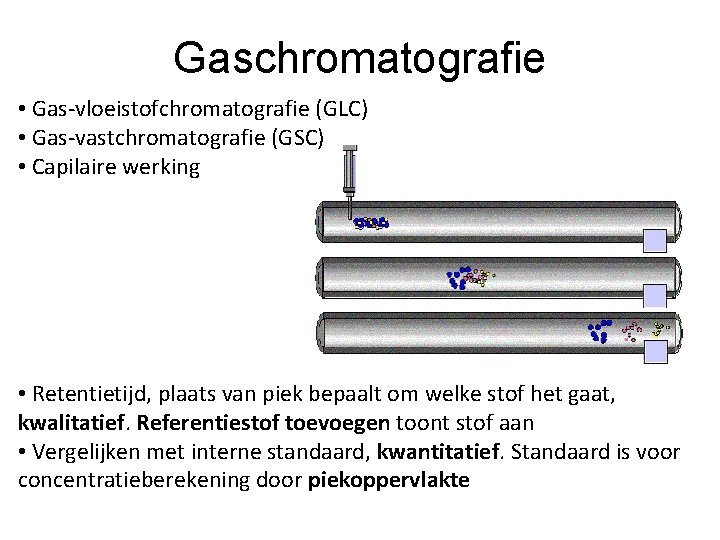
Gaschromatografie • Gas-vloeistofchromatografie (GLC) • Gas-vastchromatografie (GSC) • Capilaire werking • Retentietijd, plaats van piek bepaalt om welke stof het gaat, kwalitatief. Referentiestof toevoegen toont stof aan • Vergelijken met interne standaard, kwantitatief. Standaard is voor concentratieberekening door piekoppervlakte

Toepassingen • Urine- en bloedonderzoek • Doping • Rivierwateranalyse • Gechloreerde koolwaterstoffen uit bijv. gewasbescherming • Voedingsmiddelen • Synthetische geur- en smaakstoffen

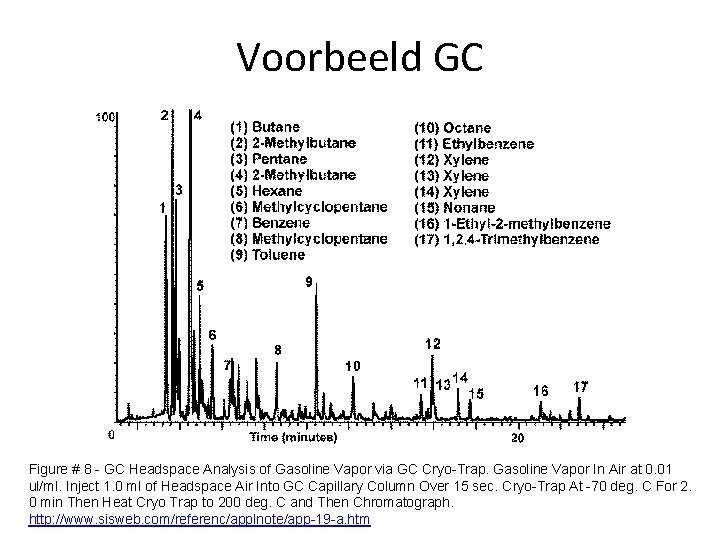
Voorbeeld GC Figure # 8 - GC Headspace Analysis of Gasoline Vapor via GC Cryo-Trap. Gasoline Vapor In Air at 0. 01 ul/ml. Inject 1. 0 ml of Headspace Air Into GC Capillary Column Over 15 sec. Cryo-Trap At -70 deg. C For 2. 0 min Then Heat Cryo Trap to 200 deg. C and Then Chromatograph. http: //www. sisweb. com/referenc/applnote/app-19 -a. htm

Aan de slag • Afronden hoofdstuk 12 M t/m opgave 15


§ 12. 1 Inleiding • Herhalen vierdeklasleerstof over deeltjes – Indeling van stoffen in een schema – Deeltjes en bindingen – Deeltjes en roosters – Deeltjes en stoffen

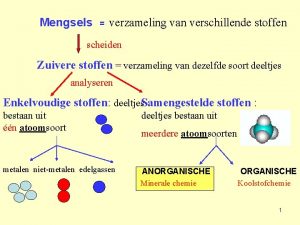
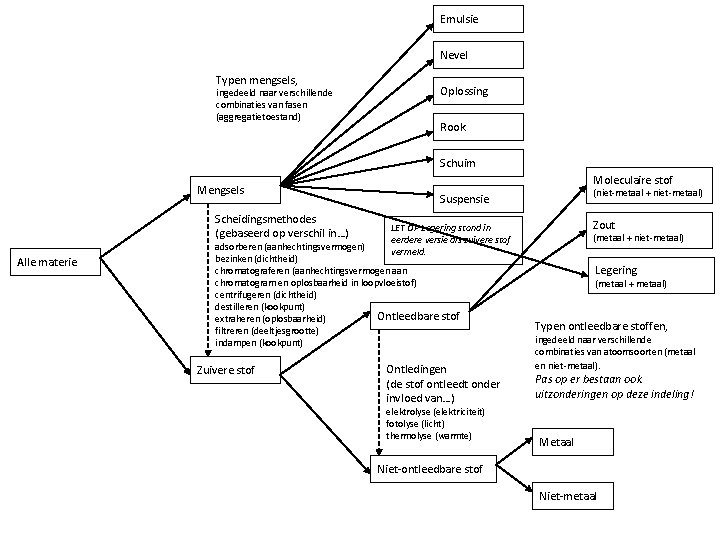
Indeling van stoffen • Verschillende stoffen hebben verschillende deeltjes – Moleculaire stof > moleculen [niet-metalen] – Metalen > metaalatomen [metalen] – Zouten > ionen [metaal met niet-metaal] • Opbouw van alle materie is in te delen in mengsels en zuivere stoffen – Mengsels kun je scheiden – Zuivere stoffen kun je ontleden

Emulsie Nevel Typen mengsels, ingedeeld naar verschillende combinaties van fasen (aggregatietoestand) Oplossing Rook Schuim Mengsels Scheidingsmethodes (gebaseerd op verschil in…) Alle materie Moleculaire stof Zout LET OP Legering stond in eerdere versie als zuivere stof vermeld. adsorberen (aanhechtingsvermogen) bezinken (dichtheid) chromatograferen (aanhechtingsvermogen aan chromatogram en oplosbaarheid in loopvloeistof) centrifugeren (dichtheid) destilleren (kookpunt) Ontleedbare stof extraheren (oplosbaarheid) filtreren (deeltjesgrootte) indampen (kookpunt) Zuivere stof (niet-metaal + niet-metaal) Suspensie Ontledingen (de stof ontleedt onder invloed van…) elektrolyse (elektriciteit) fotolyse (licht) thermolyse (warmte) (metaal + niet-metaal) Legering (metaal + metaal) Typen ontleedbare stoffen, ingedeeld naar verschillende combinaties van atoomsoorten (metaal en niet-metaal). Pas op er bestaan ook uitzonderingen op deze indeling! Metaal Niet-ontleedbare stof Niet-metaal

Deeltjes en bindingen • Verschillende deeltjes hebben verschillende bindingen – Tussen moleculen • Vanderwaalsbindingen (molecuulbindingen) • Waterstofbruggen • Dipool/dipoolbindingen – Tussen atomen • Covalente binding (atoombinding) • Polaire atoombinding – Door een polaire atoombinding kan een dipool ontstaan • Metaalbinding – Tussen ionen • Ionbindingen

Deeltjes en roosters • Verschillende deeltjes zitten in verschillende roosters – Moleculen zitten in een molecuulrooster – Atomen zitten in een atoomrooster – Metaalatomen zitten in een metaalrooster – Ionen zitten in een ionrooster

Deeltjes en stoffen • Metalen – Edele metalen / Au, Ag en Pt – Half edele metalen / bv. Cu, Hg en Ti – Onedele metalen / bv. Al, Zn, Fe, Pb en Sn – Zeer onedele metalen / bv. Li, Na, K, Ca, Ba, Mg • Alkalimetalen (groep 1) en aardalkalimetalen (groep 2) • Moleculaire stoffen – Halogenen (groep 17) – Edelgassen (groep 18) – Overige

Zelf oefenen • Teken de waterstofbruggen tussen een molecuul ethanal en twee moleculen water • Geef de hydratatie van een natriumion en een chloride-ion in water weer

 Opsomming van vragen
Opsomming van vragen 1 etmaal is hoeveel minuten
1 etmaal is hoeveel minuten 10-minuten-abschrift bewertungstabelle
10-minuten-abschrift bewertungstabelle Atomaire stoffen
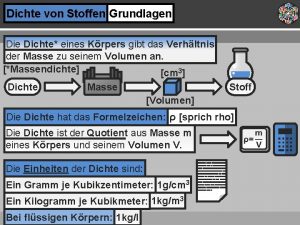
Atomaire stoffen Dichte von stoffen
Dichte von stoffen Soorten mengsels
Soorten mengsels Regulerende stoffen
Regulerende stoffen Zuurconstante tabel
Zuurconstante tabel Kunnen moleculaire stoffen elektrische stroom geleiden
Kunnen moleculaire stoffen elektrische stroom geleiden Kilo veren
Kilo veren Werkplekinstructiekaart
Werkplekinstructiekaart Zuren en basen die je moet kennen
Zuren en basen die je moet kennen Mol berekenen
Mol berekenen Autotrofe organismen voorbeelden
Autotrofe organismen voorbeelden Zelfontbrandingstemperatuur papier
Zelfontbrandingstemperatuur papier Ruhe stoffen
Ruhe stoffen Basisveiligheid betekenis
Basisveiligheid betekenis Waterstofzouten
Waterstofzouten Welke stoffen lossen op in water
Welke stoffen lossen op in water Pulsar college
Pulsar college Vraaglijn en aanbodlijn oefeningen
Vraaglijn en aanbodlijn oefeningen