GV V Th L Trng THCS Mng Thanh


























- Slides: 28

GV: Vũ Thị Lý Trường THCS Mường Thanh

KiÓm tra bµi cò 1. Phát biểu định nghĩa độ tan, những yếu tố 2. ảnh hưởng đến độ tan? Đáp án : * Độ tan ( kí hiệu S ) của một chất trong nước là số gam chất đó hoà tan trong 100 gam nước để tạo thành dung dịch bão hoà ởnhiệt độxác định. * Những yếu tố ảnh hưởng đến độ tan : - Độ tan của chất rắn trong nước phụ thuộc vào nhiệt độ ( Nói chung độ tan của chất tăng khi nhiệt độ tăng ) - Độ tan của chất khí trong nước phụ thuộc vào nhiệt độ và áp suất (Độ tan của chất khí tăng nếu giảm nhiệt độ và tăng áp suất )

• Trong đời sống hàng ngày chúng ta nhắc rất nhiều đến nồng độ dung dịch. Vậy để hiểu thế nào là nồng độ dung dịch chúng ta cùng nghiên cứu nội dung bài :

TiÕt 62: Bµi 42: Nồng ®é dung dịch Nội dung của bài 42 này gồm 2 phần : 1. Nồng độ phần trăm của dung dịch : 2. 2. Nồng độ mol của dung dịch.

TiÕt 62: Bµi 42: Nồng ®é dung dịch 1. Nồng độ phần trăm của dung dịch D. D Cu. Cl 2 D. D KMn. O 4 nồng độ 10 % Nồng độ 5 % Quan sát hình ảnh trên màn hình cho ta biết điều gì ? Dung dịch Cu. Cl 2 có nồng độ 5 % , Dung dịch KMn. O 4 có nồng độ 10 %.

Tiết 62 - bài 42 NỒNG ĐỘ DUNG DỊCH I. Nồng độ phần trăm của dung dịch VD 1: Dung dịch Cu. Cl 2 có nồng độ 5%. Em hiểu như thế nào về dung dịch Cu. Cl 2 có nồng độ 5%. Cho biết trong 100 g dung dịch Cu. Cl 2 có 5 g chất tan Cu. Cl 2 => Gọi đó là nồng độ phần trăm của dung dịch

Tiết: 62 bài 42 NỒNG ĐỘ DUNG DỊCH I. Nồng độ phần trăm của dung dịch 1. Định nghĩa: Nồng độ phần trăm (kí hiệu là C%) của dung dịch cho biết số gam chất tan có trong 100 g dung dịch. Thế nào là nồng độ phần trăm của dung dịch ?

Tiết 62 - bài 42 NỒNG ĐỘ DUNG DỊCH I. Nồng độ phần trăm của dung dịch 1. Định nghĩa: Nồng độ phần trăm (kí hiệu là C%) của dung dịch cho biết số gam chất tan có trong 100 g dung dịch. VD 1: Dung dịch Cu. Cl 2 có nồng độ 5% Cho biết trong 100 g dung dịch Cu. Cl 2 có 5 chất tan Cu. Cl 2 VD 2: Dung dịch KMn. O 4 có nồng độ 10%. Cho biết trong 100 g dung dịch KMn. O 4 có 10 g chất tan KMn. O 4 Dung dịch KMn. O 4 có nồng độ 10% cho biết điều gì?

Tiết: 62 NỒNG ĐỘ DUNG DỊCH I. Nồng độ phần trăm của dung dịch 1. Định nghĩa: 2. Công thức: C% = mct. 100% mdd (1) CÔNG THỨC TÍNH NỒNG ĐỘ PHẦN TRĂM CỦA DUNG DỊCH

Tiết: 62 NỒNG ĐỘ DUNG DỊCH I. Nồng độ phần trăm của dung dịch 1. Định nghĩa: 2. Công thức: C% = mct. 100% mdd Hãy cho biết ý nghĩa các đại lượng trong công thức. (1) Trong đó : + mct là khối lượng chất tan. + md. d là khối lượng dung dịch. mdd = mct + md. m (md. m là khối lượng dung môi)

Tiết: 62 NỒNG ĐỘ DUNG DỊCH I. Nồng độ phần trăm của dung dịch 1. Định nghĩa: Thảo luận cặp nhóm 2. Công thức: C% = mct. 100% mdd (1) Trong đó : + mct là khối lượng chất tan (g ) + md. dlà khối lượng dung dịch(g) mdd = mct + md. m (md. m là khối lượng dung môi) Dựa vào công thức C%. Hãy viết công thức tính: - m ct - md. d

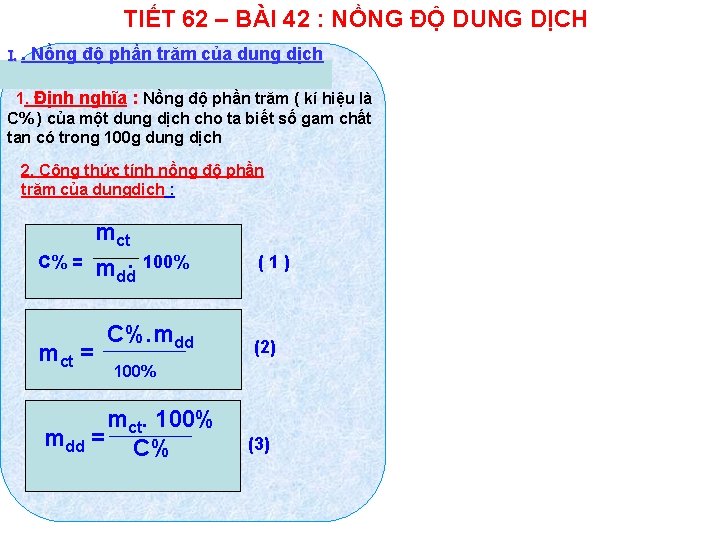
TIẾT 62 – BÀI 42 : NỒNG ĐỘ DUNG DỊCH I. . Nồng độ phần trăm của dung dịch 1. Định nghĩa : Nồng độ phần trăm ( kí hiệu là C% ) của một dung dịch cho ta biết số gam chất tan có trong 100 g dung dịch 2. Công thức tính nồng độ phần trăm của dungdịch : C% = mct mdd. 100% C%. mdd (1) (2) 100% mct. 100% mdd = C% (3)

Tiết: 62 NỒNG ĐỘ DUNG DỊCH I. Nồng độ phần trăm của dung dịch 1. Định nghĩa: 2. Công thức: C% = mct. 100% mdd C%. mdd Bài tập cho biết gì? Yêu cầu làm gì? (1) (2) 100% mct. 100% mdd = C% (3) Cho biết: 3. Bài tập áp dụng: Ví dụ 1: Hòa tan 25 g Na. Cl vào 45 g nước. Tính nồng độ phần trăm của dung dịch. Tính : C% =?

Tiết: 62 NỒNG ĐỘ DUNG DỊCH I. Nồng độ phần trăm của dung dịch 1. Định nghĩa: 2. Công thức: C% = mct. 100% mdd C%. mdd Khối lượng dung dịch Na. Cl (1) (2) Nồng độ phần trăm của dung dịch Na. Cl 100% mct. 100% mdd = C% (3) 3. Bài tập áp dụng: Ví dụ 1: Hòa tan 25 g Na. Cl vào 45 g nước. Tính nồng độ phần trăm của dung dịch. Vậy nồng độ phần trăm của dung dịch Na. Cl là 25%

• Qua ví dụ 1 em hãy cho biết cách giải bài toán tính nồng độ phần trăm, khi biết khối lượng chất tan và khối lượng của dung môi ? • Cách giải : ( 2 bước ) • Bước 1 : Tìm khối lượng dung dịch. mdd = mct + mdm • Bước 2: Áp dụng CT tính m C% = ct . 100% mdd

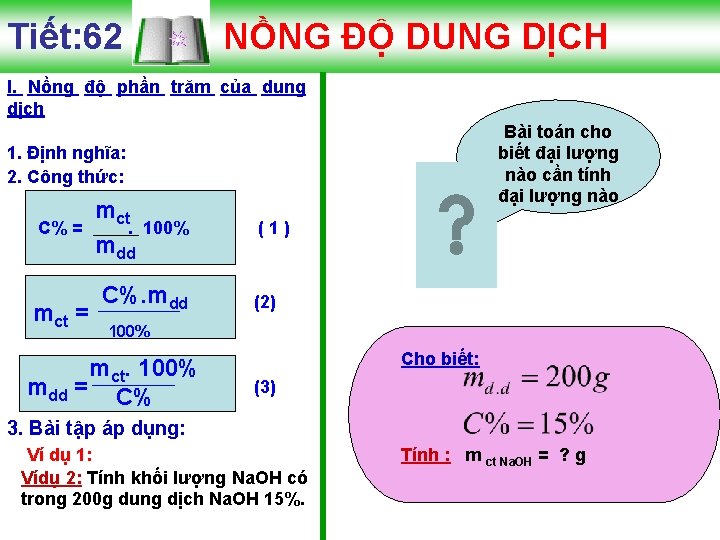
Tiết: 62 NỒNG ĐỘ DUNG DỊCH I. Nồng độ phần trăm của dung dịch Bài toán cho biết đại lượng nào cần tính đại lượng nào 1. Định nghĩa: 2. Công thức: C% = mct. 100% mdd C%. mdd (1) (2) 100% mct. 100% mdd = C% Cho biết: (3) 3. Bài tập áp dụng: Ví dụ 1: Vídụ 2: Tính khối lượng Na. OH có trong 200 g dung dịch Na. OH 15%. Tính : m ct Na. OH = ? g

Tiết: 62 NỒNG ĐỘ DUNG DỊCH I. Nồng độ phần trăm của dung dịch 1. Định nghĩa: 2. Công thức: C% = mct. 100% mdd C%. mdd Khối lượng Na. OH (1) (2) 100% mct. 100% mdd = C% ĐÁP ÁN (3) 3. Bài tập áp dụng: Ví dụ 1: Vídụ 2: Tính khối lượng Na. OH có trong 200 g dung dịch Na. OH 15%. Vậy khối lượng của Na. OH là 30 gam

• Cách giải : Em hãy cho biết cách giải bài toán tính khối lượng chất tan, khi biết nồng độ phần trăm và khối lượng của dung dịch ? • Áp dụng CT tính mct = C%. mdd 100%

Tiết: 62 NỒNG ĐỘ DUNG DỊCH I. Nồng độ phần trăm của dung dịch 1. Định nghĩa: 2. Công thức: C% = mct. 100% mdd C%. mdd (2) 100% mct. 100% mdd = C% 3. Bài tập áp dụng: Ví dụ 1: Vídụ 2: (1) (3) Ví dụ 3: Hòa tan 50 g đường vào nước được dung dịch đường có nồng độ 25%. a. Tính khối lượng dung dịch b. đường pha chế được. b. Tính khối lượng nước cần Dùng cho sự pha chế. Tóm tắt

Tiết: 62 NỒNG ĐỘ DUNG DỊCH I. Nồng độ phần trăm của dung dịch 1. Định nghĩa: 2. Công thức: C% = mct. 100% mdd C%. mdd 3. Bài tập áp dụng: Ví dụ 1: Vídụ 2: Đáp án Khối lượng dung dịch đường pha chế được: (1) (2) 100% mct. 100% mdd = C% Ví dụ 3: (3) Khối lượng nước cần dùng cho sự pha chế: mdm = mdd – mct = 200 – 50 = 150 g

• Từ ví dụ 3: Nêu các bước giải bài tập tính khối lượng dung môi khi biết nồng độ phần trăm và khối lượng chất tan? • Các bước giải : 1. Dựa vào công thức tính md. d mct. 100% mdd = C% 2. Dựa vào CT tính md. m mdm = md. d - mct

Tiết: 62 NỒNG ĐỘ DUNG DỊCH I. Nồng độ phần trăm của dung dịch 1. Định nghĩa: 2. Công thức: C% = mct. 100% mdd C%. mdd (1) (2) - C% d. d 2 = 5 % Tính : C% d. d 3 = ? Hướng dẫn giải Biết md. d 1 ; C% d. d 1 => mct 1 100% mct. 100% mdd = C% Tóm tắt các đại Ví dụ cho biết Biết - md. d 1 = 50 g lượng nào? Yêu cầu - C% d. d 1 = 20 % tìm đại lượng - md. d 2 = 50 nào? g (3) 3. Bài tập áp dụng: Ví dụ 4: Trộn 50 g dung dịch muối ăn có nồng độ 20% với 50 g dung dịch muối ăn có nồng độ 5%. Tính nồng độ phần trăm của dung dịch thu được. Biết md. d 2 ; C% d. d 2=> mct 2 Từ mct 1 , mct 2 => mct 3 Biết md. d 1 ; md. d 2 => md. d 3 Từ mct 3 và md. d 3 => C% d. d 3

Tiết: 62 NỒNG ĐỘ DUNG DỊCH Hướng dẫn giải Ví dụ 4 • Biết md. d 1 ; C% d. d 1 => mc t 1 • Biết md. d 2 ; C% d. d 2 => mct 2 • Từ mc. t 1 , mc. t 2=> mct. 3 • Biết md. d 1 ; md. d 2 => md. d 3 • Từ mct 3 và md. d 3 => C%d. d 3 Giải 20%. 50 - mct 1= C%. mdd = 100% - mct 2 = C%. mdd 100% = 10 g 100% 5%. 50 = 100% =2, 5(g) - mct 3 = m. CT 1 + m. C T 2 = 10 + 2, 5 = 12, 5 (g - md. d 3 = md. d 1+ md. d 2 = 50 + 50 = 100(g) - C% = mct. 100% mdd = 12, 5. 100% 100 =12, 5 %

• Cách giải : Em hãy cho biết cách giải bài toán tính khối lượng chất tan, khi biết nồng độ phần trăm và khối lượng của dung dịch ?

Qua bài học ngày hôm nay chúng ta cần biết và nắm những kiến thức cơ bản nào ? Kiến thức cần nhớ Nồng độ phần trăm ( kí hiệu là C% ) của một dung dịch cho ta biết số gam chất tan có trong 100 g dung dịch. m C% = ct. 100% mdd mdd = C% mct = C%. mdd = mct + mdm 100% Biết vận dụng các công thức trên để giải các bài toán có liên quan đến nồng độ phần trăm

Kiểm tra đánh giá Hãy khoanh tròn vào kết quả mà em cho là đúng. Câu 1: Nồng độ phần trăm của dung dịch 30 gam KCl trong 600 gam dung dịch là A. 4 % B. 5 % C. 6 % D. 7 % Câu 2: Ở nhiệt độ 250 C độ tan của muối ăn là 36 gam. Nồng độ phần trăm của dung dịch bão hoà ở nhiệt độ trên là : A. 26, 45 % B. 26, 46 % C. 26, 47 % D. 26, 48 %

+ Học vở ghi kết hợp SGK. + Làm bài tập 1 trang 145; 5; 6 a; 7 trang 146 SGK. + Chuẩn bị phần II: Nồng độ mol

Tài liệu tham khảo - Sách giáo khoa hóa 8, bài tập hóa 8 - Sách GV hóa 8 - Bài tập năng cao hóa 8