Guido Rasi Direttore Generale Agenzia Italiana del Farmaco
















- Slides: 21

Guido Rasi Direttore Generale Agenzia Italiana del Farmaco (AIFA) AGENZIA ITALIANA DEL FARMACO La sostenibilità del sistema farmaceutico tra appropriatezza prescrittiva e medicina personalizzata

Le sfide sanitarie future Aumento dei costi e diminuzione degli investimenti: • • Spesa sanitaria europea nel 2020: 16% GDP (Healthcast 2020, PWC) Gli investimenti in Europa in ricerca farmacologica sono diminuiti nell’ultimo decennio Il costo totale per lo sviluppo di un singolo farmaco è stimato in 1, 3 MLD di € Ageing Society e aumento delle malattie croniche: Nel 2050 un terzo della popolazione europea sarà >60: • aumento delle malattie croniche es. CVD, già causa di oltre 2 milioni di morti in EU, costi attuali associati ~ 192 MLN di €/anno • aumento di casi di Alzheimer + demenza, per il 2050 si prevedono ~ 115 MLN di casi AGENZIA ITALIANA DEL FARMACO •

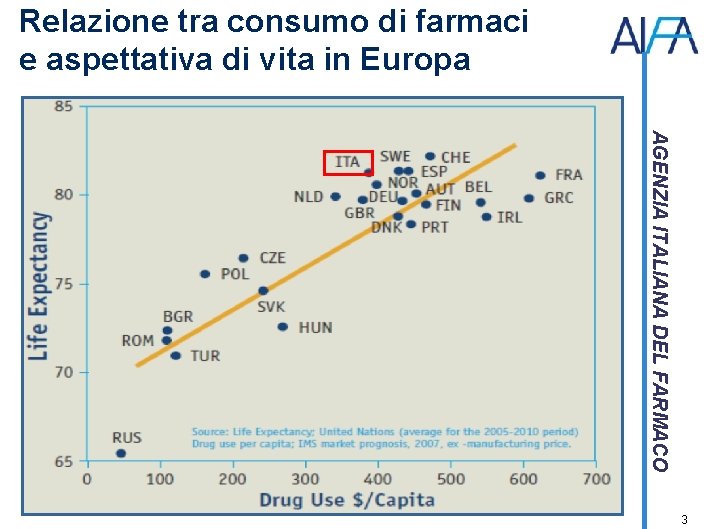
Relazione tra consumo di farmaci e aspettativa di vita in Europa AGENZIA ITALIANA DEL FARMACO 3

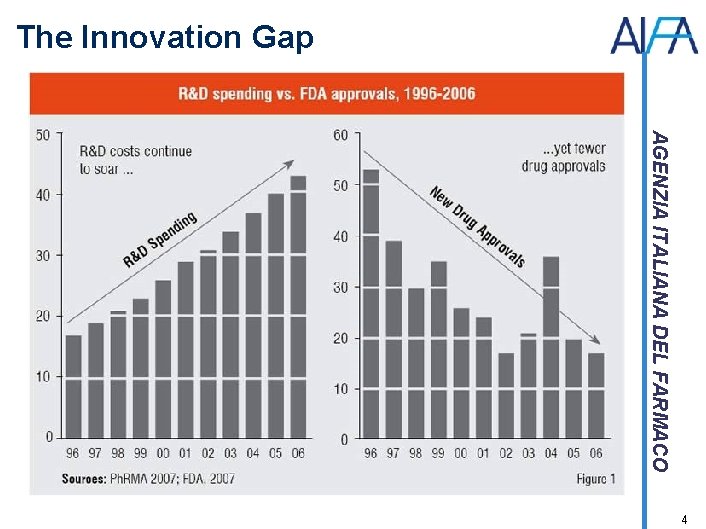
The Innovation Gap AGENZIA ITALIANA DEL FARMACO 4

Il tramonto del modello blockbuster Il modello blockbuster “One size fit to all” popolazione generale § Profilo di sicurezza parziale § Alti costi derivanti da clinical trial ampi e tempi molto dilatati § Declino della produttività e crescita dei costi R&D Limiti del blockbuster : § Risorse in diminuzione e contrazione dei prezzi § perdita della copertura brevettuale § Insostenibilità da parte dei gruppi industriali e dei sistemi sanitari. AGENZIA ITALIANA DEL FARMACO § Alto rischio di scarsa efficacia nella

Gli approcci innovativi driver che guida le strategie della ricerca þ Le terapie diverranno personalizzate grazie alla crescente conoscenza nei campi della genetica, della chimica e della biologia molecolare þ Gli approcci innovativi emergenti promettono trattamenti terapeutici per rispondere ai bisogni di salute disattesi e curare patologie neglette come i disordini genetici, le malattie rare, patologie delle popolazioni fragili (es. geriatria, pediatria) AGENZIA ITALIANA DEL FARMACO þ L’incidenza delle patologie non costituisce più il

BIOMARCATORI E APPROPRIATEZZA Ø I biomarcatori sono indicatori di processi biologici sia fisiologici sia patologici, che permettono di individuare e valutare: • • BRCA 1 -breast cancer) l’evoluzione di una patologia – biomarker prognostico (es. HER-2 -breast cancer) la risposta, in termini di efficacia e di sicurezza, ad un trattamento farmacologico - biomarker predittivo (EGFR-NSCLC/ gefitinib, DPDgastrointestinal cancer/fluoropyrimidines) Ø Un biomarcatore è una caratteristica biologica – molecolare, anatomica, fisiologica o biochimica – che può essere misurata e valutata oggettivamente. AGENZIA ITALIANA DEL FARMACO • una patologia – biomarker diagnostico (es. HCV-RNA) • il rischio di sviluppare una patologia – susceptibility/risk biomarker (es.

Personalized medicine L’uso dei biomarcatori, ad integrazione e sostituzione dei convenzionali end point clinici, può migliorare ed accelerare la valutazione precoce delle terapie già in fase di sperimentazione La stratificazione dei pazienti in base alla risposta al farmaco in termini sia di efficacia sia di tollerabilità e la stratificazione della patologia in specifici sottotipi Gli studi farmacogenomici dei sottogruppi specifici di pazienti potrebbero ridurre i tempi della ricerca clinica di circa 3 -5 anni, aumentando le informazioni sul profilo rischio/beneficio ma anche incrementando l’efficienza economica e la sostenibilità, l’accesso alle terapie e migliorando la salute globale AGENZIA ITALIANA DEL FARMACO “a medical model using molecular profiling technologies for tailoring the right therapeutic strategy for the right person at the right time”.

Based-omics Biomarker & Biosignatures ØLa comprensione dei meccanismi genetici molecolari e ØAlcune piattaforme -omics sono già disponibili per l’applicazione clinica (es. per l’analisi di acidi nucleici), mentre la proteomica, l’epigenomica, l’analisi funzionale cellulare, etc. richiedono ulteriori sviluppi ed ulteriori tecnologie prima di poter essere applicati in larga scala negli studi di clinica traslazionale. ØC’è quindi la necessità di supportare lo sviluppo di studi che conducano allo sviluppo razionale: • • di biomarker basati su tecnologie -omics modelli pre-clinici di malattia affidabili. AGENZIA ITALIANA DEL FARMACO cellulari che sottendono alle più diffuse patologie è ancora limitata

AGENZIA ITALIANA DEL FARMACO

La farmacogenomica può essere finanziariamente disastrosa!? Nel lungo termine la medicina personalizzata produrrà farmaci migliori a prezzi inferiori e aumenterà la velocità della diagnosi e dell’accesso alla terapia più appropriata. “Non uno shift diretto dall’approccio “one size fit to all” alle personalised medicines, ma una “mass personalization”, ovvero trattamenti e interventi di prevenzione basati sui profili genetici di popolazioni ristrette, ma significative” Michael Leavitt - Secretary of United States Department of Health and Human Services AGENZIA ITALIANA DEL FARMACO Nel breve termine i costi per i test genetici sono ancora insostenibili sia per i sistemi sanitari sia per l’industria farmaceutica (perdita del mercato potenziale).

I programmi di trattamento e di prevenzione personalizzati e la sostenibilità dei sistemi Ø Nel futuro la prescrizione di farmaci e trattamenti personalizzati Ø Studi prospettici e randomizzati per l’identificazione e la validazione di bio-markers and bio-signatures dovranno fornire evidenze robuste per potere garantire decisioni più rapide sul rimborso ed incentivare l’introduzione e la diffusione della cura personalizzata Ø Lo sviluppo di omics-based bio-markers & –signatures e lo sviluppo di ulteriori metodi diagnostici non invasivi per l’identificazione di gruppi di rischio supporterà l’implementazione di screening sanitari e programmi di prevenzione stratificati in base al rischio e alle caratteristiche di popolazione, con effetti sociali ed economici rilevanti AGENZIA ITALIANA DEL FARMACO per il giusto paziente, nel giusto momento, aumenterà l’efficienza dei servizi sanitari, migliorando la sostenibilità dei sistemi e riducendo lo spreco di risorse.

Le potenzialità dei Registri AIFA nella ricerca traslazionale AGENZIA ITALIANA DEL FARMACO

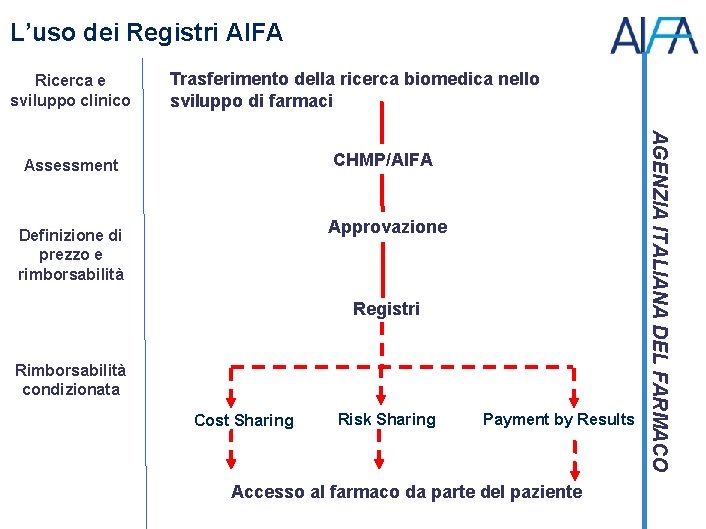
L’uso dei Registri AIFA Ricerca e sviluppo clinico Trasferimento della ricerca biomedica nello sviluppo di farmaci Approvazione Definizione di prezzo e rimborsabilità Registri Rimborsabilità condizionata Cost Sharing Risk Sharing Payment by Results Accesso al farmaco da parte del paziente AGENZIA ITALIANA DEL FARMACO CHMP/AIFA Assessment

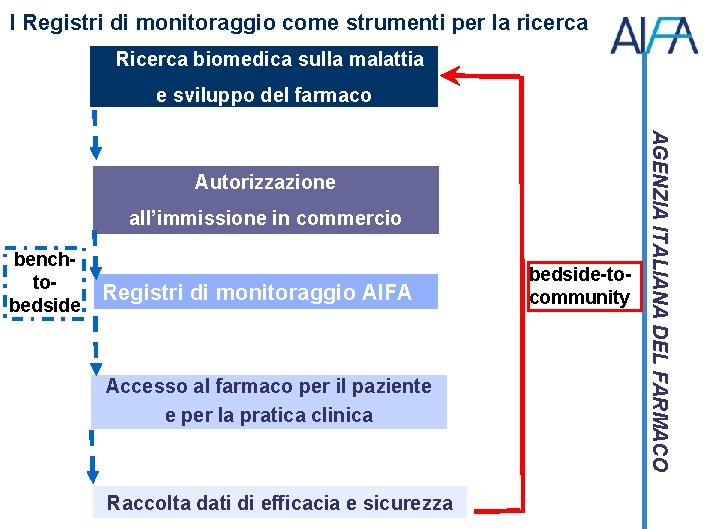
I Registri di monitoraggio come strumenti per la ricerca Ricerca biomedica sulla malattia e sviluppo del farmaco all’immissione in commercio benchtobedside Registri di monitoraggio AIFA Accesso al farmaco per il paziente e per la pratica clinica Raccolta dati di efficacia e sicurezza bedside-tocommunity AGENZIA ITALIANA DEL FARMACO Autorizzazione

Il dibattito sull’innovazione Ottimizzazione delle risorse Iniziative internazionali (EU/USA) con l’obiettivo di “modernizzare” lo sviluppo del farmaco incorporando gli sviluppi del progresso scientifico (genomica, proteomica, imaging technologies) e promuovendo le public private partnerships e consorzi per accelerare la ricerca e colmare i bisogni di salute AGENZIA ITALIANA DEL FARMACO Diritto dell’individuo ad avere accesso alle nuove terapie, tecnologie e test diagnostici 16

Definizione dell’innovazione (ISDB 2001) Accezione commerciale, secondo cui è innovazione ogni farmaco “me too”, ogni nuova sostanza, nuova indicazione, nuova formulazione e nuovo metodo di trattamento di recente commercializzazione; n Accezione tecnologica, che individua ogni tipo di innovazione industriale, come l’impiego di biotecnologie, l’introduzione di nuovi metodi di rilascio del principio attivo oppure la selezione di un isomero o di un metabolita; n Accezione di reale novità terapeutica, secondo cui un nuovo trattamento è innovativo quando offre al paziente benefici maggiori rispetto alle terapie precedentemente disponibili. AGENZIA ITALIANA DEL FARMACO n 17

Verso una valorizzazione conscia dell’innovazione q Effetti sulla qualità della cura q Effetti sul costo della cura q Effetti sul valore della cura Fino ad oggi la maggior parte dell’innovazione è stata valutata principalmente in termini di qualità della cura, spesso il costo per il raggiungimento dell’innovazione viene ignorato e così il rapporto di diminuzione di altre voci, sminuendone così il reale valore. AGENZIA ITALIANA DEL FARMACO Una corretta valorizzazione dell’innovazione richiede la valutazione degli: 18

Colmare il gap • Programmi di identificazione e validazione di biomarcatori come endpoint surrogati e come predittori di risposta al farmaco. (per es. “adaptive/flexible designs”) e statistici (per es. la statistica bayesiana). • Utilizzo di modelli e simulazioni per i programmi di sviluppo dei farmaci. BRIDGE THE GAP • Scientific advice nelle fasi precoci di sviluppo del farmaco. • Aggiornamento delle linee guida regolatorie al passo con le più recenti conoscenze scientifiche. • Partecipazione dell’AIFA al think-tank europeo EMA/CHMP • Miglioramento del flusso di scambio sulla conoscenza tra regolatori, industria, accademia operatori sanitari e pazienti. AGENZIA ITALIANA DEL FARMACO • Utilizzo di nuovi approcci metodologici

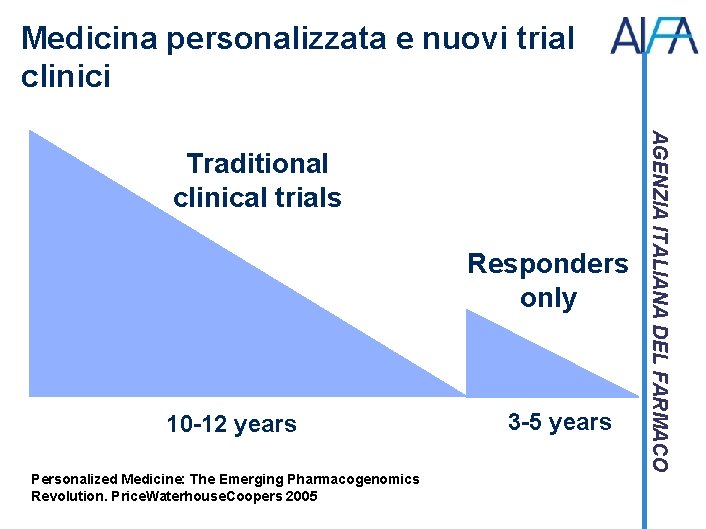
Medicina personalizzata e nuovi trial clinici Responders only 10 -12 years Personalized Medicine: The Emerging Pharmacogenomics Revolution. Price. Waterhouse. Coopers 2005 3 -5 years AGENZIA ITALIANA DEL FARMACO Traditional clinical trials

La ricerca traslazionale: legame tra ricerca regolatoria e progresso medico I medicinali più innovativi sono sviluppati dalla ricerca privata Investimento virtuoso tra pubblico e privato per colmare la scarsa conoscenza dei meccanismi di azione delle malattie che ancora oggi costituiscono un unmet medical need AGENZIA ITALIANA DEL FARMACO Le principali scoperte in medicina sono derivano da ricerca finanziata con fondi pubblici 21
 Direttore generale anpal
Direttore generale anpal Agenzia del demanio direzione regionale veneto
Agenzia del demanio direzione regionale veneto Agenzia del demanio direzione regionale toscana e umbria
Agenzia del demanio direzione regionale toscana e umbria Agenzia del demanio catania
Agenzia del demanio catania Agenzia demanio piemonte
Agenzia demanio piemonte Agenzia delle entrate pdf
Agenzia delle entrate pdf Rasi rna
Rasi rna Sat siri khalsa
Sat siri khalsa Humberto rasi
Humberto rasi Indice terapeutico
Indice terapeutico Distribuzione del farmaco
Distribuzione del farmaco Farmaco
Farmaco Biotecnologie del farmaco
Biotecnologie del farmaco Legge di fick farmacologia
Legge di fick farmacologia Kiro farmacia
Kiro farmacia Nomina direttore tecnico soa
Nomina direttore tecnico soa Direttore risorse umane carrefour
Direttore risorse umane carrefour Distanza punto retta
Distanza punto retta Alessandro cicognani bologna
Alessandro cicognani bologna Concentracion plasmática de un farmaco
Concentracion plasmática de un farmaco Enzimas y ligando
Enzimas y ligando Cinetica di ordine zero farmacologia
Cinetica di ordine zero farmacologia