GRAVIMETRI Metode gravimetri untuk analisis kuantitatif didasarkan pada








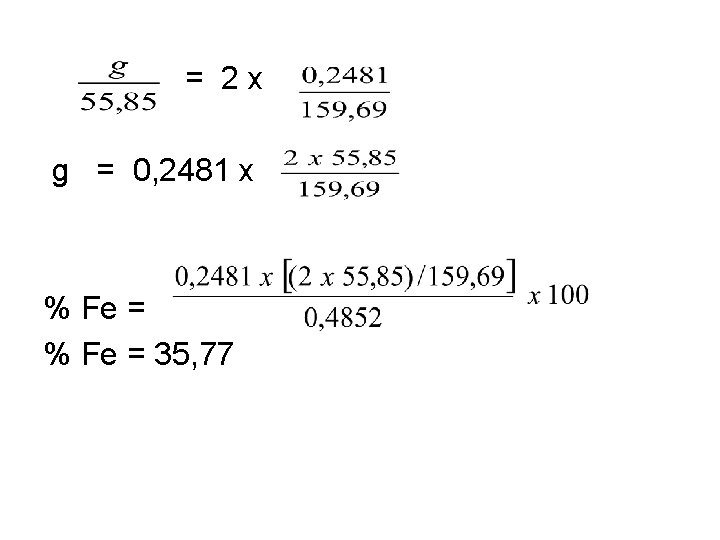



- Slides: 12

GRAVIMETRI Metode gravimetri untuk analisis kuantitatif didasarkan pada stikiometri reaksi pengendapan yang secara umum dinyatakan dengan persamaan a. A + p. P Aa. Pp a : koefisien reaksi ~reaktan analit ( A ) p : koefisien reaksi ~ reaktan pengendap (P) Aa. Pp : rumus molekul zat kimia hasil reaksi yang tergolong sulit larut ( mengendap ) yang ditentukan beratnya dengan tepat setelah proses pencucian dan pengeringan Penambahan reaktan pengendap P dilakukan secara berlebih agar dicapai proses pengendapan yang sempurna

Misal : pengendapan ion Ca 2+ dengan menggunakan reaktan pengenadap ion oksalat C 2 O 4 - dapat dinyatakan dengan persamaan reaksi berikut : • Reaksi yang menyertai pengendapan : Ca 2+ + C 2 O 4 - Ca. C 2 O 4(s) • Reaksi yang menyertai pengeringan : Ca. C 2 O 4(s) Ca. O(s) + CO 2(g) + CO(g)

• Agar penetapan kuantitas analit dalam metode gravimetri mencapai hasil yang mendekati nilai sebenarnya harus dipenuhi dua kriteria yaitu : 1) proses pemisahan atau pengendapan analit dari komponen lainnya berlangsung sempurna 2) endapan analit yang dihasilkan diketahui dengan tepat komposisinya dan memiliki tingkat kemurnian yang tinggi tidak bercampur dengan zat pengotor

Perhitungan Dalam Analisis Gravimetri • Dalam analisis gravimetri endapan yang dihasilkan ditimbang dan dibandingkan dengan berat sampel • Prosentase berat analit A terhadap sampel dinyatakan dengan persamaan • Untuk menetapkan berat analit dari berat endapan sering dihitung melalui faktor gravimetri • Faktor gravimetri : sebagai jumlah berat analit dalam 1 gram berat endapan • Hasil kali dari berat endapan P dengan faktor gravimetri sama dengan berat analit • Berat analit (A) = berat endapan P x faktor gravimetri

Faktor gravimetri ditentukan oleh dua faktor yaitu : 1. berat molekul atau atom dari analit 2. berat molekul dari endapan • % A = Untuk menghitung bobot analit dari bobot endapan sering digunakan faktor gravimetri. • Bobot A = bobot P x faktor gravimetri

Penggunaan Analisis Gravimetri • • • Analisis gravimetri banyak diaplikasikan untuk analisis kation dari unsur-unsur yang terdapat dalam sistem peiodik unsur untuk analisis kuantitatif bahan organik tertentu seperti kholesterol pada cereal dan laktosa pada produk susu Kholsterol sebagai steroid alkophol dapat diendapkan secara kuantitatif dengan saponin organik yang disebut digitonin ( MR = 1214 ) membentuk kompleks 1 : 1 yang tidak larut.

• Contoh 1. • Suatu sampel seberat 0, 6025 g dari suatu garam klorida dilarutkan dalam air dan kloridanya diendapkan dengan menambahkan perak nitrat berlebih. Endapan perak klorida disaring, dicuci, 0, 7134 g. Hitunglah persentase klorida (Cl) dalam sampel itu • Jawab : Reaksinya adalah • Ag+ + Cl - Ag. Cl(s) • Karena 1 mol Cl menghasilkan 1 mol Ag. Cl, maka • banyaknya mol Cl = banyaknya mol Ag. Cl • % Cl = • • % Cl = 29, 29 • Angka banding bobot atom Cl ke bobot molekul Ag. Cl (35, 45/143, 32) = Ar Cl/ MR Ag. Cl faktor gravimetri dari bobot Cl dalam 1 g Ag. Cl.

• Contoh 2. • Suatu sampel bijih besi seberat 0, 4852 g, dilarutkan dalam asam, besinya dioksidasi ke keadaan oksidasi + 3, dan kemudian diendapkan sebagai oksida berair, Fe 2 O 3. x. H 2 O. Endapan disaring, dicuci, dan dipanggang menjadi Fe 2 O 3, yang ternyata 0, 2481 g beratnya. Hitunglah persentase besi (Fe) dalam sample itu • Jawab : • Reaksinya adalah : 2 Fe 3+ Fe 2 O 3. x H 2 O Fe 2 O 3(s) Karena 2 mol Fe 3+ menghasilkan 1 mol Fe 2 O 3 • Banyaknya mol Fe 3+ = 2 x banyaknya mol Fe 2 O 3
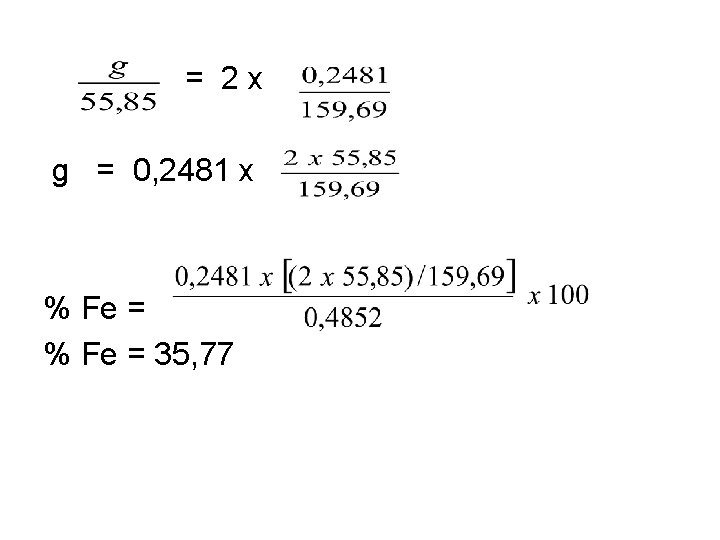
= 2 x g = 0, 2481 x % Fe = 35, 77

Contoh 3. Kemurnian persen • Fosforus dalam sebuah sampel batuan fosfat seberat 0, 5428 g, diendapkan sebagai Mg. NH 4 PO 4. 6 H 2 O dan dipanggang menjadi Mg 2 P 2 O 7. Jika bobot endapan panggangan adalah 0, 2234 g. Hitunglah (a) persentase P 2 O 5 dalam sampel (b) kemurnian persen yang dinyatakan sebagai P ? Persentase P 2 O 5 diberikan oleh : • % P 2 O 5 = x 100 • % P 2 O 5 = 26, 25 x 100

• (b) Perhitungan sama seperti (a) kecuali bahwa digunakan faktor gravimetric untuk P dalam Mg 2 P 2 O 7 • % P = x 100 • % P = 11, 46 x 100

Contoh 4. Ukuran sampel. • Berapakah bobot sampel yang mengandung 12, 0 % klor (Cl), harus diambil untuk analisis jika ingin memperoleh endapan Ag. Cl seberat 0, 500 g ? Jawab: Reaksi pengendapan: Ag+ + Cl- Ag. Cl(s) banyaknya mol Cl = banyaknya mol Ag. Cl • Jika w = banyaknya sampel dalam gram, maka : w = 1, 03 g
 Contoh metode gravimetri
Contoh metode gravimetri Rumus gravimetri
Rumus gravimetri Apa itu metode gravimetri
Apa itu metode gravimetri Jelaskan klasifikasi sistem informasi
Jelaskan klasifikasi sistem informasi Kelompok sekunder
Kelompok sekunder Contoh model analisis
Contoh model analisis Contoh analisis risiko kualitatif dan kuantitatif
Contoh analisis risiko kualitatif dan kuantitatif Evaluasi risiko adalah
Evaluasi risiko adalah Grafik garis persentase komponen berganda
Grafik garis persentase komponen berganda Data kuantitatif adalah
Data kuantitatif adalah Analisis skor min spss
Analisis skor min spss Analisis kuantitatif masalah dinamika partikel
Analisis kuantitatif masalah dinamika partikel Interpretasi sisihan piawai
Interpretasi sisihan piawai





















