GOMTRIE MOLCULAIRE GOMTRIE MOLCULAIRE La forme dune molcule







- Slides: 14

GÉOMÉTRIE MOLÉCULAIRE

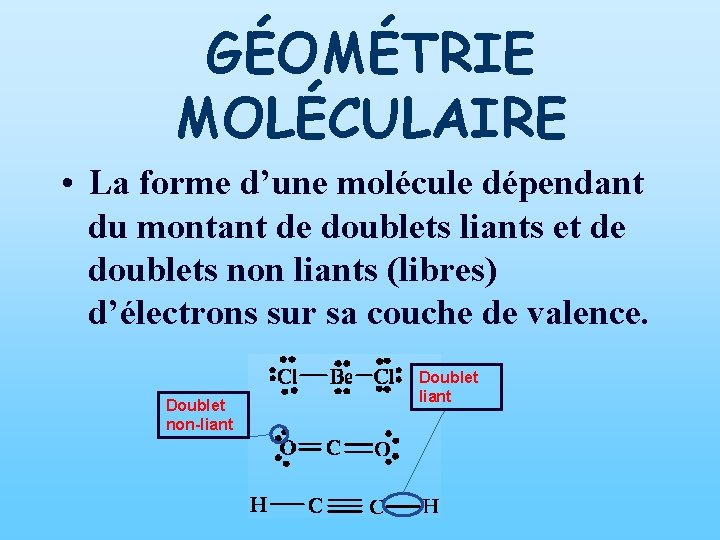
GÉOMÉTRIE MOLÉCULAIRE • La forme d’une molécule dépendant du montant de doublets liants et de doublets non liants (libres) d’électrons sur sa couche de valence. Doublet non-liant Doublet liant

GÉOMÉTRIE MOLÉCULAIRE • Une molécule possède obligatoirement des doublets liants (paires d’électrons qui participent à une liaison chimique) mais parfois aucun doublet non liants (paires d’électrons qui ne participent pas à une liaison chimique).

GÉOMÉTRIE MOLÉCULAIRE • Exemple 1 - La molécule de CO 2 possède quatre doublets liants et aucun doublets libres sur son atome central. • Exemple 2 - La molécule d’eau possède deux doublets liants et deux doublets libres sur son atome central.

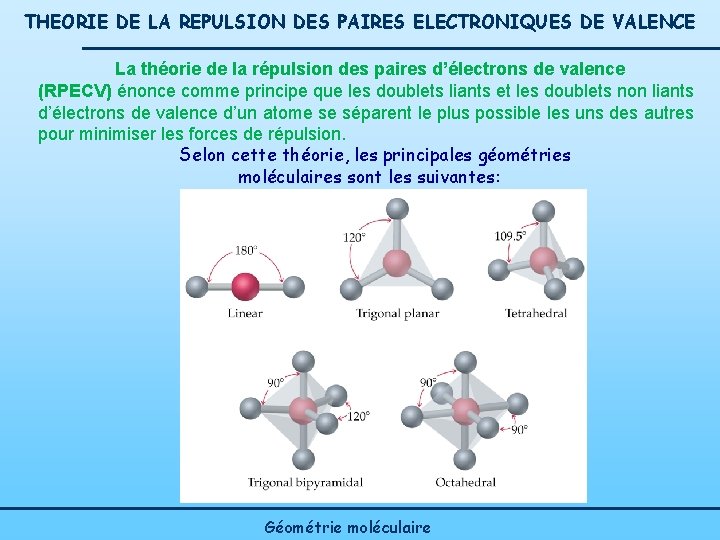
THEORIE DE LA REPULSION DES PAIRES ELECTRONIQUES DE VALENCE La théorie de la répulsion des paires d’électrons de valence (RPECV) énonce comme principe que les doublets liants et les doublets non liants d’électrons de valence d’un atome se séparent le plus possible les uns des autres pour minimiser les forces de répulsion. Selon cette théorie, les principales géométries moléculaires sont les suivantes: Géométrie moléculaire

THEORIE DE LA REPULSION DES PAIRES ELECTRONIQUES DE VALENCE La théorie de la répulsion des paires d’électrons de valence (RPECV) énonce comme principe que les doublets liants et les doublets non liants d’électrons de valence d’un atome se séparent le plus possible les uns des autres pour minimiser les forces de répulsion. DNL – Doublet non liant DL- Doublet liant Les forces de répulsion entre les doublets se situent comme suit en ordre décroissant : DNL – DNL répulsion entre doublets non liants > DNL – DL répulsion entre doublets non liants et doublets liants Géométrie moléculaire > DL – DL répulsion entre doublets liants

THEORIE DE LA REPULSION DES PAIRES ELECTRONIQUES DE VALENCE Donc, des DNL se repoussent d’avantage que un DNL et un DL ou encore deux DL. Exemple : Chaque molécule ci-dessous possède 4 paires d’électrons autour de l’atome central. Pourtant, les angles entre les atomes sont différents dus aux nombres différents de DNL et DL que possèdent ces molécules. H 2 O HOH = 104, 5 o NH 3 HNH = 107, 3 o Géométrie moléculaire CH 4 HCH = 109, 5 o

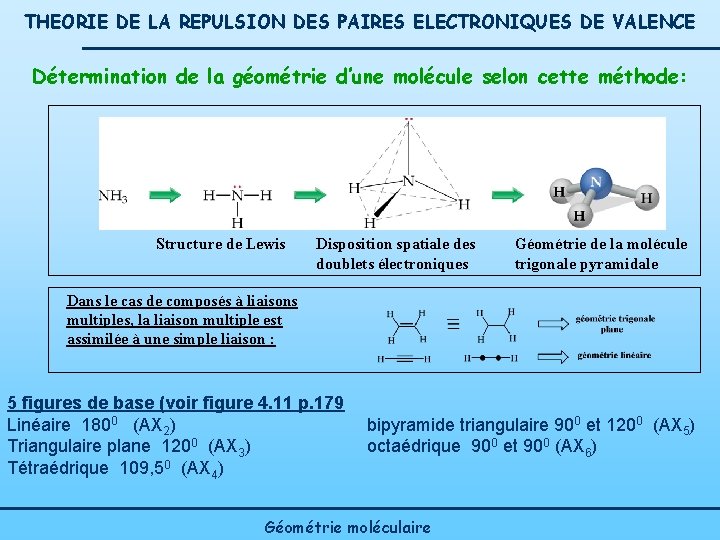
THEORIE DE LA REPULSION DES PAIRES ELECTRONIQUES DE VALENCE Détermination de la géométrie d’une molécule selon cette méthode: Structure de Lewis Disposition spatiale des doublets électroniques Géométrie de la molécule trigonale pyramidale Dans le cas de composés à liaisons multiples, la liaison multiple est assimilée à une simple liaison : 5 figures de base (voir figure 4. 11 p. 179 Linéaire 1800 (AX 2) Triangulaire plane 1200 (AX 3) Tétraédrique 109, 50 (AX 4) bipyramide triangulaire 900 et 1200 (AX 5) octaédrique 900 et 900 (AX 6) Géométrie moléculaire

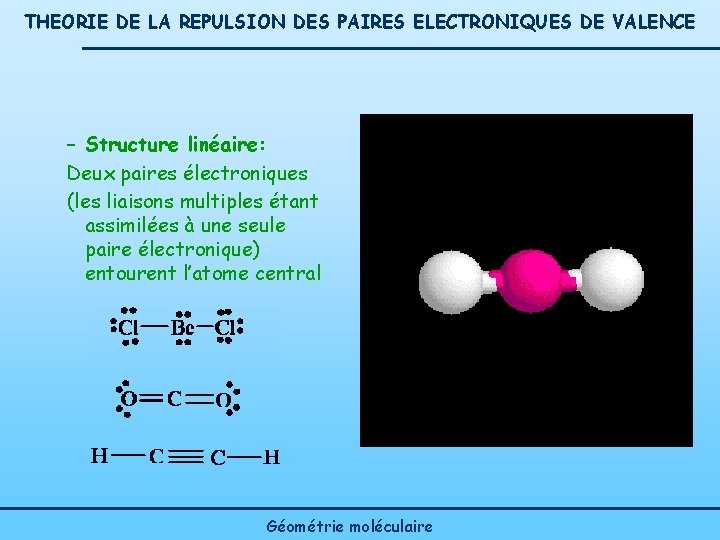
THEORIE DE LA REPULSION DES PAIRES ELECTRONIQUES DE VALENCE – Structure linéaire: Deux paires électroniques (les liaisons multiples étant assimilées à une seule paire électronique) entourent l’atome central Géométrie moléculaire

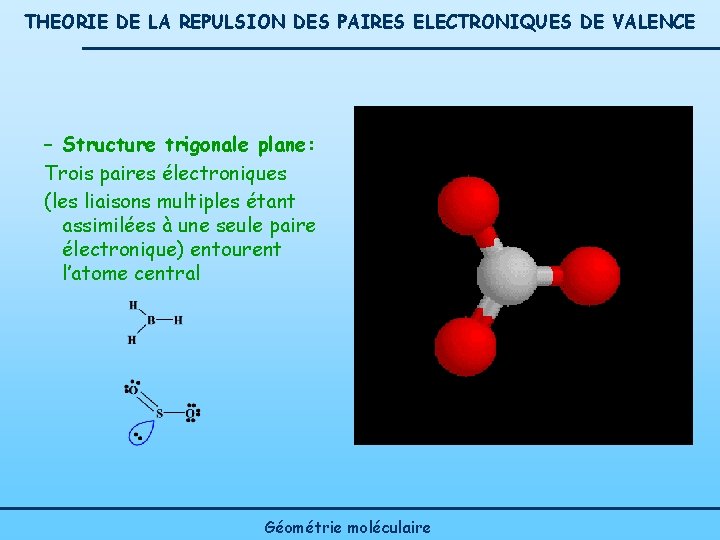
THEORIE DE LA REPULSION DES PAIRES ELECTRONIQUES DE VALENCE – Structure trigonale plane: Trois paires électroniques (les liaisons multiples étant assimilées à une seule paire électronique) entourent l’atome central Géométrie moléculaire

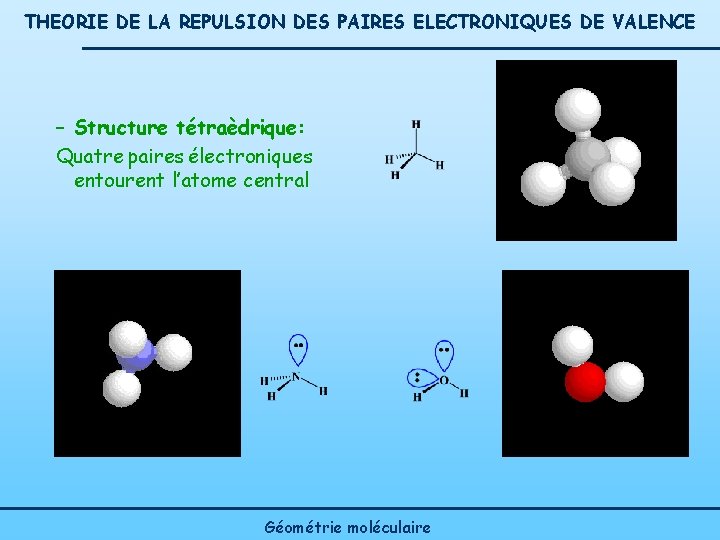
THEORIE DE LA REPULSION DES PAIRES ELECTRONIQUES DE VALENCE – Structure tétraèdrique: Quatre paires électroniques entourent l’atome central Géométrie moléculaire

THEORIE DE LA REPULSION DES PAIRES ELECTRONIQUES DE VALENCE Exemples: CO 2 Atome central: C Doublet liant : 4 Doublet libre : 0 Forme de la molécule : tétraédrique (AX 4) Géométrie moléculaire

THEORIE DE LA REPULSION DES PAIRES ELECTRONIQUES DE VALENCE Exemples: PF 3 Atome central: P Doublet liant : 3 Doublet libre : 1 Forme de la molécule : tétraédrique (AX 3 E 1) Géométrie moléculaire

THEORIE DE LA REPULSION DES PAIRES ELECTRONIQUES DE VALENCE Exemples: PCl 5 Niveau d’énergie de valence élargit (+ que 8 é périphérique) Atome central: P Doublet liant : 5 Doublet libre : 0 Forme de la molécule : bipyramide triangulaire (AX 5) Faire les exercices 18, 19 et 20 p. 185 Géométrie moléculaire et 21 et 22 p. 186