Gli atleti hanno arterie di conduzione e di




































- Slides: 58

Gli atleti hanno arterie di conduzione e di resistenza più grandi? Mentre l’effetto dell’allenamento aerobico sulla crescita dei capillari è ben documentato, la regolazione della resistenza vascolare e della pressione sono principalmente appannaggio delle arteriole e delle piccole arterie a monte, la maggior parte delle quali si trova al di fuori dell’interstizio muscolare. Questi vasi arteriosi si possono adattare all’allenamento funzionalmente oppure mediante rimodellamento strutturale verso l’esterno. È stato dimostrato che la capacità di vasodilatazione del muscolo dopo allenamento supera la possibilità del cuore di aumentare la gettata cardiaca abbastanza da mantenere la pressione arteriosa; questo sottolinea la plasticità dei vasi in risposta all’esercizio e suggerisce che adattamenti arteriosi siano indispensabili per aumentare le performance atletiche. Si studiano le variazioni dell’area complessiva dei vasi di resistenza misurando le risposte massime dopo un’ischemia prolungata o durante esercizio in ischemia, ritenendo che uno stimolo massimale possa rivelare le caratteristiche strutturali del letto vascolare.

Gli atleti mostrano un aumento della capacità massima di vasodilatazione. Per esempio tennisti di alto livello hanno più vasodilatazione nel braccio preferito rispetto all’altro: c’è un rimodellamento vascolare localizzato, indipendente dall’ipertrofia muscolare e da vari fattori di regolazione. Quindi, c’è rimodellamento in risposta a stimoli locali ed intrinseci. La capacità di dilatazione delle coronarie (risposta alla nitroglicerina) è maggiore nei corridori anche se le dimensioni a riposo sono normali. Questo indica l’importanza di studiare le risposte a stimoli dilatatori e indica anche negli atleti c’è un maggiore tono di base perché aumenta la risposta alla stimolazione alfa adrenergica, in parte per compensare la maggiore capacità vasodilatatoria. Vari studi dimostrano un aumento di diametro delle arterie di conduzione, ma soprattutto di quelle più periferiche, suggerendo che la plasticità riguardi le arterie muscolari piuttosto che quelle elastiche. È molto evidente il ruolo dell’endotelio e dell’aumento ripetitivo dello shear stress nell’aumento del diametro delle arterie. Dopo legatura dell’aorta nei conigli (per provocare ipertrofia cardiaca) il flusso cala e il diametro dell’aorta diminuisce con meccanismo endotelio dipendente. Lo shear della parete è autoregolato omeostaticamente in maniera dipendente dall’ossido nitrico. Analoghi effetti si ottengono alterando il flusso con il calore. In conclusione, lo shear stress è lo stimolo fisiologico principale per il rimodellamento vascolare.

Si modifica lo spessore di parete delle arterie degli atleti? I risultati sono contrastanti, ma nell’insieme portano a concludere che lo spessore è ridotto in tutte le arterie, per un effetto sistemico. Questo è stato identificato nell’aumento della pressione pulsatoria, che, quando è costante come nell’ipertensione ha effetti deleteri (aterogenici), ma quando è saltuario come durante l’esercizio migliora le caratteristiche di parete. Le risposte funzionali (nitroglicerina o acetilcolina) non sembrano influenzate dall’esercizio nei giovani ma lo sono negli anziani. L’allenamento potrebbe ritardare l’”invecchiamento” delle arterie. Una serie di esperimenti su animali suggerisce che l’adattamento funzionale delle arterie potrebbe precedere quello strutturale ed esserne poi mascherato per la normalizzazione dello shear stress. CONCLUSIONE: gli atleti di endurance hanno arterie di conduzione più grandi, con pareti più sottili. Queste modificazioni strutturali possono mascherare adattamenti funzionali.

Rappresentazione di dati ricavati da un gruppo di atleti di élite: La funzione delle grandi arterie, in questo caso la dilatazione mediata dal flusso (FMD%) non sembra aumentata. Questo può essere dovuto ad un problema di “supernormalizzazione” della funzione di arterie normali o a modificazioni strutturali dell’arteria che sopprimono la necessità di una sovra regolazione funzionale. Per esempio, le arterie degli atleti hanno un diametro maggiore e un diverso rapporto spessore/diametro rispetto a soggetti uguali di controllo. Pertanto, le arterie degli atleti possono avere una funzione normale ma su diversi set point strutturali

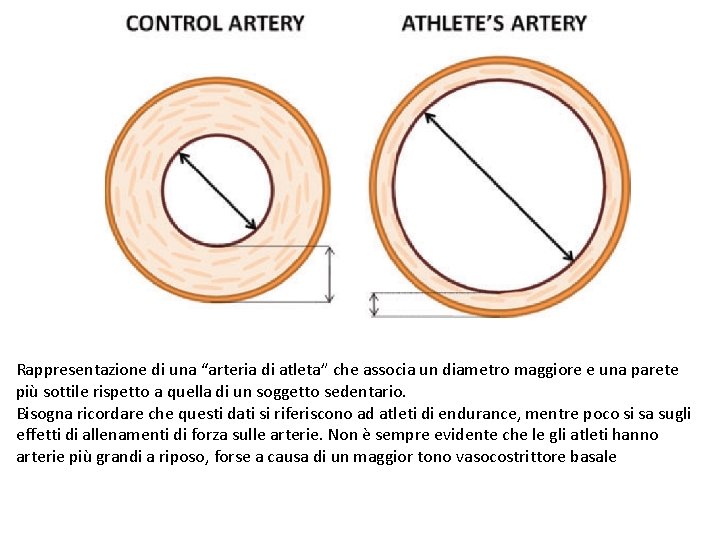
Rappresentazione di una “arteria di atleta” che associa un diametro maggiore e una parete più sottile rispetto a quella di un soggetto sedentario. Bisogna ricordare che questi dati si riferiscono ad atleti di endurance, mentre poco si sa sugli effetti di allenamenti di forza sulle arterie. Non è sempre evidente che le gli atleti hanno arterie più grandi a riposo, forse a causa di un maggior tono vasocostrittore basale

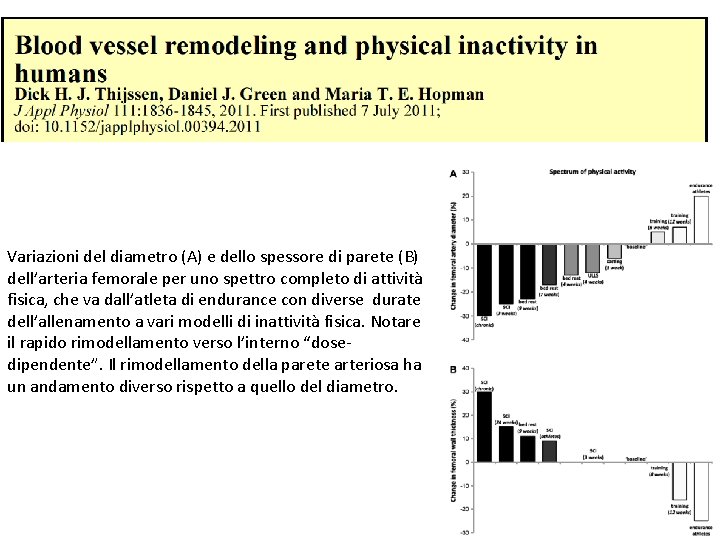
Variazioni del diametro (A) e dello spessore di parete (B) dell’arteria femorale per uno spettro completo di attività fisica, che va dall’atleta di endurance con diverse durate dell’allenamento a vari modelli di inattività fisica. Notare il rapido rimodellamento verso l’interno “dosedipendente”. Il rimodellamento della parete arteriosa ha un andamento diverso rispetto a quello del diametro.

Il rimodellamento strutturale dei vasi e l’atrofia muscolare in risposta al decondizionamento possono seguire vie simili. Il decondizionamento comporta un aumento dello shear stress medio, quindi il rimodellamento non può essere dovuto al valore assoluto dello shear stress. D’altra parte a riposo il flusso di sangue nella maggior parte delle arterie periferiche è molto oscillante con una componente anterograda (maggiore) in sistole ed una retrograda in diastole. Si ritiene che la componente retrograda abbia effetti aterogenici: è stato dimostrato che l’esposizione acuta ad elevato shear stress retrogrado diminuisce la funzione endoteliale in maniera dose dipendente. L’aumento del flusso retrogrado è dovuto ad un aumento delle resistenze periferiche. La pressione arteriosa è un altro potente stimolo emodinamico che contribuisce agli adattamenti della parete arteriosa. Ci sono risultati contrastanti, ma sembra che un aumento della pressione media provochi una deviazione dell’endotelio verso un fenotipo aterogenico. Tuttavia in seguito a decondizionamento la pressione arteriosa non aumenta, almeno nel breve termine, mentre la breve esposizione all’aumento della pressione media e pulsatoria (esercizio) avrebbe effetti benefici sulle pareti. L’inattività fisica può anche aumentare lo stress ossidativo, con tutte le sue conseguenze negative. I dati disponibili indicano che l’inattività fisica porta ad un rapido rimodellamento verso l’interno, dose dipendente, delle arterie di conduzione e di resistenza e ad un aumento dello spessore di parete. Nei vasi di resistenza vi è un aumento delle influenze vasocostrittive piuttosto che una riduzione di quelle vasodilatatorie.

BED REST Variazioni del diametro della carotide (nero) e della femorale (grigio) A: diametro; B: rapporto intima/media; C: rapporto normalizzato per il diametro in soggetti di controllo, con esercizio resistivo, con esercizio vibratorio

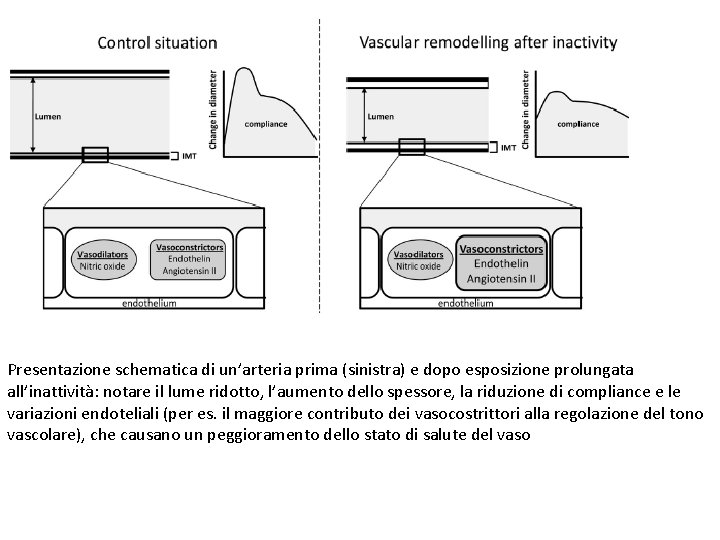
Presentazione schematica di un’arteria prima (sinistra) e dopo esposizione prolungata all’inattività: notare il lume ridotto, l’aumento dello spessore, la riduzione di compliance e le variazioni endoteliali (per es. il maggiore contributo dei vasocostrittori alla regolazione del tono vascolare), che causano un peggioramento dello stato di salute del vaso

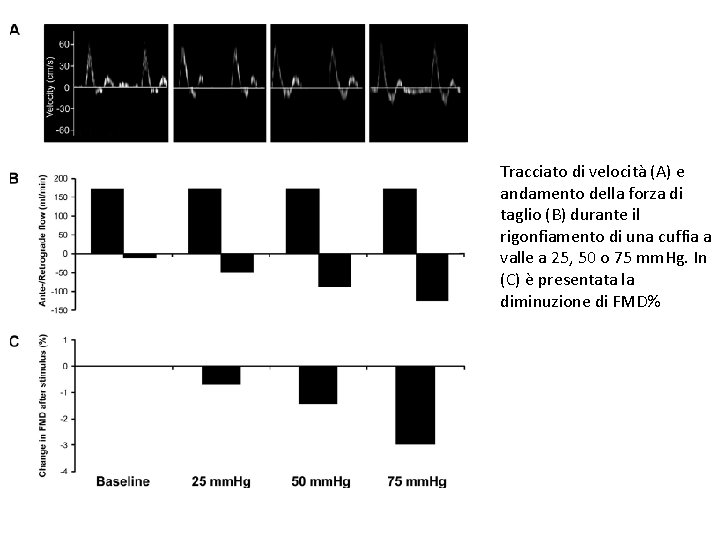
Tracciato di velocità (A) e andamento della forza di taglio (B) durante il rigonfiamento di una cuffia a valle a 25, 50 o 75 mm. Hg. In (C) è presentata la diminuzione di FMD%

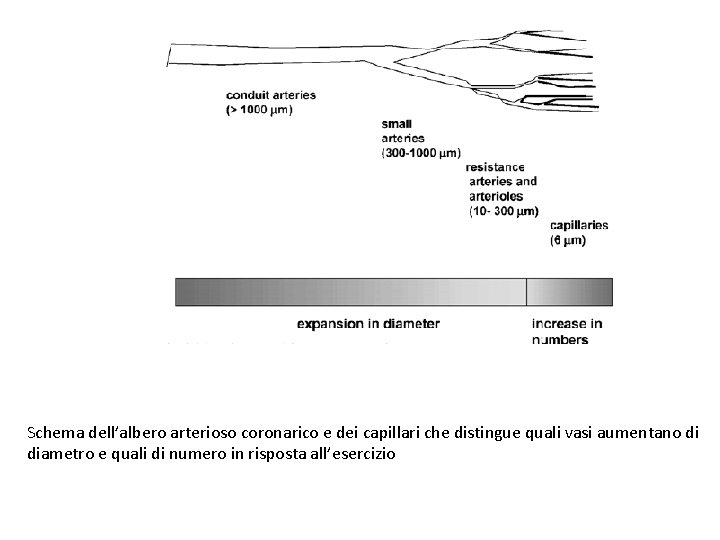
Experimental Physiology (2003) 88. 5, 645– 658. Il significato dell’accrescimento e del rimodellamento dei vasi coronarici è intrinseco ai benefici protettivi dell’esercizio. Per fare dei confronti, suddividiamo l’albero arterioso coronarico in base alle dimensioni in: grandi arterie di conduzione (> 1000 µm), piccole arterie (300 -1000 µm), arterie di resistenza (150 -300 µm), e grandi (100 -150 µm), medie (50 -100 µm) e piccole (10 -50 µm) arteriole, che alimentano i capillari (circa 6 µm).

Il rimodellamento vascolare comprende 4 processi: Angiogenesi: crescita di nuovi capillari da quelli esistenti, che comprende solo cellule endoteliali e riguarda la microcircolazione. Arterializzazione: con l’aumento di numero di questi vasi di scambio, alcuni si allargano e si trasformano in arteriole, con l’aggiunta di muscolo liscio e altri elementi che li rendono in grado di modificare il diametro. Rimodellamento arterioso: le arterie di conduzione e di resistenza variano il loro diametro e lo spessore modificando la composizione della parete sia per quanto riguarda le cellule (muscolo liscio ed endotelio), sia la componente extracellulare. Arteriogenesi: si verifica solo in seguito ad un’occlusione a monte. Piccole arterie e anastomosi pre esistenti si allargano e diventano vasi collaterali tramite l’invasione di monociti, produzione di fattori di crescita e successiva proliferazione di cellule endoteliali e di muscolo liscio, formando una rete alternativa per il territorio escluso dall’occlusione. Soltanto i primi tre processi sono fisiologici e rappresentano la risposta agli stimoli dell’esercizio.

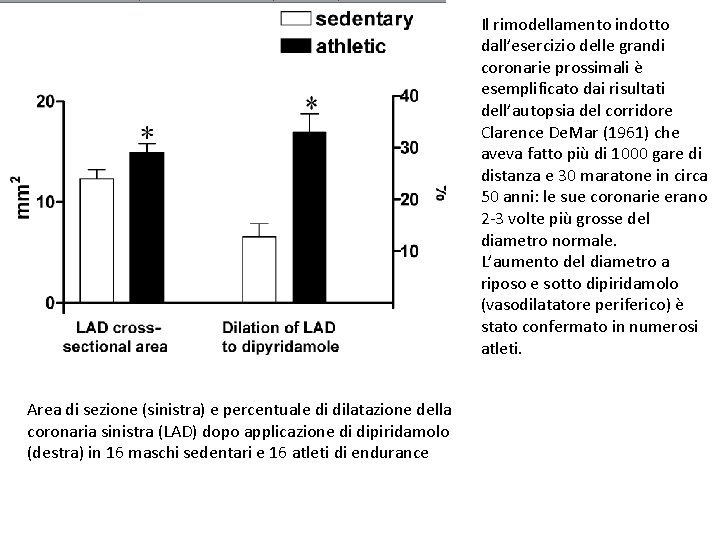
Il rimodellamento indotto dall’esercizio delle grandi coronarie prossimali è esemplificato dai risultati dell’autopsia del corridore Clarence De. Mar (1961) che aveva fatto più di 1000 gare di distanza e 30 maratone in circa 50 anni: le sue coronarie erano 2 -3 volte più grosse del diametro normale. L’aumento del diametro a riposo e sotto dipiridamolo (vasodilatatore periferico) è stato confermato in numerosi atleti. Area di sezione (sinistra) e percentuale di dilatazione della coronaria sinistra (LAD) dopo applicazione di dipiridamolo (destra) in 16 maschi sedentari e 16 atleti di endurance

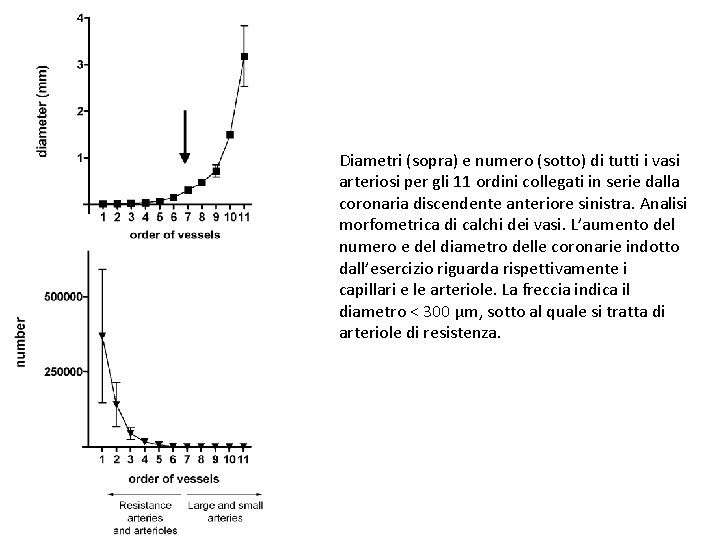
Diametri (sopra) e numero (sotto) di tutti i vasi arteriosi per gli 11 ordini collegati in serie dalla coronaria discendente anteriore sinistra. Analisi morfometrica di calchi dei vasi. L’aumento del numero e del diametro delle coronarie indotto dall’esercizio riguarda rispettivamente i capillari e le arteriole. La freccia indica il diametro < 300 µm, sotto al quale si tratta di arteriole di resistenza.

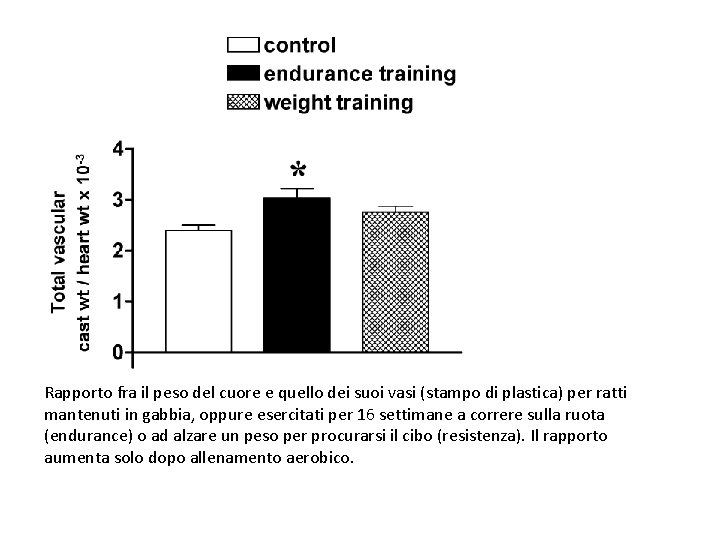
Rapporto fra il peso del cuore e quello dei suoi vasi (stampo di plastica) per ratti mantenuti in gabbia, oppure esercitati per 16 settimane a correre sulla ruota (endurance) o ad alzare un peso per procurarsi il cibo (resistenza). Il rapporto aumenta solo dopo allenamento aerobico.

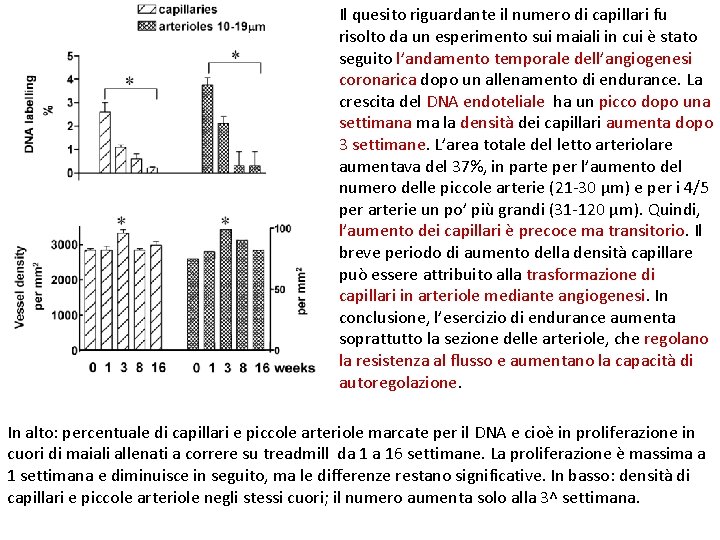
Il quesito riguardante il numero di capillari fu risolto da un esperimento sui maiali in cui è stato seguito l’andamento temporale dell’angiogenesi coronarica dopo un allenamento di endurance. La crescita del DNA endoteliale ha un picco dopo una settimana ma la densità dei capillari aumenta dopo 3 settimane. L’area totale del letto arteriolare aumentava del 37%, in parte per l’aumento del numero delle piccole arterie (21 -30 µm) e per i 4/5 per arterie un po’ più grandi (31 -120 µm). Quindi, l’aumento dei capillari è precoce ma transitorio. Il breve periodo di aumento della densità capillare può essere attribuito alla trasformazione di capillari in arteriole mediante angiogenesi. In conclusione, l’esercizio di endurance aumenta soprattutto la sezione delle arteriole, che regolano la resistenza al flusso e aumentano la capacità di autoregolazione. In alto: percentuale di capillari e piccole arteriole marcate per il DNA e cioè in proliferazione in cuori di maiali allenati a correre su treadmill da 1 a 16 settimane. La proliferazione è massima a 1 settimana e diminuisce in seguito, ma le differenze restano significative. In basso: densità di capillari e piccole arteriole negli stessi cuori; il numero aumenta solo alla 3^ settimana.

Schema dell’albero arterioso coronarico e dei capillari che distingue quali vasi aumentano di diametro e quali di numero in risposta all’esercizio

L’adattamento all’esercizio attraverso aumento di capillari e di piccole arterie richiede la proliferazione di cellule endoteliali e del muscolo liscio. Deve aumentare il numero delle cellule e anche le loro dimensioni, la matrice extracellulare e ci deve essere un riaggiustamento delle altre componenti. I segnali che scatenano questi processi di crescita comprendono l’ischemia e l’ipossia, molecole di accrescimento e forze emodinamiche, come il flusso, la pressione, la distensione e la compressione. Ischemia. C’è la possibilità che durante l’esercizio, nonostante lo stretto accoppiamento fra il metabolismo del cuore e il flusso coronarico, vi sia ischemia. Questo diventa particolarmente plausibile ad alte frequenza cardiache, quando il tempo di diastole si riduce e la compressione meccanica impedisce il flusso coronarico. Fattori di crescita. Sono stati descritti numerosi fattori stimolati dall’esercizio, in particolare: VEGF, FGF, TGF. Forze fisiche. Durante uno sforzo, la circolazione coronarica subisce l’effetto di diverse forze fisiche. L’aumento del riempimento diastolico stira le arterie di conduzione aumentandone la lunghezza ma riducendone il diametro. D’altra parte, l’aumento del flusso aumenta la forza di taglio. Molto importante il ruolo dell’ossido nitrico non solo per la risposta acuta ma per il rimodellamento

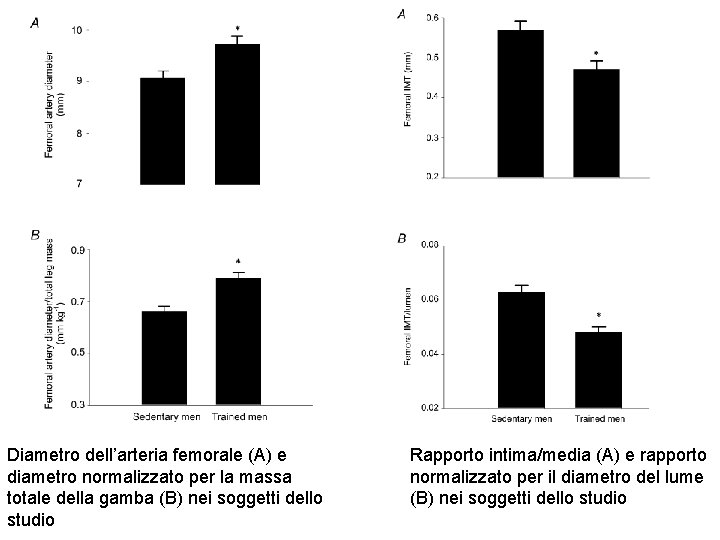
Alterazioni croniche del flusso sanguigno provocano cambiamenti nella stessa direzione del diametro del lume. Questo adattamento indotto dal flusso serve a conservare i livelli basali di shear stress (forza frizionale tangenziale alla parete) e modifica anche lo stress tangenziale (forza perpendicolare) grazie alla legge di Laplace. Un aumento cronico del flusso (sperimentale) riduce lo spessore dell’intima e della media: nell’insieme questo si chiama rimodellamento arterioso espansivo. Studi incrociati hanno documentato che giovani che hanno fatto allenamento di endurance intenso hanno il diametro delle arterie degli arti interessati aumentato. Non si può dire però se questo sia un effetto dell’allenamento oppure se la loro performance sia migliore grazie alle arterie più grandi. In questo studio si è indagato se le arterie sono più grandi anche negli adulti allenati e se tre mesi di endurance training in sedentari modificano le arterie.

Diametro dell’arteria femorale (A) e diametro normalizzato per la massa totale della gamba (B) nei soggetti dello studio Rapporto intima/media (A) e rapporto normalizzato per il diametro del lume (B) nei soggetti dello studio

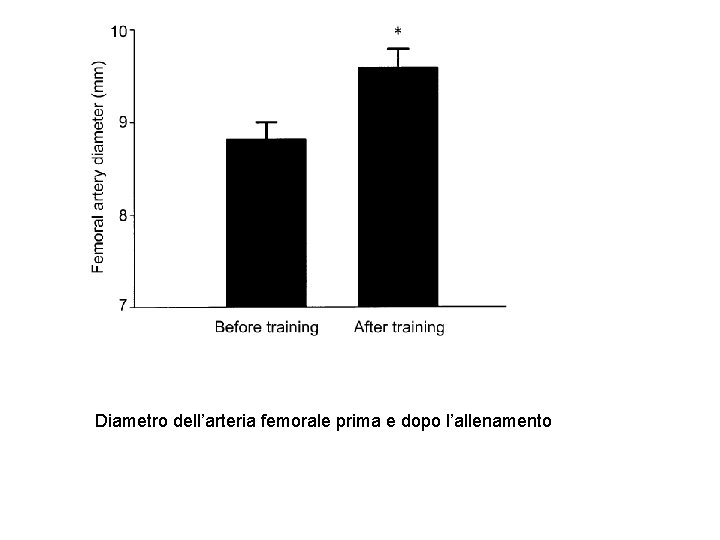
Diametro dell’arteria femorale prima e dopo l’allenamento

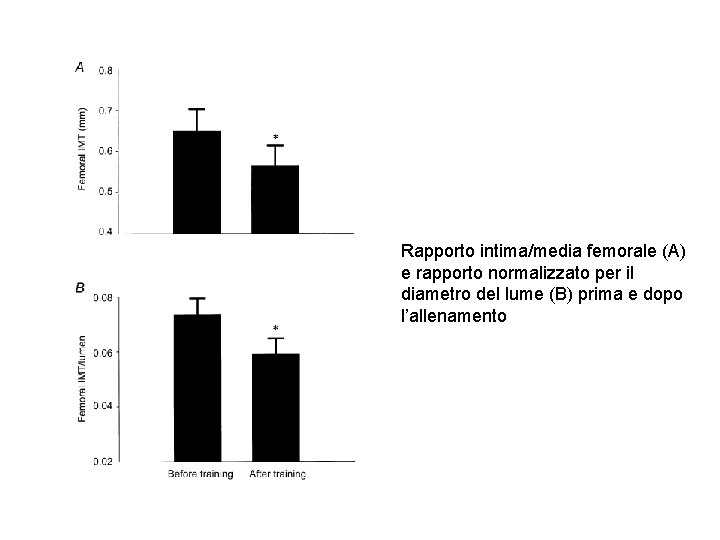
Rapporto intima/media femorale (A) e rapporto normalizzato per il diametro del lume (B) prima e dopo l’allenamento

Lo stress ossidativo è uno stato di sbilanciamento dell’ossidazione nel quale la capacità ossidante supera quella antiossidante e ne risulta un aumento della specie reattive dell’ossigeno (ROS). I ROS sono stati coinvolti nella patogenesi di quasi tutte le fasi della formazione di lesioni vascolari dell’aterosclerosi e dell’ipertensione. È chiaro che sono i macrofagi la principale fonte di ROS, ma si è capito che praticamente tutte le cellule della parete vascolare (endoteliali, muscolo liscio e avventizia) li possono produrre. I ROS hanno un ruolo fisiologico sulla parete dei vasi e sono secondi messaggeri nella funzione endoteliale e nella crescita, sopravvivenza e rimodellamento dei muscoli lisci e delle cellule endoteliali. Tutte queste risposte, quando sfuggono al controllo, contribuiscono alla patologia vascolare. Il più importante ROS vascolare è l’anione superossido (·O 2 -). Dismutato dalla superossidodismutasi (SOD) si trasforma in perossido di ossigeno (acqua ossigenata H 2 O 2), che è convertita in acqua dalla catalasi e dalla glutatione perossidasi.

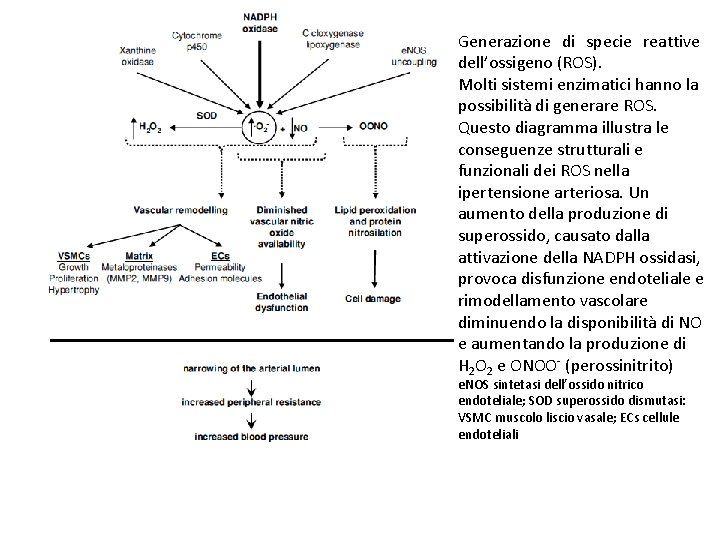
Generazione di specie reattive dell’ossigeno (ROS). Molti sistemi enzimatici hanno la possibilità di generare ROS. Questo diagramma illustra le conseguenze strutturali e funzionali dei ROS nella ipertensione arteriosa. Un aumento della produzione di superossido, causato dalla attivazione della NADPH ossidasi, provoca disfunzione endoteliale e rimodellamento vascolare diminuendo la disponibilità di NO e aumentando la produzione di H 2 O 2 e ONOO- (perossinitrito) e. NOS sintetasi dell’ossido nitrico endoteliale; SOD superossido dismutasi: VSMC muscolo liscio vasale; ECs cellule endoteliali

I processi fisiologici coordinati dai ROS sono stati studiati in animali e nell’uomo e hanno dimostrato il loro ruolo importante nello sviluppo dell’ipertensione perché favoriscono alterazioni strutturali e funzionali alla base del rimodellamento con aumento del deposito di matrice extracellulare, processi infiammatori e aumento della permeabilità endoteliale. I ROS attivano le MMPs secrete in forma inattiva dai macrofagi e dai muscoli lisci (VSMC), che degradano le membrane basali e l’elastina. Attivano le risposte derivanti dalla stimolazione dei recettori dell’angiotensina. Il reostato dello stato redox delle cellule endoteliali è in primo luogo regolato dall’interazione fra NO e ·O 2 -. Se il primo inibisce l’aggregazione delle piastrine e l’adesione dei leucociti all’endotelio, l’aumento di permeabilità provoca stravaso di proteine plasmatiche e infiammazione. Le ossidasi NADPH vascolari sono enzimi costitutivi, ma la loro attività è regolata da fattori umorali, quali angiotensina II, endotelina I e TNF-a. Ma l’attività NADPH è stimolata anche da forze meccaniche, come lo shear stress laminare e oscillatorio. Sono coinvolti anche numerosi fattori genetici. In conclusione, l’eccessiva produzione di ROS dovuta ad aumentata stimolazione di NADPH ossidasi si associa all’ipertensione perché restringe le arterie e aumenta le resistenze periferiche.

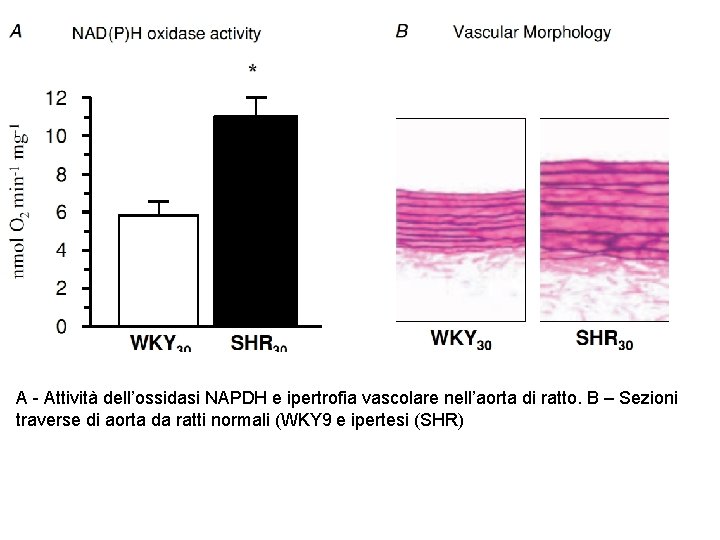
A - Attività dell’ossidasi NAPDH e ipertrofia vascolare nell’aorta di ratto. B – Sezioni traverse di aorta da ratti normali (WKY 9 e ipertesi (SHR)

Lo scopo di questa rassegna è di riassumere i meccanismi che stanno alla base degli adattamenti vascolari all’esercizio. Da oltre dieci anni è noto che l’allenamento aumenta la vasodilatazione endotelio-dipendente nelle arterie epicardiche del cane. Questa osservazione è stata ripetutamente confermata ed è sempre più chiaro che l’attivazione dovuta all’esercizio della via NO/c. GMP è un importante meccanismo alla base degli effetti benefici dell’esercizio sui vasi. Studi in vivo sull’animale e sull’uomo hanno dimostrato che l’esercizio aumenta l’espressione dell’e. NOS delle cellule endoteliali. La regolazione dell’espressione di e. NOS è molto complessa. Fra i fattori coinvolti: shear sress, lisofosfatidilcolina, analoghi del c. GMP, lipoproteine, inibitori della protein chinasi C e varie citochine. Il principale meccanismo consiste nelle variazioni di frequenza e ampiezza delle forze fisiche agiscono sui vasi, in particolare lo shear stress, a causa dell’aumento della frequenza cardiaca e del flusso.

Un altro meccanismo che può contribuire all’aumento di e. NOS dovuto all’esercizio è una funzione scatenante dello stress ossidativo indotto dall’esercizio. L’esercizio non solo aumenta il consumo di ossigeno ma anche la generazione di specie reattive dell’ossigeno come lo ione superossido e l’acqua ossigenata (perossido di ossigeno): quest’ultima stimola la e. NOS. L’aumento di e. NOS è un effetto transitorio, essendo massimo dopo 3 settimane, ma scomparendo dopo 9 settimane di allenamento. Si ipotizza un rimodellamento strutturale che “normalizza” lo shear stress. Inoltre, la risposta all’allenamento è molto maggiore in ratti sedentari che in altri più attivi prima dell’allenamento. È noto che ci sono polimorfismi (mutazioni geniche) riguardanti e. NOS e alcuni individui hanno una reattività vascolare normale in condizioni basali ma non l’aumentano in risposta all’allenamento. È stato dimostrato che l’attivazione di e. NOS da parte dello shear stress non dipende da un aumento del calcio intracellulare ma da una fosforilazione diretta dell’enzima, che può essere indotta dall’esercizio. L’esercizio acuto aerobico e anaerobico aumenta lo stress ossidativo dei vasi conseguente danneggiamento delle proteine, dei lipidi e degli acidi nucleici e del sistema del glutatione. Questi effetti acuti sono controbilanciati da un aumento dei sistemi antiossidanti in seguito all’allenamento

L’aumento dello stress ossidativo associato all’esercizio è fonte di preoccupazione quando si prescrive esercizio a pazienti cardiovascolari (coronarie, insufficienza, stroke) e dimostra l’importanza di una prescrizione individualizzata e di un’educazione del paziente sul programma da seguire. Variazioni indotte dall’esercizio sull’espressione e l’attività dell’endotelio vascolare e delle proteine del muscolo liscio

È evidente che lo stress ossidativo dell’esercizio, che in principio può provocare danni tessutali, contribuisce a modificazioni favorevoli dell’espressione genica vascolare dopo alcune settimane di allenamento. Ci si chiede quindi se gli effetti antiossidanti dell’allenamento dipendano dallo stress ossidativo intermittente sui vasi. L’acqua ossigenata nei vasi aumenta l’espressione dell’e. NOS e l’esercizio ripetuto a medio termine riduce vari segni di stress ossidativo, mentre l’e. NOS è cruciale per la produzione dell’antiossidante SOD-3. 4 settimane di esercizio riducono la produzione della NADPH ossidasi (pro-ossidante) e dei recettori di tipo 1 dell’angiotensina II (ossidanti), mentre aumentano quelli di tipo 2 (antiossidanti). Questi effetti sono reversibili quando si torna ad un regime sedentario. In confronto ad altre terapie antiossidanti (es. vit. E) l’esercizio è più efficace e meno costoso. ALTRI EFFETTI L’esercizio aumenta il numero (angiogenesi) e il diametro (arteriogenesi) dei vasi arteriosi dei muscoli e del miocardio. Queste modificazioni strutturali si accompagnano a cambiamenti funzionali che aumentano il flusso di sangue. L’angiogenesi, che è transitoria, riguarda le arterie più piccole e i capillari. Sono implicati fattori di crescita (VEGF, FGF, ANG) e i loro recettori, ma anche metalloproteinasi; sono mobilizzate cellule progenitrici dal midollo emopoietico, che hanno un potente effetto angiogenetico. Arterie più grandi, piccole arterie di conduttanza aumentano di calibro. L’induzione dell’arteriogenesi è un adattamento vascolare importante perché si formano grandi tubi conduttivi che possono compensare la perdita di funzione di arterie occluse: questo meccanismo nei pazienti cardiovascolari è più importante dell’aumento dei capillari.

L’allenamento modifica le forze fisiche agiscono sulla parete dei vasi: shear stress, pressione transmurale e stiramento ciclico. Ogni volta che aumenta la frequenza cardiaca, queste forze aumentano. Tutte queste forze hanno importanti effetti fisiologici sull’espressione genica e sulla funzione delle cellule endoteliali e del muscolo liscio. Le cellule endoteliali vascolari formano lo strato interno di tutti i vasi (e delle camere cardiache) e pertanto sono direttamente sottoposte alle forze fisiche indotte dal flusso. In vitro, l’esposizione prolungata alla forza di taglio (shear) laminare regola l’espressione di molti geni: sono stati trovati 107 geni che modificano di almeno 2 volte la loro espressione rispetto a condizioni in assenza di flusso; 60 aumentano e 47 diminuiscono e possono essere raggruppati in 9 sottospeci funzionali. Sono sottoregolati (dallo shear stress) i geni dell’accrescimento e della riproduzione cellulare, mentre quelli che presiedono al metabolismo e alla trasduzione di segnali sono sopraregolati. Si genera quindi un fenotipo di cellule endoteliali che resistono all’apoptosi, all’infiammazione e allo stress ossidativo. Non è detto che questa situazione si ripeta in seguito all’allenamento perché in vivo le forze di taglio sono sempre presenti ma aumentano di intensità e si modificano con maggiore frequenza, ma è certo che una certa modificazione dell’espressione genica abbia luogo, come già visto. Le forze meccaniche attivano numerose vie intracellulari fra cui MAP chinasi e provocano fosforilazioni sequenziali che attivano fattori di trascrizione e l’espressione genica. La meccanotrasduzione è affidata ad integrine , recettori di superficie che mediano l’adesione cellulare legandosi all’ECM e presiedono all’angiogenesi, hanno effetti antiaterogenici e rimodellanti.

L’aumento delle forze fisiche indotto dall’esercizio può cambiare il fenotipo in particolare in sezioni di vasi in cui il flusso è turbolento: le lesione atrosclerotiche si sviluppano in particolare in zone di flusso turbolento e/o scarso flusso laminare: l’attrito oscillante (disordinato) può addirittura ridurre e. NOS. Certi tipi di flusso che si ritrovano in zone particolarmente esposte all’aterogenesi (carotidi dell’anziano) producono onde di flusso con poco shear stress e stimolano l’espressione di un fenotipo endoteliale proinfiammatorio, caratterizzato dall’espressione aumentata di geni proinfiammatori come IL-8 …. TNF, PGF (placental) e CTGF (connective tissue). Al contrario, zone dove il flusso è tipicamente laminare hanno un profilo genico completamente diverso, come CNP (fatt. natriuretico C). Non è noto se l’esercizio abbia un’influenza benefica anche sulle zone esposte a flusso turbolento, ma osservazioni indirette sembrerebbero confermarlo. Le cellule muscolari lisce dei vasi (VSM) sono meno esposte allo shear stress ma subiscono la stessa pressione transmurale e lo stiramento ciclico. Pochi hanno studiato la trasduzione biomeccanica sui muscoli lisci in vivo, ma vi sono molti studi in coltura, mediante applicazione di diversi tipi di forza. Le VSM rispondono in maniera simile all’endotelio e regolano importanti funzioni cellulari come proliferazione, apoptosi, gestione del calcio e risposte miogene alla pressione. In vivo le VSM sono costantemente esposte a importanti forze fisiche, di cui l’esercizio cambia intensità e frequenza. L’effetto più importante è una riduzione dei depositi intracellulari di calcio e quindi una minore risposta a stimoli vasocostrittivi (endotelina e trombossano) nelle coronarie.

Questo lavoro considera le modificazioni strutturali indotte dall’allenamento sul sistema vascolare e i relativi meccanismi. È importante distinguere i diversi segmenti vascolari. L’aumento di diametro di vasi esistenti (arteriogenesi) è un mezzo efficace per aumentare il flusso, mentre l’espansione della rete capillare (angiogenesi) migliora gli scambi fra il sangue e i tessuti. I principale fattori sono elencati nella tabella.


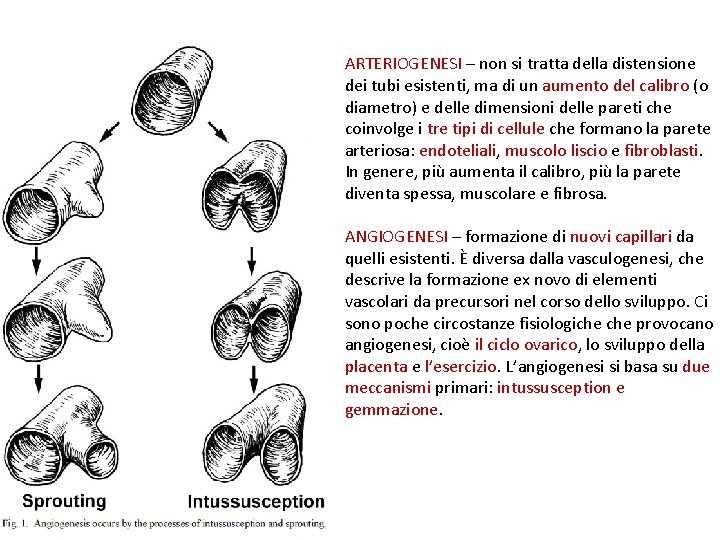
ARTERIOGENESI – non si tratta della distensione dei tubi esistenti, ma di un aumento del calibro (o diametro) e delle dimensioni delle pareti che coinvolge i tre tipi di cellule che formano la parete arteriosa: endoteliali, muscolo liscio e fibroblasti. In genere, più aumenta il calibro, più la parete diventa spessa, muscolare e fibrosa. ANGIOGENESI – formazione di nuovi capillari da quelli esistenti. È diversa dalla vasculogenesi, che descrive la formazione ex novo di elementi vascolari da precursori nel corso dello sviluppo. Ci sono poche circostanze fisiologiche provocano angiogenesi, cioè il ciclo ovarico, lo sviluppo della placenta e l’esercizio. L’angiogenesi si basa su due meccanismi primari: intussusception e gemmazione.

Intussusception è un processo per il quale un capillare si divide in due dall’interno, formando una specie di pilastro o una divisione longitudinale al suo interno: le cellule endoteliali si propagano all’interno e finiscono per formare due tubi. È il procedimento più semplice ed è probabilmente il metodo principale durante l’accrescimento. L‘angiogenesi per gemmazione è un processo nel quale cellule endoteliali attivate di un capillare esistente si espandono verso la matrice circostante e formano un cordoncino, che poi si trasforma in un tubo e rimane attaccato all’ECM. Naturalmente, perché diventi funzionante, è necessario che si attacchi ad un altro capillare o ad una venula. Il capillare neoformato inizialmente perde, ma maturando lo avvolgono i periciti e diventa un vero capillare. Contemporaneamente, la membrana basale e l’ECM circostante devono essere degradati permettere la migrazione delle cellule endoteliali e la formazione del tubo. È quindi necessario il coordinamento di processi multipli per il completamento della gemmazione. C’è in genere corrispondenza fra la massima conduttanza idraulica in un muscolo e la sua capacità aerobica. Il calibro dei vasi di conduzione corrisponde all’attività dei gruppi muscolari che ne dipendono. L’aumento della capacità di flusso dei principali gruppi muscolari di atleti molto allenati probabilmente contribuisce ad ottimizzare la performance

La capillarità nei muscoli attivi è aumentata in maniera significativa dall’allenamento. Un intenso allenamento di resistenza però provocando ipertrofia muscolare potrebbe diminuire la capillarità, ma questo non capita sempre. L’espansione della rete capillare migliora gli scambi perché: 1) aumenta la superficie di diffusione, 2) riduce la distanza media di diffusione, 3) aumenta il tempo per gli scambi diffusivi fra sangue e tessuti L’angiogenesi aumenta la capillarità del gastrocnemio del ratto dopo allenamento aerobico. I capillari appaiono come macchie o linee brune; le fibre muscolari sono colorate in giallo

I vasi arteriosi si allargano in risposta all’aumento della pressione interna, che aumenta lo stress radiale, ed all’aumento del flusso, che aumenta lo shear stress sulle cellule endoteliali. L’efficacia della produzione endoteliale di NO è molto importante permettere il rimodellamento vascolare. Il fatto che l’esercizio cronico regola verso l’alto e. NOS comporta una maggiore responsività per il rimodellamento, rispetto a condizioni sedentarie. INFIAMMAZIONE – elementi della risposta infiammatoria sono coinvolti nell’arteriogenesi, almeno nei vasi collaterali dopo occlusione di un vaso maggiore: immediatamente dopo l’occlusione c’è un’invasione di proteine chemiotattiche attraggono i monociti, che contribuiscono all’allargamento del vaso rilasciando potenti citochine (VEGF, FGF). C’è una risposta infiammatoria nel muscolo all’inizio dell’allenamento, se l’esercizio è intenso, inusuale e il muscolo è super utilizzato. Sembra però improbabile che questo sia importante per l’espansione dei capillari, perché i dolori muscolari e l’infiammazione si risolvono in fretta e non hanno più luogo continuando l’esercizio, mentre l’angiogenesi si completa in seguito. Il VEGF è un potente mitogeno per le cellule endoteliali. È stato particolarmente studiato il suo ruolo nella gemmazione, che si produce in vitro sotto il suo effetto. È anche un attrattore chimico per la migrazione di cellule endoteliali e muscolari lisce.

Il VEFG aumenta nel muscolo di ratto dopo contrazione o dopo un singolo episodio di corsa moderata su treadmill. L’m. RNA del VEFG aumentava fino a 4 volte in 4 ore e ritornava ai valori di controllo in 8 ore. Lo stesso aumento è stato trovato nell’uomo sano e con insufficienza cardiaca. Il VEFG aumenta di più nei muscoli pallidi, ma i suoi livelli di base sono 3 volte maggiori in quelli rossi. Per l’angiogenesi è necessario anche il rimodellamento delle membrane e dell’ECM. La proteolisi della membrana basale è regolata da MMPs, plasminogeno e urochinasi, ma questo processo deve essere altamente regolato per evitare la perdita di integrità funzionale e si deve modificare permettere l’accomodamento di nuovi capillari: per questo sono importanti le TIMPs. Uno dei più potenti stimoli per l’angiogenesi è l’ipossia, che esercita i suoi effetti prima di tutto aumentando la produzione di VEGF. Abbassando la PO 2 di cellule endoteliali in coltura si stimola la proliferazione, la migrazione, la formazione di tubi mentre ritornando a una PO 2 normale tutto questo sparisce. L’ipossia fa aumentare fortemente un fattore di trascrizione (HIF-1 = hypoxia induced factor), che stimola la trascrizione del gene del VEGF. Non sembra però che questo effetto sia additivo rispetto a quello dell’esercizio. Quindi la relazione fra PO 2 muscolare durante l’esercizio, la stimolazione di VEFG e lo sviluppo di angiogenesi non è semplice. Benché sia evidente che forze fisiche associate con lo shear stress o con lo stiramento meccanico danno segnali che rimodellano i vasi, è stato difficile stabilire rapporti quantitativi, perché gli stimoli sono difficili da misurare e da controllare.

La somministrazione prolungata di vasodilatatori nei ratti aumentava la capillarità. La natura di questa risposta angiogenica al flusso è diversa da quella dovuta all’esercizio: nel primo caso prevale l’intussusceptive angiogenesis e nel secondo la gemmazione. Inoltre, nel primo caso non c’è rimodellamento dell’ECM, anche se è ugualmente stimolato il VEGF. Il sovraccarico del muscolo porta ad angiogenesi con gemmazione ed è quindi ragionevole supporre che lo stimolo meccanico promuova l’angiogenesi indipendentemente dal flusso. Annu. Rev. Physiol. 2014. 76: 2. 1– 2. 18

Il primo sistema fisiologico che entra in funzione nello sviluppo embrionario dei mammiferi è il sistema circolatorio, che deve essere formato quando l’embrione diventa troppo grande perché l’ossigeno possa diffondere direttamente dai vasi uterini. In tutte le specie di metazoi il fattore inducibile dall’ipossia (HIF-1) funziona come il principale regolatore dell’omeostasi dell’ossigeno e ne controlla sia la distribuzione sia l’utilizzazione. Le tre componenti del sistema circolatorio, cuore, vasi e sangue dipendono dall’HIF-1. L’attività dell’HIF-1 è indotta dall’ipossia mediante alterazioni del suo m. RNA nel cervello, cuore, rene, polmone e muscolo scheletrico.

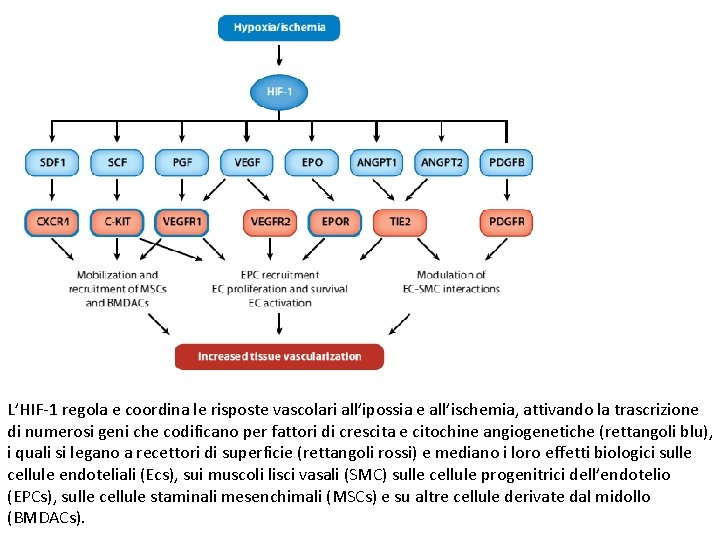
L’HIF-1 regola e coordina le risposte vascolari all’ipossia e all’ischemia, attivando la trascrizione di numerosi geni che codificano per fattori di crescita e citochine angiogenetiche (rettangoli blu), i quali si legano a recettori di superficie (rettangoli rossi) e mediano i loro effetti biologici sulle cellule endoteliali (Ecs), sui muscoli lisci vasali (SMC) sulle cellule progenitrici dell’endotelio (EPCs), sulle cellule staminali mesenchimali (MSCs) e su altre cellule derivate dal midollo (BMDACs).

Annu. Rev. Physiol. 2013. 75: 23– 47

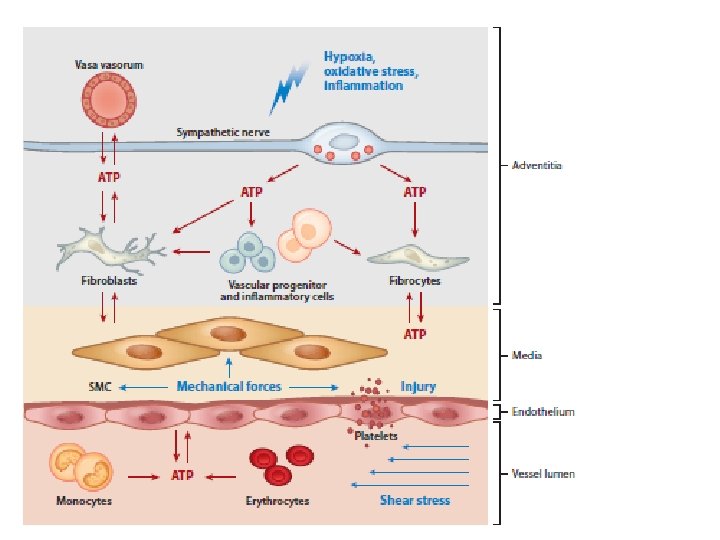
L’avventizia vascolare funziona come un centro biologico di processo per la raccolta, l’immagazzinamento, l’integrazione e il rilascio di fattori determinanti per la regolazione delle funzioni della parete vascolare. È la componente più complessa della parete vascolare e si compone di una varietà di cellule, compresi i fibroblasti, cellule immunomodulatrici (cell. dendritiche (DC) e macrofagi), cellule progenitori, cellule endoteliali dei vasa vasorum, periciti e fibre adrenergiche. In risposta a stress o lesioni vascolari le cellule avventiziali residenti sono spesso le prime ad essere attivate e riprogrammate per influenzare il tono e la struttura della parete vascolare, per iniziare e continuare l’infiammazione vascolare cronica e per stimolare l’espansione dei vasa vasorum, che funzionano come condotti per l’arrivo continuo di cellule infiammatorie e progenitori. Questa rassegna presenta le conoscenze attuali che dimostrano che l’avventizia funziona come regolatore principale delle funzioni e della struttura della parete vascolare, dal di fuori verso l’interno.

L’AVVENTIZIA: COMPARTIMENTO COMPLESSO E DINAMICO DELLA PARETE VASCOLARE La parete vascolare è una struttura eterogenea a tre strati, composta dall’intima, la media e l’avventizia. Ogni strato ha caratteristiche istologiche, biochimiche e funzionali specifiche e pertanto ciascuno contribuisce in maniera univoca all’omeostasi vascolare e alla regolazione delle risposte allo stress e al danno. Composizione cellulare complessa dell’avventizia vascolare. Al contrario degli altri strati, composti di cellule endoteliali e muscolo liscio, qui c’è una varietà di tipi cellulari: fibroblasti, cellule progenitore residenti, cellule immunomodulatrici (dendritiche, macrofagi, linfociti T), cellule endoteliali dei vasa vasorum e fibre adrenergiche. Abbreviazioni: EEL lamina elastica esterna; IEL lamina elastica interna.

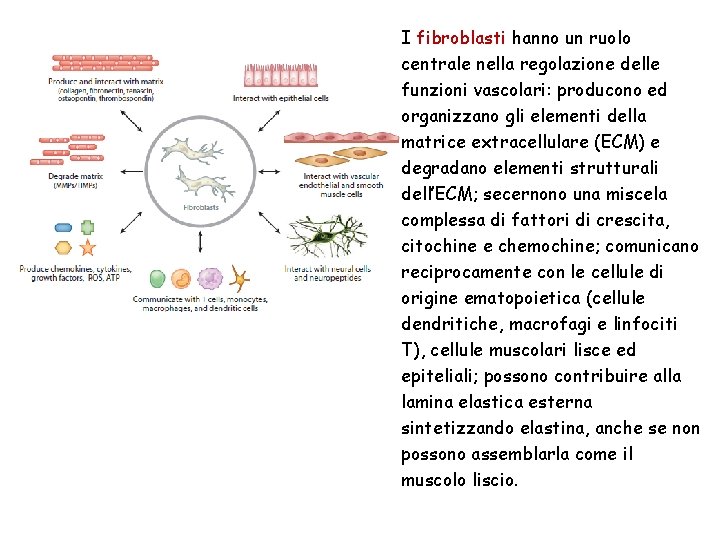
I fibroblasti hanno un ruolo centrale nella regolazione delle funzioni vascolari: producono ed organizzano gli elementi della matrice extracellulare (ECM) e degradano elementi strutturali dell’ECM; secernono una miscela complessa di fattori di crescita, citochine e chemochine; comunicano reciprocamente con le cellule di origine ematopoietica (cellule dendritiche, macrofagi e linfociti T), cellule muscolari lisce ed epiteliali; possono contribuire alla lamina elastica esterna sintetizzando elastina, anche se non possono assemblarla come il muscolo liscio.

IL FIBROBLASTO DELL’AVVENTIZIA: CELLULA SENTINELLA Il fibroblasto è il tipo di cellula più numeroso nell’avventizia, anche se non ci sono marker specifici per identificarlo, ma bisogna andare per esclusione, identificando le cellule che non ci sono (cellule non linfoidi, non epiteliali e non endoteliali), insieme a caratteristiche morfologiche, funzionali e biochimiche. I fibroblasti stromali derivano da almeno tre cellule di origine: precursori premesenchimali, transizione locale epitelio-mesenchimale (EMT) e derivati dal midollo osseo. Le diverse origini contribuiscono al fatto ormai ben accettato che siano molto eterogenei. I fibroblasti hanno schemi di espressione genica specifici per organo e tessuto così diversi come quelli dei diversi tipi di cellule della serie bianca. In particolare, sono diversi i geni espressi dai fibroblasti dell’avventizia delle arterie polmonari. Si pensava che i fibroblasti dell’avventizia (AF) servissero semplicemente a rinforzare i tessuti producendo ECM, che forma una rete di sostegno, ma uno dei reperti più frequenti nei modelli sperimentali di danni vascolari sistemici e dell’ipertensione è un precoce e abbondante rimodellamento dell’avventizia. Quindi l’AF può rappresentare una cellula sentinella parete vascolare che risponde a diversi stimoli per prima. L’AF può essere la prima cellula che sente l’ipertensione. Il rimodellamento dell’avventizia nei vasi sistemici è spesso caratterizzato dall'aumento della proliferazione degli AF, che precede ed è maggiore della proliferazione endoteliale e del muscolo liscio.

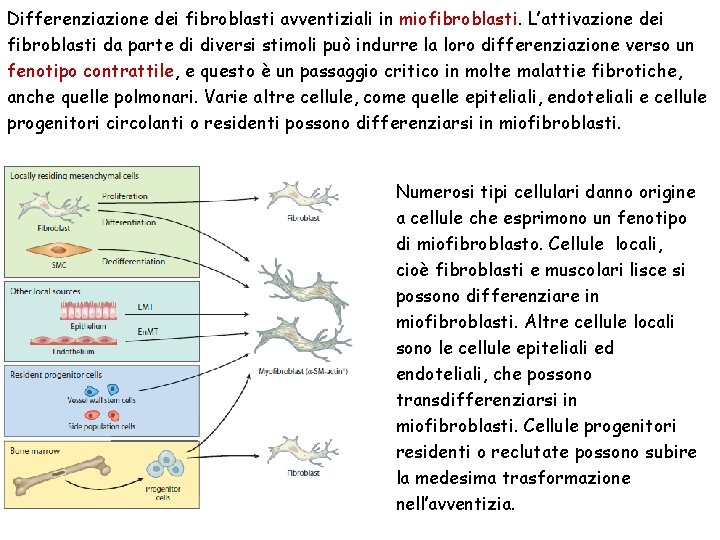
Differenziazione dei fibroblasti avventiziali in miofibroblasti. L’attivazione dei fibroblasti da parte di diversi stimoli può indurre la loro differenziazione verso un fenotipo contrattile, e questo è un passaggio critico in molte malattie fibrotiche, anche quelle polmonari. Varie altre cellule, come quelle epiteliali, endoteliali e cellule progenitori circolanti o residenti possono differenziarsi in miofibroblasti. Numerosi tipi cellulari danno origine a cellule che esprimono un fenotipo di miofibroblasto. Cellule locali, cioè fibroblasti e muscolari lisce si possono differenziare in miofibroblasti. Altre cellule locali sono le cellule epiteliali ed endoteliali, che possono transdifferenziarsi in miofibroblasti. Cellule progenitori residenti o reclutate possono subire la medesima trasformazione nell’avventizia.

Miofibroblasti che esprimono actina αSM nell’avventizia ne aumentano enormemente e precocemente l’espressione nell’ipertensione polmonare e in altre vasculopatie. I miofibroblasti sono protagonisti del rimodellamento tessutale perché esplicano, in risposta a modificazioni ambientali locali, funzioni fisiologiche multiple come la produzione di collagene e altre proteine dell’ECM (elastina e fibronectina), proteine matricellulari (altenascina-C e osteopontina) e una serie di fattori di crescita, citochine e specie reattive dell’ossigeno che hanno effetti paracrini sulla muscolatura liscia. I miofibroblasti hanno una forte capacità contrattile contrazioni lente e sostenute in risposta a molti agonisti, mentre la loro reazione ai vasodilatatori è diversa da quella delle SMC, e questo spiega la risposta vasodilatatoria alterata nell’ipertensione polmonare. La transizione da fibroblasti a miofibroblasti nell’avventizia è regolata da un microambiente complesso che comprende fattori di crescita, citochine, molecole di adesione e dell’ECM, fra cui TGF-β, trombina, endotelina-1, angiotensina II, interleuchina (IL)-6 e Fizz 1: tutti fattori aumentati dall’ipossia e presenti nell’avventizia polmonare di animali ipossici.

Interazioni fibroblasti-matrice nell’avventizia. La composizione dell’ECM dell’avventizia è regolata soprattutto dai fibroblasti: le componenti principali sono collageni fibrillari, particolarmente di tipo I e III. In condizioni normali i fibroblasti sono quiescenti e indifferenziati, in equilibrio omeostatico con l’ECM, ma quando sono attivati in risposta a stress o lesioni vi è un’alterazione importante della composizione proteica dell’ECM, come si verifica nella progressione di vari malattie vascolari, come la ristenosi, l’aterosclerosi e l’ipertensione polmonare. In questo caso, per esempio, aumenta notevolmente la produzione e l’accumulo di collagene ed elastina, il che cambia la rigidità di parete, la dinamica del flusso e alla fine la funzione del ventricolo destro. La deposizione di fibronectina, tenascina-C e osteopontina coincide con l’aumento dell’espressione di molte metalloproteinasi della matrice (MMP) responsabili del degrado di varie componenti dell’ECM, compreso il collagene delle membrane basali, quello interstiziale, la fibronectina e vari proteoglicani. L’attività proteolitica delle MMP è regolata da inibitori specifici (TIMPs), che però è ridotta in molte vasculopatie e così si crea un ambiente favorevole alla migrazione cellulare. L’espressione eccessiva di MMPs e ridotta di TIMPs facilita la patogenesi di malattie che distruggono i tessuti.

AVVENTIZIA: RUOLO DEI MACROFAGI, CELLULE DENDRITICHE E FIBROBLASTI NELL’INFIAMMAZIONE VASCOLARE. L’infiammazione vascolare è sempre stata considerate un processo che va da dentro a fuori, basato sul reclutamento di monociti e linfociti nell’intima dei vasi: in questo modello, l’endotelio lesionato esprime sulla superficie molecole di adesione e mediatori dell’infiammazione che provocano la cattura dei monociti e la loro migrazione finale all’intima e alla media. C’è però un’altra ipotesi supportata da risultati sperimentali secondo cui il processo avviene da fuori a dentro con l’inizio e la prosecuzione dell’infiammazione nell’avventizia, che si propaga alla media e all’intima: è stato infatti dimostrato un rapido flusso di leucociti nel comparto avventiziale, in un gran numero di lesioni vascolari. Inizialmente si pensava che l’attivazione dei fibroblasti fosse relativamente poco importante per i processi immunitari e le interazioni immunitarie erano attribuite a linfociti, macrofagi e DCs, mentre si sta chiarendo che molti segnali di danno non sono antigene specifici e si è spostata l’attenzione verso un sistema immunitario diffuso nel quale i fibroblasti giocano un ruolo importante: i fibroblasti prelevati da tessuti danneggiati hanno un fenotipo diverso rispetto a quelli prelevati dallo stesso tessuto sano.

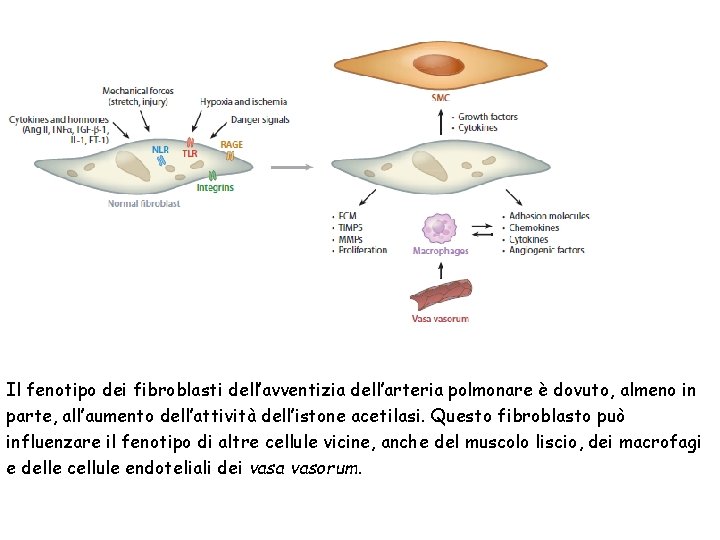
Il fenotipo dei fibroblasti dell’avventizia dell’arteria polmonare è dovuto, almeno in parte, all’aumento dell’attività dell’istone acetilasi. Questo fibroblasto può influenzare il fenotipo di altre cellule vicine, anche del muscolo liscio, dei macrofagi e delle cellule endoteliali dei vasa vasorum.

I VASA VASORUM DELL’AVVENTIZIA. I vasa vasorum (VV) sono una rete di piccoli vasi che forniscono ai grandi vasi (arterie e vene > 0. 5 mm) ossigeno e sostanze nutritizie; essi possono anche rimuovere prodotti di scarto. Nella circolazione sistemica i VV subiscono un’ampia espansione in diverse condizioni patologiche, come l’aterosclerosi, il diabete di tipo II, la sindrome metabolica, la ristenosi e le vasculiti, ma i meccanismi implicati sono poco noti, anche se spesso le risposte angiogeniche si associano ad accrescimento di fibre nervose. I vasi polmonari sono innervati dal sistema nervoso adrenergico che si distribuisce nell’avventizia e nella parte esterna della media, liberando prevalentemente noradrenalina. In alcuni pazienti con ipertensione polmonare è stato trovato un numero aumentato di terminazioni adrenergiche fino alle arterie muscolari interacinose.

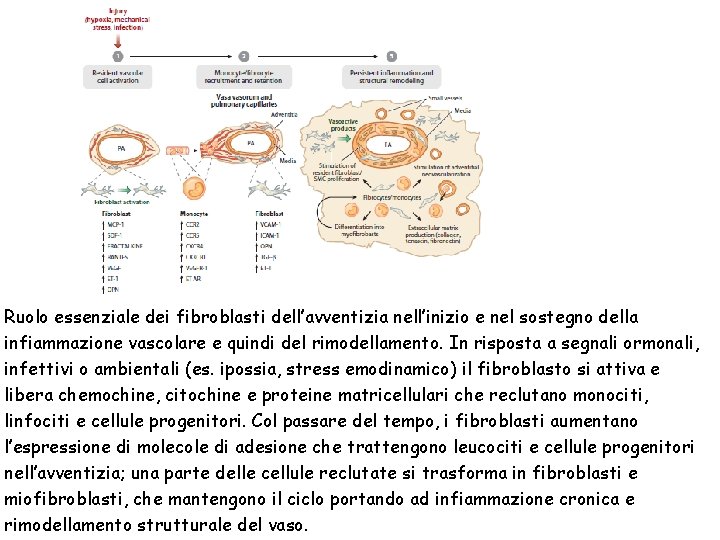
Ruolo essenziale dei fibroblasti dell’avventizia nell’inizio e nel sostegno della infiammazione vascolare e quindi del rimodellamento. In risposta a segnali ormonali, infettivi o ambientali (es. ipossia, stress emodinamico) il fibroblasto si attiva e libera chemochine, citochine e proteine matricellulari che reclutano monociti, linfociti e cellule progenitori. Col passare del tempo, i fibroblasti aumentano l’espressione di molecole di adesione che trattengono leucociti e cellule progenitori nell’avventizia; una parte delle cellule reclutate si trasforma in fibroblasti e miofibroblasti, che mantengono il ciclo portando ad infiammazione cronica e rimodellamento strutturale del vaso.

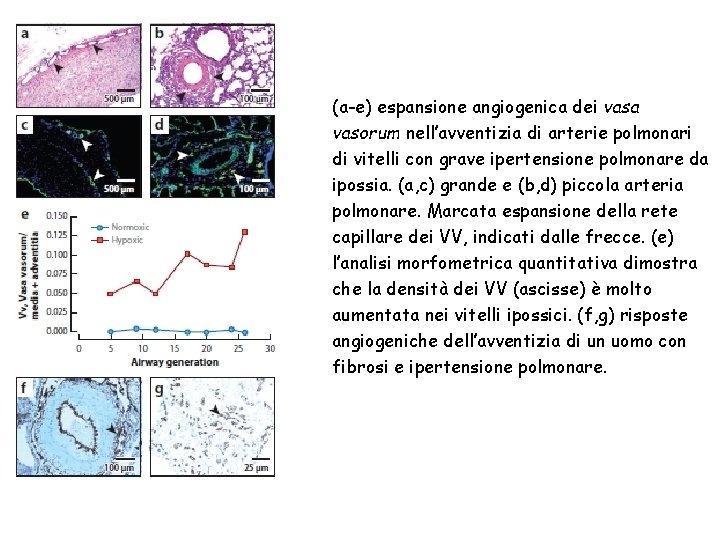
(a-e) espansione angiogenica dei vasa vasorum nell’avventizia di arterie polmonari di vitelli con grave ipertensione polmonare da ipossia. (a, c) grande e (b, d) piccola arteria polmonare. Marcata espansione della rete capillare dei VV, indicati dalle frecce. (e) l’analisi morfometrica quantitativa dimostra che la densità dei VV (ascisse) è molto aumentata nei vitelli ipossici. (f, g) risposte angiogeniche dell’avventizia di un uomo con fibrosi e ipertensione polmonare.

PURINE EXTRACELLULARI: MEDIATORI ENDOGENI NELL’AVVENTIZIA. Le purine e pirimidine (ATP, ADP, AMP, adenosina, UTP e UDP) sono le più diffuse fra i numerosi fattori che controllano il rimodellamento vascolare: la loro concentrazione aumenta nel micorambiente tessutale locale di varie forme fisiologiche e patologiche come l’ipossia, l’infiammazione, la forza di taglio del flusso, forze meccaniche, shock osmotico, trombosi e stimolazione simpatica. SPECIE REATTIVE DELL’OSSIGENO NELL’AVVENTIZIA. Anche i ROS generati nell’avventizia delle arterie polmonari contribuiscono agli effetti da fuori a dentro nella vasocostrizione polmonare e nel rimodellamento. Gli AFs attivati producono ROS soprattutto per la via NADPH ossidasi, ma ci sono anche altre fonti di ROS: i mitocondri, il disaccoppiamento dell’e. NOS e la xantina ossidasi. I ROS promuovono il reclutamento di cellule infiammatorie, ulteriore fonte di ROS. Queste diverse sorgenti di ROS producono ossidanti in diversi compartimenti cellulari che determinano lo stato redox locale e i bersagli specifici dei ROS. L’AVVENTIZIA: DEPOSITO DI CELLULE PROGENITORI VASCOLARI. Lo strato avventiziale dei vasi in sviluppo e nell’adulto funziona come una nicchia per cellule staminali e progenitori di cellule endoteliali e mesenchimali, muscolo liscio e periciti.


CONCLUSIONI. Essendo il compartimento più complesso della parete vascolare, l’avventizia funziona da unità di processo centrale (CPU: il cuore dei computers) biologica che integra una serie di meccanismi di regolazione della parete vasale. L’avventizia ospita una grande varietà di cellule con funzioni potenzialmente immunoregolatorie, quali fibroblasti, fibrociti, macrofagi, DCs e cellule progenitori residenti, cellule endoteliali dei VV e fibre adrenergiche. Queste cellule residenti avventiziali sono spesso le prime ad essere attivate in risposta a stress vascolari o lesioni e sono poi riprogrammate per modulare il tono vasale e ristrutturare l’architettura della parete. Il regolatore più importante è l’AF, che subisce modificazioni funzionali fissate epigeneticamente compresa proliferazione, differenziazione, produzione di proteine dell’ECM e di molecole di adesione, rilascio di ROS, fattori di crescita e MMPs che regolano direttamente il tono e l’ipertrofia della muscolatura liscia. Questo fenotipo di AF attivato è caratterizzato anche dalla produzione di citochine e chemochine che reclutano, trattengono e attivano cellule infiammatorie e progenitori circolanti e residenti. Interazioni bidirezionali fra fibroblasti attivati e macrofagi, DC e cellule progenitori, residenti e reclutate creano un microambiente favorevole all’infiammazione cronica. Le risposte comprendono l’espansione dei VV che sono ulteriori condotti per far arrivare le cellule dell’infiammazione con il risultato di un’alterazione strutturale e funzionale irreversibile.
 Quali caratteristiche hanno gli esseri viventi
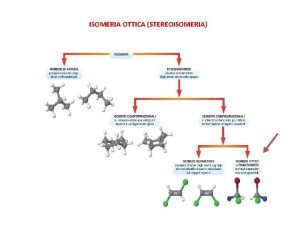
Quali caratteristiche hanno gli esseri viventi Isometria ottica
Isometria ottica Sinapsi interneuroniche
Sinapsi interneuroniche Come si propaga il calore
Come si propaga il calore Effetto serra
Effetto serra Conduzione saltatoria
Conduzione saltatoria Tecniche di conduzione dei gruppi slide
Tecniche di conduzione dei gruppi slide Conduzione saltatoria
Conduzione saltatoria Fibre del purkinje
Fibre del purkinje Druckdom arterie
Druckdom arterie Arterie circonferenziali
Arterie circonferenziali Membrana elastica interna
Membrana elastica interna Arcata riolano
Arcata riolano Rete malleolare laterale
Rete malleolare laterale Lumen bloedvat
Lumen bloedvat Equicomposte
Equicomposte Gimnosperme e angiosperme
Gimnosperme e angiosperme Hanno vares
Hanno vares Hanno kakosch
Hanno kakosch Volgeranno lo sguardo a colui che hanno trafitto
Volgeranno lo sguardo a colui che hanno trafitto Cosa hanno in comune le religioni
Cosa hanno in comune le religioni Hanno zingel
Hanno zingel Numeri relativi concordi
Numeri relativi concordi Hanno kakosch
Hanno kakosch Poesie con rime similitudini e metafore
Poesie con rime similitudini e metafore Hanno un ago magnetico
Hanno un ago magnetico I due rami in cui si biforca la trachea
I due rami in cui si biforca la trachea Ampere unità di misura
Ampere unità di misura I numeri hanno una fine
I numeri hanno una fine Quanti mesi hanno 28 giorni
Quanti mesi hanno 28 giorni Quando due figure sono equivalenti?
Quando due figure sono equivalenti? Volgeranno lo sguardo a colui che hanno trafitto
Volgeranno lo sguardo a colui che hanno trafitto Hanno saks
Hanno saks Figure piane non congruenti ma equiscomponibili sono
Figure piane non congruenti ma equiscomponibili sono Quali sono i fattori che influenzano il clima
Quali sono i fattori che influenzano il clima Due angoli consecutivi ma non adiacenti
Due angoli consecutivi ma non adiacenti Gli angeli che ci proteggono
Gli angeli che ci proteggono Tratta gli altri come vorresti essere trattato
Tratta gli altri come vorresti essere trattato Gli organi di senso mappa concettuale
Gli organi di senso mappa concettuale Mappe concettuali numeri relativi
Mappe concettuali numeri relativi Gli strati del suolo
Gli strati del suolo Gli ostacoli della vita
Gli ostacoli della vita Beatissimum
Beatissimum I vettori devono accertarsi che gli stranieri
I vettori devono accertarsi che gli stranieri Tutti i poligoni
Tutti i poligoni Tutti gli invertebrati
Tutti gli invertebrati Glo gli git
Glo gli git Molti sono gli animali a cui s'ammoglia
Molti sono gli animali a cui s'ammoglia Ottimati e popolari
Ottimati e popolari Organi garanzia costituzionale
Organi garanzia costituzionale La differenza delle misure di due angoli è 70
La differenza delle misure di due angoli è 70 Gli organi di senso zanichelli
Gli organi di senso zanichelli Cosa sono gli esborsi di portineria
Cosa sono gli esborsi di portineria Gli irraggiungibili
Gli irraggiungibili Riempiti gli occhi di meraviglie
Riempiti gli occhi di meraviglie Il falso specchio di magritte
Il falso specchio di magritte Quali sono gli strumenti del software autore
Quali sono gli strumenti del software autore Compravendita economia aziendale
Compravendita economia aziendale Istituto comprensivo mira 2
Istituto comprensivo mira 2